È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Applicazione del sistema intelligente di test di sensibilità antimicrobica/screening fagico ad alto rendimento e dell'indice Lar di resistenza antimicrobica
In questo articolo
Riepilogo
Qui introduciamo il principio, la struttura e le istruzioni del sistema intelligente di test di sensibilità antimicrobica/screening fagico ad alto rendimento. La sua applicazione è illustrata utilizzando come esempio la Salmonella isolata dal pollame nello Shandong, in Cina. Viene calcolato l'indice di Lar e viene discusso in modo esaustivo la sua importanza nella valutazione della resistenza antimicrobica.
Abstract
Per migliorare l'efficienza dei test di sensibilità antimicrobica (AST) e dello screening fagico ad alto rendimento per i batteri resistenti e per ridurre i costi di rilevamento, è stato sviluppato un sistema intelligente di screening AST/fagico ad alto rendimento, che include un inoculatore a matrice di 96 punti, un convertitore di acquisizione immagini e un software corrispondente, secondo i criteri AST e i punti di rottura della resistenza (R) formulati dal Clinical & Laboratory Standards Institute (CLSI). L'AST e le statistiche delle distribuzioni della concentrazione minima inibitoria (MIC) (da R/8 a 8R) di 1.500 ceppi di Salmonella isolati dal pollame nello Shandong, in Cina, rispetto a 10 agenti antimicrobici sono state effettuate dal sistema intelligente di screening AST/fago ad alto rendimento. L'indice di Lar, che significa "meno antibiosi, meno resistenza e residuo fino a poco antibiosi", è stato ottenuto calcolando la media ponderata di ogni MIC e dividendo per R. Questo approccio migliora l'accuratezza rispetto all'utilizzo della prevalenza della resistenza per caratterizzare il grado di resistenza antimicrobica (AMR) di ceppi altamente resistenti. Per i ceppi di Salmonella con AMR elevato, i fagi litici sono stati schermati in modo efficiente dalla libreria dei fagi da questo sistema e lo spettro di lisi è stato calcolato e analizzato. I risultati hanno mostrato che il sistema intelligente di screening AST/fago ad alto rendimento era operativo, accurato, altamente efficiente, economico e di facile manutenzione. In combinazione con il sistema di monitoraggio della resistenza antimicrobica veterinaria dello Shandong, il sistema è risultato adatto per la ricerca scientifica e il rilevamento clinico relativo alla resistenza antimicrobica.
Introduzione
Poiché gli agenti antimicrobici sono stati ampiamente utilizzati per prevenire le malattie infettive batteriche, la resistenza antimicrobica (AMR) è diventata un problema di salute pubblica globale1. La lotta alla resistenza antimicrobica è attualmente la missione principale del monitoraggio della resistenza antimicrobica dei patogeni epidemiologici e della terapia sinergica di agenti antimicrobici sensibili e batteriofagi litici2.
I test di sensibilità antimicrobica (AST) in vitro sono il cardine per il monitoraggio della terapia e la rilevazione del livello di resistenza antimicrobica. È una parte importante della farmacologia antimicrobica e la base critica per la medicina clinica. Il Clinical and Laboratory Standards Institute (CLSI) degli Stati Uniti e l'European Committee on Antimicrobial Suscceptibility Testing (EUCAST) hanno formulato e rivisto i criteri internazionali dell'AST e i metodi AST continuamente modificati e integrati e i breakpoint per determinare la MIC di una determinata combinazione "organismo-agente antimicrobico" come sensibile (S), resistente (R) o intermedia (I)3, 4. Introduzione
Dagli anni '80 agli anni '90, gli strumenti automatici per la diluizione del microbrodo sono stati rapidamente sviluppati e applicati alla pratica clinica, con esempi tra cui Alfred 60AST, VITEK System, PHOENIXTM e Cobasbact 5,6,7. Tuttavia, questi strumenti erano costosi, richiedevano materiali di consumo ad alto costo e i loro intervalli di rilevamento erano progettati per i farmaci clinici dei pazienti 5,6,7. Per questi motivi, non sono adatti per l'esame clinico veterinario e la rilevazione di grandi quantità di ceppi altamente resistenti. In questo studio, è stato sviluppato un sistema intelligente di screening AST/fagico ad alto rendimento, che include un inoculatore a matrice di 96 punti (Figura 1), un convertitore di acquisizione di immagini (Figura 2) e il software corrispondente8, per condurre l'AST per un lotto di ceppi batterici contro più agenti antimicrobici contemporaneamente mediante il metodo di diluizione dell'agar. Inoltre, il sistema è stato utilizzato anche per rilevare e analizzare i modelli di lisi dei fagi contro batteri resistenti agli antimicrobici9 e i fagi litici sono stati selezionati in modo efficiente dalla libreria dei fagi. Questo sistema si è rivelato efficiente, conveniente e facile da usare.
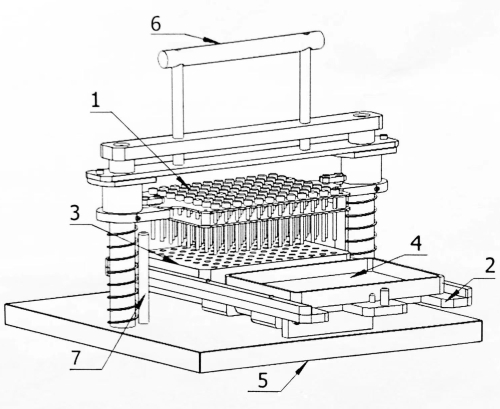
Figura 1: Schema strutturale dell'inoculatore a matrice di 96 punti. 1: Piastra del perno di inoculazione; 2: Operatore di telefonia mobile; 3: Blocco del seme; 4: Piastra incubata; 5: Base; 6: Maniglia di comando; 7: Perno limite. Fare clic qui per visualizzare una versione più grande di questa figura.
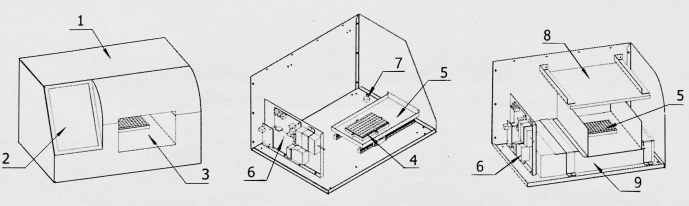
Figura 2: Schema strutturale del convertitore di acquisizione delle immagini. 1: Conchiglia; 2: Schermo di visualizzazione; 3: Sala acquisizione immagini; 4: Base della scheda di rilevamento; 5: Scheda di rilevamento dentro e fuori dal magazzino; 6: Scheda di controllo; 7: Dispositivo di conversione dell'acquisizione delle immagini; 8: Sorgente luminosa; 9: Scanner di immagini. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocollo
I ceppi di Salmonella utilizzati in questo studio sono stati raccolti da pollame nello Shandong, in Cina, dopo aver ottenuto l'approvazione del Comitato per la biosicurezza dell'Istituto di scienze animali e medicina veterinaria, Accademia di scienze agricole dello Shandong, Cina.
1. Applicazione del sistema AST intelligente ad alto rendimento8
- Preparazione dell'inoculo
- Incubare l'organismo di controllo qualità Escherichia coli e 93 ceppi di Salmonella da testare per l'AST su piastre di agar Mueller-Hinton (MHA) per 16-18 ore a 37 °C3.
- Preparare l'inoculo di ciascun ceppo in modo che corrisponda allo standard di torbidità McFarland 0,5 in base al metodo specificato nello standard CLSI3e quindi diluire 10 volte.
- Posizionare 200 μL di soluzione fisiologica normale sterile nel 1° pozzetto orizzontale (A1) della piastra a 96 pozzetti come controllo negativo, due sospensioni di organismo di controllo qualità nel 2° e 3° pozzetto orizzontali (A2 e A3) rispettivamente come controllo positivo e controllo qualità. Aggiungere 200 μL delle sospensioni di inoculo diluite di ciascun colorante testato nei corrispondenti 93 pozzetti del blocco di semi a 96 pozzetti.
- Preparazione della piastra di agar antimicrobico
- Impostare gli intervalli di concentrazione dei diversi agenti antibatterici testati in base all'intervallo di calcolo dell'indice di Lar (da 0,125R a 8R). Le concentrazioni vanno dall'intervallo di controllo qualità o 0,0625R (soggetto all'intervallo inferiore) a 8R.
NOTA: Se l'indice di Lar non viene calcolato, l'intervallo di concentrazioni di antibiotici può essere impostato in base alle esigenze dell'AST. - Eseguire uno schema di diluizione di raddoppio log2 per la soluzione antibiotica a partire da una concentrazione di riserva adeguata in base al metodo di diluizione dell'agar specificato nello standard CLSI3.
- Sterilizzare flaconi di vetro da 50 ml contenenti 18 ml di terreno agar Mueller-Hinton. Aggiungere 2 mL delle diluizioni appropriate della soluzione antimicrobica a 18 mL di terreno fuso raffreddato a 45-50 °C, mescolare accuratamente e versare nelle piastre nella cabina di biosicurezza.
- Lasciare solidificare l'agar a temperatura ambiente (RT), lasciare uno spazio vuoto sotto il coperchio delle piastre incubate e soffiare per asciugare la superficie dell'agar prima dell'inoculazione.
- Etichettare i tipi di agenti antimicrobici e le concentrazioni sul retro delle piastre incubate. Disporre le piastre incubate multiple di ciascun agente antimicrobico in una pila in ordine di diluizione log2-raddoppiante.
- Preparare due piastre di agar prive di farmaci come controlli per ciascun agente antimicrobico.
- Impostare gli intervalli di concentrazione dei diversi agenti antibatterici testati in base all'intervallo di calcolo dell'indice di Lar (da 0,125R a 8R). Le concentrazioni vanno dall'intervallo di controllo qualità o 0,0625R (soggetto all'intervallo inferiore) a 8R.
- Fasi di inoculazione per inoculatore a matrice di 96 punti
- Installare la piastra del perno di inoculazione in autoclave sul supporto di un inoculatore a matrice di 96 punti nell'armadio di sicurezza biologica.
- Posizionare il blocco di semi preparato con i ceppi testati e una piastra incubata di agar sul supporto mobile, con lo stesso angolo di posizionamento per le due piastre.
- Spingere il supporto mobile in modo che il blocco di semina si trovi direttamente sotto la piastra del perno di inoculazione.
- Premere la maniglia di azionamento, spostare la piastra del perno di inoculazione verso il basso e dirigere i 96 perni verso l'inoculo in 96 pozzetti del blocco di semina.
- Rilasciare la maniglia di comando con il comando, quindi ripristinare la piastra del perno di inoculazione sotto l'azione della molla.
- Premere la maniglia di comando 2-3 volte per mescolare bene ogni inoculo e immergere. Spingere e spostare la piastra di supporto in modo che la piastra incubata si trovi direttamente sotto la piastra del perno di inoculazione.
- Premere la maniglia di azionamento, spostare la piastra del perno di inoculazione verso il basso e fermarsi per 1-2 secondi per far sì che i perni di inoculazione entrino completamente in contatto con la superficie della piastra incubata.
- Rilasciare la maniglia di comando. In questo modo si completa un'inoculazione. Sostituire un'altra piastra incubata e continuare il ciclo fino al termine di un gruppo di piastre agar antimicrobiche.
- Sostituisci un'altra piastra di inoculazione e un blocco di semi e inocula un altro gruppo di ceppi testati. Ciclo fino al completamento di tutte le inoculazioni.
NOTA: Inoculare prima una piastra di agar di controllo (senza agente antimicrobico), poi la piastra in ordine di concentrazione del farmaco da bassa ad alta e una seconda piastra di agar di controllo per ultima per garantire che non vi siano contaminazioni o carryover di agenti antimicrobici. Il volume di inoculazione si basa sul volume della deposizione naturale di ciascun perno di circa 2 μL.
- Incubazione delle piastre di agar antimicrobico
- Incubare le piastre di agar antimicrobico inoculate a RT fino a quando l'umidità nei punti di inoculo non viene assorbita nell'agar.
- Capovolgere le piastre e incubarle per 16-20 ore a 37 °C per i ceppi testati per garantire che i batteri non inibiti formino colonie.
- Acquisizione di immagini e statistiche dei dati
- Fare doppio clic sul sistema di acquisizione immagini AST a matrice di 96 punti per aprire il programma.
- Fare clic su Informazioni sul test nella barra delle applicazioni. Fare clic su Nuovo per creare una nuova attività di test e compilare le informazioni in base alle istruzioni, inclusi il codice, il nome, la fonte, i batteri, il numero di ceppi, gli antibiotici e il gradiente.
- Fare clic su Raccolta dati > Fotografa >elemento Test per selezionare la nuova attività creata. Fare clic su Antibiotici per selezionare il nome dell'antibiotico e fare clic su Gradiente per selezionare la concentrazione iniziale di questo antibiotico.
- Fare clic su Connetti per connettersi con il convertitore di acquisizione immagini.
- Posizionare le piastre incubate corrispondenti sulla base della piastra di rilevamento con l'angolo mancante nella parte anteriore destra per l'orientamento e spingerle nel convertitore di acquisizione delle immagini.
- Clicca su Collezione per ottenere le immagini. Il gradiente antibiotico passerà automaticamente al gradiente successivo. Posizionare la piastra successiva a turno e continuare a fare clic su Raccolta fino a quando le piastre per questo antibiotico non sono state raccolte.
- Fare clic su Antibiotici e selezionare il set successivo di piastre incubate. Fare clic su Gradiente per selezionare il gradiente iniziale e procedere al round successivo di raccolta di immagini.
- Dopo aver completato tutte le raccolte, fai clic su Invia. Il programma riconoscerà automaticamente il numero di pixel bianchi formattati in ogni punto di inoculazione nelle immagini, determinerà se c'è formazione di colonie e convertirà le immagini in valori MIC.
- Fare clic su Query per ottenere tutti i risultati MIC dei ceppi contro gli antibiotici testati.
NOTA: Il sistema intelligente AST ad alta produttività è adatto per la determinazione delle MIC di grandi lotti di ceppi batterici. Il processo di test, compresa la preparazione, l'inoculazione, l'incubazione e la lettura dei risultati, richiede 3 giorni. I tipi di antibiotici e gli intervalli di rilevamento delle MIC possono essere impostati in base alle rispettive esigenze e i principali materiali di consumo possono essere riutilizzati.
- Calcolo dell'indice di Lar
- Determinare con precisione l'indice di Lar con la formula: , dove:
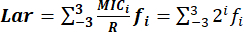
MICi: concentrazione minima inibitoria.
L'intervallo di distribuzioni MIC da MIC-3 a MIC3 rappresenta due concentrazioni seriali centrate su R: 0,125R, 0,25R, 0,5R, R, 2R, 4R e 8R. è 2 i e l'intervallo dii è compreso tra -3 e 3.
è 2 i e l'intervallo dii è compreso tra -3 e 3.
R: i breakpoint di resistenza dei batteri agli agenti antimicrobici standardizzati dal CLSI.
f: la distribuzione di frequenza del MIC.
NOTA: L'indice di Lar generale è la media aritmetica di tutti gli indici di Lar. Dopo aver calcolato l'indice Lar, arrotondare il valore finale a due cifre significative dopo la virgola decimale.
- Determinare con precisione l'indice di Lar con la formula: , dove:
2. Sistema intelligente di screening fagico ad alto rendimento9
- Preparazione del blocco di semi fagici e delle piastre incubate a doppio strato contenenti batteri.
- Utilizzare il metodo10 dell'agar a doppio strato o il metodo11 della coltura liquida per la produzione di fagi diversi. Diluire a un'adeguata concentrazione parallela con un titolo di 1 x 104-5 ufu/mL e aggiungere 200 μL di inoculo fagico nel blocco di semi a 96 pozzetti.
- Preparare piastre a doppio strato con batteri (10 mL di terreno di agar inferiore [agar 12 g/L] e 6 mL di terreno di coltura semi-agar superiore [6 g/L] con 100 μL di batteri [0,5 McFarland]) da testare.
- Realizzare una piastra incubata a doppio strato per ogni ceppo da testare. Lasciare uno spazio vuoto sotto il coperchio della piastra a doppio strato e soffiare per asciugare la superficie dell'agar nella cabina di biosicurezza.
- Test di screening
- Posizionare il blocco di semi di fago preparato e la piastra a doppio strato sul supporto mobile dell'inoculatore a matrice di 96 punti e trasferire tutti gli inoculi di fagi sulla superficie semi-agar. Continuare i cicli fino al completamento di tutti i ceppi testati.
- Lasciare che le piastre a doppio strato inoculate rimangano a RT fino a quando l'umidità nei punti di inoculo non viene assorbita completamente nel semi-agar.
- Capovolgere le piastre e incubare in condizioni adeguate per i ceppi testati per 4-6 ore per garantire la formazione di macchie litiche chiare.
- Analisi dei dati
- Ottenere e salvare l'immagine del risultato sperimentale di ciascuna lastra a doppio strato tramite il convertitore di acquisizione immagini (passaggi 1.5.4-1.5.6).
- Registra il numero e le morfologie delle diverse forme delle macchie in un foglio di calcolo basato sulle immagini ottenute e calcola le rispettive proporzioni dei diversi tipi di fagi.
Risultati
Seguendo il protocollo del sistema intelligente AST ad alto rendimento, la sua applicazione è stata illustrata dalla Salmonella del pollame nello Shandong, in Cina, come esempio.
La crescita di ceppi di Salmonella su piastre di agar con ampicillina (R di 32 μg/mL) a concentrazioni comprese tra 2 e 256 μg/mL determinate dal convertitore di acquisizione immagini è mostrata nella Figura 3. Il 1° pozzetto orizzontale A1 è stato il co...
Discussione
Il metodo di diluizione dell'agar è stato ben consolidato e ampiamente utilizzato. Il principio del sistema AST ad alto rendimento era quello del metodo di diluizione dell'agar. Uno dei passaggi critici all'interno del protocollo è stato il trasferimento accurato ad alto rendimento di 96 inoculi contemporaneamente, che è stato eseguito più volte di seguito. Per completare questo passaggio critico, i perni dell'inoculatore a matrice di 96 punti erano uniformi e molto lisci. La deposizione naturale di ciascun perno era...
Divulgazioni
Yuqing Liu et al. hanno depositato brevetti cinesi per l'inoculatore a matrice di 96 punti e il convertitore di acquisizione di immagini e le loro applicazioni (numero di brevetto ZL 201610942866.3 e numero di brevetto ZL 201910968255.X).
Riconoscimenti
Questo lavoro è stato sostenuto dal National Key Research and Development Project (2019YFA0904003); Moderno sistema industriale agricolo nella provincia di Shandong (SDAIT-011-09); Progetto di Ottimizzazione della Piattaforma di Cooperazione Internazionale (CXGC2023G15); Principali compiti di innovazione del progetto di innovazione tecnologica e scientifica agricola dell'Accademia delle scienze agrarie dello Shandong, Cina (CXGC2023G03).
Materiali
| Name | Company | Catalog Number | Comments |
| 96 well culture plate | Beijing lanjieke Technology Co., Ltd | 11510 | |
| 96-dot matrix AST image acquisition system | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| 96-dot matrix inoculator | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Patented product |
| Agar | Qingdao hi tech Industrial Park Haibo Biotechnology Co., Ltd | HB8274-1 | |
| Amikacin | Shanghai McLean Biochemical Technology Co., Ltd | A857053 | |
| Amoxicillin | Shanghai McLean Biochemical Technology Co., Ltd | A822839 | |
| Ampicillin | Shanghai McLean Biochemical Technology Co., Ltd | A830931 | |
| Analytical balance | Sartorius | BSA224S | |
| Automated calculation software for Lar index of AMR | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Bacteria Salmonella strains | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Animal origin |
| Bacterial resistance Lar index certification management system V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Ceftiofur | Shanghai McLean Biochemical Technology Co., Ltd | C873619 | |
| Ciprofloxacin | Shanghai McLean Biochemical Technology Co., Ltd | C824343 | |
| Clavulanic acid | Shanghai McLean Biochemical Technology Co., Ltd | C824181 | |
| Clean worktable | Suzhou purification equipment Co., Ltd | SW-CJ-2D | |
| Colistin sulfate | Shanghai McLean Biochemical Technology Co., Ltd | C805491 | |
| Culture plate | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Patented product |
| Doxycycline | Shanghai McLean Biochemical Technology Co., Ltd | D832390 | |
| Enrofloxacin | Shanghai McLean Biochemical Technology Co., Ltd | E809130 | |
| Filter 0.22 μm | Millipore | SLGP033RB | |
| Florfenicol | Shanghai McLean Biochemical Technology Co., Ltd | F809685 | |
| Gentamicin | Shanghai McLean Biochemical Technology Co., Ltd | G810322 | |
| Glass bottle 50 mL | Xuzhou Qianxing Glass Technology Co., Ltd | QX-7 | |
| High-throughput resistance detection system V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Image acquisition converter | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Patented product |
| Meropenem | Shanghai McLean Biochemical Technology Co., Ltd | M861173 | |
| Mueller-Hinton agar | Qingdao hi tech Industrial Park Haibo Biotechnology Co., Ltd | HB6232 | |
| Petri dish 60 mm x 15 mm | Qingdao Jindian biochemical equipment Co., Ltd | 16021-1 | |
| Petri dish 90 mm x 15 mm | Qingdao Jindian biochemical equipment Co., Ltd | 16001-1 | |
| Salmonella phages | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | |
| Shaker incubator | Shanghai Minquan Instrument Co., Ltd | MQD-S2R | |
| Turbidimeter | Shanghai XingBai Biotechnology Co., Ltd | F-TC2015 | |
| Varms base type library system V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Vertical high-pressure steam sterilizer | Shanghai Shen'an medical instrument factory | LDZX-75L | |
| Veterinary pathogen resistance testing management system | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Veterinary resistance cloud monitoring and phage control platform V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright |
Riferimenti
- Ramanan, L., et al. Antimicrobial resistance-the need for global solutions. The Lancet Infectious Diseases. 13 (12), 1057-1098 (2013).
- Xiaonan, Z., Qing, Z., Thomas, S. P., Yuqing, L., Martha, R. J. C. inPhocus: Perspectives of the application of bacteriophages in poultry and aquaculture industries based on Varms in China. PHAGE: Therapy, Applications, and Research. 2 (2), 69-74 (2021).
- CLSI. . Performance Standards for Antimicrobial Disk Susceptibility Tests. CLSI document M100. , (2022).
- Yuqing, L., et al. . Antimicrobial Sensitivity Testing Standard of EUCAST. , (2017).
- Barnini, S., et al. A new rapid method for direct antimicrobial susceptibility testing of bacteria from positive blood cultures. BMC Microbiology. 16 (1), 185-192 (2016).
- Höring, S., Massarani, A. S., Löffler, B., Rödel, J. Rapid antimicrobial susceptibility testing in blood culture diagnostics performed by direct inoculation using the VITEK®-2 and BD PhoenixTM platforms. European Journal of Clinical Microbiology & Infectious Diseases. 38 (3), 471-478 (2019).
- Dupuis, G. Evaluation of the Cobasbact automated antimicrobial susceptibility testing system. European Journal of Clinical Microbiology & Infectious Diseases. 4 (2), 119-122 (1985).
- Liu, Y., et al. A system of bacterial antimicrobial resistance detection and its operation method. China Patent. , (2019).
- Liu, Y. A high throughput test plate for screening bacteriophage of zoonotic pathogens and its application. China Patent. , (2022).
- Adams, M. H. . Bacteriophages. , (1959).
- Nair, A., Ghugare, G. S., Khairnar, K. An appraisal of bacteriophage isolation techniques from environment. Microbial Ecology. 83 (3), 519-535 (2022).
- . . Shandong veterinary antibiotic resistance system. , (2023).
- Ming, H., et al. Comparison of the results of 96-dot agar dilution method and broth microdilution method. Chinese Journal of Antibiotics. 43 (6), 729-733 (2018).
- Laxminarayan, R., Klugman, K. P. Communicating trends in resistance using a drug resistance index. BMJ Open. 1 (2), e000135 (2011).
- Chen, Y., et al. Assessing antibiotic therapy effectiveness against the major bacterial pathogens in a hospital using an integrated index. Future Microbiology. 12, 853-866 (2017).
- Ciccolini, M., Spoorenberg, V., Geerlings, S. E., Prins, J. M., Grundmann, H. Using an index-based approach to assess the population-level appropriateness of empirical antibiotic therapy. Journal of Antimicrobial Chemotherapy. 70 (1), 286-293 (2015).
- Yanbo, L., et al. Preliminary application of inoculation system for high-throughput drug susceptibility test. China Poultry. 42 (6), 52-57 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon