Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Anwendung des intelligenten Hochdurchsatz-Antimikrobiell-Sensitivitätstest-/Phagen-Screening-Systems und des Lar-Index der antimikrobiellen Resistenz
In diesem Artikel
Zusammenfassung
Hier stellen wir das Prinzip, den Aufbau und die Anleitung des intelligenten Hochdurchsatz-Antimikrobiell-Sensitivitätstest-/Phagen-Screening-Systems vor. Die Anwendung wird am Beispiel von Salmonellen , die aus Geflügel in Shandong, China, isoliert wurden, veranschaulicht. Der Lar-Index wird berechnet und seine Bedeutung für die Bewertung antimikrobieller Resistenzen wird umfassend diskutiert.
Zusammenfassung
Um die Effizienz von antimikrobiellen Empfindlichkeitstests (AST) und Phagen-Hochdurchsatz-Screenings auf resistente Bakterien zu verbessern und die Nachweiskosten zu senken, wurde ein intelligentes Hochdurchsatz-AST/Phagen-Screening-System entwickelt, das einen 96-Punkt-Matrix-Inokuultator, einen Bildaufnahmekonverter und eine entsprechende Software umfasst, die den AST-Kriterien und den vom Clinical & Laboratory Standards Institute (CLSI) formulierten Breakpoints of Resistance (R) entsprechen. AST und Statistiken über die Verteilung der minimalen Hemmkonzentration (MIC) (von R/8 bis 8R) von 1.500 Salmonellenstämmen , die aus Geflügel in Shandong, China, gegen 10 antimikrobielle Wirkstoffe isoliert wurden, wurden mit dem intelligenten Hochdurchsatz-AST/Phagen-Screening-System durchgeführt. Der Lar-Index, d.h. "weniger Antibiose, weniger Resistenz und Residuum bis wenig Antibiose", wurde durch die Berechnung des gewichteten Durchschnitts jedes MHK und die Division durch R ermittelt. Dieser Ansatz verbessert die Genauigkeit im Vergleich zur Verwendung der Prävalenz von Resistenzen zur Charakterisierung des Grades der antimikrobiellen Resistenz (AMR) von hochresistenten Stämmen. Für die Salmonellenstämme mit hoher AMR wurden lytische Phagen mit diesem System effizient aus der Phagenbibliothek gescreent und das Lysespektrum berechnet und analysiert. Die Ergebnisse zeigten, dass das intelligente Hochdurchsatz-AST/Phagen-Screening-System bedienbar, genau, hocheffizient, kostengünstig und einfach zu warten war. In Kombination mit dem veterinärmedizinischen antimikrobiellen Resistenzüberwachungssystem von Shandong war das System für die wissenschaftliche Forschung und den klinischen Nachweis im Zusammenhang mit AMR geeignet.
Einleitung
Da antimikrobielle Wirkstoffe in großem Umfang zur Vorbeugung bakterieller Infektionskrankheiten eingesetzt werden, ist die antimikrobielle Resistenz (AMR) zu einem globalen Problem für die öffentliche Gesundheit geworden1. Die Bekämpfung antimikrobieller Resistenzen ist derzeit die Hauptaufgabe der Überwachung von Antibiotikaresistenzen epidemiologischer Krankheitserreger und der synergistischen Therapie empfindlicher antimikrobieller Wirkstoffe und lytischer Bakteriophagen2.
In-vitro-Tests auf antimikrobielle Empfindlichkeit (AST) sind die wichtigste Säule für die Überwachung der Therapie und den Nachweis des AMR-Niveaus. Es ist ein wichtiger Bestandteil der antimikrobiellen Pharmakologie und die entscheidende Grundlage für die klinische Medikation. Das Clinical and Laboratory Standards Institute (CLSI) der Vereinigten Staaten und das Europäische Komitee für antimikrobielle Empfindlichkeitstests (EUCAST) haben internationale Kriterien für AST formuliert und überarbeitet und kontinuierlich modifiziert und ergänzt AST-Methoden und die Breakpoints zur Bestimmung der MHK einer bestimmten Kombination aus "Organismus und antimikrobiellem Wirkstoff" als sensitiv (S), resistent (R) oder intermediär (I)3, 4. Anmelden
Von den 1980er bis in die 1990er Jahre wurden schnell automatische Mikrobrühe-Verdünnungsgeräte entwickelt und in der klinischen Praxis eingesetzt, mit Beispielen wie Alfred 60AST, VITEK System, PHOENIXTM und Cobasbact 5,6,7. Diese Instrumente waren jedoch teuer, erforderten teure Verbrauchsmaterialien und ihre Detektionsbereiche waren für die klinische Patientenmedikation ausgelegt 5,6,7. Aus diesen Gründen eignen sie sich nicht für die veterinärklinische Untersuchung und den Nachweis großer Mengen hochresistenter Stämme. In dieser Studie wurde ein intelligentes Hochdurchsatz-AST/Phagen-Screening-System entwickelt, das einen 96-Punkt-Matrix-Inokulator (Abbildung 1), einen Bilderfassungskonverter (Abbildung 2) und die entsprechende Software8 umfasst, um AST für eine Charge von Bakterienstämmen gegen mehrere antimikrobielle Wirkstoffe gleichzeitig mit der Agar-Verdünnungsmethode durchzuführen. Darüber hinaus wurde das System auch verwendet, um die Lysemuster von Phagen gegen antimikrobiell resistente Bakterien zu detektieren und zu analysieren9, und lytische Phagen wurden effizient aus der Phagenbibliothek ausgewählt. Dieses System erwies sich als effizient, erschwinglich und einfach zu bedienen.
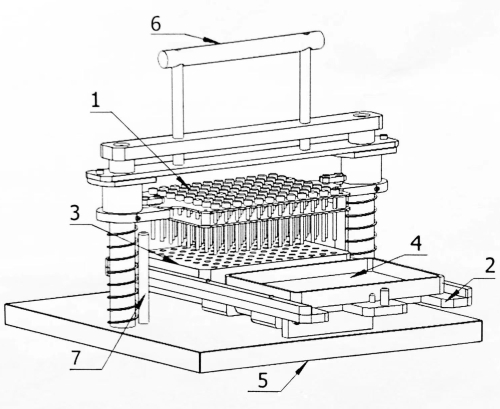
Abbildung 1: Strukturdiagramm des 96-Punkt-Matrix-Inokulators. 1: Inokulations-Pin-Platte; 2: Mobilfunkanbieter; 3: Saatblock; 4: Inkubierte Platte; 5: Basis; 6: Bedienungsgriff; 7: Pin begrenzen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
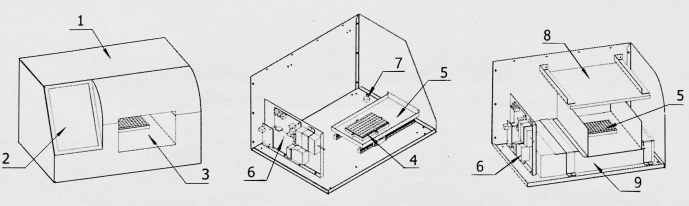
Abbildung 2: Strukturdiagramm des Bildaufnahmekonverters. 1: Schale; 2: Bildschirm anzeigen; 3: Raum für die Bildaufnahme; 4: Basis der Detektionsplatine; 5: Erkennungstafel in und aus dem Lager; 6: Steuerplatine; 7: Bildaufnahme-Konvertierungsgerät; 8: Lichtquelle; 9: Bildscanner. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protokoll
Die in dieser Studie verwendeten Salmonellenstämme wurden von Geflügel in Shandong, China, gesammelt, nachdem sie die Genehmigung des Ausschusses für biologische Sicherheit des Instituts für Tierwissenschaften und Veterinärmedizin der Shandong Academy of Agricultural Sciences, China, erhalten hatten.
1. Anwendung des intelligenten Hochdurchsatz-AST-Systems8
- Inokulum-Präparat
- Inkubieren Sie den Qualitätskontrollorganismus Escherichia coli und 93 Salmonellenstämme , die auf AST getestet werden sollen, auf Mueller-Hinton-Agarplatten (MHA) für 16-18 Stunden bei 37 °C3.
- Bereiten Sie das Inokulum jedes Stammes so vor, dass es dem McFarland-Trübungsstandard von 0,5 entspricht, basierend auf der im CLSI-Standard3angegebenen Methode, und verdünnen Sie es dann 10-fach.
- Geben Sie 200 μl sterile normale Kochsalzlösung als Negativkontrolle in die horizontale 1. Vertiefung (A1) der 96-Well-Platte, zwei Suspensionen des Qualitätskontrollorganismus in die horizontale 2. und 3. Vertiefung (A2 und A3) als Positivkontrolle bzw. Qualitätskontrolle. Geben Sie 200 μl der verdünnten Inokulumsuspensionen jedes getesteten Farbstoffs in die entsprechenden 93 Vertiefungen im 96-Well-Saatblock.
- Herstellung einer antimikrobiellen Agarplatte
- Stellen Sie die Konzentrationsbereiche der verschiedenen getesteten antibakteriellen Wirkstoffe gemäß dem Berechnungsbereich des Lar-Index (von 0,125 R bis 8 R) ein. Die Konzentrationen reichen vom Qualitätskontrollbereich oder 0,0625R (vorbehaltlich des unteren Bereichs) bis zu 8R.
HINWEIS: Wenn der Lar-Index nicht berechnet wird, kann der Bereich der Antibiotikakonzentrationen entsprechend den Anforderungen der AST eingestellt werden. - Führen Sie ein log2-Verdopplungsverdünnungsschema für Antibiotikalösung aus, beginnend mit einer geeigneten Stammkonzentration auf der Grundlage der im CLSI-Standard3 festgelegten Agar-Verdünnungsmethode.
- Sterilisieren Sie 50-ml-Glasflaschen mit 18 ml Mueller-Hinton-Agarmedien. 2 ml der entsprechenden Verdünnungen der antimikrobiellen Lösung in 18 ml geschmolzenes Medium geben, das auf 45-50 °C abgekühlt ist, gründlich mischen und in die Platten in der Biosicherheitswerkbank gießen.
- Lassen Sie den Agar bei Raumtemperatur (RT) erstarren, lassen Sie einen Spalt unter dem Deckel der inkubierten Platten und blasen Sie, um die Agaroberfläche vor der Inokulation zu trocknen.
- Beschriften Sie die Arten der antimikrobiellen Wirkstoffe und Konzentrationen auf der Rückseite der inkubierten Platten. Ordnen Sie die mehrfach inkubierten Platten jedes antimikrobiellen Wirkstoffs in einem Stapel in log2-verdoppelnder Verdünnungsreihenfolge an.
- Bereiten Sie zwei arzneimittelfreie Agarplatten als Kontrollen für jedes antimikrobielle Mittel vor.
- Stellen Sie die Konzentrationsbereiche der verschiedenen getesteten antibakteriellen Wirkstoffe gemäß dem Berechnungsbereich des Lar-Index (von 0,125 R bis 8 R) ein. Die Konzentrationen reichen vom Qualitätskontrollbereich oder 0,0625R (vorbehaltlich des unteren Bereichs) bis zu 8R.
- Inokulationsschritte für 96-Punkt-Matrix-Inokulator
- Montieren Sie die autoklavierte Impfstiftplatte auf dem Träger eines 96-Punkt-Matrix-Inokuultators in der Biosicherheitswerkbank.
- Legen Sie den vorbereiteten Saatgutblock mit den getesteten Stämmen und einer Agar-Inkubationsplatte auf den mobilen Träger, mit dem gleichen Positionierungswinkel für die beiden Platten.
- Schieben Sie den mobilen Träger so, dass sich der Saatblock direkt unter der Impfstiftplatte befindet.
- Drücken Sie auf den Bediengriff, bewegen Sie die Impfnadelplatte nach unten und richten Sie die 96 Stifte in 96 Vertiefungen des Saatblocks.
- Lassen Sie den Bediengriff mit Kontrolle los und stellen Sie dann die Impfstiftplatte unter Federwirkung wieder her.
- Drücken Sie 2-3 Mal auf den Bediengriff, um jedes Inokulum gut umzurühren und einzutauchen. Schieben und bewegen Sie die Trägerplatte so, dass sich die inkubierte Platte direkt unter der Inokulationsplatte befindet.
- Drücken Sie auf den Bediengriff, bewegen Sie die Impfstiftplatte nach unten und halten Sie sie für 1-2 s an, damit die Impfstifte die Oberfläche der inkubierten Platte vollständig berühren.
- Lassen Sie den Bediengriff los. Damit ist eine Inokulation abgeschlossen. Ersetzen Sie eine weitere inkubierte Platte und setzen Sie den Zyklus fort, bis eine Gruppe von antimikrobiellen Agarplatten aufgebraucht ist.
- Ersetzen Sie eine weitere Impfnadelplatte und einen anderen Saatblock und impfen Sie eine andere Gruppe getesteter Stämme. Zyklus, bis alle Impfungen abgeschlossen sind.
HINWEIS: Beimpfen Sie zuerst eine Kontrollagarplatte (kein antimikrobielles Mittel), dann die Platte in der Reihenfolge der Arzneimittelkonzentration von niedrig nach hoch und zuletzt eine zweite Kontrollagarplatte, um sicherzustellen, dass keine Kontamination oder Verschleppung antimikrobieller Wirkstoffe auftritt. Das Impfvolumen beruht auf dem Volumen der natürlichen Abscheidung jedes Stifts von ca. 2 μl.
- Inkubation der antimikrobiellen Agarplatten
- Inkubieren Sie die inokulierten antimikrobiellen Agarplatten bei RT, bis die Feuchtigkeit in den Inokulumflecken in den Agar absorbiert ist.
- Invertieren Sie die Platten und inkubieren Sie sie für 16-20 h bei 37 °C für die getesteten Stämme, um sicherzustellen, dass die ungehemmten Bakterien Kolonien bilden.
- Bildaufnahme und Datenstatistik
- Doppelklicken Sie auf das 96-Punkt-Matrix-AST-Bilderfassungssystem , um das Programm zu öffnen.
- Klicken Sie in der Taskleiste auf Testinformationen . Klicken Sie auf Neu , um eine neue Testaufgabe zu erstellen, und geben Sie die Informationen gemäß den Eingabeaufforderungen ein, einschließlich Code, Name, Quelle, Bakterien, Anzahl der Stämme, Antibiotika und Gradient.
- Klicken Sie auf Datenerfassung > Foto > Testelement , um die neu erstellte Aufgabe auszuwählen. Klicken Sie auf Antibiotika , um den Namen des Antibiotikums auszuwählen, und klicken Sie auf Gradient , um die Anfangskonzentration dieses Antibiotikums auszuwählen.
- Klicken Sie auf Verbinden , um eine Verbindung mit dem Bildaufnahmekonverter herzustellen.
- Legen Sie die entsprechenden inkubierten Platten mit dem fehlenden Winkel zur Orientierung vorne rechts auf die Detektionsplattenbasis und schieben Sie sie in den Bildaufnahmekonverter.
- Klicken Sie auf Sammlung , um die Bilder zu erhalten. Der antibiotische Gradient springt automatisch zum nächsten Gradienten. Platzieren Sie den nächsten Teller der Reihe nach und klicken Sie so lange auf Sammeln , bis die Platten für dieses Antibiotikum gesammelt wurden.
- Klicken Sie auf Antibiotika und wählen Sie den nächsten Satz inkubierter Platten aus. Klicken Sie auf Farbverlauf, um den Startverlauf auszuwählen und mit der nächsten Runde der Bildsammlung fortzufahren.
- Nachdem Sie alle Sammlungen abgeschlossen haben, klicken Sie auf Senden. Das Programm erkennt automatisch die Anzahl der weißen Pixel, die an jedem Impfpunkt in den Bildern formatiert sind, stellt fest, ob eine Koloniebildung vorliegt, und wandelt die Bilder in MIC-Werte um.
- Klicken Sie auf Abfrage , um alle MIC-Ergebnisse der Stämme gegen die getesteten Antibiotika zu erhalten.
HINWEIS: Das intelligente Hochdurchsatz-AST-System eignet sich für die Bestimmung von MHK großer Chargen von Bakterienstämmen. Der Testprozess, einschließlich Vorbereitung, Impfung, Inkubation und Ablesen der Ergebnisse, dauert 3 Tage. Die Arten von Antibiotika und MHK-Nachweisbereiche können entsprechend den jeweiligen Bedürfnissen eingestellt werden, und die wichtigsten Verbrauchsmaterialien können wiederverwendet werden.
- Berechnung des Lar-Index
- Bestimmen Sie den Lar-Index genau mit der Formel: , wobei:
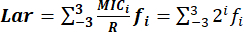
MHKi: minimale Hemmkonzentration.
Der Bereich der MHK-Verteilungen von MHK-3 bis MHK3 stellt serielle zweifache Konzentrationen dar, die auf R zentriert sind: 0,125R, 0,25R, 0,5R, R, 2R, 4R und 8R. ist 2 i, und der Bereich voni ist -3 bis 3.
ist 2 i, und der Bereich voni ist -3 bis 3.
R: die Bruchstellen der Resistenz von Bakterien gegen antimikrobielle Wirkstoffe, die durch CLSI standardisiert wurden.
f: die MIC-Häufigkeitsverteilung.
HINWEIS: Der allgemeine Lar-Index ist das arithmetische Mittel aller Lar-Indizes. Nachdem der Lar-Index berechnet wurde, runden Sie den Endwert auf zwei signifikante Stellen nach dem Dezimaltrennzeichen ab.
- Bestimmen Sie den Lar-Index genau mit der Formel: , wobei:
2. Intelligentes Hochdurchsatz-Phagen-Screening-System9
- Vorbereitung des Phagen-Samenblocks und der doppellagigen inkubierten Platten, die Bakterien enthalten.
- Verwenden Sie die Doppelschicht-Agar-Methode10 oder die Flüssigkulturmethode11 zur Herstellung verschiedener Phagen. Man verdünnt auf eine geeignete parallele Konzentration mit einem Titer von 1 x 104-5 pfu/ml und fügt 200 μl des Phagen-Inokulums in den 96-Well-Samenblock hinzu.
- Stellen Sie doppellagige Platten mit Bakterien her (10 ml unteres Agarmedium [Agar 12 g/l] und 6 ml oberes Semi-Agar-Medium [6 g/l] mit 100 μl Bakterien [0,5 McFarland]), die getestet werden sollen.
- Stellen Sie für jeden zu testenden Stamm eine doppellagige Inkubationsplatte her. Lassen Sie eine Lücke unter dem Deckel der doppellagigen Platte und blasen Sie die Agaroberfläche in der Biosicherheitswerkbank zum Trocknen.
- Screening-Test
- Platzieren Sie den vorbereiteten Phagen-Seed-Block und die doppellagige Platte auf dem mobilen Träger des 96-Punkt-Matrix-Inokulators und übertragen Sie alle Phagen-Inokula auf die Semi-Agar-Oberfläche. Fahren Sie mit den Zyklen fort, bis alle getesteten Stämme abgeschlossen sind.
- Lassen Sie die inokulierten Doppelschichtplatten bei RT verbleiben, bis die Feuchtigkeit in den Inokulumflecken vollständig in den Halbagar aufgenommen ist.
- Invertieren Sie die Platten und inkubieren Sie unter geeigneten Bedingungen für die getesteten Stämme für 4-6 Stunden, um sicherzustellen, dass klare lytische Flecken gebildet werden.
- Analysieren von Daten
- Das Bild des experimentellen Ergebnisses jeder Doppelschichtplatte wird mit dem Bildaufnahmekonverter abgerufen und gespeichert (Schritte 1.5.4-1.5.6).
- Erfassen Sie die Anzahl und Morphologien der verschiedenen Formen von Flecken in einer Tabelle, die auf den erhaltenen Bildern basiert, und berechnen Sie die jeweiligen Proportionen der verschiedenen Arten von Phagen.
Ergebnisse
In Anlehnung an das Protokoll des intelligenten Hochdurchsatz-AST-Systems wurde dessen Anwendung am Beispiel von Salmonellen aus Geflügel in Shandong, China, veranschaulicht.
Das Wachstum von Salmonella-Stämmen auf Agarplatten mit Ampicillin (R von 32 μg/ml) bei Konzentrationen von 2 bis 256 μg/ml, bestimmt durch den Bildaufnahmekonverter, ist in Abbildung 3 dargestellt. Die horizontale 1. Vertiefung A1 war die Negativkontrolle und...
Diskussion
Die Agar-Verdünnungsmethode ist gut etabliert und weit verbreitet. Das Prinzip des Hochdurchsatz-AST-Systems war das der Agar-Verdünnungsmethode. Einer der kritischen Schritte innerhalb des Protokolls war der genaue Hochdurchsatztransfer von 96 Inokula auf einmal, der mehrmals hintereinander durchgeführt wurde. Um diesen kritischen Schritt abzuschließen, waren die Pins des 96-Punkt-Matrix-Inokulators gleichmäßig und sehr glatt. Die natürliche Abscheidung jedes Stifts hatte ein Volumen von ca. 2 μl, das sich zu kl...
Offenlegungen
Yuqing Liu et al. haben chinesische Patente für den 96-Punkt-Matrix-Inokulator und den Bilderfassungskonverter und deren Anwendungen angemeldet (Patentnummer ZL 201610942866.3 und Patentnummer ZL 201910968255.X).
Danksagungen
Diese Arbeit wurde durch das National Key Research and Development Project (2019YFA0904003) unterstützt; Modernes landwirtschaftliches Industriesystem in der Provinz Shandong (SDAIT-011-09); Projekt zur Optimierung der internationalen Kooperationsplattform (CXGC2023G15); Wesentliche Innovationsaufgaben des agrarwissenschaftlichen und technologischen Innovationsprojekts der Akademie der Agrarwissenschaften Shandong, China (CXGC2023G03).
Materialien
| Name | Company | Catalog Number | Comments |
| 96 well culture plate | Beijing lanjieke Technology Co., Ltd | 11510 | |
| 96-dot matrix AST image acquisition system | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| 96-dot matrix inoculator | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Patented product |
| Agar | Qingdao hi tech Industrial Park Haibo Biotechnology Co., Ltd | HB8274-1 | |
| Amikacin | Shanghai McLean Biochemical Technology Co., Ltd | A857053 | |
| Amoxicillin | Shanghai McLean Biochemical Technology Co., Ltd | A822839 | |
| Ampicillin | Shanghai McLean Biochemical Technology Co., Ltd | A830931 | |
| Analytical balance | Sartorius | BSA224S | |
| Automated calculation software for Lar index of AMR | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Bacteria Salmonella strains | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Animal origin |
| Bacterial resistance Lar index certification management system V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Ceftiofur | Shanghai McLean Biochemical Technology Co., Ltd | C873619 | |
| Ciprofloxacin | Shanghai McLean Biochemical Technology Co., Ltd | C824343 | |
| Clavulanic acid | Shanghai McLean Biochemical Technology Co., Ltd | C824181 | |
| Clean worktable | Suzhou purification equipment Co., Ltd | SW-CJ-2D | |
| Colistin sulfate | Shanghai McLean Biochemical Technology Co., Ltd | C805491 | |
| Culture plate | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Patented product |
| Doxycycline | Shanghai McLean Biochemical Technology Co., Ltd | D832390 | |
| Enrofloxacin | Shanghai McLean Biochemical Technology Co., Ltd | E809130 | |
| Filter 0.22 μm | Millipore | SLGP033RB | |
| Florfenicol | Shanghai McLean Biochemical Technology Co., Ltd | F809685 | |
| Gentamicin | Shanghai McLean Biochemical Technology Co., Ltd | G810322 | |
| Glass bottle 50 mL | Xuzhou Qianxing Glass Technology Co., Ltd | QX-7 | |
| High-throughput resistance detection system V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Image acquisition converter | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Patented product |
| Meropenem | Shanghai McLean Biochemical Technology Co., Ltd | M861173 | |
| Mueller-Hinton agar | Qingdao hi tech Industrial Park Haibo Biotechnology Co., Ltd | HB6232 | |
| Petri dish 60 mm x 15 mm | Qingdao Jindian biochemical equipment Co., Ltd | 16021-1 | |
| Petri dish 90 mm x 15 mm | Qingdao Jindian biochemical equipment Co., Ltd | 16001-1 | |
| Salmonella phages | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | |
| Shaker incubator | Shanghai Minquan Instrument Co., Ltd | MQD-S2R | |
| Turbidimeter | Shanghai XingBai Biotechnology Co., Ltd | F-TC2015 | |
| Varms base type library system V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Vertical high-pressure steam sterilizer | Shanghai Shen'an medical instrument factory | LDZX-75L | |
| Veterinary pathogen resistance testing management system | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Veterinary resistance cloud monitoring and phage control platform V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright |
Referenzen
- Ramanan, L., et al. Antimicrobial resistance-the need for global solutions. The Lancet Infectious Diseases. 13 (12), 1057-1098 (2013).
- Xiaonan, Z., Qing, Z., Thomas, S. P., Yuqing, L., Martha, R. J. C. inPhocus: Perspectives of the application of bacteriophages in poultry and aquaculture industries based on Varms in China. PHAGE: Therapy, Applications, and Research. 2 (2), 69-74 (2021).
- CLSI. . Performance Standards for Antimicrobial Disk Susceptibility Tests. CLSI document M100. , (2022).
- Yuqing, L., et al. . Antimicrobial Sensitivity Testing Standard of EUCAST. , (2017).
- Barnini, S., et al. A new rapid method for direct antimicrobial susceptibility testing of bacteria from positive blood cultures. BMC Microbiology. 16 (1), 185-192 (2016).
- Höring, S., Massarani, A. S., Löffler, B., Rödel, J. Rapid antimicrobial susceptibility testing in blood culture diagnostics performed by direct inoculation using the VITEK®-2 and BD PhoenixTM platforms. European Journal of Clinical Microbiology & Infectious Diseases. 38 (3), 471-478 (2019).
- Dupuis, G. Evaluation of the Cobasbact automated antimicrobial susceptibility testing system. European Journal of Clinical Microbiology & Infectious Diseases. 4 (2), 119-122 (1985).
- Liu, Y., et al. A system of bacterial antimicrobial resistance detection and its operation method. China Patent. , (2019).
- Liu, Y. A high throughput test plate for screening bacteriophage of zoonotic pathogens and its application. China Patent. , (2022).
- Adams, M. H. . Bacteriophages. , (1959).
- Nair, A., Ghugare, G. S., Khairnar, K. An appraisal of bacteriophage isolation techniques from environment. Microbial Ecology. 83 (3), 519-535 (2022).
- . . Shandong veterinary antibiotic resistance system. , (2023).
- Ming, H., et al. Comparison of the results of 96-dot agar dilution method and broth microdilution method. Chinese Journal of Antibiotics. 43 (6), 729-733 (2018).
- Laxminarayan, R., Klugman, K. P. Communicating trends in resistance using a drug resistance index. BMJ Open. 1 (2), e000135 (2011).
- Chen, Y., et al. Assessing antibiotic therapy effectiveness against the major bacterial pathogens in a hospital using an integrated index. Future Microbiology. 12, 853-866 (2017).
- Ciccolini, M., Spoorenberg, V., Geerlings, S. E., Prins, J. M., Grundmann, H. Using an index-based approach to assess the population-level appropriateness of empirical antibiotic therapy. Journal of Antimicrobial Chemotherapy. 70 (1), 286-293 (2015).
- Yanbo, L., et al. Preliminary application of inoculation system for high-throughput drug susceptibility test. China Poultry. 42 (6), 52-57 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten