Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Application du système intelligent de test de sensibilité aux antimicrobiens/criblage des phages à haut débit et de l’indice Lar de résistance aux antimicrobiens
Dans cet article
Résumé
Nous présentons ici le principe, la structure et l’instruction du système intelligent de test de sensibilité antimicrobienne à haut débit / criblage des phages. Son application est illustrée par l’utilisation de Salmonella isolée de volailles dans le Shandong, en Chine, à titre d’exemple. L’indice Lar est calculé, et son importance dans l’évaluation de la résistance aux antimicrobiens est discutée de manière approfondie.
Résumé
Afin d’améliorer l’efficacité des tests de sensibilité aux antimicrobiens (AST) et du criblage à haut débit des phages pour les bactéries résistantes et de réduire le coût de détection, un système intelligent de criblage AST/phages à haut débit, comprenant un inoculateur matriciel à 96 points, un convertisseur d’acquisition d’images et le logiciel correspondant, a été développé selon les critères AST et les points de rupture de résistance (R) formulés par le Clinical & Laboratory Standards Institute (CLSI). L’AST et les statistiques de distribution de la concentration minimale inhibitrice (CMI) (de R/8 à 8R) de 1 500 souches de Salmonella isolées de volailles dans le Shandong, en Chine, contre 10 agents antimicrobiens ont été réalisées par le système intelligent de criblage AST/phages à haut débit. L’indice Lar, qui signifie « moins d’antibiose, moins de résistance et résiduel jusqu’à peu d’antibiose », a été obtenu en calculant la moyenne pondérée de chaque CMI et en divisant par R. Cette approche améliore la précision par rapport à l’utilisation de la prévalence de la résistance pour caractériser le degré de résistance aux antimicrobiens (RAM) des souches hautement résistantes. Pour les souches de Salmonella présentant une résistance aux antimicrobiens élevée, les phages lytiques ont été efficacement criblés à partir de la bibliothèque de phages par ce système, et le spectre de lyse a été calculé et analysé. Les résultats ont montré que le système intelligent de criblage AST/phages à haut débit était opérationnel, précis, très efficace, peu coûteux et facile à entretenir. Combiné au système vétérinaire de surveillance de la résistance aux antimicrobiens du Shandong, le système était adapté à la recherche scientifique et à la détection clinique liée à la résistance aux antimicrobiens.
Introduction
Les agents antimicrobiens ayant été largement utilisés pour prévenir les maladies infectieuses bactériennes, la résistance aux antimicrobiens (RAM) est devenue un problème de santé publique mondial1. La lutte contre la résistance aux antimicrobiens est actuellement la mission principale de surveillance de la résistance aux antimicrobiens des agents pathogènes épidémiologiques et de la thérapie synergique des agents antimicrobiens sensibles et des bactériophages lytiques2.
Les tests de sensibilité aux antimicrobiens (AST) in vitro sont le pilier de la surveillance du traitement et de la détection du niveau de résistance aux antimicrobiens. Il s’agit d’une partie importante de la pharmacologie antimicrobienne et de la base essentielle de la médication clinique. Le Clinical and Laboratory Standards Institute (CLSI) des États-Unis et l’European Committee on Antimicrobial Susceptibility Testing (EUCAST) ont formulé et révisé les critères internationaux de l’AST et modifié et complété en permanence les méthodes AST et les points de rupture pour déterminer la CMI d’une certaine combinaison « organisme-agent antimicrobien » comme sensible (S), résistante (R) ou intermédiaire (I)3, 4. Le
Des années 1980 aux années 1990, les instruments automatiques de dilution du micro-bouillon ont été rapidement développés et appliqués à la pratique clinique, avec des exemples tels que Alfred 60AST, VITEK System, PHOENIXTM et Cobasbact 5,6,7. Cependant, ces instruments étaient coûteux, nécessitaient des consommables coûteux et leurs plages de détection étaient conçues pour les médicaments cliniquesdes patients 5,6,7. Pour ces raisons, ils ne sont pas adaptés à l’examen clinique vétérinaire et à la détection de grandes quantités de souches hautement résistantes. Dans cette étude, un système intelligent de criblage AST/phages à haut débit, comprenant un inoculateur matriciel à 96 points (Figure 1), un convertisseur d’acquisition d’images (Figure 2) et le logiciel correspondant8, a été mis au point pour effectuer une AST pour un lot de souches bactériennes contre plusieurs agents antimicrobiens à la fois par la méthode de dilution sur gélose. De plus, le système a également été utilisé pour détecter et analyser les schémas de lyse des phages contre les bactéries résistantes aux antimicrobiens9, et les phages lytiques ont été sélectionnés efficacement dans la bibliothèque de phages. Ce système s’est avéré efficace, abordable et facile à utiliser.
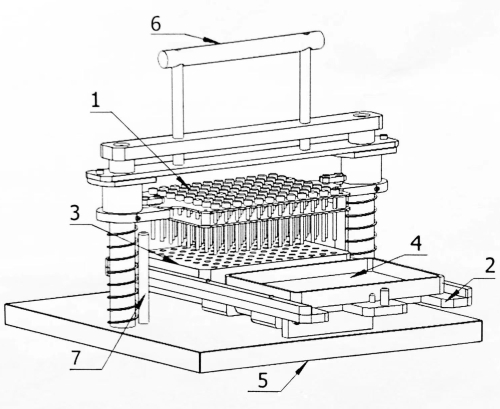
Figure 1 : Schéma structurel de l’inoculateur matriciel à 96 points. 1 : Plaque d’épingle d’inoculation ; 2 : Opérateur mobile ; 3 : Bloc de semences ; 4 : Plaque incubée ; 5 : Base ; 6 : Poignée de commande ; 7 : Goupille de limite. Veuillez cliquer ici pour voir une version agrandie de cette figure.
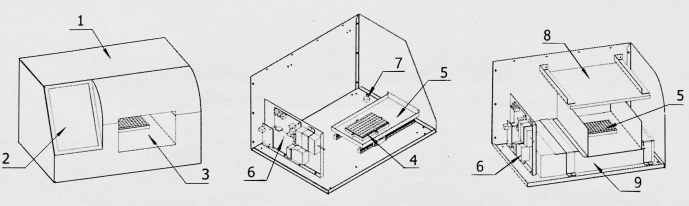
Figure 2 : Schéma structurel du convertisseur d’acquisition d’images. 1 : Coquille ; 2 : Écran d’affichage ; 3 : Salle d’acquisition d’images ; 4 : Base de la carte de détection ; 5 : Panneau de détection à l’intérieur et à l’extérieur de l’entrepôt ; 6 : Panneau de commande ; 7 : Dispositif de conversion d’acquisition d’images ; 8 : Source de lumière ; 9 : Scanner d’images. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocole
Les souches de Salmonella utilisées dans cette étude ont été prélevées sur des volailles du Shandong, en Chine, après avoir obtenu l’approbation du Comité de biosécurité de l’Institut des sciences animales et de médecine vétérinaire de l’Académie des sciences agricoles du Shandong, en Chine.
1. Application du système AST intelligent à haut débit8
- Préparation de l’inoculum
- Incuber l’organisme de contrôle de la qualité Escherichia coli et 93 souches de Salmonella à tester pour l’ASAT sur des plaques de gélose Mueller-Hinton (MHA) pendant 16 à 18 h à 37 °C3.
- Préparer l’inoculum de chaque souche pour qu’il corresponde à la norme de turbidité de McFarland de 0,5 selon la méthode spécifiée dans la norme CLSI3, puis diluer 10 fois.
- Placer 200 μL de solution saline normale stérile dans le 1er puits horizontal (A1) de la plaque à 96 puits en tant que témoin négatif, deux suspensions d’organisme de contrôle de la qualité dans les 2e et 3e puits horizontaux (A2 et A3) en tant que témoin positif et contrôle de la qualité, respectivement. Ajouter 200 μL des suspensions d’inoculum diluées de chaque coloration testée dans les 93 puits correspondants du bloc de semences à 96 puits.
- Préparation d’une plaque de gélose antimicrobienne
- Définissez les plages de concentration des différents agents antibactériens testés en fonction de la plage de calcul de l’indice Lar (de 0,125R à 8R). Les concentrations vont de la plage de contrôle de la qualité ou 0,0625R (sous réserve de la plage inférieure) à 8R.
REMARQUE : Si l’indice Lar n’est pas calculé, la plage de concentrations d’antibiotiques peut être réglée en fonction des besoins de l’AST. - Exécuter un schéma de dilution par doublement log2 pour la solution d’antibiotique en commençant par une concentration mère appropriée basée sur la méthode de dilution de la gélose spécifiée dans la norme CLSI3.
- Stériliser les flacons en verre de 50 ml contenant 18 ml de gélose Mueller-Hinton. Ajouter 2 mL des dilutions appropriées de la solution antimicrobienne à 18 mL de milieu fondu refroidi à 45-50 °C, bien mélanger et verser dans les plaques de l’enceinte de sécurité biologique.
- Laissez la gélose se solidifier à température ambiante (RT), laissez un espace sous le couvercle des plaques incubées et soufflez pour sécher la surface de la gélose avant de l’inoculer.
- Étiquetez les types d’agents antimicrobiens et les concentrations au verso des plaques incubées. Disposez les multiples plaques incubées de chaque agent antimicrobien dans une pile dans l’ordre de dilution du doublement log2.
- Préparez deux plaques de gélose sans médicament comme témoins pour chaque agent antimicrobien.
- Définissez les plages de concentration des différents agents antibactériens testés en fonction de la plage de calcul de l’indice Lar (de 0,125R à 8R). Les concentrations vont de la plage de contrôle de la qualité ou 0,0625R (sous réserve de la plage inférieure) à 8R.
- Étapes d’inoculation pour l’inoculateur matriciel à 96 points
- Installez la plaque d’inoculation autoclavée sur le support d’un inoculateur matriciel à 96 points dans l’enceinte de sécurité biologique.
- Placez le bloc de semences préparé avec les souches testées et une plaque incubée d’agar sur le support mobile, avec le même angle de positionnement pour les deux plaques.
- Poussez le support mobile de manière à ce que le bloc de semences se trouve directement sous la plaque d’inoculation.
- Appuyez sur la poignée de commande, déplacez la plaque de broches d’inoculation vers le bas et dirigez les 96 broches vers les inocules dans 96 puits du bloc de semences.
- Relâchez la poignée de commande avec la commande, puis réinitialisez la plaque de broches d’inoculation sous l’action du ressort.
- Appuyez 2 à 3 fois sur la poignée de commande pour bien remuer chaque inoculum et trempez-le. Poussez et déplacez la plaque de support de manière à ce que la plaque incubée se trouve directement sous la plaque de broches d’inoculation.
- Appuyez sur la poignée de commande, déplacez la plaque de broches d’inoculation vers le bas et arrêtez-vous pendant 1 à 2 secondes pour que les broches d’inoculation entrent complètement en contact avec la surface de la plaque incubée.
- Relâchez la poignée de commande. Cela complète une inoculation. Remplacez une autre plaque incubée et continuez le cycle jusqu’à ce qu’un groupe de plaques de gélose antimicrobienne soit terminé.
- Remplacez une autre plaque d’inoculation et un bloc de semences, et inoculez un autre groupe de souches testées. Cyclez jusqu’à ce que toutes les inoculations soient terminées.
REMARQUE : Inoculez d’abord une plaque de gélose de contrôle (sans agent antimicrobien), puis la plaque dans l’ordre de concentration du médicament de faible à élevée, et une deuxième plaque de gélose de contrôle en dernier pour vous assurer qu’il n’y a pas de contamination ou de transfert d’agent antimicrobien. Le volume d’inoculation dépend du volume du dépôt naturel de chaque broche d’environ 2 μL.
- Incubation des plaques de gélose antimicrobienne
- Incuber les plaques de gélose antimicrobienne inoculées à RT jusqu’à ce que l’humidité contenue dans les taches d’inoculum soit absorbée par la gélose.
- Retournez les plaques et incubez-les pendant 16 à 20 h à 37 °C pour les souches testées afin de vous assurer que les bactéries non inhibées forment des colonies.
- Acquisition d’images et statistiques de données
- Double-cliquez sur le système d’acquisition d’images AST matricielle à 96 points pour ouvrir le programme.
- Cliquez sur Informations sur le test dans la barre des tâches. Cliquez sur Nouveau pour créer une nouvelle tâche de test et remplissez les informations en fonction des invites, y compris le code, le nom, la source, les bactéries, le nombre de souches, les antibiotiques et le gradient.
- Cliquez sur Collecte de données > Photographier > élément de test pour sélectionner la nouvelle tâche créée. Cliquez sur Antibiotiques pour sélectionner le nom de l’antibiotique, puis cliquez sur Gradient pour sélectionner la concentration initiale de cet antibiotique.
- Cliquez sur Connecter pour vous connecter au convertisseur d’acquisition d’images.
- Placez les plaques incubées correspondantes sur la base de la plaque de détection avec l’angle manquant à l’avant droit pour l’orientation et poussez-les dans le convertisseur d’acquisition d’images.
- Cliquez sur Collection pour obtenir les images. Le gradient d’antibiotiques passera automatiquement au gradient suivant. Placez la plaque suivante à tour de rôle et continuez à cliquer sur Collection jusqu’à ce que les plaques de cet antibiotique aient été collectées.
- Cliquez sur Antibiotiques et sélectionnez le prochain ensemble de plaques incubées. Cliquez sur Dégradé pour sélectionner le dégradé de départ et passer à la prochaine série de collecte d’images.
- Après avoir terminé toutes les collectes, cliquez sur Envoyer. Le programme reconnaîtra automatiquement le nombre de pixels blancs formatés à chaque point d’inoculation dans les images, déterminera s’il y a formation de colonies et convertira les images en valeurs MIC.
- Cliquez sur Interroger pour obtenir tous les résultats de la CMI des souches par rapport aux antibiotiques testés.
REMARQUE : Le système AST intelligent à haut débit convient à la détermination des CMI de grands lots de souches bactériennes. Le processus de test, y compris la préparation, l’inoculation, l’incubation et la lecture des résultats, prend 3 jours. Les types d’antibiotiques et les plages de détection des CMI peuvent être réglés en fonction des besoins respectifs, et les principaux consommables peuvent être réutilisés.
- Calcul de l’indice Lar
- Déterminez l’indice Lar avec précision à l’aide de la formule : , où :
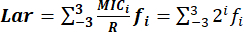
CMIi : concentration minimale inhibitrice.
La gamme de distributions de CMI de MIC-3 à MIC3 représente des concentrations en série doubles centrées sur R : 0,125R, 0,25R, 0,5R, R, 2R, 4R et 8R. est de 2 i et l’intervalle dei est compris entre -3 et 3.
est de 2 i et l’intervalle dei est compris entre -3 et 3.
R : les points de rupture de résistance des bactéries aux agents antimicrobiens normalisés par le CLSI.
f : la distribution de fréquence du MIC.
NOTE : L’indice Lar général est la moyenne arithmétique de tous les indices Lar. Une fois l’indice Lar calculé, arrondissez la valeur finale à deux chiffres significatifs après la virgule.
- Déterminez l’indice Lar avec précision à l’aide de la formule : , où :
2. Système intelligent de criblage de phages à haut débit9
- Préparation du bloc de graines de phages et des plaques incubées à double couche contenant des bactéries.
- Utilisez la méthode de gélose à double couche10 ou la méthode de culture liquide11 pour fabriquer différents phages. Diluer à une concentration parallèle appropriée avec un titre de 1 x 104-5 pfu/mL, et ajouter 200 μL de l’inoculum de phage dans le bloc de semences à 96 puits.
- Fabriquer des plaques à double couche avec des bactéries (10 mL de gélose inférieure [gélose 12 g/L] et 6 mL de gélose supérieure [6 g/L] avec 100 μL de bactéries [0,5 McFarland]) à tester.
- Fabriquez une plaque incubée à double couche pour chaque souche à tester. Laissez un espace sous le couvercle de la plaque à double couche et soufflez pour sécher la surface de la gélose dans l’enceinte de sécurité biologique.
- Test de dépistage
- Placez le bloc de graines de phage préparé et la plaque à double couche sur le support mobile de l’inoculateur matriciel à 96 points et transférez tous les inocula de phage sur la surface de la gélose semi-agée. Continuez les cycles jusqu’à ce que toutes les souches testées soient terminées.
- Laissez les plaques à double couche inoculées rester à RT jusqu’à ce que l’humidité dans les taches d’inoculum soit complètement absorbée dans la gélose semi-aclé.
- Retournez les plaques et incubez-les dans des conditions appropriées pour les souches testées pendant 4 à 6 h pour vous assurer que des taches lytiques claires se forment.
- Analyse des données
- Obtenir et enregistrer l’image du résultat expérimental de chaque plaque double couche par le convertisseur d’acquisition d’images (étapes 1.5.4-1.5.6).
- Enregistrez le nombre et la morphologie des différentes formes de taches dans une feuille de calcul à partir des images obtenues, et calculez les proportions respectives des différents types de phages.
Résultats
Suivant le protocole du système AST intelligent à haut débit, son application a été illustrée par Salmonella provenant de volailles du Shandong, en Chine, à titre d’exemple.
La figure 3 montre la croissance de souches de Salmonella sur des plaques de gélose contenant de l’ampicilline (R de 32 μg/mL) à des concentrations de 2 à 256 μg/mL déterminées par le convertisseur d’acquisition d’images. Le1er puits horizonta...
Discussion
La méthode de dilution de la gélose est bien établie et largement utilisée. Le principe du système AST à haut débit était celui de la méthode de dilution sur gélose. L’une des étapes critiques du protocole a été le transfert précis à haut débit de 96 inocula en une seule fois, qui a été effectué plusieurs fois de suite. Pour compléter cette étape critique, les broches de l’inoculateur matriciel à 96 points étaient uniformes et très lisses. Le dépôt naturel de chaque broche était d’un volu...
Déclarations de divulgation
Yuqing Liu et al. ont déposé des brevets chinois pour l’inoculateur matriciel à 96 points et le convertisseur d’acquisition d’images et leurs applications (numéro de brevet ZL 201610942866.3 et numéro de brevet ZL 201910968255.X).
Remerciements
Ces travaux ont été financés par le Projet national de recherche et de développement clé (2019YFA0904003) ; Système industriel agricole moderne dans la province du Shandong (SDAIT-011-09) ; Projet d’optimisation de la plate-forme de coopération internationale (CXGC2023G15) ; Principales tâches d’innovation du projet d’innovation en sciences et technologies agricoles de l’Académie des sciences agricoles du Shandong, Chine (CXGC2023G03).
matériels
| Name | Company | Catalog Number | Comments |
| 96 well culture plate | Beijing lanjieke Technology Co., Ltd | 11510 | |
| 96-dot matrix AST image acquisition system | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| 96-dot matrix inoculator | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Patented product |
| Agar | Qingdao hi tech Industrial Park Haibo Biotechnology Co., Ltd | HB8274-1 | |
| Amikacin | Shanghai McLean Biochemical Technology Co., Ltd | A857053 | |
| Amoxicillin | Shanghai McLean Biochemical Technology Co., Ltd | A822839 | |
| Ampicillin | Shanghai McLean Biochemical Technology Co., Ltd | A830931 | |
| Analytical balance | Sartorius | BSA224S | |
| Automated calculation software for Lar index of AMR | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Bacteria Salmonella strains | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Animal origin |
| Bacterial resistance Lar index certification management system V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Ceftiofur | Shanghai McLean Biochemical Technology Co., Ltd | C873619 | |
| Ciprofloxacin | Shanghai McLean Biochemical Technology Co., Ltd | C824343 | |
| Clavulanic acid | Shanghai McLean Biochemical Technology Co., Ltd | C824181 | |
| Clean worktable | Suzhou purification equipment Co., Ltd | SW-CJ-2D | |
| Colistin sulfate | Shanghai McLean Biochemical Technology Co., Ltd | C805491 | |
| Culture plate | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Patented product |
| Doxycycline | Shanghai McLean Biochemical Technology Co., Ltd | D832390 | |
| Enrofloxacin | Shanghai McLean Biochemical Technology Co., Ltd | E809130 | |
| Filter 0.22 μm | Millipore | SLGP033RB | |
| Florfenicol | Shanghai McLean Biochemical Technology Co., Ltd | F809685 | |
| Gentamicin | Shanghai McLean Biochemical Technology Co., Ltd | G810322 | |
| Glass bottle 50 mL | Xuzhou Qianxing Glass Technology Co., Ltd | QX-7 | |
| High-throughput resistance detection system V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Image acquisition converter | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Patented product |
| Meropenem | Shanghai McLean Biochemical Technology Co., Ltd | M861173 | |
| Mueller-Hinton agar | Qingdao hi tech Industrial Park Haibo Biotechnology Co., Ltd | HB6232 | |
| Petri dish 60 mm x 15 mm | Qingdao Jindian biochemical equipment Co., Ltd | 16021-1 | |
| Petri dish 90 mm x 15 mm | Qingdao Jindian biochemical equipment Co., Ltd | 16001-1 | |
| Salmonella phages | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | |
| Shaker incubator | Shanghai Minquan Instrument Co., Ltd | MQD-S2R | |
| Turbidimeter | Shanghai XingBai Biotechnology Co., Ltd | F-TC2015 | |
| Varms base type library system V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Vertical high-pressure steam sterilizer | Shanghai Shen'an medical instrument factory | LDZX-75L | |
| Veterinary pathogen resistance testing management system | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Veterinary resistance cloud monitoring and phage control platform V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright |
Références
- Ramanan, L., et al. Antimicrobial resistance-the need for global solutions. The Lancet Infectious Diseases. 13 (12), 1057-1098 (2013).
- Xiaonan, Z., Qing, Z., Thomas, S. P., Yuqing, L., Martha, R. J. C. inPhocus: Perspectives of the application of bacteriophages in poultry and aquaculture industries based on Varms in China. PHAGE: Therapy, Applications, and Research. 2 (2), 69-74 (2021).
- CLSI. . Performance Standards for Antimicrobial Disk Susceptibility Tests. CLSI document M100. , (2022).
- Yuqing, L., et al. . Antimicrobial Sensitivity Testing Standard of EUCAST. , (2017).
- Barnini, S., et al. A new rapid method for direct antimicrobial susceptibility testing of bacteria from positive blood cultures. BMC Microbiology. 16 (1), 185-192 (2016).
- Höring, S., Massarani, A. S., Löffler, B., Rödel, J. Rapid antimicrobial susceptibility testing in blood culture diagnostics performed by direct inoculation using the VITEK®-2 and BD PhoenixTM platforms. European Journal of Clinical Microbiology & Infectious Diseases. 38 (3), 471-478 (2019).
- Dupuis, G. Evaluation of the Cobasbact automated antimicrobial susceptibility testing system. European Journal of Clinical Microbiology & Infectious Diseases. 4 (2), 119-122 (1985).
- Liu, Y., et al. A system of bacterial antimicrobial resistance detection and its operation method. China Patent. , (2019).
- Liu, Y. A high throughput test plate for screening bacteriophage of zoonotic pathogens and its application. China Patent. , (2022).
- Adams, M. H. . Bacteriophages. , (1959).
- Nair, A., Ghugare, G. S., Khairnar, K. An appraisal of bacteriophage isolation techniques from environment. Microbial Ecology. 83 (3), 519-535 (2022).
- . . Shandong veterinary antibiotic resistance system. , (2023).
- Ming, H., et al. Comparison of the results of 96-dot agar dilution method and broth microdilution method. Chinese Journal of Antibiotics. 43 (6), 729-733 (2018).
- Laxminarayan, R., Klugman, K. P. Communicating trends in resistance using a drug resistance index. BMJ Open. 1 (2), e000135 (2011).
- Chen, Y., et al. Assessing antibiotic therapy effectiveness against the major bacterial pathogens in a hospital using an integrated index. Future Microbiology. 12, 853-866 (2017).
- Ciccolini, M., Spoorenberg, V., Geerlings, S. E., Prins, J. M., Grundmann, H. Using an index-based approach to assess the population-level appropriateness of empirical antibiotic therapy. Journal of Antimicrobial Chemotherapy. 70 (1), 286-293 (2015).
- Yanbo, L., et al. Preliminary application of inoculation system for high-throughput drug susceptibility test. China Poultry. 42 (6), 52-57 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon