Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Применение интеллектуальной высокопроизводительной системы тестирования чувствительности к противомикробным препаратам/скрининга фагов и индекса устойчивости к противомикробным препаратам Lar
В этой статье
Резюме
Здесь мы познакомим вас с принципом, структурой и инструкцией интеллектуальной высокопроизводительной системы тестирования чувствительности к противомикробным препаратам/скрининга фагов. Его применение проиллюстрировано на примере сальмонеллы , выделенной от домашней птицы в провинции Шаньдун, Китай. Рассчитан индекс Лара и всесторонне рассмотрено его значение в оценке антимикробной резистентности.
Аннотация
Для повышения эффективности тестирования на чувствительность к противомикробным препаратам (AST) и высокопроизводительного скрининга фагов на резистентные бактерии, а также для снижения затрат на обнаружение, была разработана интеллектуальная высокопроизводительная система AST/фагового скрининга, включающая 96-точечный матричный инокулятор, преобразователь получения изображений и соответствующее программное обеспечение, в соответствии с критериями AST и точками разрыва резистентности (R), сформулированными Институтом клинических и лабораторных стандартов (CLSI). АСТ и статистические данные о распределении минимальной ингибирующей концентрации (МПК) (от R/8 до 8R) 1500 штаммов сальмонеллы , выделенных от домашней птицы в Шаньдуне, Китай, по сравнению с 10 антимикробными агентами были проведены с помощью интеллектуальной высокопроизводительной системы скрининга АСТ/фагов. Индекс Лара, означающий «меньше антибиотика, меньше резистентности и остаточный до тех пор, пока антибиотика мало», был получен путем вычисления средневзвешенного значения каждого МПК и деления на R. Такой подход повышает точность по сравнению с использованием показателя распространенности резистентности для характеристики степени устойчивости к противомикробным препаратам (УПП) штаммов с высокой устойчивостью. Для штаммов сальмонелл с высоким УПП литические фаги были эффективно отобраны из библиотеки фагов с помощью этой системы, а также рассчитан и проанализирован спектр лизиса. Результаты показали, что интеллектуальная высокопроизводительная система скрининга АСТ/фагов является работоспособной, точной, высокоэффективной, недорогой и простой в обслуживании. В сочетании с Шаньдунской ветеринарной системой мониторинга устойчивости к противомикробным препаратам эта система была пригодна для научных исследований и клинического выявления УПП.
Введение
Поскольку противомикробные препараты широко используются для профилактики бактериальных инфекционных заболеваний, устойчивость к противомикробным препаратам (УПП) стала глобальной проблемой общественногоздравоохранения1. Борьба с УПП в настоящее время является основной миссией мониторинга УПП эпидемиологических патогенов и синергической терапии чувствительных антимикробных препаратов и литических бактериофагов2.
Тестирование чувствительности к противомикробным препаратам in vitro (АСТ) является основой для мониторинга терапии и определения уровня УПП. Это важная часть фармакологии противомикробных препаратов и важнейшая основа для клинических препаратов. Институт клинических и лабораторных стандартов (CLSI) Соединенных Штатов Америки и Европейский комитет по тестированию на чувствительность к противомикробным препаратам (EUCAST) сформулировали и пересмотрели международные критерии АСТ, а также постоянно модифицировали и дополняли методы АСТ и контрольные точки для определения МПК одной определенной комбинации «организм-антимикробный агент» как чувствительного (S), резистентного (R) или промежуточного (I)3. 4. См.
В период с 1980-х по 1990-е годы были быстро разработаны и применены в клинической практике автоматические приборы для разведения микробульона, в том числе Alfred 60AST, VITEK System, PHOENIXTM и Cobasbact 5,6,7. Однако эти приборы были дорогими, требовали дорогостоящих расходных материалов, а их диапазоны обнаружения были рассчитаны на клиническое лечение пациентов 5,6,7. По этим причинам они не подходят для ветеринарного клинического обследования и выявления больших количеств высокорезистентных штаммов. В данном исследовании была разработана интеллектуальная высокопроизводительная система скрининга АСТ/фагов, включающая 96-точечный матричный инокулятор (рис. 1), преобразователь получения изображений (рис. 2) и соответствующее программное обеспечение8, для проведения АСТ для партии штаммов бактерий против нескольких антимикробных агентов одновременно методом агарового разведения. Кроме того, система также использовалась для обнаружения и анализа паттернов лизиса фагов против устойчивых к противомикробным препаратам бактерий9, а литические фаги были эффективно отобраны из библиотеки фагов. Эта система оказалась эффективной, доступной и простой в эксплуатации.
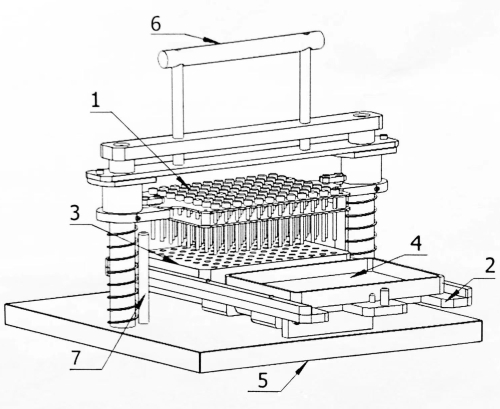
Рисунок 1: Структурная схема 96-точечного матричного инокулятора. 1: Штифтовая пластина для прививки; 2: Оператор мобильной связи; 3: Исходный блок; 4: Инкубационная пластина; 5: База; 6: Рукоятка управления; 7: Ограничительный штифт. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
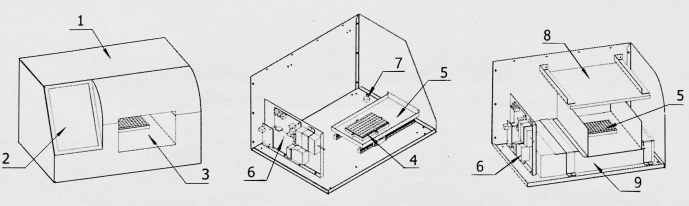
Рисунок 2: Структурная схема конвертера для получения изображений. 1: Оболочка; 2: Экран дисплея; 3: Помещение для получения изображений; 4: Основание платы детектирования; 5: Доска обнаружения на складе и за его пределами; 6: Пульт управления; 7: Устройство преобразования изображения; 8: Источник света; 9: Сканер изображений. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
протокол
Штаммы сальмонеллы, использованные в этом исследовании, были получены от домашней птицы в провинции Шаньдун, Китай, после получения одобрения от Комитета по биобезопасности Института животноводства и ветеринарной медицины Шаньдунской академии сельскохозяйственных наук, Китай.
1. Применение интеллектуальной высокопроизводительной системы АСТ8
- Подготовка посевного материала
- Инкубируют микроорганизм контроля качества Escherichia coli и 93 штамма сальмонеллы для тестирования на АСТ на планшетах из агара Мюллера-Хинтона (MHA) в течение 16-18 ч при 37 °C3.
- Приготовьте посевной материал каждого штамма в соответствии со стандартом мутности 0,5 по Мак-Фарланду на основе метода, указанного в стандарте CLSI3, а затем разбавьте в 10 раз.
- Поместите 200 мкл стерильного физиологического раствора в горизонтальную 1-ю лунку (А1) 96-луночной планшета в качестве отрицательного контроля, две суспензии микроорганизма контроля качества в горизонтальные 2-ю и3-ю лунки (А2 и А3) в качестве положительного контроля и контроля качества, соответственно. Добавьте 200 мкл разбавленной суспензии посевного материала каждого испытуемого пятна в соответствующие 93 лунки в 96-луночном семенном блоке.
- Приготовление антимикробной агаровой пластины
- Установите диапазоны концентраций различных антибактериальных средств, тестируемых в соответствии с диапазоном расчета индекса Лара (от 0,125R до 8R). Концентрация колеблется от диапазона контроля качества или 0,0625R (в зависимости от нижнего диапазона) до 8R.
ПРИМЕЧАНИЕ: Если индекс Лара не рассчитан, диапазон концентраций антибиотиков может быть установлен в соответствии с потребностями АСТ. - Выполняйте схему удвоения log2 для раствора антибиотика, начиная с подходящей концентрации запаса на основе метода разбавления агара, указанного в стандартеCLSI 3.
- Стерилизовать стеклянные флаконы объемом 50 мл, содержащие 18 мл агаровой среды Мюллера-Хинтона. Добавьте 2 мл соответствующих разведений противомикробного раствора к 18 мл расплавленной среды, охлажденной до 45-50 °C, тщательно перемешайте и разлейте по тарелкам в шкафу биобезопасности.
- Дайте агару застыть при комнатной температуре (RT), оставьте зазор под крышкой инкубированных планшетов и продуйте, чтобы высушить поверхность агара перед инокуляцией.
- Маркируйте типы противомикробных агентов и их концентрации на обратной стороне инкубированных планшетов. Расположите несколько инкубационных планшетов каждого противомикробного препарата в стопку в порядке удвоения log2.
- Подготовьте две безлекарственные агаровые пластины в качестве контрольных для каждого противомикробного средства.
- Установите диапазоны концентраций различных антибактериальных средств, тестируемых в соответствии с диапазоном расчета индекса Лара (от 0,125R до 8R). Концентрация колеблется от диапазона контроля качества или 0,0625R (в зависимости от нижнего диапазона) до 8R.
- Этапы инокуляции для 96-точечного матричного инокулятора
- Установите булавочную пластину для автоклавного инокуляции на опору 96-точечного матричного инокулятора в шкафу биобезопасности.
- Подготовленный семенной блок с испытуемыми штаммами и агаровую инкубационную пластину помещают на подвижный носитель с одинаковым углом позиционирования для двух планшетов.
- Сдвиньте передвижной держатель так, чтобы семенной блок находился прямо под пластиной инокуляционного штифта.
- Нажмите на рукоятку управления, переместите пластину инокуляционного штифта вниз и направьте штифты 96 на инокуляцию в 96 лунок семенного блока.
- Отпустите рукоятку управления с управлением, затем сбросьте пластину штифта прививки под действием пружины.
- Нажмите на ручку управления 2-3 раза, чтобы хорошо перемешать каждый посевной материал и окунуть. Надавите и переместите несущую пластину так, чтобы инкубационная пластина находилась прямо под пластиной для прививки.
- Нажмите на рукоятку управления, переместите пластину инокуляционного штифта вниз и остановитесь на 1-2 с, чтобы инокуляционные штифты полностью соприкоснулись с поверхностью инкубируемой планшета.
- Отпустите рукоятку управления. На этом одна прививка завершена. Замените другую инкубационную чашку и продолжайте цикл до тех пор, пока не закончится одна группа антимикробных агаровых планшетов.
- Замените другую инокуляционную контактную пластину и семенной блок и инокуляцию другой группы тестируемых штаммов. Цикл до тех пор, пока все прививки не будут завершены.
ПРИМЕЧАНИЕ: Сначала засейте контрольную агаровую пластину (без антимикробного агента), затем планшет в порядке концентрации препарата от низкой до высокой и вторую контрольную агаровую пластину последней, чтобы убедиться в отсутствии загрязнения или переноса антимикробного агента. Объем инокуляции зависит от объема естественного осаждения каждого штифта, составляющего примерно 2 мкл.
- Инкубация антимикробных агаровых планшетов
- Инкубируют модифицированные антимикробные агаровые пластины при РТ до тех пор, пока влага в пятнах посева не впитается в агар.
- Переверните планшеты и инкубируйте их в течение 16-20 ч при 37 °C для испытуемых штаммов, чтобы убедиться, что неингибированные бактерии образуют колонии.
- Получение изображений и статистика данных
- Дважды щелкните по 96-точечной матричной системе получения изображений AST , чтобы открыть программу.
- Нажмите « Тестовая информация » на панели задач. Нажмите « Создать », чтобы создать новое тестовое задание, и заполните информацию в соответствии с подсказками, включая код, название, источник, бактерии, количество штаммов, антибиотиков и градиент.
- Нажмите на пункт Data Collection > Photograph > Test , чтобы выбрать новую созданную задачу. Нажмите « Антибиотики », чтобы выбрать название антибиотика, и нажмите « Градиент », чтобы выбрать начальную концентрацию этого антибиотика.
- Нажмите « Подключиться», чтобы подключиться к конвертеру для получения изображений.
- Поместите соответствующие инкубированные планшеты на основание планшета обнаружения так, чтобы недостающий угол был справа спереди для ориентации, и вставьте их в конвертер для получения изображений.
- Нажмите на Коллекцию , чтобы получить изображения. Градиент антибиотика автоматически перейдет к следующему градиенту. Поместите следующую тарелку по очереди и продолжайте нажимать на «Сбор » до тех пор, пока не будут собраны пластины для этого антибиотика.
- Нажмите « Антибиотики» и выберите следующий набор инкубационных планшетов. Нажмите на Градиент, чтобы выбрать начальный градиент и перейти к следующему раунду сбора изображений.
- После завершения всех коллекций нажмите « Отправить». Программа автоматически распознает количество белых пикселей, отформатированных в каждой точке посева на изображениях, определит, есть ли образование колоний, и преобразует изображения в значения MIC.
- Нажмите « Запрос», чтобы получить все результаты МПК штаммов против тестируемых антибиотиков.
ПРИМЕЧАНИЕ: Интеллектуальная высокопроизводительная система AST подходит для определения MICs больших партий бактериальных штаммов. Процесс тестирования, включая подготовку, посев, инкубацию и считывание результатов, занимает 3 дня. Типы антибиотиков и диапазоны обнаружения МПК могут быть установлены в соответствии с соответствующими потребностями, а основные расходные материалы могут быть использованы повторно.
- Расчет индекса Лара
- Точно определите индекс Лара по формуле: , где:
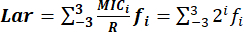
MICi: минимальная ингибирующая концентрация.
Диапазон распределений МПК от MIC-3 до MIC3 представляет собой последовательные двойные концентрации, центрированные на R: 0,125R, 0,25R, 0,5R, R, 2R, 4R и 8R. равен 2i, а диапазон i равен -3 до 3.
равен 2i, а диапазон i равен -3 до 3.
R: точки разрыва резистентности бактерий к антимикробным препаратам, стандартизированные CLSI.
f: частотное распределение микрофона.
ПРИМЕЧАНИЕ: Общий индекс Лара представляет собой среднее арифметическое всех индексов Лара. После вычисления индекса Lar округлите итоговое значение до двух значащих цифр после запятой.
- Точно определите индекс Лара по формуле: , где:
2. Интеллектуальная высокопроизводительная система фагового скрининга9
- Подготовка фагового затравочного блока и двухслойных инкубационных планшетов, содержащих бактерии.
- Для получения различных фагов используют метод10 двухслойного агара или метод11 жидкого культивирования. Разбавляют до подходящей параллельной концентрации с титром 1 x 104-5 КОЕ/мл и добавляют 200 мкл фагового посевного материала в 96-луночный посевной блок.
- Изготовьте двухслойные пластины с бактериями (10 мл нижней агаровой среды [агар 12 г/л] и 6 мл верхней полуагарной среды [6 г/л] со 100 мкл бактерий [0,5 Макфарланда]) для испытания.
- Сделайте двухслойную инкубационную пластину для каждого тестируемого штамма. Оставьте зазор под крышкой двухслойной пластины и выдуйте для просушки поверхность агара в шкафу биобезопасности.
- Скрининговый тест
- Подготовленный фаговый затравочный блок и двухслойную пластину поместить на мобильный носитель 96-точечного матричного инокулятора и перенести весь фаговый посевной материал на поверхность полуагара. Продолжайте циклы до тех пор, пока не будут завершены все тестируемые штаммы.
- Оставьте модифицированные двухслойные пластины на RT до тех пор, пока влага в пятнах посева полностью не впитается в полуагар.
- Переверните планшеты и инкубируйте в условиях, подходящих для испытуемых штаммов, в течение 4-6 ч, чтобы обеспечить образование четких литических пятен.
- Анализ данных
- Получение и сохранение изображения экспериментального результата каждой двухслойной пластины с помощью преобразователя получения изображений (шаги 1.5.4-1.5.6).
- Запишите количество и морфологию пятен различной формы в электронную таблицу на основе полученных изображений и рассчитайте соответствующие пропорции различных видов фагов.
Результаты
Следуя протоколу интеллектуальной высокопроизводительной системы АСТ, ее применение было проиллюстрировано на примере сальмонеллы домашней птицы в провинции Шаньдун, Китай.
Рост штаммов сальмонелл на агаровых пластинах с ампициллином (R 32 мкг/мл) в концентрац...
Обсуждение
Метод разбавления агаром хорошо зарекомендовал себя и широко используется. Принцип работы высокопроизводительной системы АСТ был основан на методе разбавления агара. Одним из важнейших шагов в рамках протокола была точная высокопроизводительная передача 96 инокулей за один раз, кото?...
Раскрытие информации
Yuqing Liu et al. подали заявки на китайские патенты на 96-точечный матричный инокулятор и преобразователь для получения изображений и их применение (патент No ZL 201610942866.3 и патент No ZL 201910968255.X).
Благодарности
Работа выполнена при поддержке Национального проекта по ключевым исследованиям и разработкам (2019YFA0904003); Современная сельскохозяйственная промышленная система в провинции Шаньдун (SDAIT-011-09); Проект по оптимизации платформы международного сотрудничества (CXGC2023G15); Основные инновационные задачи сельскохозяйственной науки и техники, инновационный проект Академии сельскохозяйственных наук, Шаньдун, Китай (CXGC2023G03).
Материалы
| Name | Company | Catalog Number | Comments |
| 96 well culture plate | Beijing lanjieke Technology Co., Ltd | 11510 | |
| 96-dot matrix AST image acquisition system | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| 96-dot matrix inoculator | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Patented product |
| Agar | Qingdao hi tech Industrial Park Haibo Biotechnology Co., Ltd | HB8274-1 | |
| Amikacin | Shanghai McLean Biochemical Technology Co., Ltd | A857053 | |
| Amoxicillin | Shanghai McLean Biochemical Technology Co., Ltd | A822839 | |
| Ampicillin | Shanghai McLean Biochemical Technology Co., Ltd | A830931 | |
| Analytical balance | Sartorius | BSA224S | |
| Automated calculation software for Lar index of AMR | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Bacteria Salmonella strains | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Animal origin |
| Bacterial resistance Lar index certification management system V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Ceftiofur | Shanghai McLean Biochemical Technology Co., Ltd | C873619 | |
| Ciprofloxacin | Shanghai McLean Biochemical Technology Co., Ltd | C824343 | |
| Clavulanic acid | Shanghai McLean Biochemical Technology Co., Ltd | C824181 | |
| Clean worktable | Suzhou purification equipment Co., Ltd | SW-CJ-2D | |
| Colistin sulfate | Shanghai McLean Biochemical Technology Co., Ltd | C805491 | |
| Culture plate | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Patented product |
| Doxycycline | Shanghai McLean Biochemical Technology Co., Ltd | D832390 | |
| Enrofloxacin | Shanghai McLean Biochemical Technology Co., Ltd | E809130 | |
| Filter 0.22 μm | Millipore | SLGP033RB | |
| Florfenicol | Shanghai McLean Biochemical Technology Co., Ltd | F809685 | |
| Gentamicin | Shanghai McLean Biochemical Technology Co., Ltd | G810322 | |
| Glass bottle 50 mL | Xuzhou Qianxing Glass Technology Co., Ltd | QX-7 | |
| High-throughput resistance detection system V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Image acquisition converter | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Patented product |
| Meropenem | Shanghai McLean Biochemical Technology Co., Ltd | M861173 | |
| Mueller-Hinton agar | Qingdao hi tech Industrial Park Haibo Biotechnology Co., Ltd | HB6232 | |
| Petri dish 60 mm x 15 mm | Qingdao Jindian biochemical equipment Co., Ltd | 16021-1 | |
| Petri dish 90 mm x 15 mm | Qingdao Jindian biochemical equipment Co., Ltd | 16001-1 | |
| Salmonella phages | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | |
| Shaker incubator | Shanghai Minquan Instrument Co., Ltd | MQD-S2R | |
| Turbidimeter | Shanghai XingBai Biotechnology Co., Ltd | F-TC2015 | |
| Varms base type library system V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Vertical high-pressure steam sterilizer | Shanghai Shen'an medical instrument factory | LDZX-75L | |
| Veterinary pathogen resistance testing management system | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Veterinary resistance cloud monitoring and phage control platform V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright |
Ссылки
- Ramanan, L., et al. Antimicrobial resistance-the need for global solutions. The Lancet Infectious Diseases. 13 (12), 1057-1098 (2013).
- Xiaonan, Z., Qing, Z., Thomas, S. P., Yuqing, L., Martha, R. J. C. inPhocus: Perspectives of the application of bacteriophages in poultry and aquaculture industries based on Varms in China. PHAGE: Therapy, Applications, and Research. 2 (2), 69-74 (2021).
- CLSI. . Performance Standards for Antimicrobial Disk Susceptibility Tests. CLSI document M100. , (2022).
- Yuqing, L., et al. . Antimicrobial Sensitivity Testing Standard of EUCAST. , (2017).
- Barnini, S., et al. A new rapid method for direct antimicrobial susceptibility testing of bacteria from positive blood cultures. BMC Microbiology. 16 (1), 185-192 (2016).
- Höring, S., Massarani, A. S., Löffler, B., Rödel, J. Rapid antimicrobial susceptibility testing in blood culture diagnostics performed by direct inoculation using the VITEK®-2 and BD PhoenixTM platforms. European Journal of Clinical Microbiology & Infectious Diseases. 38 (3), 471-478 (2019).
- Dupuis, G. Evaluation of the Cobasbact automated antimicrobial susceptibility testing system. European Journal of Clinical Microbiology & Infectious Diseases. 4 (2), 119-122 (1985).
- Liu, Y., et al. A system of bacterial antimicrobial resistance detection and its operation method. China Patent. , (2019).
- Liu, Y. A high throughput test plate for screening bacteriophage of zoonotic pathogens and its application. China Patent. , (2022).
- Adams, M. H. . Bacteriophages. , (1959).
- Nair, A., Ghugare, G. S., Khairnar, K. An appraisal of bacteriophage isolation techniques from environment. Microbial Ecology. 83 (3), 519-535 (2022).
- . . Shandong veterinary antibiotic resistance system. , (2023).
- Ming, H., et al. Comparison of the results of 96-dot agar dilution method and broth microdilution method. Chinese Journal of Antibiotics. 43 (6), 729-733 (2018).
- Laxminarayan, R., Klugman, K. P. Communicating trends in resistance using a drug resistance index. BMJ Open. 1 (2), e000135 (2011).
- Chen, Y., et al. Assessing antibiotic therapy effectiveness against the major bacterial pathogens in a hospital using an integrated index. Future Microbiology. 12, 853-866 (2017).
- Ciccolini, M., Spoorenberg, V., Geerlings, S. E., Prins, J. M., Grundmann, H. Using an index-based approach to assess the population-level appropriateness of empirical antibiotic therapy. Journal of Antimicrobial Chemotherapy. 70 (1), 286-293 (2015).
- Yanbo, L., et al. Preliminary application of inoculation system for high-throughput drug susceptibility test. China Poultry. 42 (6), 52-57 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены