É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Aplicação do Sistema Inteligente de Teste de Sensibilidade Antimicrobiana de Alto Rendimento/Phage Screening System e Índice Lar de Resistência Antimicrobiana
Neste Artigo
Resumo
Aqui apresentamos o princípio, a estrutura e a instrução do sistema inteligente de teste de sensibilidade antimicrobiana de alto rendimento/triagem de fagos. Sua aplicação é ilustrada usando Salmonella isolada de aves em Shandong, China, como exemplo. O índice Lar é calculado, e sua importância na avaliação da resistência antimicrobiana é discutida de forma abrangente.
Resumo
Para melhorar a eficiência do teste de sensibilidade antimicrobiana (AST) e da triagem de alto rendimento de fago para bactérias resistentes e reduzir o custo de detecção, um sistema inteligente de triagem de AST/fago de alto rendimento, incluindo um inoculador de matriz de 96 pontos, conversor de aquisição de imagem e software correspondente, foi desenvolvido de acordo com os critérios AST e os pontos de quebra de resistência (R) formulados pelo Clinical & Laboratory Standards Institute (CLSI). AST e estatísticas de distribuição da concentração inibitória mínima (CIM) (de R/8 a 8R) de 1.500 cepas de Salmonella isoladas de aves em Shandong, China, contra 10 agentes antimicrobianos, foram realizadas pelo sistema inteligente de triagem AST/fago de alto rendimento. O índice Lar, que significa "menos antibiose, menor resistência e residual até pouca antibiose", foi obtido calculando-se a média ponderada de cada CIM e dividindo-se por R. Essa abordagem melhora a acurácia em comparação com o uso da prevalência de resistência para caracterizar o grau de resistência antimicrobiana (RAM) de cepas altamente resistentes. Para as cepas de Salmonella com alto AMR, fagos líticos foram eficientemente selecionados da biblioteca de fagos por este sistema, e o espectro de lise foi computado e analisado. Os resultados mostraram que o sistema inteligente de triagem AST/fago de alto rendimento era operável, preciso, altamente eficiente, barato e de fácil manutenção. Combinado com o sistema de monitoramento da resistência antimicrobiana veterinária Shandong, o sistema foi adequado para pesquisa científica e detecção clínica relacionada à RAM.
Introdução
Como os agentes antimicrobianos têm sido amplamente utilizados na prevenção de doenças infecciosas bacterianas, a resistência antimicrobiana (RAM) tornou-se um problema de saúde pública mundial1. O combate à RAM é a principal missão atual de monitoramento da RAM de patógenos epidemiológicos e terapia sinérgica de agentes antimicrobianos sensíveis e bacteriófagos líticos2.
O teste de sensibilidade antimicrobiana in vitro (AST) é a base para monitorar a terapia e detectar o nível de RAM. É uma parte importante da farmacologia antimicrobiana e a base crítica para a medicação clínica. O Clinical and Laboratory Standards Institute (CLSI) dos Estados Unidos e o European Committee on Antimicrobial Susceptibility Testing (EUCAST) formularam e revisaram critérios internacionais de AST e continuamente modificaram e complementaram os métodos AST e os pontos de interrupção para determinar a CIM de uma determinada combinação "organismo e agente antimicrobiano" como sensível (S), resistente (R) ou intermediário (I)3, 4º.
Entre as décadas de 1980 e 1990, instrumentos automáticos de microdiluição em caldo foram rapidamente desenvolvidos e aplicados à prática clínica, com exemplos como Alfred 60AST, VITEK System, PHOENIX® e Cobasbact 5,6,7. No entanto, esses instrumentos eram caros, exigiam consumíveis de alto custo e suas faixas de detecção foram projetadas para medicação clínica do paciente 5,6,7. Por essas razões, não são adequados para exame clínico veterinário e detecção de grandes quantidades de cepas altamente resistentes. Neste estudo, um sistema inteligente de triagem AST/fago de alto rendimento, incluindo um inoculador de matriz de 96 pontos (Figura 1), conversor de aquisição de imagens (Figura 2) e software correspondente8, foi desenvolvido para conduzir AST para um lote de cepas de bactérias contra múltiplos agentes antimicrobianos ao mesmo tempo pelo método de diluição em ágar. Além disso, o sistema também foi usado para detectar e analisar os padrões de lise de fagos contra bactérias resistentes a antimicrobianos9, e fagos líticos foram selecionados eficientemente da biblioteca de fagos. Este sistema mostrou-se eficiente, acessível e fácil de operar.
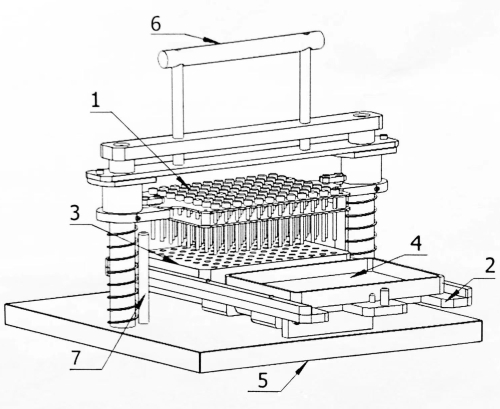
Figura 1: Diagrama estrutural do inoculador matricial de 96 pontos. 1: Placa de pino de inoculação; 2: Operadora de celular; 3: Bloco de sementes; 4: Placa incubada; 5: Base; 6: Alça de operação; 7: Pino de limite. Clique aqui para ver uma versão maior desta figura.
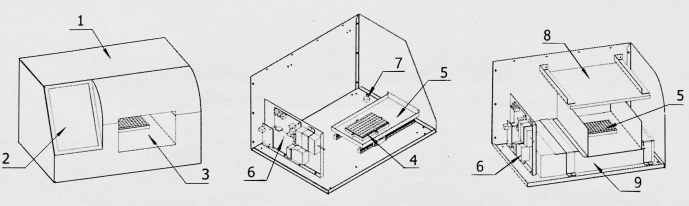
Figura 2: Diagrama estrutural do conversor de aquisição de imagens. 1: Concha; 2: Tela de exibição; 3: Sala de aquisição de imagens; 4: Base da placa de detecção; 5: Placa de detecção dentro e fora do armazém; 6: Placa de controle; 7: Aparelho de conversão para aquisição de imagens; 8: Fonte de luz; 9: Scanner de imagem. Clique aqui para ver uma versão maior desta figura.
Protocolo
As cepas de Salmonella utilizadas neste estudo foram coletadas de aves de capoeira em Shandong, China, após aprovação do Comitê de Biossegurança do Instituto de Ciências Animais e Medicina Veterinária da Academia de Ciências Agrárias de Shandong, China.
1. Aplicação do sistema AST inteligente de alto rendimento8
- Preparação do inóculo
- Incubar o organismo de controle de qualidade Escherichia coli e 93 cepas de Salmonella para serem testadas para AST em placas de ágar Mueller-Hinton (MHA) por 16-18 h a 37 °C3.
- Preparar o inóculo de cada estirpe para corresponder ao padrão de turbidez de McFarland de 0,5 com base no método especificado na norma CLSI3e, em seguida, diluir 10 vezes.
- Colocar 200 μL de soro fisiológico estéril no 1º poço horizontal (A1) da placa de 96 poços como controle negativo, duas suspensões do organismo de controle de qualidade nos 2º e3º poços horizontais (A2 e A3) como controle positivo e controle de qualidade, respectivamente. Adicionar 200 μL das suspensões de inóculo diluídas de cada mancha testada nos 93 poços correspondentes no bloco de sementes de 96 poços.
- Preparo de placa de ágar antimicrobiana
- Definir as faixas de concentração dos diferentes agentes antibacterianos testados de acordo com a faixa de cálculo do índice Lar (de 0,125R a 8R). As concentrações variam da faixa de controle de qualidade ou 0,0625R (sujeito à faixa inferior) a 8R.
NOTA: Se o índice Lar não for calculado, o intervalo de concentrações de antibióticos pode ser definido de acordo com as necessidades de AST. - Executar um esquema de diluição log2 duplicado para solução antibiótica começando com uma concentração de estoque adequada com base no método de diluição em ágar especificado na norma CLSI3.
- Esterilizar frascos de vidro de 50 mL contendo 18 mL de meio ágar Mueller-Hinton. Adicionar 2 ml das diluições adequadas da solução antimicrobiana a 18 ml de meio fundido refrigerado a 45-50 °C, misturar cuidadosamente e despejar nas placas do gabinete de biossegurança.
- Deixe o ágar solidificar à temperatura ambiente (TR), deixe uma lacuna sob a tampa das placas incubadas e sopre para secar a superfície do ágar antes de inocular.
- Rotular os tipos de agentes antimicrobianos e concentrações no verso das placas incubadas. Organize as múltiplas placas incubadas de cada agente antimicrobiano em uma pilha em ordem de diluição log2-duplicando.
- Preparar duas placas de ágar livres de medicamentos como controles para cada agente antimicrobiano.
- Definir as faixas de concentração dos diferentes agentes antibacterianos testados de acordo com a faixa de cálculo do índice Lar (de 0,125R a 8R). As concentrações variam da faixa de controle de qualidade ou 0,0625R (sujeito à faixa inferior) a 8R.
- Etapas de inoculação para inoculador de matriz de 96 pontos
- Instale a placa de pino de inoculação autoclavada no suporte de um inoculador matricial de 96 pontos no gabinete de biossegurança.
- Colocar o bloco de sementes preparado com as cepas testadas e uma placa de ágar incubada no carregador móvel, com o mesmo ângulo de posicionamento para as duas placas.
- Empurre o suporte móvel para que o bloco de sementes fique diretamente abaixo da placa do pino de inoculação.
- Pressione a alça de operação, mova a placa do pino de inoculação para baixo e direcione os 96 pinos para o inóculo em 96 poços do bloco de sementes.
- Solte a alça de operação com controle e, em seguida, redefina a placa do pino de inoculação sob a ação da mola.
- Pressione a alça de operação 2-3 vezes para mexer cada poço de inóculo e mergulhar. Empurre e mova a placa transportadora para que a placa incubada fique diretamente abaixo da placa do pino de inoculação.
- Pressione a alça de operação, mova a placa do pino de inoculação para baixo e pare por 1-2 s para fazer com que os pinos de inoculação entrem em contato totalmente com a superfície da placa incubada.
- Solte a alça de operação. Isso completa uma inoculação. Substitua outra placa incubada e continue o ciclo até que um grupo de placas de ágar antimicrobiano esteja terminado.
- Substitua outra placa de pino de inoculação e bloco de sementes e inocular outro grupo de cepas testadas. Ciclo até que todas as inoculações estejam completas.
NOTA: Inocular uma placa de ágar controle (sem agente antimicrobiano) primeiro, depois a placa em ordem de concentração do medicamento de baixa para alta e uma segunda placa de ágar controle por último para garantir que não haja contaminação ou transferência de agente antimicrobiano. O volume de inoculação depende do volume de deposição natural de cada pino de aproximadamente 2 μL.
- Incubação das placas de ágar antimicrobiano
- Incubar as placas de ágar antimicrobiano inoculadas em RT até que a umidade nos pontos de inóculo seja absorvida pelo ágar.
- Inverter as placas e incubá-las durante 16-20 h a 37 °C para as estirpes testadas para garantir que as bactérias não inibidas formam colónias.
- Aquisição de imagens e estatísticas de dados
- Clique duas vezes no sistema de aquisição de imagens AST matriciais de 96 pontos para abrir o programa.
- Clique em Informações de teste na barra de tarefas. Clique em Novo para criar uma nova tarefa de teste e preencha as informações de acordo com os prompts, incluindo o código, nome, fonte, bactérias, número de cepas, antibióticos e gradiente.
- Clique no item Coleta de dados > Fotografia > teste para selecionar a nova tarefa criada. Clique em Antibióticos para selecionar o nome do antibiótico e clique em Gradiente para selecionar a concentração inicial deste antibiótico.
- Clique em Conectar para se conectar com o conversor de aquisição de imagem.
- Coloque as placas incubadas correspondentes na base da placa de detecção com o ângulo ausente na frente direita para orientação e empurre para dentro do conversor de aquisição de imagem.
- Clique em Acervo para obter as imagens. O gradiente antibiótico saltará automaticamente para o próximo gradiente. Coloque a próxima placa por sua vez e continue a clicar em Coleta até que as placas para este antibiótico tenham sido coletadas.
- Clique em Antibióticos e selecione o próximo conjunto de placas incubadas. Clique em Gradiente para selecionar o gradiente inicial e prosseguir para a próxima rodada de coleta de imagens.
- Após concluir todas as coletas, clique em Enviar. O programa reconhecerá automaticamente o número de pixels brancos formatados em cada ponto de inoculação nas imagens, determinará se há formação de colônias e converterá as imagens em valores MIC.
- Clique em Consulta para obter todos os resultados da CIM das cepas contra os antibióticos testados.
NOTA: O sistema AST inteligente de alto rendimento é adequado para determinar CIMs de grandes lotes de cepas bacterianas. O processo de teste, incluindo preparação, inoculação, incubação e leitura dos resultados, leva 3 dias. Os tipos de antibióticos e as faixas de detecção de CIM podem ser definidos de acordo com as respectivas necessidades, e os principais consumíveis podem ser reutilizados.
- Cálculo do índice de Lar
- Determine o índice de Lar com precisão com a fórmula: , onde:
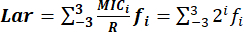
CIMi: concentração inibitória mínima.
A faixa de distribuições da CIM de MIC-3 a MIC3 representa duas concentrações seriais centradas em R: 0,125R, 0,25R, 0,5R, R, 2R, 4R e 8R. é 2 i, e o intervalo dei é -3 a 3.
é 2 i, e o intervalo dei é -3 a 3.
R: os pontos de quebra de resistência de bactérias contra antimicrobianos padronizados pelo CLSI.
f: a distribuição de frequência MIC.
NOTA: O índice geral de Lar é a média aritmética de todos os índices Lar. Depois que o índice Lar for calculado, arredondar o valor final para dois dígitos significativos após a vírgula decimal.
- Determine o índice de Lar com precisão com a fórmula: , onde:
2. Sistema inteligente de triagem de fagos de alto rendimento9
- Preparo do bloco de sementes de fago e placas incubadas de camada dupla contendo bactérias.
- Use o método de ágar de camada dupla10 ou o método de cultura líquida11 para fazer diferentes fagos. Diluir para uma concentração paralela adequada com um título de 1 x 104-5 pfu/mL e adicionar 200 μL do inóculo do fago no bloco de sementes de 96 poços.
- Fazer placas de dupla camada com bactérias (10 mL de meio ágar de fundo [ágar 12 g/L] e 6 mL de meio semiágar superior [6 g/L] com 100 μL de bactérias [0,5 McFarland]) a serem testadas.
- Faça uma placa incubada de camada dupla para cada cepa a ser testada. Deixe uma lacuna sob a tampa da placa de camada dupla e sopre para secar a superfície do ágar no armário de biossegurança.
- Teste de triagem
- Coloque o bloco de sementes de fago preparado e a placa de camada dupla no portador móvel do inoculador de matriz de 96 pontos e transfira todos os inóculos de fago para a superfície de semiágar. Continue os ciclos até que todas as cepas testadas sejam concluídas.
- Deixe as placas de dupla camada inoculadas permanecerem em RT até que a umidade nos pontos de inóculo seja totalmente absorvida pelo semiágar.
- Inverter as placas e incubar em condições adequadas para as cepas testadas por 4-6 h para garantir que pontos líticos claros sejam formados.
- Analisando dados
- Obter e salvar a imagem do resultado experimental de cada placa de camada dupla pelo conversor de aquisição de imagem (passos 1.5.4-1.5.6).
- Registre o número e as morfologias das diferentes formas de manchas em uma planilha com base nas imagens obtidas e calcule as respectivas proporções dos diferentes tipos de fagos.
Resultados
Seguindo o protocolo do sistema AST inteligente de alto rendimento, sua aplicação foi ilustrada por Salmonella de aves de Shandong, China, como exemplo.
O crescimento de cepas de Salmonella em placas de ágar com ampicilina (R de 32 μg/mL) nas concentrações de 2 a 256 μg/mL determinadas pelo conversor de aquisição de imagens é mostrado na Figura 3. O1º poço horizontal A1 foi o controle negativo e não apresentou crescimento ...
Discussão
O método de diluição em ágar foi bem estabelecido e amplamente utilizado. O princípio do sistema AST de alto rendimento foi o método de diluição em ágar. Uma das etapas críticas dentro do protocolo foi a transferência precisa de alto rendimento de 96 inóculos de uma só vez, que foi realizada várias vezes seguidas. Para completar esta etapa crítica, os pinos do inoculador de matriz de 96 pontos foram uniformes e muito lisos. A deposição natural de cada pino foi um volume de aproximadamente 2 μL, que se a...
Divulgações
registraram patentes chinesas para o inoculador matricial de 96 pontos e conversor de aquisição de imagem e suas aplicações (número de patente ZL 201610942866.3 e número de patente ZL 201910968255.X).
Agradecimentos
Este trabalho foi apoiado pelo National Key Research and Development Project (2019YFA0904003); Sistema Industrial Agrícola Moderno na Província de Shandong (SDAIT-011-09); Projeto de Otimização de Plataforma de Cooperação Internacional (CXGC2023G15); Principais tarefas de inovação do projeto de inovação de ciência e tecnologia agrícola da Academia de Ciências Agrárias de Shandong, China (CXGC2023G03).
Materiais
| Name | Company | Catalog Number | Comments |
| 96 well culture plate | Beijing lanjieke Technology Co., Ltd | 11510 | |
| 96-dot matrix AST image acquisition system | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| 96-dot matrix inoculator | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Patented product |
| Agar | Qingdao hi tech Industrial Park Haibo Biotechnology Co., Ltd | HB8274-1 | |
| Amikacin | Shanghai McLean Biochemical Technology Co., Ltd | A857053 | |
| Amoxicillin | Shanghai McLean Biochemical Technology Co., Ltd | A822839 | |
| Ampicillin | Shanghai McLean Biochemical Technology Co., Ltd | A830931 | |
| Analytical balance | Sartorius | BSA224S | |
| Automated calculation software for Lar index of AMR | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Bacteria Salmonella strains | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Animal origin |
| Bacterial resistance Lar index certification management system V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Ceftiofur | Shanghai McLean Biochemical Technology Co., Ltd | C873619 | |
| Ciprofloxacin | Shanghai McLean Biochemical Technology Co., Ltd | C824343 | |
| Clavulanic acid | Shanghai McLean Biochemical Technology Co., Ltd | C824181 | |
| Clean worktable | Suzhou purification equipment Co., Ltd | SW-CJ-2D | |
| Colistin sulfate | Shanghai McLean Biochemical Technology Co., Ltd | C805491 | |
| Culture plate | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Patented product |
| Doxycycline | Shanghai McLean Biochemical Technology Co., Ltd | D832390 | |
| Enrofloxacin | Shanghai McLean Biochemical Technology Co., Ltd | E809130 | |
| Filter 0.22 μm | Millipore | SLGP033RB | |
| Florfenicol | Shanghai McLean Biochemical Technology Co., Ltd | F809685 | |
| Gentamicin | Shanghai McLean Biochemical Technology Co., Ltd | G810322 | |
| Glass bottle 50 mL | Xuzhou Qianxing Glass Technology Co., Ltd | QX-7 | |
| High-throughput resistance detection system V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Image acquisition converter | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Patented product |
| Meropenem | Shanghai McLean Biochemical Technology Co., Ltd | M861173 | |
| Mueller-Hinton agar | Qingdao hi tech Industrial Park Haibo Biotechnology Co., Ltd | HB6232 | |
| Petri dish 60 mm x 15 mm | Qingdao Jindian biochemical equipment Co., Ltd | 16021-1 | |
| Petri dish 90 mm x 15 mm | Qingdao Jindian biochemical equipment Co., Ltd | 16001-1 | |
| Salmonella phages | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | |
| Shaker incubator | Shanghai Minquan Instrument Co., Ltd | MQD-S2R | |
| Turbidimeter | Shanghai XingBai Biotechnology Co., Ltd | F-TC2015 | |
| Varms base type library system V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Vertical high-pressure steam sterilizer | Shanghai Shen'an medical instrument factory | LDZX-75L | |
| Veterinary pathogen resistance testing management system | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Veterinary resistance cloud monitoring and phage control platform V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright |
Referências
- Ramanan, L., et al. Antimicrobial resistance-the need for global solutions. The Lancet Infectious Diseases. 13 (12), 1057-1098 (2013).
- Xiaonan, Z., Qing, Z., Thomas, S. P., Yuqing, L., Martha, R. J. C. inPhocus: Perspectives of the application of bacteriophages in poultry and aquaculture industries based on Varms in China. PHAGE: Therapy, Applications, and Research. 2 (2), 69-74 (2021).
- CLSI. . Performance Standards for Antimicrobial Disk Susceptibility Tests. CLSI document M100. , (2022).
- Yuqing, L., et al. . Antimicrobial Sensitivity Testing Standard of EUCAST. , (2017).
- Barnini, S., et al. A new rapid method for direct antimicrobial susceptibility testing of bacteria from positive blood cultures. BMC Microbiology. 16 (1), 185-192 (2016).
- Höring, S., Massarani, A. S., Löffler, B., Rödel, J. Rapid antimicrobial susceptibility testing in blood culture diagnostics performed by direct inoculation using the VITEK®-2 and BD PhoenixTM platforms. European Journal of Clinical Microbiology & Infectious Diseases. 38 (3), 471-478 (2019).
- Dupuis, G. Evaluation of the Cobasbact automated antimicrobial susceptibility testing system. European Journal of Clinical Microbiology & Infectious Diseases. 4 (2), 119-122 (1985).
- Liu, Y., et al. A system of bacterial antimicrobial resistance detection and its operation method. China Patent. , (2019).
- Liu, Y. A high throughput test plate for screening bacteriophage of zoonotic pathogens and its application. China Patent. , (2022).
- Adams, M. H. . Bacteriophages. , (1959).
- Nair, A., Ghugare, G. S., Khairnar, K. An appraisal of bacteriophage isolation techniques from environment. Microbial Ecology. 83 (3), 519-535 (2022).
- . . Shandong veterinary antibiotic resistance system. , (2023).
- Ming, H., et al. Comparison of the results of 96-dot agar dilution method and broth microdilution method. Chinese Journal of Antibiotics. 43 (6), 729-733 (2018).
- Laxminarayan, R., Klugman, K. P. Communicating trends in resistance using a drug resistance index. BMJ Open. 1 (2), e000135 (2011).
- Chen, Y., et al. Assessing antibiotic therapy effectiveness against the major bacterial pathogens in a hospital using an integrated index. Future Microbiology. 12, 853-866 (2017).
- Ciccolini, M., Spoorenberg, V., Geerlings, S. E., Prins, J. M., Grundmann, H. Using an index-based approach to assess the population-level appropriateness of empirical antibiotic therapy. Journal of Antimicrobial Chemotherapy. 70 (1), 286-293 (2015).
- Yanbo, L., et al. Preliminary application of inoculation system for high-throughput drug susceptibility test. China Poultry. 42 (6), 52-57 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados