A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مقايسات السمية الخلوية مع خطوط خلايا الزرد
In This Article
Summary
يقدم هذا البروتوكول مقايسات السمية الخلوية شائعة الاستخدام (مقايسات Alamar Blue [AB] ، CFDA-AM ، الأحمر المحايد ، و MTT) التي تم تكييفها لتقييم السمية الخلوية في جنين الزرد (ZEM2S) وخطوط خلايا الكبد (ZFL) في 96 لوحة بئر.
Abstract
أصبحت خطوط خلايا الأسماك تستخدم بشكل متزايد في دراسات السمية البيئية ، وتم اقتراح مقايسات السمية الخلوية كطرق للتنبؤ بالسمية الحادة للأسماك. وبالتالي ، يقدم هذا البروتوكول مقايسات السمية الخلوية المعدلة لتقييم صلاحية الخلية في جنين الزرد (Danio rerio) (ZEM2S) وخطوط خلايا الكبد (ZFL) في 96 لوحة بئر. نقاط نهاية السمية الخلوية التي تم تقييمها هي سلامة الميتوكوندريا (مقايسات Alamar Blue [AB] و MTT) ، وسلامة الغشاء عبر نشاط الإستراز (مقايسة CFDA-AM) ، وسلامة الغشاء الليزوزومي (مقايسة الأحمر المحايد [NR]). بعد التعرض لمواد الاختبار في لوحة 96 بئرا ، يتم إجراء فحوصات السمية الخلوية ؛ هنا ، يتم تنفيذ AB و CFDA-AM في وقت واحد ، متبوعا ب NR على نفس اللوحة ، بينما يتم إجراء اختبار MTT على لوحة منفصلة. يتم أخذ قراءات هذه المقايسات عن طريق مضان AB و CFDA-AM ، وامتصاص MTT و NR. يمكن استخدام مقايسات السمية الخلوية التي يتم إجراؤها باستخدام خطوط خلايا الأسماك هذه لدراسة السمية الحادة للمواد الكيميائية على الأسماك.
Introduction
يجب اختبار المواد الكيميائية فيما يتعلق بسلامتها لصحة الإنسان والبيئة. تم النظر بشكل متزايد في المؤشرات الحيوية الجزيئية والخلوية في تقييمات السلامة للتنبؤ بالتأثيرات على الكائنات الحية من قبل الوكالات التنظيمية و / أو التشريعات (على سبيل المثال ، REACH ، OECD ، US EPA)1,2 ، لأنها يمكن أن تسبق النتائج الضارة في الجسم الحي (على سبيل المثال ، اضطراب الغدد الصماء ، والاستجابة المناعية ، والسمية الحادة ، والسمية الضوئية)3،4،5،6،7 . في هذا السياق ، تم أخذ السمية الخلوية كقياس للتنبؤ بالسمية الحادة للأسماك 5,8 ؛ ومع ذلك ، يمكن أن يكون لها العديد من التطبيقات الأخرى في دراسات السمية البيئية ، مثل تحديد تركيزات المواد الكيميائية شبه السامة للخلايا لدراسة مجموعة آثارها الأكثر تنوعا على الأسماك (على سبيل المثال ، تأثيرات تعطيل الغدد الصماء).
في أنظمة زراعة الخلايا (في الأنظمة المختبرية ) ، يمكن تحديد السمية الخلوية للمواد الكيميائية بطرق مختلفة في أنواع نقاط النهاية. على سبيل المثال ، يمكن أن تستند طريقة السمية الخلوية إلى نقطة نهاية تتعلق بمورفولوجيا محددة لوحظت أثناء عملية موت الخلية ، بينما يمكن لطريقة أخرى تحديد السمية الخلوية عن طريق قياس موت الخلية ، وصلاحيتها ووظائفها ، والتشكل ، واستقلاب الطاقة ، وتعلق الخلية وتكاثرها. يمكن أن تؤثر المواد الكيميائية على صلاحية الخلية من خلال آليات مختلفة ، وبالتالي فإن تقييم السمية الخلوية الذي يغطي نقاط نهاية مختلفة لصلاحية الخلية ضروري للتنبؤ بالتأثيرات الكيميائية9.
MTT و Alamar Blue (AB) هي فحوصات تحدد التأثيرات على صلاحية الخلية بناء على نشاط التمثيل الغذائي للخلية. يقوم اختبار MTT بتقييم نشاط إنزيم الميتوكوندريا سكسينات ديهيدروجيناز10. يحدث اختزال بروميد 3- [4،5-ثنائي ميثيل ثيازول-2yl] -2،5-ثنائي فينيل تيترازوليوم (MTT) إلى اللون الأزرق الفورمازان فقط في الخلايا القابلة للحياة ، وتتناسب كثافته البصرية طرديا مع عدد الخلايا القابلة للحياة10. اختبار AB هو مؤشر حساس لتقليل الأكسدة ، بوساطة إنزيمات الميتوكوندريا التي تتألق وتغير لونها عند تقليل resazurin إلى resorufin بواسطة الخلايا الحية11 ؛ ومع ذلك ، تساهم الإنزيمات الخلوية والميكروسومية أيضا في تقليل AB و MTT12. قد تشمل هذه الإنزيمات العديد من الاختزالات، مثل مؤكسدات الكحول والألدهيد، NAD(P)H: كينون أوكسيدوريدوكتاز، اختزال الفلافين، نازعة هيدروجين NADH، والسيتوكرومات11.
مقايسة الأحمر المحايد (NR) هي مقايسة صلاحية الخلية بناء على دمج هذه الصبغة في الجسيمات الحالة للخلايا القابلة للحياة13. يعتمد امتصاص NR على قدرة الخلايا على الحفاظ على تدرجات الأس الهيدروجيني. يحافظ تدرج البروتون داخل الجسيمات الحالة على درجة حموضة أقل من السيتوبلازم. عند درجة الحموضة الفسيولوجية الطبيعية ، يقدم NR شحنة صافية تبلغ صفرا تقريبا ، مما يمكنه من اختراق أغشية الخلايا. وبالتالي ، تصبح الصبغة مشحونة ويتم الاحتفاظ بها داخل الليزوزومات. وبالتالي ، كلما زادت كمية NR المحتفظ بها ، زاد عدد الخلايا القابلة للحياة14. المواد الكيميائية التي تلحق الضرر بسطح الخلية أو الأغشية الليزوزومية تضعف امتصاص هذه الصبغة.
مقايسة CFDA-AM هي مقايسة صلاحية خلية فلورومترية تعتمد على الاحتفاظ ب 5-كربوكسي فلوريسئين ثنائي أسيتات أسيتوكسي ميثيل استر (CFDA-AM)15. يتم تحويل 5-CFDA-AM ، ركيزة استراز ، إلى كربوكسي فلوريسئين ، وهي مادة فلورية قطبية وغير منفذة بواسطة أغشية الخلايا الحية15 ؛ وبالتالي ، يتم الاحتفاظ به في الجانب الداخلي لغشاء الخلية السليم ، مما يشير إلى خلايا قابلة للحياة.
في الآونة الأخيرة ، تم دمج ثلاثة مقايسات للسمية الخلوية (مقايسات CFDA-AM ، NR ، و AB) في إرشادات ISO (المنظمة الدولية للتوحيد القياسي) (ISO 21115: 2019) 16 وطريقة اختبار OECD (منظمة التعاون الاقتصادي والتنمية (OECD TG 249) لتقييم السمية الحادة للأسماك باستخدام خط خلايا RTgill-W1 (خط الخلية الدائم من تراوت قوس قزح [Oncorhynchus mykiss] الخيشومية) في 24 لوحة بئر17 . على الرغم من وجود طريقة قائمة على الخلايا للتنبؤ بالسمية الحادة للأسماك ، فقد تم استثمار الجهود في تطوير طرق مماثلة مع أنواع الأسماك الأخرى وزيادة إنتاجية الطريقة. تتضمن بعض الأمثلة تطوير خطوط خلايا ZFL المنقولة بجينات المراسل لمسارات سمية محددة18,19 ، واختبارات السمية الضوئية في خط خلية RTgill-W1 20 ، واستخدام خطوط خلايا ZFL و ZF4 (الخلايا الليفية الزرد المشتقة من أجنة عمرها يوم واحد) لتقييم السمية من خلال العديد من فحوصات السمية الخلوية21.
دانيو ريريو (الزرد) هو أحد أنواع الأسماك الرئيسية المستخدمة في دراسات السمية المائية. وبالتالي ، قد تكون الطرق القائمة على الخلايا مع خطوط خلايا الزرد لاختبار سمية الأسماك مفيدة للغاية. خط خلية ZFL هو خط خلايا الكبد الظهارية الزرد الذي يقدم الخصائص الرئيسية لخلايا متني الكبد ويمكنه استقلاب xenobiotics7،22،23،24،25. وفي الوقت نفسه ، فإن خط خلية ZEM2S هو خط خلايا ليفية جنينية من الزرد مشتق من مرحلة البلاستولا التي يمكن استخدامها للتحقيق في الآثار التنموية على الأسماك26،27. وبالتالي ، يصف هذا البروتوكول أربعة مقايسات للسمية الخلوية (مقايسات MTT و AB و NR و CFDA-AM) ، مع إجراء تعديلات مع خطوط خلايا ZFL و ZEM2S في 96 لوحة بئر.
Protocol
ملاحظة: انظر جدول المواد للحصول على قائمة المواد المستخدمة في هذا البروتوكول والجدول 1 لمعرفة تركيبة المحاليل والوسائط المستخدمة في هذا البروتوكول.
1. تحضير خلايا ZFL و ZEM2S
- ابدأ بقارورة T75 من خلايا ZFL أو ZEM2S مع التقاء 80٪ ، مستزرعة في الوسط الكامل المعني عند 28 درجة مئوية بدون ثاني أكسيد الكربون2.
- قم بإزالة وسط الاستزراع من القارورة واغسل الخلايا بإضافة 10 مل من 1x محلول ملحي مخزن بالفوسفات (PBS) (0.01 م). أضف 3 مل من 1x تربسين (0.05٪ v / v ؛ 0.5 mM trypsin-EDTA) إلى قوارير الاستزراع. احتضان في 28 درجة مئوية لمدة 3 دقائق.
- اضغط برفق على القارورة لتحرير الخلايا ، ثم أوقف هضم التربسين بإضافة 3 مل من وسط الاستزراع الكامل إلى القارورة.
- انقل تعليق الخلية إلى أنبوب طرد مركزي مخروطي سعة 15 مل وجهاز طرد مركزي عند 100 × جم لمدة 5 دقائق.
- بعد الطرد المركزي ، قم بإزالة المادة الطافية بعناية ، وأضف 1 مل من الوسط الكامل لخلايا ZFL أو ZEM2S ، وأعد تعليق الحبيبات باستخدام ماصة دقيقة.
2. عد الخلايا عن طريق استبعاد صبغة التريبان الزرقاء
- أضف 10 ميكرولتر من معلق الخلية و 10 ميكرولتر من صبغة التريبان الزرقاء إلى أنبوب دقيق لحساب الخلايا وتقييم صلاحيتها. امزج تعليق الخلية وصبغها باستخدام ماصة.
- بعد ذلك ، انقل 10 ميكرولتر من هذا الخليط (تعليق الخلية + تريبان الأزرق) إلى غرفة نيوباور وعد الخلايا في المربعات الأربعة الكبيرة (Quadrants Q) الموضوعة في زوايا الغرفة ، مع الأخذ في الاعتبار أن الخلايا القابلة للحياة هي تلك التي لا تمتص التريبان الأزرق. حدد عدد الخلايا القابلة للحياة باستخدام المعادلة (1):
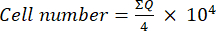 (1)
(1) - احسب رقم الخلية النهائي في تعليق الخلية بضرب رقم الخلية المحدد باستخدام المعادلة (1) في اثنين (عامل التخفيف بسبب استخدام التريبان الأزرق).
ملاحظة: بدلا من ذلك ، يمكن استخدام نظام عد الخلايا الآلي (على سبيل المثال ، cytomer مع وظيفة عد الخلايا وقابليتها للحياة).
3. طلاء الخلايا في لوحات 96 بئر
- احسب حجم تعليق الخلية اللازم للحصول على عدد الخلايا المطلوبة لإجراء مقايسات السمية الخلوية. يشار أدناه إلى عدد الخلايا القابلة للحياة لكل خط خلية:
- لوحة 60000 خلية ZEM2S قابلة للحياة لكل بئر ؛ وبالتالي ، بالنسبة للوحة بأكملها ، استخدم ستة ملايين خلية في 20 مل من الوسط الكامل (200 ميكرولتر / بئر ، لوحة 96 بئر).
- لوحة 40000 خلية ZFL قابلة للحياة لكل بئر ؛ وبالتالي ، بالنسبة للوحة بأكملها ، استخدم أربعة ملايين خلية في 20 مل من الوسط الكامل (200 ميكرولتر / بئر ، لوحة 96 بئر).
- بعد ذلك ، قم بنقل الحجم المعني لتعليق الخلية إلى خزان كاشف (معقم) واملأه بوسط الاستزراع الكامل ل ZFL أو ZEM2S إلى 20 مل. باستخدام ماصة متعددة القنوات ، امزج المحلول برفق لأعلى ولأسفل.
ملاحظة: احرص على عدم تشكيل رغوة أو فقاعات. - أضف 200 ميكرولتر من تعليق الخلية إلى كل بئر من لوحة البوليسترين الشفافة ذات 96 بئرا باستخدام الماصة الدقيقة متعددة القنوات. احتضان الألواح عند 28 درجة مئوية لمدة 24 ساعة.
ملاحظة: يجب أن تحتوي اللوحة على ثلاثة آبار على الأقل بدون خلايا للتحكم الفارغ ، ويجب إضافة الوسائط الكاملة فقط إلى هذه الآبار. يحدث تأثير الحافة (الناجم عن التبخر العالي في آبار الحافة) بشكل شائع في مقايسات صفيحة 96 بئرا ويمكن أن يؤثر على صلاحية الخلايا في آبار حافة اللوحة28. يمكن أن يكون هذا التأثير أعلى أو أقل اعتمادا على العلامة التجارية للوحة 96 بئرا والتصميم28. على الرغم من أننا لم نلاحظ أي اضطراب في نمو الخلايا / صلاحيتها ل ZFL و ZEM2S في آبار الحافة ، فإننا نقترح إغلاق اللوحة ببارافيلم أو رقائق مانعة للتسرب لاصقة لمنع هذا التأثير ، أو زراعة الخلايا فقط في 60 بئرا داخليا وملء آبار الحافة ب PBS.
4. تعرض الخلايا لاختبار المواد الكيميائية
- تخلص بعناية من الوسائط المستهلكة من الآبار باستخدام ماصة صغيرة متعددة القنوات.
- تعريض الخلايا لاختبار المواد الكيميائية بتركيزات مختلفة. تحضير محاليل اختبار التركيزات الكيميائية في أوساط الاستزراع ل ZFL أو ZEM2S بدون مصل بقري جنيني (FBS) (وسائط التعرض). ثم أضف 100 ميكرولتر لكل بئر من هذه المحاليل في ثلاث نسخ تقنية (أي ثلاثة آبار / اختبار التركيز الكيميائي).
- بالنسبة لعناصر التحكم ، ضع مجموعات التحكم على نفس اللوحة مثل مادة الاختبار الكيميائية في ثلاث نسخ تقنية (ثلاثة آبار / مجموعة تحكم). وبالتالي ، بالنسبة للتحكم الفارغ (B) ، أضف 100 ميكرولتر من وسائط التعرض في الآبار الخالية من الخلايا ، وللتحكم السلبي (NC) ، أضف 100 ميكرولتر من وسائط التعرض إلى الآبار ذات الخلايا ، وللتحكم الإيجابي (PC) ، قم بتعريض الخلايا لمحلول 1٪ Triton X-100 المحضر في وسائط التعرض. في بعض الحالات ، يجب تضمين التحكم في المذيبات (SC) في اللوحة ، مع الأخذ في الاعتبار التركيز غير السام للخلايا بشكل واضح كتركيز نهائي للمذيب.
ملاحظة: يوصى باستخدام 0.5٪ DMSO كمذيب ؛ يمكن استخدام DMSO بنسبة تصل إلى 1٪ كمذيب في خطوط الخلايا هذه دون تجاوز عتبة السمية الخلوية البالغة 10٪ المتعلقة بالتحكم السلبي. - احتضان الألواح عند 28 درجة مئوية لمدة 24 ساعة. قم بإغلاق الألواح بورق بارافيلم أو رقائق لاصقة لمنع تبخر وسط الثقافة.
ملاحظة: قد تحتوي بعض المواد الكيميائية على امتصاص داخلي للخلفية أو مضان قد يتداخل مع امتصاص أو مضان صبغة (صبغات) المؤشر (على سبيل المثال ، قد تؤثر المركبات ذات اللون على الامتصاص ، وألبومين المصل29 ، والمركبات التي تتداخل مع إنزيمات الاختزال30،31). في هذه الحالة ، يجب أن تتضمن اللوحة تحكما إضافيا عن طريق إضافة محاليل كيميائية للاختبار في الآبار بدون خلايا. هذا للتحقق من التداخل المحتمل للامتصاص الذاتي الكيميائي / التألق الذاتي مع الأصباغ. إذا تم الكشف عن التداخل ، ينبغي للمرء أن يقيم ما إذا كان يمكن استبعاده للحصول على التنبؤ الصحيح للسمية الخلوية.
5. مقايسات السمية الخلوية
ملاحظة: قم بإعداد جميع الحلول وفقا للجدول 1. يتم تنفيذ جميع الخطوات الموضحة أدناه (الشكل 1) في ظل ظروف معقمة. لا ينصح باستخدام ماصة للتخلص من وسائط التعرض ، لأن الخلايا يمكن أن تنفصل بسهولة عن الآبار بعد المعالجة الكيميائية.
- مقايسات AB و CFDA-AM
- بعد 24 ساعة من التعرض للمواد الكيميائية الاختبارية ، تخلص بعناية من وسائط التعريض عن طريق سكب المحتوى في درج التجميع.
- اغسل اللوحة ب 200 ميكرولتر من برنامج تلفزيوني. قم بإزالة PBS بعناية عن طريق سكبه في صينية تجميع لتجنب فقدان الخلايا.
- أضف 100 ميكرولتر لكل بئر من محلول AB / CFDA-AM. احتضان الطبق لمدة 30 دقيقة في الظلام عند 28 درجة مئوية.
- قم بقياس التألق في قارئ لوحة مضان عند 530 نانومتر (إثارة) و 595 نانومتر (انبعاث) ل AB ، وعند 493 نانومتر (إثارة) و 541 نانومتر (انبعاث) ل CFDA-AM.
- مقايسة NR
ملاحظة: يتم تنفيذ خطوات اختبار NR مباشرة بعد مقايسات AB و CFDA-AM (الشكل 1).- جهاز طرد مركزي حل عمل NR (40 ميكروغرام / مل) عند 600 × جم لمدة 10 دقائق.
ملاحظة: يجب عدم نقل ترسيب NR في الأنبوب إلى الألواح. وهكذا ، بعد الطرد المركزي لحل العمل NR ، اجمع المادة الطافية باستخدام ماصة دون استنشاق رواسب NR. نقل الطافية إلى خزان الكاشف. - قم بإزالة محلول AB / CFDA-AM بعناية عن طريق سكب المحتوى في درج التجميع.
- أضف 100 ميكرولتر لكل بئر من حل العمل NR باستخدام ماصة دقيقة متعددة القنوات. احتضان اللوحة عند 28 درجة مئوية لمدة 3 ساعات.
ملاحظة: بعد الحضانة لمدة 3 ساعات ، لاحظ ما إذا كان هطول الأمطار NR قد حدث في اللوحات باستخدام المجهر. قد تتداخل رواسب NR مع القياس الكمي لصلاحية الخلية ، وبالتالي ، لا ينبغي أن تكون موجودة. - قم بإزالة محلول NR بعناية عن طريق سكب المحتوى في درج التجميع. اغسل الآبار بإضافة 150 ميكرولتر من برنامج تلفزيوني لكل بئر.
- أضف 150 ميكرولتر لكل بئر من محلول استخراج NR واحتضن اللوحة على شاكر لوحة لمدة 10 دقائق للرج برفق. قم بقياس الامتصاص عند 540 نانومتر في قارئ اللوحة.
ملاحظة: يجب إجراء قراءة ثانية عند 690 نانومتر لاستبعاد أي امتصاص لبصمات الأصابع في الخلفية في اللوحة.
- جهاز طرد مركزي حل عمل NR (40 ميكروغرام / مل) عند 600 × جم لمدة 10 دقائق.
- مقايسة MTT
ملاحظة: يجب إجراء اختبار MTT بشكل منفصل عن المقايسات الموضحة أعلاه (في لوحة جديدة) (الشكل 2).- قم بإزالة وسائط التعريض الضوئي بعناية عن طريق سكب المحتوى في درج التجميع.
- أضف 100 ميكرولتر من محلول عمل MTT لكل بئر باستخدام ماصة دقيقة متعددة القنوات. احتضان اللوحة عند 28 درجة مئوية لمدة 4 ساعات.
- تجاهل حل MTT عن طريق سكب المحتوى في درج التجميع.
- أضف 100 ميكرولتر لكل بئر من DMSO لاستخراج بلورات الفورمازان ، واحتضان اللوحة على شاكر لوحة لمدة 10 دقائق. قم بقياس الامتصاص عند 570 نانومتر باستخدام قارئ اللوحة.
ملاحظة: يجب إجراء قراءة ثانية عند 690 نانومتر لاستبعاد أي امتصاص لبصمات الأصابع في الخلفية في اللوحة. من المهم ملاحظة أن المواد الكيميائية الاختبارية قد تتداخل مع MTT ، والتي يجب تقييمها لضمان جودة البيانات التي تم إنشاؤها32. لهذا الغرض ، يجب تعريض الآبار الخالية من الخلايا التي تحتوي على تركيزات الاختبار و MTT (0.5 مجم / مل) ، تليها الحضانة لمراقبة أي تغيير في اللون في الآبار قد يزيد من الامتصاص ويؤدي إلى نتائج جدوى خاطئة. يجب تجنب المواد الكيميائية التي تتفاعل مع MTT في هذا الاختبار.
6. حساب صلاحية الخلية / السمية الخلوية
ملاحظة: يتم استخدام الامتصاص الخام أو التألق المكتسب لحساب صلاحية الخلية كنسبة مئوية تتعلق بالتحكم السلبي (لمواد الاختبار الكيميائية المحضرة مباشرة في وسائط التعرض) أو التحكم في المذيبات (لمواد الاختبار الكيميائية المحضرة باستخدام المذيبات ، مثل DMSO). قبل تحديد النسبة المئوية لصلاحية الخلية ، يجب تسوية البيانات الأولية بواسطة عنصر التحكم الفارغ.
- احسب متوسط الامتصاص أو التألق لكل اختبار تركيز كيميائي ومجموعة تحكم (ثلاثة آبار / معالجة).
- لتحديد النسبة المئوية لصلاحية الخلية بالنسبة للتحكم (سالب أو مذيب) ، استخدم المعادلة (2):
 (2)
(2)
ملاحظة: تمثل وحدات الامتصاص (abs) أو التألق (fluo) متوسط الامتصاص أو التألق المقاس في الآبار الثلاثة لكل تركيز؛ فارغ يمثل الآبار بدون خلايا.
النتائج
يوضح الشكل 3 لوحات مقايسات AB و CFDA-AM و NR و MTT. بالنسبة لمقايسة AB (الشكل 3A) ، تظهر الآبار والآبار الفارغة التي لا تحتوي على خلايا قابلة للحياة أو عدد أقل منها اللون الأزرق ومضان منخفض ، في حين أن الآبار التي تحتوي على عدد كبير من الخلايا القابلة للحياة تكون وردية ?...
Discussion
تستخدم مقايسات السمية الخلوية على نطاق واسع لتقييم السمية في المختبر ، وتقدم مقالة البروتوكول هذه أربعة مقايسات سمية خلوية شائعة الاستخدام معدلة ليتم إجراؤها في خطوط خلايا الزرد (أي كثافة الخلية للوحة 96 بئرا ، ووقت الحضانة في مقايسة MTT ، واستنفاد FBS أثناء حالة التعرض الكيميائي ، والت?...
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
في ذكرى الدكتور مارسيو لورينسيني ، مؤلف مشارك في هذا العمل ، باحث ممتاز في مجال مستحضرات التجميل ومكرس لتعزيز أبحاث التجميل في البرازيل. يعرب المؤلفون عن امتنانهم للمختبر متعدد المستخدمين في قسم علم وظائف الأعضاء (UFPR) لتوافر المعدات وللدعم المالي المقدم من التنسيق من أجل تحسين موظفي التعليم العالي (CAPES ، البرازيل) (قانون المالية 001) و Grupo Boticario.
Materials
| Name | Company | Catalog Number | Comments |
| 5-CFDA, AM (5-Carboxyfluorescein Diacetate, Acetoxymethyl Ester) | Invitrogen | C1345 | |
| Cell culture plate, 96 well plate | Sarstedt | 83.3924 | Surface: Standard, flat base |
| DMEM | Gibco | 12800-017 | Powder, high glucose, pyruvate |
| FBS - Fetal Bovine Serum, qualified, USDA-approved regions | Gibco | 12657-029 | |
| Ham's F-12 Nutrient Mix, powder | Gibco | 21700026 | Powder |
| HEPES (1 M) | Gibco | 15630080 | |
| Leibovitz's L-15 Medium | Gibco | 41300021 | Powder |
| Neutral red | Sigma-Aldrich | N4638 | Powder, BioReagent, suitable for cell culture |
| Orbital shaker | Warmnest | KLD-350-BI | 22 mm rotation diameter |
| Dulbeccos PBS (10X) with calcium and magnesium | Invitrogen | 14080055 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| Resazurin sodium salt | Sigma-Aldrich | R7017 | Powder, BioReagent, suitable for cell culture |
| RPMI 1640 Medium | Gibco | 31800-014 | Powder |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | Powder, bioreagent for molecular biology |
| Thiazolyl Blue Tetrazolium Bromide 98% | Sigma-Aldrich | M2128 | |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Trypsin-EDTA (0.5%), no phenol red | Gibco | 15400054 | |
| ZEM2S cell line | ATCC | CRL-2147 | This cell line was kindly donated by Professor Dr. Michael J. Carvan (University of Wisconsin, Milwaukee, USA) |
| ZFL cell line | BCRJ | 256 |
References
- ECHA. Non-Animal Approaches-Current Status of Regulatory Applicability Under the REACH, CLP and Biocidal Products Regulations. ECHA. , (2017).
- Alternative Methods Accepted by US Agencies. National Toxicology Program, and US Department of Health and Human Services Available from: https://ntp.niehs.nih.gov/whatwestudy/niceatm/accept-methods/index.html (2022)
- Schirmer, K. Proposal to improve vertebrate cell cultures to establish them as substitutes for the regulatory testing of chemicals and effluents using fish. Toxicology. 224 (3), 163-183 (2006).
- Scholz, S., et al. Alternatives to in vivo tests to detect endocrine disrupting chemicals (EDCs) in fish and amphibians-screening for estrogen, androgen and thyroid hormone disruption. Critical Reviews in Toxicology. 43 (1), 45-72 (2013).
- Tanneberger, K., et al. Predicting fish acute toxicity using a fish gill cell line-based toxicity assay. Environmental Science & Technology. 47 (2), 1110-1119 (2013).
- Roesler, R., Lorencini, M., Pastore, G. Brazilian cerrado antioxidant sources: cytotoxicity and phototoxicity in vitro. Food Science and Technology. 30, 814-821 (2010).
- Ruyra, A., et al. Zebrafish liver (ZFL) cells are able to mount an anti-viral response after stimulation with Poly (I:C). Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology. 182, 55-63 (2015).
- Natsch, A., Laue, H., Haupt, T., von Niederhäusen, V., Sanders, G. Accurate prediction of acute fish toxicity of fragrance chemicals with the RTgill-W1 cell assay. Environmental Toxicology and Chemistry. 37 (3), 931-941 (2018).
- Freshney, R. I. Cytotoxicity. Culture of Animal Cells: A Manual of Basic Technique. , (2005).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- O'Brien, J., Wilson, I., Orton, T., Pognan, F. Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity. European Journal of Biochemistry. 267 (17), 5421-5426 (2000).
- Gonzalez, R. J., Tarloff, J. B. Evaluation of hepatic subcellular fractions for Alamar blue and MTT reductase activity. Toxicology In Vitro. 15 (3), 257-259 (2001).
- Borenfreund, E., Puerner, J. A. Toxicity determined in vitro by morphological alterations and neutral red absorption. Toxicology Letters. 24 (2-3), 119-124 (1985).
- Repetto, G., del Peso, A., Zurita, J. L. Neutral red uptake assay for the estimation of cell viability/cytotoxicity. Nature Protocols. 3 (7), 1125-1131 (2008).
- Kamiloglu, S., Sari, G., Ozdal, T., Capanoglue, E. Guidelines for cell viability assays. Food Frontiers. 1 (3), 332-349 (2020).
- Water Quality-Determination of Acute Toxicity of Water Samples and Chemicals to a Fish Gill Cell Line (RTgill-W1) (ISO 21115:2019). International Organization for Standardization Available from: https://www.iso.org/standar/69933.html (2019)
- Organisation for Economic Co-operation and Development. . Test Guideline No. 249: Fish Cell Line Acute Toxicity-The RTgill-W1 Cell Line Assay. OECD Guidelines for the Testing of Chemicals, Section 2. Effects on Biotic Systems. , (2021).
- Lungu-Mitea, S., Lundqvist, J. Potentials and pitfalls of transient in vitro reporter bioassays: interference by vector geometry and cytotoxicity in recombinant zebrafish cell lines. Archives of Toxicology. 94 (8), 2769-2784 (2020).
- Lungu-Mitea, S., Han, Y., Lundqvist, J. Development, scrutiny, and modulation of transient reporter gene assays of the xenobiotic metabolism pathway in zebrafish hepatocytes. Cell Biology and Toxicology. , 1-23 (2021).
- Schirmer, K., Chan, A. G., Greenberg, B. M., Dixon, D. G., Bols, N. C. Methodology for demonstrating and measuring the photocytotoxicity of fluoranthene to fish cells in culture. Toxicology In Vitro. 11 (1-2), 107-119 (1997).
- Lungu-Mitea, S., et al. Modeling bioavailable concentrations in zebrafish cell lines and embryos increases the correlation of toxicity potencies across test systems. Environmental Science & Technology. 55 (1), 447-457 (2021).
- Cavalcante, D. G. S. M., et al. Cytotoxic, biochemical and genotoxic effects of biodiesel produced by different routes on ZFL cell line. Toxicology In Vitro. 28 (6), 1117-1125 (2014).
- Meng, Q., Yeung, K., Chan, K. M. Toxic effects of octocrylene on zebrafish larvae and liver cell line (ZFL). Aquatic Toxicology. 236, 105843 (2021).
- Kwok, M. L., Chan, K. M. Oxidative stress and apoptotic effects of copper and cadmium in the zebrafish liver cell line ZFL. Toxicology Reports. 7, 822-835 (2020).
- Yang, J., Chan, K. M. Evaluation of the toxic effects of brominated compounds (BDE-47, 99, 209, TBBPA) and bisphenol A (BPA) using a zebrafish liver cell line, ZFL. Aquatic Toxicology. 159, 138-147 (2015).
- Bradford, C. S., Sun, L., Collodi, P., Barnes, D. W. Cell cultures from zebrafish embryos and adult tissues. Journal of Tissue Culture Methods. 16 (2), 99-107 (1994).
- He, S., et al. Genetic and transcriptome characterization of model zebrafish cell lines. Zebrafish. 3 (4), 441-453 (2006).
- Mansoury, M., Hamed, M., Karmustaji, R., Al Hannan, F., Safrany, S. T. The edge effect: A global problem. The trouble with culturing cells in 96-well plates. Biochemistry and Biophysics Reports. 26, 100987 (2021).
- Funk, D., Schrenk, H. -. H., Frei, E. Serum albumin leads to false-positive results in the XTT and the MTT assay. BioTechniques. 43 (2), 178 (2007).
- Dayeh, V. R., Bols, N. C., Tanneberger, K., Schirmer, K., Lee, L. E. J. The use of fish-derived cell lines for investigation of environmental contaminants: An update following OECD's fish toxicity testing framework no. 171. Current Protocols in Toxicology. 1, (2013).
- Stepanenko, A. A., Dmitrenko, V. V. Pitfalls of the MTT assay: Direct and off-target effects of inhibitors can result in over/underestimation of cell viability. Gene. 574 (2), 193-203 (2015).
- Ulukaya, E., Colakogullari, M., Wood, E. J. Interference by anti-cancer chemotherapeutic agents in the MTT-tumor chemosensitivity assay. Chemotherapy. 50 (1), 43-50 (2004).
- Sebaugh, J. L. Guidelines for accurate EC50/IC50 estimation. Pharmaceutical Statistics. 10 (2), 128-134 (2011).
- Weimer, M., et al. The impact of data transformations on concentration-response modeling. Toxicology Letters. 213 (2), 292-298 (2012).
- Green, J. W., Holbech, T. A., Henrik, Chapter 4: Analysis of Continuous Data (Regression). Statistical Analysis of Ecotoxicity Studies. , (2018).
- Proença, S., et al. Effective exposure of chemicals in in vitro cell systems: A review of chemical distribution models. Toxicology In Vitro. 73, 105133 (2021).
- Guidony, N. S., et al. ABC proteins activity and cytotoxicity in zebrafish hepatocytes exposed to triclosan. Environmental Pollution. 271, 116368 (2021).
- da Silva, N. D. G., et al. Interference of goethite in the effects of glyphosate and Roundup® on ZFL cell line. Toxicology In Vitro. 65, 104755 (2020).
- Yang, Y., et al. Temperature is a key factor influencing the invasion and proliferation of Toxoplasma gondii in fish cells. Experimental Parasitology. 217, 107966 (2020).
- Lopes, F. M., Sandrini, J. Z., Souza, M. M. Toxicity induced by glyphosate and glyphosate-based herbicides in the zebrafish hepatocyte cell line (ZF-L). Ecotoxicology and Environmental Safety. 162, 201-207 (2018).
- Lachner, D., Oliveira, L. F., Martinez, C. B. R. Effects of the water soluble fraction of gasoline on ZFL cell line: Cytotoxicity, genotoxicity and oxidative stress. Toxicology In Vitro. 30, 225-230 (2015).
- Morozesk, M., et al. Effects of multiwalled carbon nanotubes co-exposure with cadmium on zebrafish cell line: Metal uptake and accumulation, oxidative stress, genotoxicity and cell cycle. Ecotoxicology and Environmental Safety. 202, 110892 (2020).
- Dognani, G., et al. Nanofibrous membranes for low-concentration Cr VI adsorption: kinetic, thermodynamic and the influence on ZFL cells viability. Materials Research. , 24 (2021).
- ZEM2S (ATCC®CRL-2147™). American Type Culture Collection Available from: https://www.atcc.org/products/crl-2147 (2023)
- Chen, Y., et al. Acute toxicity of the cationic surfactant C12-benzalkonium in different bioassays: how test design affects bioavailability and effect concentrations. Environmental Toxicology and Chemistry. 33 (3), 606-615 (2014).
- Pomponio, G., et al. In vitro kinetics of amiodarone and its major metabolite in two human liver cell models after acute and repeated treatments. Toxicology In Vitro. 30, 36-51 (2015).
- Mori, M., Wakabayashi, M. Cytotoxicity evaluation of chemicals using cultured fish cells. Water Science and Technology. 42 (7-8), 277-282 (2000).
- Caminada, D., Escher, C., Fent, K. Cytotoxicity of pharmaceuticals found in aquatic systems: comparison of PLHC-1 and RTG-2 fish cell lines. Aquatic Toxicology. 79 (2), 114-123 (2006).
- Giltrap, M., et al. In vitro screening of organotin compounds and sediment extracts for cytotoxicity to fish cells. Environmental Toxicology and Chemistry. 30 (1), 154-161 (2011).
- Hollert, H., Duerr, M., Erdinger, L., Braunbeck, T. Cytotoxicity of settling particulate matter and sediments of the Neckar River (Germany) during a winter flood. Environmental Toxicology and Chemistry. 19 (3), 528-534 (2000).
- Pannetier, P., et al. Toxicity assessment of pollutants sorbed on environmental sample microplastics collected on beaches: Part I-adverse effects on fish cell line. Environmental Pollution. 248, 1088-1097 (2019).
- Ternjej, I., Srček, V. G., Mihaljević, Z., Kopjar, N. Cytotoxic and genotoxic effects of water and sediment samples from gypsum mining area in channel catfish ovary (CCO) cells. Ecotoxicology and Environmental Safety. 98, 119-127 (2013).
- Hamid, R., Rotshteyn, Y., Rabadi, L., Parikh, R., Bullock, P. Comparison of alamar blue and MTT assays for high throughput screening. Toxicology In Vitro. 18 (5), 703-710 (2004).
- Vistica, D. T., et al. Tetrazolium-based assays for cellular viability: a critical examination of selected parameters affecting formazan production. Cancer Research. 51 (10), 2515-2520 (1991).
- Knauer, K., Lampert, C., Gonzalez-Valero, J. Comparison of in vitro and in vivo acute fish toxicity in relation to toxicant mode of action. Chemosphere. 68 (8), 1435-1441 (2007).
- Stadnicka-Michalak, J., Tanneberger, K., Schirmer, K., Ashauer, R. Measured and modeled toxicokinetics in cultured fish cells and application to in vitro-in vivo toxicity extrapolation. PLoS One. 9 (3), 92303 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved