A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בדיקות ציטוטוקסיות עם קווי תאים של דגי זברה
In This Article
Summary
פרוטוקול זה מציג מבחני ציטוטוקסיות נפוצים (Alamar Blue [AB], CFDA-AM, Neutral Red ו-MTT assays) המותאמים להערכת ציטוטוקסיות בעוברים של דגי זברה (ZEM2S) ובקווי תאי כבד (ZFL) בלוחות של 96 בארות.
Abstract
קווי תאי דגים הפכו יותר ויותר בשימוש במחקרי רעילות אקולוגית, ומבחני ציטוטוקסיות הוצעו כשיטות לחיזוי רעילות חריפה של דגים. לפיכך, פרוטוקול זה מציג מבחני ציטוטוקסיות ששונו כדי להעריך את כדאיות התא בדגי זברה (Danio rerio), עובר (ZEM2S) וקווי תאי כבד (ZFL) בלוחות 96 בארות. נקודות הקצה של ציטוטוקסיות שהוערכו הן שלמות מיטוכונדריאלית (מבחני Alamar Blue [AB] ו-MTT), שלמות הממברנה באמצעות פעילות אסטראז (בדיקת CFDA-AM), ושלמות הממברנה הליזוזומלית (בדיקת אדום נייטרלי [NR]). לאחר חשיפת חומרי הבדיקה בצלחת 96 בארות, מבוצעות בדיקות ציטוטוקסיות; כאן, AB ו- CFDA-AM מתבצעים בו זמנית, ואחריו NR על אותה צלחת, בעוד בדיקת MTT מבוצעת על צלחת נפרדת. הקריאות עבור בדיקות אלה נלקחות על ידי פלואורסצנטיות עבור AB ו- CFDA-AM, וספיגה עבור MTT ו- NR. ניתן להשתמש במבחני ציטוטוקסיות המבוצעים עם קווי תאי דגים אלה כדי לחקור את הרעילות החריפה של חומרים כימיים על דגים.
Introduction
חומרים כימיים צריכים להיבדק לגבי בטיחותם לבריאות האדם והסביבה. סמנים ביולוגיים מולקולריים ותאיים נלקחים בחשבון יותר ויותר בהערכות בטיחות כדי לחזות השפעות על אורגניזמים חיים על ידי סוכנויות רגולטוריות ו / או חקיקה (למשל, REACH, OECD, US EPA)1,2, שכן הם יכולים להקדים את התוצאה השלילית in vivo (למשל, הפרעה אנדוקרינית, תגובה חיסונית, רעילות חריפה, פוטוטוקסיות)3,4,5,6,7 . בהקשר זה, ציטוטוקסיות נלקחה כמדד לחיזוי רעילות חריפהשל דגים 5,8; עם זאת, יכולים להיות לה יישומים רבים אחרים במחקרי רעילות אקולוגית, כגון הגדרת ריכוזים תת-ציטוטוקסיים של חומרים כימיים כדי לחקור את מערך ההשפעות המגוון ביותר שלהם על דגים (למשל, השפעות משבשות אנדוקריניות).
במערכות תרבית תאים (מערכות במבחנה ), ציטוטוקסיות של חומרים כימיים יכולה להיקבע על ידי שיטות שונות בסוגי נקודות הקצה. לדוגמה, שיטה ציטוטוקסית יכולה להתבסס על נקודת קצה הקשורה למורפולוגיה ספציפית שנצפתה במהלך תהליך המוות של התא, בעוד ששיטה אחרת יכולה לקבוע ציטוטוקסיות על ידי מדידת מוות תאי, כדאיות ופונקציונליות, מורפולוגיה, מטבוליזם של אנרגיה והתקשרות תאים והתפשטות. חומרים כימיים יכולים להשפיע על כדאיות התא באמצעות מנגנונים שונים, ולכן הערכת ציטוטוקסיות המכסה נקודות קצה שונות של כדאיות התא נחוצה כדי לחזות השפעות כימיות9.
MTT ו- Alamar Blue (AB) הם מבחנים הקובעים את ההשפעות על כדאיות התא בהתבסס על פעילות מטבולית של תאים. בדיקת MTT מעריכה את הפעילות של האנזים המיטוכונדריאלי סוקצינאט דהידרוגנאז10. ההפחתה של 3-[4,5-dimethylthiazol-2yl]-2,5-diphenyltetrazolium bromide (MTT) לכחול formazan מתרחשת רק בתאים בני קיימא, והצפיפות האופטית שלו עומדת ביחס ישר למספר התאים הקיימים10. בדיקת AB היא אינדיקטור רגיש להפחתת חמצון, המתווך על ידי אנזימים מיטוכונדריאליים המפליאים ומשנים את צבעם בעת הפחתת רזזורין לרסורופין על ידי תאים חיים11; עם זאת, אנזימים ציטוסוליים ומיקרוזומליים תורמים גם הם להפחתת AB ו- MTT12. אנזימים אלה עשויים לכלול מספר רדוקטאזים, כגון אלכוהול ואלדהיד אוקסידוקטאז, NAD(P)H: quinone oxidoreductase, flavin reductase, NADH dehydrogenase, ו cytochromes11.
בדיקת אדום נייטרלי (NR) היא בדיקת כדאיות תאים המבוססת על שילוב צבע זה בליזוזומים של תאים בני קיימא13. ספיגת NR תלויה ביכולת התאים לשמור על שיפועי pH. שיפוע הפרוטון בתוך הליזוזומים שומר על pH נמוך יותר מהציטופלסמה. ב-pH פיזיולוגי תקין, ה-NR מציג מטען נטו של כאפס, המאפשר לו לחדור לקרומי התא. לכן, הצבע הופך טעון ונשמר בתוך הליזוזומים. כתוצאה מכך, ככל שכמות ה-NR השמור גדולה יותר, כך גדל מספר התאים בני הקיימא14. חומרים כימיים הפוגעים בפני השטח של התא או בקרומים הליזוזומליים פוגעים בספיגה של צבע זה.
בדיקת CFDA-AM היא בדיקת כדאיות תאים פלואורומטרית המבוססת על שימור 5-carboxyfluorescein diacetate acetoxymethyl ester (CFDA-AM)15. 5-CFDA-AM, מצע אסטראז, מומר לקרבוקסיפלואורסצאין, חומר פלואורסצנטי שהוא קוטבי ובלתי חדיר על ידי ממברנות של תאים חיים15; לכן, הוא נשמר בצד הפנימי של קרום התא שלם, המציין תאים קיימא.
לאחרונה, שלוש בדיקות ציטוטוקסיות (CFDA-AM, NR ו- AB assays) שולבו בהנחיית ISO (ארגון התקינה הבינלאומי) מאומתת (ISO 21115:2019)16 ובשיטת הבדיקה של OECD (הארגון לשיתוף פעולה ופיתוח כלכלי) (OECD TG 249) להערכת רעילות חריפה של דגים באמצעות קו התאים RTgill-W1 (קו תאים קבוע מפורל הקשת [Oncorhynchus mykiss] gill) בצלחות 24 בארות17 . למרות שקיימת שיטה מבוססת תאים לחיזוי רעילות חריפה של דגים, הושקעו מאמצים בפיתוח שיטות דומות עם מיני דגים אחרים ובהגדלת התפוקה של השיטה. כמה דוגמאות כוללות פיתוח של קווי תאי ZFL הנגועים בגנים של כתב עבור מסלולי רעילות ספציפיים18,19, בדיקות פוטוטוקסיות בקו תאי RTgill-W120, והשימוש בקווי תאים ZFL ו- ZF4 (פיברובלסטי של דגי זברה שמקורם בעוברים בני יום אחד) כדי להעריך רעילות על ידי מספר בדיקות ציטוטוקסיות21.
דג זברה (Danio rerio) הוא אחד ממיני הדגים העיקריים המשמשים בחקר רעילות ימית; לכן, שיטות מבוססות תאים עם שורות תאים של דגי זברה לבדיקת רעילות דגים עשויות להיות שימושיות ביותר. קו תאי ZFL הוא קו תאי הפטוציטים אפיתל של דג זברה המציג את המאפיינים העיקריים של תאים פרנכימליים בכבד ויכול לעכל קסנוביוטיקה 7,22,23,24,25. בינתיים, קו התאים ZEM2S הוא קו תאים פיברובלסטי עוברי של דג זברה הנגזר משלב הבלסטולה שניתן להשתמש בו כדי לחקור השפעות התפתחותיות על דגים26,27. לפיכך, פרוטוקול זה מתאר ארבע בדיקות ציטוטוקסיות (מבחני MTT, AB, NR ו- CFDA-AM), עם שינויים שיש לבצע עם קווי תאים ZFL ו- ZEM2S בלוחות 96 בארות.
Protocol
הערה: עיין בטבלת החומרים לקבלת רשימת החומרים המשמשים בפרוטוקול זה ובטבלה 1 עבור הרכב הפתרונות והמדיה המשמשים בפרוטוקול זה.
1. הכנת תאי ZFL ו- ZEM2S
- התחל עם בקבוק T75 של תאי ZFL או ZEM2S עם מפגש של 80%, בתרבית בתווך המלא המתאים ב 28 ° C ללא CO2.
- הסר את מדיום התרבית מן הבקבוק ולשטוף את התאים על ידי הוספת 10 מ"ל של 1x פוספט חוצץ מלוחים (PBS) (0.01 M). הוסף 3 מ"ל של 1x טריפסין (0.05% v/v; 0.5 mM טריפסין-EDTA) לצלוחיות התרבית. יש לדגור בטמפרטורה של 28°C למשך 3 דקות.
- טפחו בעדינות על הבקבוק כדי לשחרר את התאים, ולאחר מכן עצרו את עיכול הטריפסין על ידי הוספת 3 מ"ל של מדיום תרבית שלם לצלוחית.
- מעבירים את מתלה התא לצינור צנטריפוגה חרוטי 15 מ"ל וצנטריפוגה ב 100 × גרם למשך 5 דקות.
- לאחר צנטריפוגה, בזהירות להסיר את supernatant, להוסיף 1 מ"ל של מדיום מלא עבור תאי ZFL או ZEM2S, ולהשעות מחדש את הגלולה באמצעות micropipette.
2. ספירת תאים על ידי הרחקת צבע כחול טריפאן
- הוסף 10 μL של תרחיף התא ו 10 μL של צבע כחול טריפאן למיקרו-צינורית כדי לספור את התאים ולהעריך את הכדאיות שלהם. מערבבים את תרחיף התא וצובעים בעזרת פיפטה.
- לאחר מכן, העבירו 10 μL של תערובת זו (תרחיף תאים + טריפאן כחול) לתא נויבאואר וספרו את התאים בארבעת הריבועים הגדולים (רבעים Q) הממוקמים בפינות התא, בהתחשב בכך שתאים בני קיימא הם אלה שאינם תופסים טריפאן כחול. קבע את מספר התאים בני קיימא באמצעות משוואה (1):
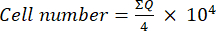 (1)
(1) - חשב את מספר התא הסופי בתרחיף התא על-ידי הכפלת מספר התא שנקבע באמצעות משוואה (1) בשניים (גורם הדילול עקב השימוש בכחול טריפאן).
הערה: לחלופין, ניתן להשתמש במערכת ספירת תאים אוטומטית (למשל, ציטומר עם פונקציית ספירת תאים ויכולת כדאיות).
3. ציפוי תאים בצלחות 96 בארות
- חשב את נפח תרחיף התא הדרוש כדי לקבל את מספר התאים הדרושים לביצוע בדיקות ציטוטוקסיות. מספר התאים בני קיימא עבור כל קו תא מצוין להלן:
- צלחת 60,000 תאי ZEM2S קיימא לכל באר; לכן, עבור הצלחת כולה, להשתמש שישה מיליון תאים ב 20 מ"ל של תווך שלם (200 μL / באר, צלחת 96 באר).
- צלחת 40,000 תאי ZFL קיימא לכל באר; לכן, עבור הצלחת כולה, להשתמש ארבעה מיליון תאים ב 20 מ"ל של תווך שלם (200 μL / טוב, צלחת 96 באר).
- לאחר מכן, להעביר את נפח המתאים של תרחיף התא למאגר מגיב (סטרילי) ולמלא עם המדיום תרבית מלאה עבור ZFL או ZEM2S ל 20 מ"ל. בעזרת פיפטה רב ערוצית, מערבבים את התמיסה בעדינות למעלה ולמטה.
הערה: יש להקפיד לא ליצור קצף או בועות. - הוסף 200 μL של תרחיף התא לכל באר של צלחת פוליסטירן שקופה 96 באר באמצעות micropipette רב ערוצי. לדגור את הצלחות ב 28 ° C במשך 24 שעות.
הערה: על הלוח להכיל לפחות שלוש בארות ללא תאים לבקרה הריקה, ויש להוסיף רק מדיה שלמה לבארות אלה. אפקט הקצה (הנגרם על ידי אידוי גבוה יותר בבארות הקצה) מתרחש בדרך כלל במבחני לוחות של 96 בארות ויכול להשפיע על הכדאיות של התאים בבארות הקצה של הצלחת28. השפעה זו יכולה להיות גבוהה או נמוכה יותר בהתאם למותג הצלחת 96 בארות ועיצוב28. למרות שלא הבחנו בהפרעה כלשהי בצמיחת תאים / כדאיות עבור ZFL ו- ZEM2S בבארות הקצה, אנו מציעים לאטום את הצלחת עם רדיד איטום פרפילם או דבק כדי למנוע השפעה זו, או לטפח את התאים רק ב -60 הבארות הפנימיות ולמלא את בארות הקצה עם PBS.
4. חשיפה של תאים לבדיקת כימיקלים
- בזהירות להשליך את התקשורת בילה מן הבארות באמצעות micropipette רב ערוצי.
- חשוף את התאים לבדיקת כימיקלים בריכוזים שונים. הכינו את התמיסות של הריכוזים הכימיים לבדיקה בתרבית עבור ZFL או ZEM2S ללא נסיוב בקר עוברי (FBS) (מדיית חשיפה). לאחר מכן, הוסף 100 μL לכל באר של תמיסות אלה בטריפליקט טכני (כלומר, שלוש בארות / ריכוז כימי בדיקה).
- עבור בקרות, מקם את קבוצות הבקרה על אותה צלחת כמו כימיקל הבדיקה בטריפליקטים טכניים (שלוש בארות/קבוצת ביקורת). כך, עבור הבקרה הריקה (B), הוסף 100 μL של מדיית החשיפה בבארות נטולות תאים, עבור הבקרה השלילית (NC), הוסף 100 μL של מדיית החשיפה לבארות עם תאים, ועבור הבקרה החיובית (PC), חשוף את התאים לתמיסה של 1% Triton X-100 שהוכנה במדיית החשיפה. במקרים מסוימים, בקרת ממס (SC) צריכה להיכלל בצלחת, בהתחשב בריכוז לא ציטוטוקסי בעליל כריכוז ממס סופי.
הערה: מומלץ להשתמש ב-0.5% DMSO כממס; DMSO יכול לשמש עד 1% כממס בשורות תאים אלה מבלי לחרוג מסף ציטוטוקסיות של 10% הקשורים לבקרה השלילית. - לדגור את הצלחות ב 28 ° C במשך 24 שעות. אטמו את הצלחות עם רדיד אלומיניום פרפילם או דבק כדי למנוע אידוי בינוני של התרבית.
הערה: כימיקלים מסוימים עשויים להיות בעלי ספיגת רקע פנימית או פלואורסצנטיות שעלולים להפריע לספיגה או לפלואורסצנטיות של צבעי האינדיקטור (למשל, תרכובות עם צבע עשויות להשפיע על הספיגה, אלבומיןבסרום 29 ותרכובות המפריעות לאנזימי חיזור30,31). במקרה זה, הצלחת חייבת לכלול בקרה נוספת על ידי הוספת פתרונות כימיים בדיקה בבארות ללא תאים. זאת כדי לאמת את ההפרעה האפשרית של הספיגה האוטומטית הכימית / אוטופלואורסצנטיות עם הצבעים. אם מזוהה הפרעה, יש להעריך אם ניתן לשלול אותה כדי לקבל חיזוי נכון של ציטוטוקסיות.
5. בדיקות ציטוטוקסיות
הערה: הכינו את כל הפתרונות לפי טבלה 1. כל השלבים המתוארים להלן (איור 1) מתבצעים בתנאים סטריליים. השימוש בפיפטה כדי להשליך את אמצעי החשיפה אינו מומלץ, מכיוון שהתאים יכולים להתנתק בקלות מהבארות לאחר טיפול כימי.
- מבחני AB ו- CFDA-AM
- לאחר 24 שעות של חשיפה לכימיקלים בבדיקה, יש להשליך בזהירות את מדיית החשיפה על-ידי מזיגת התוכן למגש איסוף.
- לשטוף את הצלחת עם 200 μL של PBS. הסר בזהירות את PBS על ידי מזיגת אותו לתוך מגש איסוף כדי למנוע אובדן תאים.
- הוסף 100 μL לכל באר של תמיסת AB/CFDA-AM. לדגור על הצלחת במשך 30 דקות בחושך ב 28 ° C.
- מדוד את הפלואורסצנטיות בקורא לוחות פלואורסצנטיים ב- 530 ננומטר (עירור) ו- 595 ננומטר (פליטה) עבור AB, וב- 493 ננומטר (עירור) ו- 541 ננומטר (פליטה) עבור CFDA-AM.
- בדיקת NR
הערה: השלבים עבור בדיקת NR מתבצעים מיד לאחר מבחני AB ו-CFDA-AM (איור 1).- צנטריפוגה את פתרון העבודה NR (40 מיקרוגרם / מ"ל) ב 600 × גרם למשך 10 דקות.
הערה: אין להעביר משקעים של NR בצינור ללוחות. לכן, לאחר צנטריפוגה של פתרון העבודה NR, לאסוף את supernatant באמצעות פיפטה מבלי לשאוף את משקעי NR. מעבירים את הסופרנאטנט למאגר מגיבים. - הסר בזהירות את תמיסת AB/CFDA-AM על-ידי מזיגת התוכן למגש איסוף.
- הוסף 100 μL לכל באר של פתרון העבודה NR באמצעות מיקרופיפטה רב ערוצית. לדגור את הצלחת ב 28 ° C במשך 3 שעות.
הערה: לאחר הדגירה של 3 שעות, בדוק אם משקעים NR התרחשו בלוחות באמצעות מיקרוסקופ. משקעי NR עלולים להפריע לכימות יכולת הקיום של התא, ולכן הם לא אמורים להיות נוכחים. - הסר בזהירות את תמיסת NR על-ידי מזיגת התוכן למגש איסוף. לשטוף את הבארות על ידי הוספת 150 μL של PBS לכל באר.
- מוסיפים 150 μL לכל באר של תמיסת מיצוי NR ודגרים על הצלחת על שייקר צלחת למשך 10 דקות לניעור עדין. מדוד את הספיגה ב- 540 ננומטר בקורא לוחות.
הערה: יש לבצע קריאה שנייה ב- 690 ננומטר כדי לא לכלול ספיגת טביעות אצבע ברקע בלוחית.
- צנטריפוגה את פתרון העבודה NR (40 מיקרוגרם / מ"ל) ב 600 × גרם למשך 10 דקות.
- בדיקת MTT
הערה: בדיקת MTT חייבת להתבצע בנפרד מהבדיקות המתוארות לעיל (בלוח חדש) (איור 2).- הסר בזהירות את המדיה החשופה על-ידי מזיגת התוכן למגש איסוף.
- הוסף 100 μL של פתרון עבודה MTT לכל באר באמצעות מיקרופיפטה רב ערוצית. לדגור את הצלחת ב 28 ° C במשך 4 שעות.
- השליכו את תמיסת MTT על ידי יציקת התוכן למגש איסוף.
- מוסיפים 100 μL לכל באר של DMSO כדי לחלץ את גבישי הפורמזן, ודוגרים את הצלחת על שייקר צלחת במשך 10 דקות. מדוד את הספיגה ב- 570 ננומטר באמצעות קורא לוחות.
הערה: יש לבצע קריאה שנייה ב- 690 ננומטר כדי לא לכלול ספיגת טביעות אצבע ברקע בלוחית. חשוב לציין כי כימיקלים לבדיקה עלולים להפריע ל- MTT, אשר יש להעריך כדי להבטיח את איכות הנתונים שנוצרו32. לשם כך יש לחשוף בארות נטולות תאים המכילות את ריכוזי הבדיקה ו-MTT (0.5 מ"ג/מ"ל), ולאחר מכן לדגור כדי לצפות בכל שינוי צבע בבארות שעלול להגביר את הספיגה ולהוביל לתוצאות כדאיות שווא. יש להימנע מכימיקלים המקיימים אינטראקציה עם MTT בבדיקה זו.
6. חישוב כדאיות התא / ציטוטוקסיות
הערה: הספיגה הגולמית או הפלואורסצנטיות הנרכשת משמשת לחישוב כדאיות התא כאחוז הקשור לבקרה שלילית (עבור כימיקלים לבדיקה שהוכנו ישירות באמצעי חשיפה) או בקרת ממס (עבור כימיקלים לבדיקה שהוכנו באמצעות ממסים, כגון DMSO). לפני קביעת אחוז הכדאיות של התא, הנתונים הגולמיים חייבים להיות מנורמלים על-ידי הפקד הריק.
- חישוב ממוצע הספיגה או הפלואורסצנטיות עבור כל קבוצת בדיקה של ריכוז כימי וקבוצת ביקורת (שלוש בארות/טיפול).
- כדי לקבוע את אחוז הכדאיות של התא ביחס לבקרה (שלילית או ממס), השתמש במשוואה (2):
 (2)
(2)
הערה: יחידות ספיגה (ABS) או פלואורסצנטיות (fluo) מייצגות את ממוצע הספיגה או הפלואורסצנטיות הנמדד בשלוש הבארות לכל ריכוז; ריק מייצג בארות ללא תאים.
תוצאות
איור 3 מראה את הלוחות של מבחני AB, CFDA-AM, NR ו-MTT. עבור בדיקת AB (איור 3A), הבארות והבארות הריקות ללא או מספר מופחת של תאים בני קיימא מראות צבע כחול ופלואורסצנטיות נמוכה, בעוד שהבארות עם מספר גבוה של תאים בני קיימא הן ורדרדות ומציגות ערכי פלואורסצנטיות גבוהים עקב הפי?...
Discussion
מבחני ציטוטוקסיות נמצאים בשימוש נרחב להערכת רעילות חוץ גופית, ומאמר פרוטוקול זה מציג ארבע בדיקות ציטוטוקסיות נפוצות ששונו לביצוע בשורות תאים של דגי זברה (כלומר, צפיפות תאים עבור צלחת 96 בארות, זמן דגירה במבחן MTT, דלדול FBS במהלך מצב החשיפה לכימיקלים, וריכוז מרבי מקובל עבור SC). מכיוון שבדי...
Disclosures
המחברים מצהירים כי אין ניגוד עניינים.
Acknowledgements
לזכרו של ד"ר מרסיו לורנצ'יני, מחבר שותף של עבודה זו, חוקר מעולה בתחום הקוסמטיקה ומוקדש לקידום המחקר הקוסמטי בברזיל. המחברים אסירי תודה למעבדה מרובת המשתמשים במחלקה לפיזיולוגיה (UFPR) על זמינות הציוד ועל התמיכה הכספית של התיאום לשיפור כוח האדם להשכלה גבוהה (CAPES, ברזיל) (קוד כספים 001) ו- Grupo Boticario.
Materials
| Name | Company | Catalog Number | Comments |
| 5-CFDA, AM (5-Carboxyfluorescein Diacetate, Acetoxymethyl Ester) | Invitrogen | C1345 | |
| Cell culture plate, 96 well plate | Sarstedt | 83.3924 | Surface: Standard, flat base |
| DMEM | Gibco | 12800-017 | Powder, high glucose, pyruvate |
| FBS - Fetal Bovine Serum, qualified, USDA-approved regions | Gibco | 12657-029 | |
| Ham's F-12 Nutrient Mix, powder | Gibco | 21700026 | Powder |
| HEPES (1 M) | Gibco | 15630080 | |
| Leibovitz's L-15 Medium | Gibco | 41300021 | Powder |
| Neutral red | Sigma-Aldrich | N4638 | Powder, BioReagent, suitable for cell culture |
| Orbital shaker | Warmnest | KLD-350-BI | 22 mm rotation diameter |
| Dulbeccos PBS (10X) with calcium and magnesium | Invitrogen | 14080055 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| Resazurin sodium salt | Sigma-Aldrich | R7017 | Powder, BioReagent, suitable for cell culture |
| RPMI 1640 Medium | Gibco | 31800-014 | Powder |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | Powder, bioreagent for molecular biology |
| Thiazolyl Blue Tetrazolium Bromide 98% | Sigma-Aldrich | M2128 | |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Trypsin-EDTA (0.5%), no phenol red | Gibco | 15400054 | |
| ZEM2S cell line | ATCC | CRL-2147 | This cell line was kindly donated by Professor Dr. Michael J. Carvan (University of Wisconsin, Milwaukee, USA) |
| ZFL cell line | BCRJ | 256 |
References
- ECHA. Non-Animal Approaches-Current Status of Regulatory Applicability Under the REACH, CLP and Biocidal Products Regulations. ECHA. , (2017).
- Alternative Methods Accepted by US Agencies. National Toxicology Program, and US Department of Health and Human Services Available from: https://ntp.niehs.nih.gov/whatwestudy/niceatm/accept-methods/index.html (2022)
- Schirmer, K. Proposal to improve vertebrate cell cultures to establish them as substitutes for the regulatory testing of chemicals and effluents using fish. Toxicology. 224 (3), 163-183 (2006).
- Scholz, S., et al. Alternatives to in vivo tests to detect endocrine disrupting chemicals (EDCs) in fish and amphibians-screening for estrogen, androgen and thyroid hormone disruption. Critical Reviews in Toxicology. 43 (1), 45-72 (2013).
- Tanneberger, K., et al. Predicting fish acute toxicity using a fish gill cell line-based toxicity assay. Environmental Science & Technology. 47 (2), 1110-1119 (2013).
- Roesler, R., Lorencini, M., Pastore, G. Brazilian cerrado antioxidant sources: cytotoxicity and phototoxicity in vitro. Food Science and Technology. 30, 814-821 (2010).
- Ruyra, A., et al. Zebrafish liver (ZFL) cells are able to mount an anti-viral response after stimulation with Poly (I:C). Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology. 182, 55-63 (2015).
- Natsch, A., Laue, H., Haupt, T., von Niederhäusen, V., Sanders, G. Accurate prediction of acute fish toxicity of fragrance chemicals with the RTgill-W1 cell assay. Environmental Toxicology and Chemistry. 37 (3), 931-941 (2018).
- Freshney, R. I. Cytotoxicity. Culture of Animal Cells: A Manual of Basic Technique. , (2005).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- O'Brien, J., Wilson, I., Orton, T., Pognan, F. Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity. European Journal of Biochemistry. 267 (17), 5421-5426 (2000).
- Gonzalez, R. J., Tarloff, J. B. Evaluation of hepatic subcellular fractions for Alamar blue and MTT reductase activity. Toxicology In Vitro. 15 (3), 257-259 (2001).
- Borenfreund, E., Puerner, J. A. Toxicity determined in vitro by morphological alterations and neutral red absorption. Toxicology Letters. 24 (2-3), 119-124 (1985).
- Repetto, G., del Peso, A., Zurita, J. L. Neutral red uptake assay for the estimation of cell viability/cytotoxicity. Nature Protocols. 3 (7), 1125-1131 (2008).
- Kamiloglu, S., Sari, G., Ozdal, T., Capanoglue, E. Guidelines for cell viability assays. Food Frontiers. 1 (3), 332-349 (2020).
- Water Quality-Determination of Acute Toxicity of Water Samples and Chemicals to a Fish Gill Cell Line (RTgill-W1) (ISO 21115:2019). International Organization for Standardization Available from: https://www.iso.org/standar/69933.html (2019)
- Organisation for Economic Co-operation and Development. . Test Guideline No. 249: Fish Cell Line Acute Toxicity-The RTgill-W1 Cell Line Assay. OECD Guidelines for the Testing of Chemicals, Section 2. Effects on Biotic Systems. , (2021).
- Lungu-Mitea, S., Lundqvist, J. Potentials and pitfalls of transient in vitro reporter bioassays: interference by vector geometry and cytotoxicity in recombinant zebrafish cell lines. Archives of Toxicology. 94 (8), 2769-2784 (2020).
- Lungu-Mitea, S., Han, Y., Lundqvist, J. Development, scrutiny, and modulation of transient reporter gene assays of the xenobiotic metabolism pathway in zebrafish hepatocytes. Cell Biology and Toxicology. , 1-23 (2021).
- Schirmer, K., Chan, A. G., Greenberg, B. M., Dixon, D. G., Bols, N. C. Methodology for demonstrating and measuring the photocytotoxicity of fluoranthene to fish cells in culture. Toxicology In Vitro. 11 (1-2), 107-119 (1997).
- Lungu-Mitea, S., et al. Modeling bioavailable concentrations in zebrafish cell lines and embryos increases the correlation of toxicity potencies across test systems. Environmental Science & Technology. 55 (1), 447-457 (2021).
- Cavalcante, D. G. S. M., et al. Cytotoxic, biochemical and genotoxic effects of biodiesel produced by different routes on ZFL cell line. Toxicology In Vitro. 28 (6), 1117-1125 (2014).
- Meng, Q., Yeung, K., Chan, K. M. Toxic effects of octocrylene on zebrafish larvae and liver cell line (ZFL). Aquatic Toxicology. 236, 105843 (2021).
- Kwok, M. L., Chan, K. M. Oxidative stress and apoptotic effects of copper and cadmium in the zebrafish liver cell line ZFL. Toxicology Reports. 7, 822-835 (2020).
- Yang, J., Chan, K. M. Evaluation of the toxic effects of brominated compounds (BDE-47, 99, 209, TBBPA) and bisphenol A (BPA) using a zebrafish liver cell line, ZFL. Aquatic Toxicology. 159, 138-147 (2015).
- Bradford, C. S., Sun, L., Collodi, P., Barnes, D. W. Cell cultures from zebrafish embryos and adult tissues. Journal of Tissue Culture Methods. 16 (2), 99-107 (1994).
- He, S., et al. Genetic and transcriptome characterization of model zebrafish cell lines. Zebrafish. 3 (4), 441-453 (2006).
- Mansoury, M., Hamed, M., Karmustaji, R., Al Hannan, F., Safrany, S. T. The edge effect: A global problem. The trouble with culturing cells in 96-well plates. Biochemistry and Biophysics Reports. 26, 100987 (2021).
- Funk, D., Schrenk, H. -. H., Frei, E. Serum albumin leads to false-positive results in the XTT and the MTT assay. BioTechniques. 43 (2), 178 (2007).
- Dayeh, V. R., Bols, N. C., Tanneberger, K., Schirmer, K., Lee, L. E. J. The use of fish-derived cell lines for investigation of environmental contaminants: An update following OECD's fish toxicity testing framework no. 171. Current Protocols in Toxicology. 1, (2013).
- Stepanenko, A. A., Dmitrenko, V. V. Pitfalls of the MTT assay: Direct and off-target effects of inhibitors can result in over/underestimation of cell viability. Gene. 574 (2), 193-203 (2015).
- Ulukaya, E., Colakogullari, M., Wood, E. J. Interference by anti-cancer chemotherapeutic agents in the MTT-tumor chemosensitivity assay. Chemotherapy. 50 (1), 43-50 (2004).
- Sebaugh, J. L. Guidelines for accurate EC50/IC50 estimation. Pharmaceutical Statistics. 10 (2), 128-134 (2011).
- Weimer, M., et al. The impact of data transformations on concentration-response modeling. Toxicology Letters. 213 (2), 292-298 (2012).
- Green, J. W., Holbech, T. A., Henrik, Chapter 4: Analysis of Continuous Data (Regression). Statistical Analysis of Ecotoxicity Studies. , (2018).
- Proença, S., et al. Effective exposure of chemicals in in vitro cell systems: A review of chemical distribution models. Toxicology In Vitro. 73, 105133 (2021).
- Guidony, N. S., et al. ABC proteins activity and cytotoxicity in zebrafish hepatocytes exposed to triclosan. Environmental Pollution. 271, 116368 (2021).
- da Silva, N. D. G., et al. Interference of goethite in the effects of glyphosate and Roundup® on ZFL cell line. Toxicology In Vitro. 65, 104755 (2020).
- Yang, Y., et al. Temperature is a key factor influencing the invasion and proliferation of Toxoplasma gondii in fish cells. Experimental Parasitology. 217, 107966 (2020).
- Lopes, F. M., Sandrini, J. Z., Souza, M. M. Toxicity induced by glyphosate and glyphosate-based herbicides in the zebrafish hepatocyte cell line (ZF-L). Ecotoxicology and Environmental Safety. 162, 201-207 (2018).
- Lachner, D., Oliveira, L. F., Martinez, C. B. R. Effects of the water soluble fraction of gasoline on ZFL cell line: Cytotoxicity, genotoxicity and oxidative stress. Toxicology In Vitro. 30, 225-230 (2015).
- Morozesk, M., et al. Effects of multiwalled carbon nanotubes co-exposure with cadmium on zebrafish cell line: Metal uptake and accumulation, oxidative stress, genotoxicity and cell cycle. Ecotoxicology and Environmental Safety. 202, 110892 (2020).
- Dognani, G., et al. Nanofibrous membranes for low-concentration Cr VI adsorption: kinetic, thermodynamic and the influence on ZFL cells viability. Materials Research. , 24 (2021).
- ZEM2S (ATCC®CRL-2147™). American Type Culture Collection Available from: https://www.atcc.org/products/crl-2147 (2023)
- Chen, Y., et al. Acute toxicity of the cationic surfactant C12-benzalkonium in different bioassays: how test design affects bioavailability and effect concentrations. Environmental Toxicology and Chemistry. 33 (3), 606-615 (2014).
- Pomponio, G., et al. In vitro kinetics of amiodarone and its major metabolite in two human liver cell models after acute and repeated treatments. Toxicology In Vitro. 30, 36-51 (2015).
- Mori, M., Wakabayashi, M. Cytotoxicity evaluation of chemicals using cultured fish cells. Water Science and Technology. 42 (7-8), 277-282 (2000).
- Caminada, D., Escher, C., Fent, K. Cytotoxicity of pharmaceuticals found in aquatic systems: comparison of PLHC-1 and RTG-2 fish cell lines. Aquatic Toxicology. 79 (2), 114-123 (2006).
- Giltrap, M., et al. In vitro screening of organotin compounds and sediment extracts for cytotoxicity to fish cells. Environmental Toxicology and Chemistry. 30 (1), 154-161 (2011).
- Hollert, H., Duerr, M., Erdinger, L., Braunbeck, T. Cytotoxicity of settling particulate matter and sediments of the Neckar River (Germany) during a winter flood. Environmental Toxicology and Chemistry. 19 (3), 528-534 (2000).
- Pannetier, P., et al. Toxicity assessment of pollutants sorbed on environmental sample microplastics collected on beaches: Part I-adverse effects on fish cell line. Environmental Pollution. 248, 1088-1097 (2019).
- Ternjej, I., Srček, V. G., Mihaljević, Z., Kopjar, N. Cytotoxic and genotoxic effects of water and sediment samples from gypsum mining area in channel catfish ovary (CCO) cells. Ecotoxicology and Environmental Safety. 98, 119-127 (2013).
- Hamid, R., Rotshteyn, Y., Rabadi, L., Parikh, R., Bullock, P. Comparison of alamar blue and MTT assays for high throughput screening. Toxicology In Vitro. 18 (5), 703-710 (2004).
- Vistica, D. T., et al. Tetrazolium-based assays for cellular viability: a critical examination of selected parameters affecting formazan production. Cancer Research. 51 (10), 2515-2520 (1991).
- Knauer, K., Lampert, C., Gonzalez-Valero, J. Comparison of in vitro and in vivo acute fish toxicity in relation to toxicant mode of action. Chemosphere. 68 (8), 1435-1441 (2007).
- Stadnicka-Michalak, J., Tanneberger, K., Schirmer, K., Ashauer, R. Measured and modeled toxicokinetics in cultured fish cells and application to in vitro-in vivo toxicity extrapolation. PLoS One. 9 (3), 92303 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved