このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ゼブラフィッシュ細胞株を用いた細胞毒性アッセイ
要約
このプロトコルは、96ウェルプレートのゼブラフィッシュ胚(ZEM2S)および肝臓(ZFL)細胞株の細胞毒性の評価に適した、一般的に使用される細胞毒性アッセイ(Alamar Blue [AB]、CFDA-AM、ニュートラルレッド、およびMTTアッセイ)を提示します。
要約
魚類細胞株は生態毒性試験でますます使用されるようになり、細胞毒性アッセイは魚類の急性毒性を予測する方法として提案されている。したがって、このプロトコルは、96ウェルプレートのゼブラフィッシュ(ダニオレリオ)胚(ZEM2S)および肝臓(ZFL)細胞株における細胞生存率を評価するために改変された細胞毒性アッセイを提示します。評価された細胞毒性エンドポイントは、ミトコンドリアの完全性(Alamar Blue [AB]およびMTTアッセイ)、エステラーゼ活性 を介した 膜の完全性(CFDA-AMアッセイ)、およびリソソーム膜の完全性(ニュートラルレッド[NR]アッセイ)です。96ウェルプレートに試験物質を曝露した後、細胞毒性アッセイが行われます。ここでは、ABおよびCFDA-AMが同時に行われ、続いて同じプレート上でNRが行われ、一方、MTTアッセイは別のプレート上で行われる。これらのアッセイの読み出しは、ABおよびCFDA-AMの蛍光、MTTおよびNRの吸光度によって取得されます。これらの魚細胞株を用いて実施される細胞毒性アッセイは、魚に対する化学物質の急性毒性を研究するために使用することができる。
概要
化学物質は、人の健康と環境に対する安全性についてテストする必要があります。分子および細胞バイオマーカーは、in vivoの有害転帰(内分泌かく乱、免疫学的反応、急性毒性、光毒性など)に先行する可能性があるため、規制当局および/または法律(REACH、OECD、US EPAなど)1,2による生物への影響を予測するための安全性評価においてますます考慮されています3,4,5,6,7。.これに関連して、細胞毒性は、魚類の急性毒性を予測するための測定値として採用されている5,8;しかし、化学物質のサブ細胞毒性濃度を定義して魚に対する最も多様な影響(内分泌かく乱効果など)を研究するなど、生態毒性研究には他の多くの用途があります。
細胞培養系(in vitro 系)では、化学物質の細胞毒性は、エンドポイントの種類が異なる方法で決定できます。例えば、細胞毒性法は、細胞死プロセス中に観察される特定の形態に関連するエンドポイントに基づくことができ、別の方法は、細胞死、生存率および機能性、形態、エネルギー代謝、ならびに細胞の付着および増殖の測定によって細胞毒性を決定することができる。化学物質はさまざまなメカニズムで細胞生存率に影響を与える可能性があるため、化学的影響を予測するには、さまざまな細胞生存率エンドポイントをカバーする細胞毒性評価が必要です9。
MTTおよびAlamar Blue(AB)は、細胞代謝活性に基づいて細胞生存率への影響を決定するアッセイです。MTTアッセイは、ミトコンドリア酵素コハク酸デヒドロゲナーゼ10の活性を評価する。黄色がかった3-[4,5-ジメチルチアゾール-2イル]-2,5-ジフェニルテトラゾリウムブロミド(MTT)のホルマザンブルーへの還元は、生細胞でのみ起こり、その光学密度は生細胞の数に正比例します10。ABアッセイは高感度酸化還元指標であり、生細胞によってレサズリンをレゾルフィンに還元すると蛍光を発し、色が変化するミトコンドリア酵素によって媒介されます11。しかしながら、細胞質およびミクロソーム酵素もまた、ABおよびMTT12の減少に寄与する。これらの酵素には、アルコールおよびアルデヒドオキシドレダクターゼ、NAD(P)H:キノンオキシドレダクターゼ、フラビンレダクターゼ、NADHデヒドロゲナーゼ、およびシトクロム11などのいくつかのレダクターゼが含まれる場合があります。
ニュートラルレッド(NR)アッセイは、生存細胞のリソソームへのこの色素の取り込みに基づく細胞生存率アッセイです13。NRの取り込みは、pH勾配を維持する細胞の能力に依存します。リソソーム内のプロトン勾配は、細胞質よりも低いpHを維持します。通常の生理的pHでは、NRはほぼゼロの正味電荷を示し、細胞膜を透過することができます。したがって、色素は荷電し、リソソームの内部に保持されます。その結果、保持されるNRの量が多いほど、生細胞14の数が多くなる。細胞表面またはリソソーム膜を損傷する化学物質は、この色素の取り込みを損ないます。
CFDA-AMアッセイは、5-カルボキシフルオレセインジアセテートアセトキシメチルエステル(CFDA-AM)15の保持に基づく蛍光細胞生存率アッセイです。エステラーゼ基質である5-CFDA-AMは、極性があり、生細胞の膜によって非透過性の蛍光物質であるカルボキシフルオレセインに変換されます15;したがって、それは無傷の細胞膜の内側に保持され、生存細胞を示す。
最近、3つの細胞毒性アッセイ(CFDA-AM、NR、およびABアッセイ)が、検証済みのISO(国際標準化機構)ガイドライン(ISO 21115:2019)16およびOECD(経済協力開発機構)試験方法(OECD TG 249)で組み合わされ、24ウェルプレートでRTgill-W1細胞株(ニジマス[Oncorhynchus mykiss]ギルからの永久細胞株)を使用して魚の急性毒性を評価しました17.魚類の急性毒性を予測するための既存の細胞ベースの方法がありますが、他の魚種と同様の方法を開発し、その処理量を増やすことに努力が払われてきました。いくつかの例には、特異的毒性経路18、19のためのレポーター遺伝子をトランスフェクトしたZFL細胞株の開発、RTgill−W1細胞株20における光毒性試験、およびいくつかの細胞毒性アッセイ21によって毒性を評価するためのZFLおよびZF4細胞株(1日齢の胚に由来するゼブラフィッシュ線維芽細胞)の使用が含まれる。
ダニオレリオ(ゼブラフィッシュ)は、水生毒性試験で使用される主要な魚種の1つです。したがって、魚類毒性試験のためのゼブラフィッシュ細胞株を用いた細胞ベースの方法は非常に有用であり得る。ZFL細胞株は、肝実質細胞の主な特徴を示し、生体異物を代謝できるゼブラフィッシュ上皮肝細胞株です7、22、23、24、25。一方、ZEM2S細胞株は、胚芽細胞期に由来する胚性ゼブラフィッシュ線維芽細胞株であり、魚類の発生効果を調べるために使用することができる26,27。したがって、このプロトコルは、96ウェルプレート中のZFLおよびZEM2S細胞株を用いて実施される修飾を伴う4つの細胞毒性アッセイ(MTT、AB、NR、およびCFDA-AMアッセイ)を記載しています。
プロトコル
注:このプロトコルで使用される材料のリストについては材料表を、このプロトコルで使用される溶液と培地の構成については表1を参照してください。
1. ZFLおよびZEM2Sセルの準備
- ZFLまたはZEM2S細胞のT75フラスコを80%コンフルエントで開始し、CO2を含まない28°Cのそれぞれの完全培地中で培養した。
- フラスコから培養液を取り出し、10 mLの1xリン酸緩衝生理食塩水(PBS)(0.01 M)を加えて細胞を洗浄します。3 mL の 1x トリプシン (0.05% v/v; 0.5 mM トリプシン-EDTA) を培養フラスコに加えます。28°Cで3分間インキュベートします。
- フラスコを軽くたたいて細胞を放出し、3 mLの完全培養培地をフラスコに加えてトリプシン消化を停止します。
- 細胞懸濁液を15 mLのコニカル遠沈管に移し、100 × g で5分間遠心分離します。
- 遠心分離後、上清を注意深く除去し、ZFLまたはZEM2S細胞用の完全培地1 mLを加え、マイクロピペットを使用してペレットを再懸濁します。
2.トリパンブルー色素排除による細胞カウント
- 10 μLの細胞懸濁液と10 μLのトリパンブルー色素をマイクロチューブに加え、細胞をカウントし、生存率を評価します。ピペットを使用して細胞懸濁液と染料を混合します。
- 次に、この混合物(細胞懸濁液+トリパンブルー)10 μLをノイバウアーチャンバーに移し、チャンバーの角に配置された4つの大きな正方形(象限Q)の細胞をカウントし、生存可能な細胞をトリパンブルーを取り込まないものと見なします。式 (1) を使用して生細胞数を決定します。
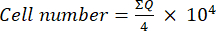 (1)
(1) - 式(1)を用いて求めた細胞数に2(トリパンブルーの使用による希釈倍率)を乗じて細胞懸濁液中の最終細胞数を算出する。
注:あるいは、自動細胞計数システム(例えば、 細胞計数および生存能力機能を備えた細胞腫)を使用することができる。
3. 96ウェルプレートでのセルプレーティング
- 細胞毒性アッセイを実行するために必要な細胞数を得るために必要な細胞懸濁液量を計算する。各細胞株の生細胞数を以下に示す:
- ウェルあたり60,000個の生存可能な ZEM2S細胞 をプレート化します。したがって、プレート全体に対して、20 mLの完全培地(200 μL/ウェル、96ウェルプレート)に600万個の細胞を使用します。
- ウェルあたり40,000個の生存可能な ZFL細胞 をプレートします。したがって、プレート全体に対して、20 mLの完全培地(200 μL/ウェル、96ウェルプレート)に400万個の細胞を使用します。
- その後、細胞懸濁液の各容量を試薬リザーバー(滅菌済み)に移し、ZFLまたはZEM2S用の完全培養培地を20mLまで充填します。マルチチャンネルピペットを使用して、溶液を穏やかに上下に混合します。
注意: 泡や泡を形成しないように注意してください。 - マルチチャンネルマイクロピペットを使用して、透明ポリスチレン96ウェルプレートの各ウェルに200 μLの細胞懸濁液を追加します。プレートを28°Cで24時間インキュベートします。
注:プレートには、ブランクコントロール用のセルのないウェルが少なくとも3つ必要であり、これらのウェルには完全な培地のみを追加する必要があります。エッジ効果(エッジウェルにおけるより高い蒸発によって引き起こされる)は、96ウェルプレートアッセイにおいて一般的に起こり、プレート28のエッジウェルにおける細胞の生存率に影響を及ぼし得る。この効果は、96ウェルプレートのブランドおよび設計に応じて高くまたは低くなり得る28。エッジウェルではZFLおよびZEM2Sの細胞増殖/生存率の乱れは見られませんでしたが、この影響を防ぐためにプレートをパラフィルムまたは接着剤シーリングフォイルで密封するか、60個のウェル内でのみ細胞を培養し、エッジウェルにPBSを充填することをお勧めします。
4.テスト化学物質への細胞の暴露
- マルチチャンネルマイクロピペットを使用して、使用済みの培地をウェルから慎重に廃棄します。
- 細胞をさまざまな濃度の試験化学物質にさらします。ウシ胎児血清(FBS)を含まないZFLまたはZEM2Sの培養培地(暴露培地)中の試験化学物質濃度の溶液を調製する。次に、これらの溶液を1ウェルあたり100 μLのテクニカルトリプリケート(つまり、3ウェル/テスト化学物質濃度)で追加します。
- コントロールの場合は、テクニカルトリプリケート(3つのウェル/コントロールグループ)の試験化学物質と同じプレートにコントロールグループを配置します。したがって、ブランクコントロール(B)については、無細胞ウェルに100μLの暴露培地を加え、ネガティブコントロール(NC)については、100μLの暴露培地を細胞を含むウェルに加え、ポジティブコントロール(PC)については、暴露培地で調製した1%Triton X-100の溶液に細胞をさらす。場合によっては、明らかに非細胞毒性濃度を最終溶媒濃度として考慮して、溶媒コントロール(SC)をプレートに含める必要があります。
注意: 溶媒として0.5%DMSOを使用することをお勧めします。DMSOは、陰性対照に関連する細胞毒性閾値10%を超えることなく、これらの細胞株において溶媒として1%まで使用することができる。 - プレートを28°Cで24時間インキュベートします。培地の蒸発を防ぐために、パラフィルムまたは接着剤シーリングホイルでプレートをシールします。
注:特定の化学物質は、指示色素の吸光度または蛍光を妨げる可能性のある固有のバックグラウンド吸光度または蛍光を有する可能性がある(例えば、色を有する化合物は吸光度、血清アルブミン29、および還元酵素を妨害する化合物30,31に影響を与える可能性がある)。この場合、プレートは、細胞のないウェルに試験化学溶液を添加することによる追加の対照を含まなければならない。これは、化学自己吸光/自家蛍光と色素の干渉の可能性を検証するためです。干渉が検出された場合、細胞毒性の正しい予測を得るためにそれを除外できるかどうかを評価する必要があります。
5. 細胞毒性アッセイ
メモ: 表 1 に従ってすべての溶液を準備します。以下に説明するすべてのステップ(図1)は、無菌条件下で実行されます。ピペットを使用して暴露媒体を廃棄することは、化学処理後に細胞がウェルから容易に剥離する可能性があるため、推奨されません。
- ABおよびCFDA-AMアッセイ
- 24時間の試験化学物質暴露後、内容物を収集トレイに注ぎ、暴露媒体を慎重に廃棄します。
- プレートを200 μLのPBSで洗浄します。細胞が失われないように、PBSを収集トレイに注いで慎重に取り外します。
- AB/CFDA-AM溶液のウェルあたり100 μLを追加します。プレートを28°Cの暗所で30分間インキュベートします。
- 蛍光プレートリーダーで、ABの場合は530 nm(励起)と595 nm(発光)、CFDA-AMの場合は493 nm(励起)と541 nm(発光)で蛍光を測定します。
- NRアッセイ
注:NRアッセイの手順は、ABおよびCFDA-AMアッセイの直後に実行されます(図1)。- NR作業溶液(40 μg/mL)を600 × g で10分間遠心分離します。
注意: チューブ内のNRの沈殿はプレートに移してはなりません。従って、NR作動液を遠心分離した後、NR沈殿物を吸引することなくピペットを用いて上清を回収する。上清を試薬リザーバーに移します。 - 内容物を収集トレイに注ぎ、AB / CFDA-AMソリューションを慎重に取り外します。
- マルチチャンネルマイクロピペットを使用して、NR作業溶液のウェルあたり100 μLを追加します。プレートを28°Cで3時間インキュベートします。
注:3時間のインキュベーション後、顕微鏡を使用してプレートにNR沈殿が発生したかどうかを観察します。NR沈殿物は、細胞生存率の定量化を妨げる可能性があり、したがって、それらは存在すべきではない。 - 内容物を収集トレイに注ぎ、NR溶液を慎重に取り出します。ウェルあたり150 μLのPBSを加えてウェルを洗浄します。
- NR抽出溶液のウェルあたり150 μLを加え、プレートシェーカーでプレートを10分間インキュベートして穏やかに振とうします。プレートリーダーで540 nmの吸光度を測定します。
注意: プレート内のバックグラウンド指紋吸光度を除外するために、690nmでの2回目の読み出しを実行する必要があります。
- NR作業溶液(40 μg/mL)を600 × g で10分間遠心分離します。
- MTTアッセイ
注:MTTアッセイは、上記のアッセイとは別に(新しいプレートで)実行する必要があります(図2)。- 内容物を収集トレイに注ぎ、露光メディアを慎重に取り外します。
- マルチチャンネルマイクロピペットを使用して、ウェルあたり100 μLのMTT作業溶液を追加します。プレートを28°Cで4時間インキュベートします。
- MTTソリューションを廃棄するには、内容物を収集トレイに注ぎます。
- DMSOを1ウェルあたり100 μL加えてホルマザン結晶を抽出し、プレートシェーカー上でプレートを10分間インキュベートします。プレートリーダーを使用して570 nmの吸光度を測定します。
注意: プレート内のバックグラウンド指紋吸光度を除外するために、690nmでの2回目の読み出しを実行する必要があります。試験化学物質がMTTに干渉する可能性があることに留意することは重要であり、これは生成されたデータ32の品質を保証するために評価されなければならない。このためには、試験濃度とMTT(0.5 mg / mL)を含む無細胞ウェルを曝露し、続いてインキュベーションして、吸光度を増加させ、誤った生存率の結果につながる可能性のあるウェルの色の変化を観察する必要があります。このテストでは、MTTと相互作用する化学物質を避ける必要があります。
6. 細胞生存率/細胞毒性の計算
注:取得した生の吸光度または蛍光は、ネガティブコントロール(曝露媒体で直接調製された試験化学物質の場合)または溶媒コントロール(DMSOなどの溶媒を使用して調製された試験化学物質の場合)に関連するパーセンテージとして細胞生存率を計算するために使用されます。細胞生存率を決定する前に、生データをブランクコントロールで正規化する必要があります。
- 各試験化学物質濃度および対照群(3ウェル/処理)の平均吸光度または蛍光を計算します。
- 対照(陰性または溶媒)に対する細胞生存率を決定するには、式(2)を使用します。
 (2)
(2)
注:吸光度(abs)または蛍光(fluo)単位は、濃度ごとに3つのウェルで測定された吸光度または蛍光の平均を表します。空白はセルのないウェルを表します。
結果
図3は、AB、CFDA-AM、NR、およびMTTアッセイのプレートを示しています。ABアッセイ(図3A)では、ブランクウェルおよび生存細胞数がない、または生存細胞数が減少したウェルは青色で蛍光が低いのに対し、生細胞数が多いウェルはピンクがかっており、生存細胞によるレサズリン(AB)のレゾルフィン(ピンクがかった物質)への変換により高い蛍光値を示?...
ディスカッション
細胞毒性アッセイはin vitro毒性評価に広く使用されており、このプロトコル記事では、ゼブラフィッシュ細胞株で実施するように改変された4つの一般的に使用される細胞毒性アッセイ(すなわち、96ウェルプレートの細胞密度、MTTアッセイでのインキュベーション時間、化学物質暴露条件下でのFBS枯渇、およびSCの最大許容濃度)を紹介します。これらのアッセイは、異なる細胞生存率エ?...
開示事項
著者は利益相反を宣言しません。
謝辞
この作品の共著者であり、化粧品の分野で優れた研究者であり、ブラジルでの化粧品研究の促進に専念しているマルシオ・ロレンチーニ博士を記念して。著者らは、生理学部(UFPR)のマルチユーザーラボラトリーの機器の入手可能性と、高等教育要員の改善のための調整(CAPES、ブラジル)(財務コード001)およびGrupo Boticarioの財政的支援に感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| 5-CFDA, AM (5-Carboxyfluorescein Diacetate, Acetoxymethyl Ester) | Invitrogen | C1345 | |
| Cell culture plate, 96 well plate | Sarstedt | 83.3924 | Surface: Standard, flat base |
| DMEM | Gibco | 12800-017 | Powder, high glucose, pyruvate |
| FBS - Fetal Bovine Serum, qualified, USDA-approved regions | Gibco | 12657-029 | |
| Ham's F-12 Nutrient Mix, powder | Gibco | 21700026 | Powder |
| HEPES (1 M) | Gibco | 15630080 | |
| Leibovitz's L-15 Medium | Gibco | 41300021 | Powder |
| Neutral red | Sigma-Aldrich | N4638 | Powder, BioReagent, suitable for cell culture |
| Orbital shaker | Warmnest | KLD-350-BI | 22 mm rotation diameter |
| Dulbeccos PBS (10X) with calcium and magnesium | Invitrogen | 14080055 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| Resazurin sodium salt | Sigma-Aldrich | R7017 | Powder, BioReagent, suitable for cell culture |
| RPMI 1640 Medium | Gibco | 31800-014 | Powder |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | Powder, bioreagent for molecular biology |
| Thiazolyl Blue Tetrazolium Bromide 98% | Sigma-Aldrich | M2128 | |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Trypsin-EDTA (0.5%), no phenol red | Gibco | 15400054 | |
| ZEM2S cell line | ATCC | CRL-2147 | This cell line was kindly donated by Professor Dr. Michael J. Carvan (University of Wisconsin, Milwaukee, USA) |
| ZFL cell line | BCRJ | 256 |
参考文献
- ECHA. Non-Animal Approaches-Current Status of Regulatory Applicability Under the REACH, CLP and Biocidal Products Regulations. ECHA. , (2017).
- Alternative Methods Accepted by US Agencies. National Toxicology Program, and US Department of Health and Human Services Available from: https://ntp.niehs.nih.gov/whatwestudy/niceatm/accept-methods/index.html (2022)
- Schirmer, K. Proposal to improve vertebrate cell cultures to establish them as substitutes for the regulatory testing of chemicals and effluents using fish. Toxicology. 224 (3), 163-183 (2006).
- Scholz, S., et al. Alternatives to in vivo tests to detect endocrine disrupting chemicals (EDCs) in fish and amphibians-screening for estrogen, androgen and thyroid hormone disruption. Critical Reviews in Toxicology. 43 (1), 45-72 (2013).
- Tanneberger, K., et al. Predicting fish acute toxicity using a fish gill cell line-based toxicity assay. Environmental Science & Technology. 47 (2), 1110-1119 (2013).
- Roesler, R., Lorencini, M., Pastore, G. Brazilian cerrado antioxidant sources: cytotoxicity and phototoxicity in vitro. Food Science and Technology. 30, 814-821 (2010).
- Ruyra, A., et al. Zebrafish liver (ZFL) cells are able to mount an anti-viral response after stimulation with Poly (I:C). Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology. 182, 55-63 (2015).
- Natsch, A., Laue, H., Haupt, T., von Niederhäusen, V., Sanders, G. Accurate prediction of acute fish toxicity of fragrance chemicals with the RTgill-W1 cell assay. Environmental Toxicology and Chemistry. 37 (3), 931-941 (2018).
- Freshney, R. I. Cytotoxicity. Culture of Animal Cells: A Manual of Basic Technique. , (2005).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- O'Brien, J., Wilson, I., Orton, T., Pognan, F. Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity. European Journal of Biochemistry. 267 (17), 5421-5426 (2000).
- Gonzalez, R. J., Tarloff, J. B. Evaluation of hepatic subcellular fractions for Alamar blue and MTT reductase activity. Toxicology In Vitro. 15 (3), 257-259 (2001).
- Borenfreund, E., Puerner, J. A. Toxicity determined in vitro by morphological alterations and neutral red absorption. Toxicology Letters. 24 (2-3), 119-124 (1985).
- Repetto, G., del Peso, A., Zurita, J. L. Neutral red uptake assay for the estimation of cell viability/cytotoxicity. Nature Protocols. 3 (7), 1125-1131 (2008).
- Kamiloglu, S., Sari, G., Ozdal, T., Capanoglue, E. Guidelines for cell viability assays. Food Frontiers. 1 (3), 332-349 (2020).
- Water Quality-Determination of Acute Toxicity of Water Samples and Chemicals to a Fish Gill Cell Line (RTgill-W1) (ISO 21115:2019). International Organization for Standardization Available from: https://www.iso.org/standar/69933.html (2019)
- Organisation for Economic Co-operation and Development. . Test Guideline No. 249: Fish Cell Line Acute Toxicity-The RTgill-W1 Cell Line Assay. OECD Guidelines for the Testing of Chemicals, Section 2. Effects on Biotic Systems. , (2021).
- Lungu-Mitea, S., Lundqvist, J. Potentials and pitfalls of transient in vitro reporter bioassays: interference by vector geometry and cytotoxicity in recombinant zebrafish cell lines. Archives of Toxicology. 94 (8), 2769-2784 (2020).
- Lungu-Mitea, S., Han, Y., Lundqvist, J. Development, scrutiny, and modulation of transient reporter gene assays of the xenobiotic metabolism pathway in zebrafish hepatocytes. Cell Biology and Toxicology. , 1-23 (2021).
- Schirmer, K., Chan, A. G., Greenberg, B. M., Dixon, D. G., Bols, N. C. Methodology for demonstrating and measuring the photocytotoxicity of fluoranthene to fish cells in culture. Toxicology In Vitro. 11 (1-2), 107-119 (1997).
- Lungu-Mitea, S., et al. Modeling bioavailable concentrations in zebrafish cell lines and embryos increases the correlation of toxicity potencies across test systems. Environmental Science & Technology. 55 (1), 447-457 (2021).
- Cavalcante, D. G. S. M., et al. Cytotoxic, biochemical and genotoxic effects of biodiesel produced by different routes on ZFL cell line. Toxicology In Vitro. 28 (6), 1117-1125 (2014).
- Meng, Q., Yeung, K., Chan, K. M. Toxic effects of octocrylene on zebrafish larvae and liver cell line (ZFL). Aquatic Toxicology. 236, 105843 (2021).
- Kwok, M. L., Chan, K. M. Oxidative stress and apoptotic effects of copper and cadmium in the zebrafish liver cell line ZFL. Toxicology Reports. 7, 822-835 (2020).
- Yang, J., Chan, K. M. Evaluation of the toxic effects of brominated compounds (BDE-47, 99, 209, TBBPA) and bisphenol A (BPA) using a zebrafish liver cell line, ZFL. Aquatic Toxicology. 159, 138-147 (2015).
- Bradford, C. S., Sun, L., Collodi, P., Barnes, D. W. Cell cultures from zebrafish embryos and adult tissues. Journal of Tissue Culture Methods. 16 (2), 99-107 (1994).
- He, S., et al. Genetic and transcriptome characterization of model zebrafish cell lines. Zebrafish. 3 (4), 441-453 (2006).
- Mansoury, M., Hamed, M., Karmustaji, R., Al Hannan, F., Safrany, S. T. The edge effect: A global problem. The trouble with culturing cells in 96-well plates. Biochemistry and Biophysics Reports. 26, 100987 (2021).
- Funk, D., Schrenk, H. -. H., Frei, E. Serum albumin leads to false-positive results in the XTT and the MTT assay. BioTechniques. 43 (2), 178 (2007).
- Dayeh, V. R., Bols, N. C., Tanneberger, K., Schirmer, K., Lee, L. E. J. The use of fish-derived cell lines for investigation of environmental contaminants: An update following OECD's fish toxicity testing framework no. 171. Current Protocols in Toxicology. 1, (2013).
- Stepanenko, A. A., Dmitrenko, V. V. Pitfalls of the MTT assay: Direct and off-target effects of inhibitors can result in over/underestimation of cell viability. Gene. 574 (2), 193-203 (2015).
- Ulukaya, E., Colakogullari, M., Wood, E. J. Interference by anti-cancer chemotherapeutic agents in the MTT-tumor chemosensitivity assay. Chemotherapy. 50 (1), 43-50 (2004).
- Sebaugh, J. L. Guidelines for accurate EC50/IC50 estimation. Pharmaceutical Statistics. 10 (2), 128-134 (2011).
- Weimer, M., et al. The impact of data transformations on concentration-response modeling. Toxicology Letters. 213 (2), 292-298 (2012).
- Green, J. W., Holbech, T. A., Henrik, Chapter 4: Analysis of Continuous Data (Regression). Statistical Analysis of Ecotoxicity Studies. , (2018).
- Proença, S., et al. Effective exposure of chemicals in in vitro cell systems: A review of chemical distribution models. Toxicology In Vitro. 73, 105133 (2021).
- Guidony, N. S., et al. ABC proteins activity and cytotoxicity in zebrafish hepatocytes exposed to triclosan. Environmental Pollution. 271, 116368 (2021).
- da Silva, N. D. G., et al. Interference of goethite in the effects of glyphosate and Roundup® on ZFL cell line. Toxicology In Vitro. 65, 104755 (2020).
- Yang, Y., et al. Temperature is a key factor influencing the invasion and proliferation of Toxoplasma gondii in fish cells. Experimental Parasitology. 217, 107966 (2020).
- Lopes, F. M., Sandrini, J. Z., Souza, M. M. Toxicity induced by glyphosate and glyphosate-based herbicides in the zebrafish hepatocyte cell line (ZF-L). Ecotoxicology and Environmental Safety. 162, 201-207 (2018).
- Lachner, D., Oliveira, L. F., Martinez, C. B. R. Effects of the water soluble fraction of gasoline on ZFL cell line: Cytotoxicity, genotoxicity and oxidative stress. Toxicology In Vitro. 30, 225-230 (2015).
- Morozesk, M., et al. Effects of multiwalled carbon nanotubes co-exposure with cadmium on zebrafish cell line: Metal uptake and accumulation, oxidative stress, genotoxicity and cell cycle. Ecotoxicology and Environmental Safety. 202, 110892 (2020).
- Dognani, G., et al. Nanofibrous membranes for low-concentration Cr VI adsorption: kinetic, thermodynamic and the influence on ZFL cells viability. Materials Research. , 24 (2021).
- ZEM2S (ATCC®CRL-2147™). American Type Culture Collection Available from: https://www.atcc.org/products/crl-2147 (2023)
- Chen, Y., et al. Acute toxicity of the cationic surfactant C12-benzalkonium in different bioassays: how test design affects bioavailability and effect concentrations. Environmental Toxicology and Chemistry. 33 (3), 606-615 (2014).
- Pomponio, G., et al. In vitro kinetics of amiodarone and its major metabolite in two human liver cell models after acute and repeated treatments. Toxicology In Vitro. 30, 36-51 (2015).
- Mori, M., Wakabayashi, M. Cytotoxicity evaluation of chemicals using cultured fish cells. Water Science and Technology. 42 (7-8), 277-282 (2000).
- Caminada, D., Escher, C., Fent, K. Cytotoxicity of pharmaceuticals found in aquatic systems: comparison of PLHC-1 and RTG-2 fish cell lines. Aquatic Toxicology. 79 (2), 114-123 (2006).
- Giltrap, M., et al. In vitro screening of organotin compounds and sediment extracts for cytotoxicity to fish cells. Environmental Toxicology and Chemistry. 30 (1), 154-161 (2011).
- Hollert, H., Duerr, M., Erdinger, L., Braunbeck, T. Cytotoxicity of settling particulate matter and sediments of the Neckar River (Germany) during a winter flood. Environmental Toxicology and Chemistry. 19 (3), 528-534 (2000).
- Pannetier, P., et al. Toxicity assessment of pollutants sorbed on environmental sample microplastics collected on beaches: Part I-adverse effects on fish cell line. Environmental Pollution. 248, 1088-1097 (2019).
- Ternjej, I., Srček, V. G., Mihaljević, Z., Kopjar, N. Cytotoxic and genotoxic effects of water and sediment samples from gypsum mining area in channel catfish ovary (CCO) cells. Ecotoxicology and Environmental Safety. 98, 119-127 (2013).
- Hamid, R., Rotshteyn, Y., Rabadi, L., Parikh, R., Bullock, P. Comparison of alamar blue and MTT assays for high throughput screening. Toxicology In Vitro. 18 (5), 703-710 (2004).
- Vistica, D. T., et al. Tetrazolium-based assays for cellular viability: a critical examination of selected parameters affecting formazan production. Cancer Research. 51 (10), 2515-2520 (1991).
- Knauer, K., Lampert, C., Gonzalez-Valero, J. Comparison of in vitro and in vivo acute fish toxicity in relation to toxicant mode of action. Chemosphere. 68 (8), 1435-1441 (2007).
- Stadnicka-Michalak, J., Tanneberger, K., Schirmer, K., Ashauer, R. Measured and modeled toxicokinetics in cultured fish cells and application to in vitro-in vivo toxicity extrapolation. PLoS One. 9 (3), 92303 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved