Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Zytotoxizitäts-Assays mit Zebrafisch-Zelllinien
In diesem Artikel
Zusammenfassung
Dieses Protokoll enthält häufig verwendete Zytotoxizitätstests (Alamar Blue [AB], CFDA-AM-, Neutral Red- und MTT-Assays), die für die Bewertung der Zytotoxizität in Zebrafischembryo- (ZEM2S) und Leberzelllinien (ZFL) in 96-Well-Platten geeignet sind.
Zusammenfassung
Fischzelllinien werden zunehmend in Ökotoxizitätsstudien verwendet, und Zytotoxizitätstests wurden als Methoden zur Vorhersage der akuten Toxizität von Fischen vorgeschlagen. Daher enthält dieses Protokoll Zytotoxizitätsassays, die modifiziert wurden, um die Zelllebensfähigkeit in Zebrafisch- (Danio rerio), Embryo- (ZEM2S) und Leber- (ZFL) Zelllinien in 96-Well-Platten zu bewerten. Die bewerteten Endpunkte der Zytotoxizität sind die mitochondriale Integrität (Alamar Blue [AB]- und MTT-Assays), die Membranintegrität über die Esteraseaktivität (CFDA-AM-Assay) und die lysosomale Membranintegrität (Neutral Red [NR]-Assay). Nach der Exposition der Testsubstanzen in einer 96-Well-Platte werden die Zytotoxizitätstests durchgeführt; Hier werden AB und CFDA-AM gleichzeitig durchgeführt, gefolgt von NR auf derselben Platte, während der MTT-Assay auf einer separaten Platte durchgeführt wird. Die Messwerte für diese Assays werden durch Fluoreszenz für AB und CFDA-AM und Absorption für MTT und NR ermittelt. Die mit diesen Fischzelllinien durchgeführten Zytotoxizitätstests können verwendet werden, um die akute Toxizität chemischer Substanzen an Fischen zu untersuchen.
Einleitung
Chemische Stoffe müssen auf ihre Sicherheit für die menschliche Gesundheit und die Umwelt geprüft werden. Molekulare und zelluläre Biomarker werden zunehmend in Sicherheitsbewertungen zur Vorhersage von Auswirkungen auf lebende Organismen durch Regulierungsbehörden und/oder Gesetzgebungen (z. B. REACH, OECD, US-EPA)1,2 berücksichtigt, da sie dem unerwünschten In-vivo-Ergebnis (z. B. endokrine Störung, immunologische Reaktion, akute Toxizität, Phototoxizität) vorausgehen können3,4,5,6,7 . In diesem Zusammenhang wurde die Zytotoxizität als Maß für die Vorhersage der akuten Toxizität von Fischen herangezogen 5,8; Es kann jedoch viele andere Anwendungen in Ökotoxizitätsstudien haben, wie z. B. die Definition subzytotoxischer Konzentrationen chemischer Substanzen, um ihre unterschiedlichsten Auswirkungen auf Fische zu untersuchen (z. B. endokrine Disruptoren).
In Zellkultursystemen (In-vitro-Systemen ) kann die Zytotoxizität chemischer Substanzen durch Methoden bestimmt werden, die sich in der Art der Endpunkte unterscheiden. Zum Beispiel kann eine Zytotoxizitätsmethode auf einem Endpunkt basieren, der sich auf die spezifische Morphologie bezieht, die während des Zelltodprozesses beobachtet wird, während eine andere die Zytotoxizität durch Messung des Zelltods, der Lebensfähigkeit und Funktionalität, der Morphologie, des Energiestoffwechsels sowie der Zellanhaftung und -proliferation bestimmen kann. Chemische Substanzen können die Zelllebensfähigkeit durch verschiedene Mechanismen beeinflussen, daher ist eine Bewertung der Zytotoxizität erforderlich, die verschiedene Endpunkte der Zelllebensfähigkeit abdeckt, um chemische Wirkungen vorherzusagen9.
MTT und Alamar Blue (AB) sind Assays, die die Auswirkungen auf die Zelllebensfähigkeit auf der Grundlage der Zellstoffwechselaktivität bestimmen. Der MTT-Assay bewertet die Aktivität des mitochondrialen Enzyms Succinat-Dehydrogenase10. Die Reduktion von gelblichem 3-[4,5-Dimethylthiazol-2yl]-2,5-diphenyltetrazoliumbromid (MTT) zu Formazanblau tritt nur in lebensfähigen Zellen auf, und seine optische Dichte ist direkt proportional zur Anzahl lebensfähiger Zellen10. Der AB-Assay ist ein empfindlicher Oxidations-Reduktions-Indikator, der durch mitochondriale Enzyme vermittelt wird, die fluoreszieren und ihre Farbe ändern, wenn Resazurin von lebenden Zellen zu Resorufin reduziertwird 11; aber auch zytosolische und mikrosomale Enzyme tragen zur Reduktion von AB und MTT12 bei. Diese Enzyme können mehrere Reduktasen umfassen, wie z. B. Alkohol- und Aldehydoxidoreduktasen, NAD(P)H: Chinonoxidoreduktase, Flavinreduktase, NADH-Dehydrogenase und Cytochrome11.
Der Neutral Red (NR)-Assay ist ein Zellviabilitätstest, der auf dem Einbau dieses Farbstoffs in die Lysosomen lebensfähiger Zellenbasiert 13. Die Aufnahme von NR hängt von der Fähigkeit der Zellen ab, pH-Gradienten aufrechtzuerhalten. Der Protonengradient innerhalb der Lysosomen hält einen niedrigeren pH-Wert als das Zytoplasma aufrecht. Bei normalem physiologischen pH-Wert weist der NR eine Nettoladung von ungefähr Null auf, wodurch er die Zellmembranen durchdringen kann. Somit wird der Farbstoff geladen und bleibt in den Lysosomen zurück. Folglich ist die Anzahl der lebensfähigen Zellen14 umso größer, je größer die Menge an zurückgehaltenem NR ist. Chemische Substanzen, die die Zelloberfläche oder die lysosomalen Membranen schädigen, beeinträchtigen die Aufnahme dieses Farbstoffs.
Der CFDA-AM-Assay ist ein fluorometrischer Zellviabilitätstest, der auf der Retention von 5-Carboxyfluorescein-Diacetat-Acetoxymethylester (CFDA-AM)15 basiert. 5-CFDA-AM, ein Esterasesubstrat, wird in Carboxyfluorescein umgewandelt, eine fluoreszierende Substanz, die polar und durch Membranen lebender Zellen nicht durchlässig ist15; Somit wird es in der Innenseite einer intakten Zellmembran zurückgehalten, was auf lebensfähige Zellen hinweist.
Kürzlich wurden drei Zytotoxizitätstests (CFDA-AM-, NR- und AB-Assays) in einer validierten ISO-Richtlinie (International Organization for Standardization) (ISO 21115:2019)16 und einer OECD-Testmethode (OECD TG 249) kombiniert, um die akute Toxizität von Fischen unter Verwendung der RTgill-W1-Zelllinie (permanente Zelllinie aus der Kieme der Regenbogenforelle [Oncorhynchus mykiss]) in 24-Well-Plattenzu bewerten 17 . Obwohl es eine bestehende zellbasierte Methode zur Vorhersage der akuten Toxizität von Fischen gibt, wurden Anstrengungen unternommen, um ähnliche Methoden mit anderen Fischarten zu entwickeln und den Durchsatz der Methode zu erhöhen. Einige Beispiele umfassen die Entwicklung von ZFL-Zelllinien, die mit Reportergenen für spezifische Toxizitätswege18,19 transfiziert wurden, Phototoxizitätstests in der RTgill-W1-Zelllinie 20 und die Verwendung von ZFL- und ZF4-Zelllinien (Zebrafisch-Fibroblasten, die aus 1 Tag alten Embryonen gewonnen wurden) zur Bewertung der Toxizität durch mehrere Zytotoxizitätstests21.
Danio rerio (Zebrafisch) ist eine der wichtigsten Fischarten, die in aquatischen Toxizitätsstudien verwendet werden. Daher können zellbasierte Methoden mit Zebrafisch-Zelllinien für die Toxizitätsprüfung von Fischen äußerst nützlich sein. Die ZFL-Zelllinie ist eine zebrafischepitheliale Hepatozytenzelllinie, die die Hauptmerkmale von Leberparenchymzellen aufweist und Xenobiotika 7,22,23,24,25 metabolisieren kann. Inzwischen ist die ZEM2S-Zelllinie eine embryonale Zebrafisch-Fibroblasten-Zelllinie, die aus dem Blastula-Stadium stammt und zur Untersuchung von Entwicklungseffekten auf Fische verwendet werden kann26,27. Daher beschreibt dieses Protokoll vier Zytotoxizitäts-Assays (MTT-, AB-, NR- und CFDA-AM-Assays), deren Modifikationen mit ZFL- und ZEM2S-Zelllinien in 96-Well-Platten durchgeführt werden müssen.
Protokoll
ANMERKUNG: In der Materialtabelle finden Sie die Liste der in diesem Protokoll verwendeten Materialien und in Tabelle 1 die Zusammensetzung der in diesem Protokoll verwendeten Lösungen und Medien.
1. Vorbereitung von ZFL- und ZEM2S-Zellen
- Beginnen Sie mit einem T75-Kolben aus ZFL- oder ZEM2S-Zellen mit 80% Konfluenz, kultiviert im jeweiligen vollständigen Medium bei 28 °C ohne CO2.
- Nehmen Sie das Nährmedium aus dem Kolben und waschen Sie die Zellen unter Zugabe von 10 ml 1x phosphatgepufferter Kochsalzlösung (PBS) (0,01 M). 3 ml 1x Trypsin (0,05% v/v; 0,5 mM Trypsin-EDTA) in die Kulturkolben geben. Bei 28 °C 3 min inkubieren.
- Klopfen Sie vorsichtig auf den Kolben, um die Zellen freizusetzen, und stoppen Sie dann die Trypsinverdauung, indem Sie 3 ml vollständiges Nährmedium in den Kolben geben.
- Die Zellsuspension wird in ein konisches 15-ml-Zentrifugenröhrchen überführt und 5 Minuten lang bei 100 × g zentrifugiert.
- Entfernen Sie nach der Zentrifugation vorsichtig den Überstand, fügen Sie 1 ml vollständiges Medium für ZFL- oder ZEM2S-Zellen hinzu und resuspendieren Sie das Pellet mit einer Mikropipette.
2. Zellzählung durch Ausschluss von Trypanblau
- Geben Sie 10 μl der Zellsuspension und 10 μl Trypanblau-Farbstoff in ein Mikroröhrchen, um die Zellen zu zählen und ihre Lebensfähigkeit zu bewerten. Mischen Sie die Zellsuspension und färben Sie sie mit einer Pipette.
- Übertragen Sie dann 10 μl dieser Mischung (Zellsuspension + Trypanblau) in eine Neubauer-Kammer und zählen Sie die Zellen in den vier großen Quadraten (Quadranten Q), die an den Ecken der Kammer platziert sind, wobei lebensfähige Zellen als solche betrachtet werden, die kein Trypanblau aufnehmen. Bestimmen Sie die Anzahl der lebensfähigen Zellen mit Gleichung (1):
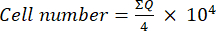 Bewertungen (1)
Bewertungen (1) - Berechnen Sie die endgültige Zellzahl in der Zellsuspension, indem Sie die mit Gleichung (1) ermittelte Zellzahl mit zwei multiplizieren (der Verdünnungsfaktor aufgrund der Verwendung von Trypanblau).
HINWEIS: Alternativ kann ein automatisiertes Zellzählsystem (z. B. ein Zytomer mit Zellzähl- und Viabilitätsfunktion) verwendet werden.
3. Zellplattierung in 96-Well-Platten
- Berechnen Sie das Zellsuspensionsvolumen, das benötigt wird, um die Anzahl der Zellen zu erhalten, die zur Durchführung der Zytotoxizitätstests erforderlich sind. Die Anzahl der lebensfähigen Zellen für jede Zelllinie ist unten angegeben:
- Platte 60.000 lebensfähige ZEM2S-Zellen pro Well; Verwenden Sie daher für die gesamte Platte sechs Millionen Zellen in 20 ml vollständigem Medium (200 μl/Well, 96-Well-Platte).
- Platte 40.000 lebensfähige ZFL-Zellen pro Well; Verwenden Sie daher für die gesamte Platte vier Millionen Zellen in 20 ml vollständigem Medium (200 μl/Well, 96-Well-Platte).
- Danach wird das jeweilige Volumen der Zellsuspension in ein Reagenzreservoir (steril) überführt und mit dem kompletten Nährmedium für ZFL oder ZEM2S auf 20 ml aufgefüllt. Mischen Sie die Lösung mit einer Mehrkanalpipette vorsichtig auf und ab.
HINWEIS: Achten Sie darauf, keinen Schaum oder Blasen zu bilden. - Geben Sie 200 μl der Zellsuspension mit der Mehrkanal-Mikropipette in jede Vertiefung einer transparenten Polystyrol-96-Well-Platte. Die Platten werden 24 h lang bei 28 °C inkubiert.
HINWEIS: Die Platte muss mindestens drei Vertiefungen ohne Zellen für die Blindkontrolle aufweisen, und diesen Vertiefungen sollten nur vollständige Medien zugesetzt werden. Der Randeffekt (verursacht durch eine höhere Verdunstung in den Randvertiefungen) tritt häufig bei 96-Well-Plattenassays auf und kann die Lebensfähigkeit der Zellen in den Randvertiefungen der Platte28 beeinträchtigen. Dieser Effekt kann je nach Marke und Design der 96-Well-Platte höher oder niedriger sein28. Obwohl wir in den Randvertiefungen keine Störung des Zellwachstums/der Lebensfähigkeit von ZFL und ZEM2S festgestellt haben, empfehlen wir, die Platte mit Parafilm oder Klebesiegelfolie zu versiegeln, um diesen Effekt zu verhindern, oder die Zellen nur in den 60 Innenvertiefungen zu kultivieren und die Randvertiefungen mit PBS zu füllen.
4. Exposition von Zellen gegenüber Prüfchemikalien
- Entsorgen Sie das verbrauchte Medium vorsichtig mit einer Mehrkanal-Mikropipette aus den Vertiefungen.
- Setzen Sie die Zellen Testchemikalien in unterschiedlichen Konzentrationen aus. Bereiten Sie die Lösungen der Prüfchemikalienkonzentrationen in den Nährmedien für ZFL oder ZEM2S ohne fötales Rinderserum (FBS) (Expositionsmedien) vor. Fügen Sie dann 100 μl dieser Lösungen pro Vertiefung in technischer Verdreifachung hinzu (d. h. drei Vertiefungen/Testchemikalienkonzentration).
- Für Kontrollen werden die Kontrollgruppen in technischen Dreifachteilen (drei Vertiefungen/Kontrollgruppe) auf die gleiche Platte wie die Prüfchemikalie gelegt. So werden für die Blindkontrolle (B) 100 μl des Belichtungsmediums in die zellfreien Vertiefungen gegeben, für die Negativkontrolle (NC) 100 μl des Belichtungsmediums in Vertiefungen mit Zellen gegeben und für die Positivkontrolle (PC) die Zellen einer Lösung von 1% Triton X-100 ausgesetzt, die in den Belichtungsmedien hergestellt wurde. In einigen Fällen sollte eine Lösungsmittelkontrolle (SC) in die Platte aufgenommen werden, wobei eine eindeutig nicht-zytotoxische Konzentration als endgültige Lösungsmittelkonzentration berücksichtigt wird.
HINWEIS: Es wird empfohlen, 0,5% DMSO als Lösungsmittel zu verwenden; DMSO kann in diesen Zelllinien bis zu 1% als Lösungsmittel verwendet werden, ohne die Zytotoxizitätsschwelle von 10% in Bezug auf die Negativkontrolle zu überschreiten. - Die Platten werden 24 h lang bei 28 °C inkubiert. Versiegeln Sie die Platten mit Parafilm oder selbstklebender Siegelfolie, um die Verdunstung des Nährmediums zu verhindern.
ANMERKUNG: Bestimmte Chemikalien können eine intrinsische Hintergrundabsorption oder Fluoreszenz aufweisen, die die Absorption oder Fluoreszenz des/der Indikatorfarbstoff(e) beeinträchtigen kann (z. B. können Verbindungen mit Farbe die Absorption, das Serumalbumin29 und Verbindungen, die die Reduktionsenzymestören 30,31). In diesem Fall muss die Platte eine zusätzliche Kontrolle enthalten, indem Testchemikalienlösungen in die Vertiefungen ohne Zellen gegeben werden. Damit soll die mögliche Interferenz der chemischen Autoabsorption/Autofluoreszenz mit den Farbstoffen überprüft werden. Wenn eine Interferenz festgestellt wird, sollte bewertet werden, ob sie ausgeschlossen werden kann, um eine korrekte Vorhersage der Zytotoxizität zu erhalten.
5. Zytotoxizitäts-Assays
HINWEIS: Bereiten Sie alle Lösungen gemäß Tabelle 1 vor. Alle unten beschriebenen Schritte (Abbildung 1) werden unter sterilen Bedingungen durchgeführt. Die Verwendung einer Pipette zum Verwerfen des Expositionsmediums wird nicht empfohlen, da sich die Zellen nach einer chemischen Behandlung leicht von den Vertiefungen lösen können.
- AB- und CFDA-AM-Assays
- Entsorgen Sie das Expositionsmedium nach 24 Stunden Exposition gegenüber der Prüfchemikalie vorsichtig, indem Sie den Inhalt in eine Auffangschale gießen.
- Waschen Sie den Teller mit 200 μl PBS. Entfernen Sie das PBS vorsichtig, indem Sie es in eine Auffangschale gießen, um den Verlust von Zellen zu vermeiden.
- Fügen Sie 100 μl AB/CFDA-AM-Lösung pro Vertiefung hinzu. Inkubieren Sie die Platte 30 Minuten lang im Dunkeln bei 28 °C.
- Messen Sie die Fluoreszenz in einem Fluoreszenzplatten-Reader bei 530 nm (Anregung) und 595 nm (Emission) für AB und bei 493 nm (Anregung) und 541 nm (Emission) für CFDA-AM.
- NR-Assay
ANMERKUNG: Die Schritte für den NR-Assay werden unmittelbar nach den AB- und CFDA-AM-Assays durchgeführt (Abbildung 1).- Zentrifugieren Sie die NR-Arbeitslösung (40 μg/ml) bei 600 × g für 10 min.
HINWEIS: Die Ausfällung von NR im Röhrchen darf nicht auf die Platten übertragen werden. Sammeln Sie daher nach dem Zentrifugieren der NR-Arbeitslösung den Überstand mit einer Pipette, ohne die NR-Ausfällungen abzusaugen. Übertragen Sie den Überstand in ein Reagenzreservoir. - Entfernen Sie die AB/CFDA-AM-Lösung vorsichtig, indem Sie den Inhalt in eine Auffangschale gießen.
- 100 μl der NR-Arbeitslösung pro Well mit einer Mehrkanal-Mikropipette zugeben. Die Platte wird 3 h bei 28 °C inkubiert.
HINWEIS: Beobachten Sie nach der 3-stündigen Inkubation mit einem Mikroskop, ob in den Platten NR-Niederschlag aufgetreten ist. NR-Ausfällungen können die Quantifizierung der Zelllebensfähigkeit beeinträchtigen und sollten daher nicht vorhanden sein. - Entfernen Sie die NR-Lösung vorsichtig, indem Sie den Inhalt in eine Auffangschale gießen. Waschen Sie die Vertiefungen, indem Sie 150 μl PBS pro Vertiefung hinzufügen.
- Fügen Sie 150 μl der NR-Extraktionslösung pro Vertiefung hinzu und inkubieren Sie die Platte 10 Minuten lang auf einem Tellerschüttler zum sanften Schütteln. Messen Sie die Absorption bei 540 nm in einem Plattenleser.
HINWEIS: Eine zweite Anzeige bei 690 nm sollte durchgeführt werden, um eine Absorption von Fingerabdrücken im Hintergrund in der Platte auszuschließen.
- Zentrifugieren Sie die NR-Arbeitslösung (40 μg/ml) bei 600 × g für 10 min.
- MTT-Assay
ANMERKUNG: Der MTT-Test muss getrennt von den oben beschriebenen Assays (in einer neuen Platte) durchgeführt werden (Abbildung 2).- Entfernen Sie das Belichtungsmedium vorsichtig, indem Sie den Inhalt in ein Auffangfach gießen.
- 100 μl MTT-Arbeitslösung pro Well mit einer Mehrkanal-Mikropipette zugeben. Inkubieren Sie die Platte bei 28 °C für 4 h.
- Entsorgen Sie die MTT-Lösung, indem Sie den Inhalt in eine Auffangschale gießen.
- Fügen Sie 100 μl DMSO pro Vertiefung hinzu, um die Formazankristalle zu extrahieren, und inkubieren Sie die Platte 10 Minuten lang auf einem Tellerschüttler. Messen Sie die Absorption bei 570 nm mit einem Plattenleser.
HINWEIS: Eine zweite Anzeige bei 690 nm sollte durchgeführt werden, um eine Absorption von Fingerabdrücken im Hintergrund in der Platte auszuschließen. Es ist wichtig zu beachten, dass Prüfchemikalien die MTT stören können, die bewertet werden muss, um die Qualität der erzeugten Datenzu gewährleisten 32. Dazu sollten zellfreie Vertiefungen, die die Testkonzentrationen und MTT (0,5 mg/ml) enthalten, exponiert werden, gefolgt von einer Inkubation, um jede Farbveränderung in den Vertiefungen zu beobachten, die die Absorption erhöhen und zu falschen Viabilitätsergebnissen führen kann. Chemikalien, die mit MTT interagieren, müssen bei diesem Test vermieden werden.
6. Berechnung der Zelllebensfähigkeit/Zytotoxizität
ANMERKUNG: Die erfasste Rohabsorption oder -fluoreszenz wird verwendet, um die Zellviabilität als Prozentsatz in Bezug auf die Negativkontrolle (für Prüfchemikalien, die direkt in Expositionsmedien hergestellt werden) oder die Lösungsmittelkontrolle (für Prüfchemikalien, die mit Lösungsmitteln hergestellt werden, wie z. B. DMSO) zu berechnen. Vor dem Bestimmen des Prozentsatzes der Zellviabilität müssen die Rohdaten durch das leere Steuerelement normalisiert werden.
- Berechnen Sie die durchschnittliche Absorption oder Fluoreszenz für jede Prüfchemikalienkonzentration und Kontrollgruppe (drei Vertiefungen/Behandlung).
- Um den Prozentsatz der Zellviabilität relativ zur Kontrolle (negativ oder Lösungsmittel) zu bestimmen, verwenden Sie Gleichung (2):
 Bewertungen (2)
Bewertungen (2)
ANMERKUNG: Die Einheiten Absorption (abs) oder Fluoreszenz (Fluo) stellen den Mittelwert der Absorption oder Fluoreszenz dar, der in den drei Vertiefungen pro Konzentration gemessen wird. blank steht für Vertiefungen ohne Zellen.
Ergebnisse
Abbildung 3 zeigt die Platten der AB-, CFDA-AM-, NR- und MTT-Assays. Für den AB-Assay (Abbildung 3A) zeigen die Blindvertiefungen und Vertiefungen ohne oder mit einer reduzierten Anzahl lebensfähiger Zellen eine blaue Farbe und eine geringe Fluoreszenz, während die Vertiefungen mit einer hohen Anzahl lebensfähiger Zellen rosa sind und aufgrund der Umwandlung von Resazurin (AB) in Resorufin (rosafarbene Substanz) durch die lebensfähigen Zellen hohe Fluoresze...
Diskussion
Zytotoxizitätstests werden häufig für die In-vitro-Toxizitätsbewertung verwendet, und in diesem Protokollartikel werden vier häufig verwendete Zytotoxizitätstests vorgestellt, die für die Durchführung in Zebrafischzelllinien modifiziert wurden (d. h. Zelldichte für 96-Well-Platten, Inkubationszeit im MTT-Assay, FBS-Erschöpfung während der chemischen Expositionsbedingungen und maximal akzeptable Konzentration für die SC). Da diese Assays die Zytotoxizität anhand verschiedener Endpunkte der Zellleben...
Offenlegungen
Die Autoren erklären, dass kein Interessenkonflikt besteht.
Danksagungen
In Erinnerung an Dr. Márcio Lorencini, einen Mitautor dieser Arbeit, einen exzellenten Forscher auf dem Gebiet der Kosmetik, der sich der Förderung der kosmetischen Forschung in Brasilien verschrieben hat. Die Autoren danken dem Multi-User-Labor in der Abteilung für Physiologie (UFPR) für die Verfügbarkeit von Geräten und für die finanzielle Unterstützung der Koordination zur Verbesserung des Hochschulpersonals (CAPES, Brasilien) (Finanzcode 001) und der Grupo Boticario.
Materialien
| Name | Company | Catalog Number | Comments |
| 5-CFDA, AM (5-Carboxyfluorescein Diacetate, Acetoxymethyl Ester) | Invitrogen | C1345 | |
| Cell culture plate, 96 well plate | Sarstedt | 83.3924 | Surface: Standard, flat base |
| DMEM | Gibco | 12800-017 | Powder, high glucose, pyruvate |
| Ham's F-12 Nutrient Mix, powder | Gibco | 21700026 | Powder |
| HEPES (1 M) | Gibco | 15630080 | |
| Leibovitz's L-15 Medium | Gibco | 41300021 | Powder |
| Neutral red | Sigma-Aldrich | N4638 | Powder, BioReagent, suitable for cell culture |
| Orbital shaker | Warmnest | KLD-350-BI | 22 mm rotation diameter |
| Dulbeccos PBS (10X) with calcium and magnesium | Invitrogen | 14080055 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| Resazurin sodium salt | Sigma-Aldrich | R7017 | Powder, BioReagent, suitable for cell culture |
| RPMI 1640 Medium | Gibco | 31800-014 | Powder |
| SFB - Fetal Bovine Serum, qualified, USDA-approved regions | Gibco | 12657-029 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | Powder, bioreagent for molecular biology |
| Thiazolyl Blue Tetrazolium Bromide 98% | Sigma-Aldrich | M2128 | |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Trypsin-EDTA (0.5%), no phenol red | Gibco | 15400054 | |
| ZEM2S cell line | ATCC | CRL-2147 | This cell line was kindly donated by Professor Dr. Michael J. Carvan (University of Wisconsin, Milwaukee, USA) |
| ZFL cell line | BCRJ | 256 |
Referenzen
- ECHA. Non-Animal Approaches-Current Status of Regulatory Applicability Under the REACH, CLP and Biocidal Products Regulations. ECHA. , (2017).
- Alternative Methods Accepted by US Agencies. National Toxicology Program, and US Department of Health and Human Services Available from: https://ntp.niehs.nih.gov/whatwestudy/niceatm/accept-methods/index.html (2022)
- Schirmer, K. Proposal to improve vertebrate cell cultures to establish them as substitutes for the regulatory testing of chemicals and effluents using fish. Toxicology. 224 (3), 163-183 (2006).
- Scholz, S., et al. Alternatives to in vivo tests to detect endocrine disrupting chemicals (EDCs) in fish and amphibians-screening for estrogen, androgen and thyroid hormone disruption. Critical Reviews in Toxicology. 43 (1), 45-72 (2013).
- Tanneberger, K., et al. Predicting fish acute toxicity using a fish gill cell line-based toxicity assay. Environmental Science & Technology. 47 (2), 1110-1119 (2013).
- Roesler, R., Lorencini, M., Pastore, G. Brazilian cerrado antioxidant sources: cytotoxicity and phototoxicity in vitro. Food Science and Technology. 30, 814-821 (2010).
- Ruyra, A., et al. Zebrafish liver (ZFL) cells are able to mount an anti-viral response after stimulation with Poly (I:C). Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology. 182, 55-63 (2015).
- Natsch, A., Laue, H., Haupt, T., von Niederhäusen, V., Sanders, G. Accurate prediction of acute fish toxicity of fragrance chemicals with the RTgill-W1 cell assay. Environmental Toxicology and Chemistry. 37 (3), 931-941 (2018).
- Freshney, R. I. Cytotoxicity. Culture of Animal Cells: A Manual of Basic Technique. , (2005).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- O'Brien, J., Wilson, I., Orton, T., Pognan, F. Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity. European Journal of Biochemistry. 267 (17), 5421-5426 (2000).
- Gonzalez, R. J., Tarloff, J. B. Evaluation of hepatic subcellular fractions for Alamar blue and MTT reductase activity. Toxicology In Vitro. 15 (3), 257-259 (2001).
- Borenfreund, E., Puerner, J. A. Toxicity determined in vitro by morphological alterations and neutral red absorption. Toxicology Letters. 24 (2-3), 119-124 (1985).
- Repetto, G., del Peso, A., Zurita, J. L. Neutral red uptake assay for the estimation of cell viability/cytotoxicity. Nature Protocols. 3 (7), 1125-1131 (2008).
- Kamiloglu, S., Sari, G., Ozdal, T., Capanoglue, E. Guidelines for cell viability assays. Food Frontiers. 1 (3), 332-349 (2020).
- Water Quality-Determination of Acute Toxicity of Water Samples and Chemicals to a Fish Gill Cell Line (RTgill-W1) (ISO 21115:2019). International Organization for Standardization Available from: https://www.iso.org/standar/69933.html (2019)
- Organisation for Economic Co-operation and Development. . Test Guideline No. 249: Fish Cell Line Acute Toxicity-The RTgill-W1 Cell Line Assay. OECD Guidelines for the Testing of Chemicals, Section 2. Effects on Biotic Systems. , (2021).
- Lungu-Mitea, S., Lundqvist, J. Potentials and pitfalls of transient in vitro reporter bioassays: interference by vector geometry and cytotoxicity in recombinant zebrafish cell lines. Archives of Toxicology. 94 (8), 2769-2784 (2020).
- Lungu-Mitea, S., Han, Y., Lundqvist, J. Development, scrutiny, and modulation of transient reporter gene assays of the xenobiotic metabolism pathway in zebrafish hepatocytes. Cell Biology and Toxicology. , 1-23 (2021).
- Schirmer, K., Chan, A. G., Greenberg, B. M., Dixon, D. G., Bols, N. C. Methodology for demonstrating and measuring the photocytotoxicity of fluoranthene to fish cells in culture. Toxicology In Vitro. 11 (1-2), 107-119 (1997).
- Lungu-Mitea, S., et al. Modeling bioavailable concentrations in zebrafish cell lines and embryos increases the correlation of toxicity potencies across test systems. Environmental Science & Technology. 55 (1), 447-457 (2021).
- Cavalcante, D. G. S. M., et al. Cytotoxic, biochemical and genotoxic effects of biodiesel produced by different routes on ZFL cell line. Toxicology In Vitro. 28 (6), 1117-1125 (2014).
- Meng, Q., Yeung, K., Chan, K. M. Toxic effects of octocrylene on zebrafish larvae and liver cell line (ZFL). Aquatic Toxicology. 236, 105843 (2021).
- Kwok, M. L., Chan, K. M. Oxidative stress and apoptotic effects of copper and cadmium in the zebrafish liver cell line ZFL. Toxicology Reports. 7, 822-835 (2020).
- Yang, J., Chan, K. M. Evaluation of the toxic effects of brominated compounds (BDE-47, 99, 209, TBBPA) and bisphenol A (BPA) using a zebrafish liver cell line, ZFL. Aquatic Toxicology. 159, 138-147 (2015).
- Bradford, C. S., Sun, L., Collodi, P., Barnes, D. W. Cell cultures from zebrafish embryos and adult tissues. Journal of Tissue Culture Methods. 16 (2), 99-107 (1994).
- He, S., et al. Genetic and transcriptome characterization of model zebrafish cell lines. Zebrafish. 3 (4), 441-453 (2006).
- Mansoury, M., Hamed, M., Karmustaji, R., Al Hannan, F., Safrany, S. T. The edge effect: A global problem. The trouble with culturing cells in 96-well plates. Biochemistry and Biophysics Reports. 26, 100987 (2021).
- Funk, D., Schrenk, H. -. H., Frei, E. Serum albumin leads to false-positive results in the XTT and the MTT assay. BioTechniques. 43 (2), 178 (2007).
- Dayeh, V. R., Bols, N. C., Tanneberger, K., Schirmer, K., Lee, L. E. J. The use of fish-derived cell lines for investigation of environmental contaminants: An update following OECD's fish toxicity testing framework no. 171. Current Protocols in Toxicology. 1, (2013).
- Stepanenko, A. A., Dmitrenko, V. V. Pitfalls of the MTT assay: Direct and off-target effects of inhibitors can result in over/underestimation of cell viability. Gene. 574 (2), 193-203 (2015).
- Ulukaya, E., Colakogullari, M., Wood, E. J. Interference by anti-cancer chemotherapeutic agents in the MTT-tumor chemosensitivity assay. Chemotherapy. 50 (1), 43-50 (2004).
- Sebaugh, J. L. Guidelines for accurate EC50/IC50 estimation. Pharmaceutical Statistics. 10 (2), 128-134 (2011).
- Weimer, M., et al. The impact of data transformations on concentration-response modeling. Toxicology Letters. 213 (2), 292-298 (2012).
- Green, J. W., Holbech, T. A., Henrik, Chapter 4: Analysis of Continuous Data (Regression). Statistical Analysis of Ecotoxicity Studies. , (2018).
- Proença, S., et al. Effective exposure of chemicals in in vitro cell systems: A review of chemical distribution models. Toxicology In Vitro. 73, 105133 (2021).
- Guidony, N. S., et al. ABC proteins activity and cytotoxicity in zebrafish hepatocytes exposed to triclosan. Environmental Pollution. 271, 116368 (2021).
- da Silva, N. D. G., et al. Interference of goethite in the effects of glyphosate and Roundup® on ZFL cell line. Toxicology In Vitro. 65, 104755 (2020).
- Yang, Y., et al. Temperature is a key factor influencing the invasion and proliferation of Toxoplasma gondii in fish cells. Experimental Parasitology. 217, 107966 (2020).
- Lopes, F. M., Sandrini, J. Z., Souza, M. M. Toxicity induced by glyphosate and glyphosate-based herbicides in the zebrafish hepatocyte cell line (ZF-L). Ecotoxicology and Environmental Safety. 162, 201-207 (2018).
- Lachner, D., Oliveira, L. F., Martinez, C. B. R. Effects of the water soluble fraction of gasoline on ZFL cell line: Cytotoxicity, genotoxicity and oxidative stress. Toxicology In Vitro. 30, 225-230 (2015).
- Morozesk, M., et al. Effects of multiwalled carbon nanotubes co-exposure with cadmium on zebrafish cell line: Metal uptake and accumulation, oxidative stress, genotoxicity and cell cycle. Ecotoxicology and Environmental Safety. 202, 110892 (2020).
- Dognani, G., et al. Nanofibrous membranes for low-concentration Cr VI adsorption: kinetic, thermodynamic and the influence on ZFL cells viability. Materials Research. , 24 (2021).
- ZEM2S (ATCC®CRL-2147™). American Type Culture Collection Available from: https://www.atcc.org/products/crl-2147 (2023)
- Chen, Y., et al. Acute toxicity of the cationic surfactant C12-benzalkonium in different bioassays: how test design affects bioavailability and effect concentrations. Environmental Toxicology and Chemistry. 33 (3), 606-615 (2014).
- Pomponio, G., et al. In vitro kinetics of amiodarone and its major metabolite in two human liver cell models after acute and repeated treatments. Toxicology In Vitro. 30, 36-51 (2015).
- Mori, M., Wakabayashi, M. Cytotoxicity evaluation of chemicals using cultured fish cells. Water Science and Technology. 42 (7-8), 277-282 (2000).
- Caminada, D., Escher, C., Fent, K. Cytotoxicity of pharmaceuticals found in aquatic systems: comparison of PLHC-1 and RTG-2 fish cell lines. Aquatic Toxicology. 79 (2), 114-123 (2006).
- Giltrap, M., et al. In vitro screening of organotin compounds and sediment extracts for cytotoxicity to fish cells. Environmental Toxicology and Chemistry. 30 (1), 154-161 (2011).
- Hollert, H., Duerr, M., Erdinger, L., Braunbeck, T. Cytotoxicity of settling particulate matter and sediments of the Neckar River (Germany) during a winter flood. Environmental Toxicology and Chemistry. 19 (3), 528-534 (2000).
- Pannetier, P., et al. Toxicity assessment of pollutants sorbed on environmental sample microplastics collected on beaches: Part I-adverse effects on fish cell line. Environmental Pollution. 248, 1088-1097 (2019).
- Ternjej, I., Srček, V. G., Mihaljević, Z., Kopjar, N. Cytotoxic and genotoxic effects of water and sediment samples from gypsum mining area in channel catfish ovary (CCO) cells. Ecotoxicology and Environmental Safety. 98, 119-127 (2013).
- Hamid, R., Rotshteyn, Y., Rabadi, L., Parikh, R., Bullock, P. Comparison of alamar blue and MTT assays for high throughput screening. Toxicology In Vitro. 18 (5), 703-710 (2004).
- Vistica, D. T., et al. Tetrazolium-based assays for cellular viability: a critical examination of selected parameters affecting formazan production. Cancer Research. 51 (10), 2515-2520 (1991).
- Knauer, K., Lampert, C., Gonzalez-Valero, J. Comparison of in vitro and in vivo acute fish toxicity in relation to toxicant mode of action. Chemosphere. 68 (8), 1435-1441 (2007).
- Stadnicka-Michalak, J., Tanneberger, K., Schirmer, K., Ashauer, R. Measured and modeled toxicokinetics in cultured fish cells and application to in vitro-in vivo toxicity extrapolation. PLoS One. 9 (3), 92303 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten