É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Ensaios de citotoxicidade com linhagens celulares de peixe-zebra
Neste Artigo
Resumo
Este protocolo apresenta ensaios de citotoxicidade comumente utilizados (ensaios de Alamar Blue [AB], CFDA-AM, Neutral Red e MTT) adaptados para a avaliação da citotoxicidade em linhagens celulares de embrião de peixe-zebra (ZEM2S) e fígado (ZFL) em placas de 96 poços.
Resumo
As linhagens celulares de peixes têm se tornado cada vez mais utilizadas em estudos de ecotoxicidade, e ensaios de citotoxicidade têm sido propostos como métodos para prever a toxicidade aguda de peixes. Assim, este protocolo apresenta ensaios de citotoxicidade modificados para avaliar a viabilidade celular em linhagens celulares de peixe-zebra (Danio rerio) embrionário (ZEM2S) e fígado (ZFL) em placas de 96 poços. Os desfechos de citotoxicidade avaliados são a integridade mitocondrial (ensaios de Alamar Blue [AB] e MTT), a integridade da membrana via atividade da esterase (ensaio CFDA-AM) e a integridade da membrana lisossômica (ensaio Vermelho Neutro [NR]). Após a exposição das substâncias em estudo numa placa de 96 poços, são realizados os ensaios de citotoxicidade; aqui, AB e CFDA-AM são realizados simultaneamente, seguidos de NR na mesma placa, enquanto o ensaio MTT é realizado em uma placa separada. As leituras para esses ensaios são tomadas por fluorescência para AB e CFDA-AM, e absorbância para MTT e NR. Os ensaios de citotoxicidade realizados com estas linhagens celulares de peixes podem ser utilizados para estudar a toxicidade aguda de substâncias químicas em peixes.
Introdução
As substâncias químicas têm de ser testadas quanto à sua segurança para a saúde humana e para o ambiente. Biomarcadores moleculares e celulares têm sido cada vez mais considerados em avaliações de segurança para predizer efeitos em organismos vivos por agências reguladoras e/ou legislações (por exemplo, REACH, OCDE, EUA EPA)1,2, uma vez que podem preceder o desfecho adverso in vivo (por exemplo, desregulação endócrina, resposta imunológica, toxicidade aguda, fototoxicidade)3,4,5,6,7 . Nesse contexto, a citotoxicidade tem sido tomada como medida para predizer a toxicidade aguda dos peixes 5,8; no entanto, pode ter muitas outras aplicações em estudos de ecotoxicidade, como a definição de concentrações subcitotóxicas de substâncias químicas para estudar seu conjunto mais diversificado de efeitos em peixes (por exemplo, efeitos desreguladores endócrinos).
Em sistemas de cultura celular (sistemas in vitro ), a citotoxicidade de substâncias químicas pode ser determinada por métodos diferentes nos tipos de parâmetros. Por exemplo, um método de citotoxicidade pode ser baseado em um desfecho relacionado à morfologia específica observada durante o processo de morte celular, enquanto outro pode determinar a citotoxicidade pela medição da morte celular, viabilidade e funcionalidade, morfologia, metabolismo energético e fixação e proliferação celular. As substâncias químicas podem afetar a viabilidade celular por meio de diferentes mecanismos, portanto, a avaliação da citotoxicidade abrangendo diferentes desfechos de viabilidade celular é necessária para predizer os efeitos químicos9.
MTT e Alamar Blue (AB) são ensaios que determinam os efeitos sobre a viabilidade celular com base na atividade metabólica celular. O ensaio MTT avalia a atividade da enzima mitocondrial succinato desidrogenase10. A redução do brometo amarelado de 3-[4,5-dimetiltiazol-2il]-2,5-difeniltetrazólio (MTT) para o azul formazano ocorre apenas em células viáveis, e sua densidade óptica é diretamente proporcional ao número de células viáveis10. O ensaio AB é um indicador sensível de oxidação-redução, mediado por enzimas mitocondriais que fluorescem e mudam de cor ao reduzir a resazurina a resorufina por células vivas11; no entanto, enzimas citosólicas e microssômicas também contribuem para a redução de AB e MTT12. Essas enzimas podem incluir várias redutases, como álcool e aldeído oxidorredutases, NAD(P)H: quinona oxidorredutase, flavina redutase, NADH desidrogenase e citocromos11.
O ensaio de Vermelho Neutro (NR) é um ensaio de viabilidade celular baseado na incorporação desse corante nos lisossomos de células viáveis13. A absorção de NR depende da capacidade das células de manter gradientes de pH. O gradiente de prótons dentro dos lisossomos mantém um pH inferior ao citoplasma. Em pH fisiológico normal, o NR apresenta uma carga líquida de aproximadamente zero, o que lhe permite penetrar nas membranas celulares. Assim, o corante torna-se carregado e é retido dentro dos lisossomos. Consequentemente, quanto maior a quantidade de NR retido, maior o número de células viáveis14. Substâncias químicas que danificam a superfície celular ou membranas lisossômicas prejudicam a absorção desse corante.
O ensaio CFDA-AM é um ensaio de viabilidade celular fluorométrico baseado na retenção de éster acetato de acetato de 5-carboxifluoresceína acetoximetílico (CFDA-AM)15. A 5-CFDA-AM, substrato da esterase, é convertida em carboxifluoresceína, substância fluorescente polar e não permeável por membranas de células vivas15; assim, é retido no lado interno de uma membrana celular intacta, indicando células viáveis.
Recentemente, três ensaios de citotoxicidade (ensaios CFDA-AM, NR e AB) foram combinados em uma diretriz ISO (International Organization for Standardization) validada (ISO 21115:2019)16 e método de teste da OCDE (Organização para a Cooperação e Desenvolvimento Econômico) (OCDE TG 249) para avaliar a toxicidade aguda de peixes usando a linhagem celular RTgill-W1 (linhagem celular permanente da guelra da truta arco-íris [Oncorhynchus mykiss]) em placas de 24 poços17 . Embora exista um método baseado em células para prever a toxicidade aguda dos peixes, esforços têm sido investidos no desenvolvimento de métodos semelhantes com outras espécies de peixes e no aumento do rendimento do método. Alguns exemplos incluem o desenvolvimento de linhagens celulares ZFL transfectadas com genes repórteres para vias de toxicidade específicas18,19, testes de fototoxicidade na linhagem celular RTgill-W1 20 e o uso de linhagens celulares ZFL e ZF4 (fibroblásticos de peixe-zebra derivados de embriões de 1 dia de idade) para avaliar a toxicidade por vários ensaios de citotoxicidade21.
Danio rerio (peixe-zebra) é uma das principais espécies de peixes utilizadas em estudos de toxicidade aquática; assim, métodos baseados em células com linhagens celulares de peixe-zebra para testes de toxicidade de peixes podem ser extremamente úteis. A linhagem celular ZFL é uma linhagem celular epitelial de hepatócitos zebrafish que apresenta as principais características das células parenquimatosas hepáticas e pode metabolizar xenobióticos 7,22,23,24,25. Enquanto isso, a linhagem celular ZEM2S é uma linhagem celular fibroblástica embrionária de peixe-zebra derivada do estágio de blástula que pode ser usada para investigar os efeitos do desenvolvimento em peixes26,27. Assim, este protocolo descreve quatro ensaios de citotoxicidade (ensaios de MTT, AB, NR e CFDA-AM), com modificações a serem realizadas com linhagens celulares ZFL e ZEM2S em placas de 96 poços.
Protocolo
NOTA: Consulte a Tabela de Materiais para a lista de materiais utilizados neste protocolo e a Tabela 1 para a composição das soluções e meios utilizados neste protocolo.
1. Preparação das células ZFL e ZEM2S
- Comece por um balão T75 de células ZFL ou ZEM2S com 80% de confluência, cultivadas no respectivo meio completo a 28 °C sem CO2.
- Retirar o meio de cultura do balão e lavar as células adicionando 10 ml de solução salina tamponada com fosfato (PBS) 1x (0,01 M). Adicionar 3 mL de tripsina 1x (0,05% v/v; tripsina-EDTA 0,5 mM) aos frascos de cultura. Incubar a 28 °C durante 3 min.
- Bater suavemente no balão para libertar as células e, em seguida, parar a digestão da tripsina adicionando 3 ml de meio de cultura completo ao balão.
- Transfira a suspensão celular para um tubo de centrífuga cônico de 15 mL e centrífuga a 100 × g por 5 min.
- Após a centrifugação, remova cuidadosamente o sobrenadante, adicione 1 mL de meio completo para as células ZFL ou ZEM2S e ressuspenda o pellet usando uma micropipeta.
2. Contagem de células por exclusão de corante azul de tripano
- Adicionar 10 μL da suspensão celular e 10 μL de corante azul de tripano a um microtubo para contar as células e avaliar a sua viabilidade. Misture a suspensão celular e o corante usando uma pipeta.
- Em seguida, transfira 10 μL dessa mistura (suspensão celular + azul de tripano) para uma câmara de Neubauer e conte as células nos quatro grandes quadrados (Quadrantes Q) colocados nos cantos da câmara, considerando que as células viáveis são aquelas que não ocupam azul tripano. Determine o número de células viáveis usando a equação (1):
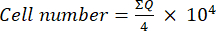 (1)
(1) - Calcular o número final de células na suspensão celular multiplicando o número de células determinado utilizando a equação (1) por dois (o factor de diluição devido à utilização de azul de tripano).
NOTA: Alternativamente, um sistema automatizado de contagem de células (por exemplo, um citômero com função de contagem de células e viabilidade) pode ser usado.
3. Revestimento de células em placas de 96 poços
- Calcular o volume de suspensão celular necessário para obter o número de células necessárias para realizar os ensaios de citotoxicidade. O número de células viáveis para cada linhagem celular é indicado abaixo:
- Placa 60.000 células ZEM2S viáveis por poço; assim, para toda a placa, utilizar seis milhões de células em 20 mL de meio completo (200 μL/poço, placa de 96 poços).
- Placa 40.000 células ZFL viáveis por poço; assim, para toda a placa, utilizar quatro milhões de células em 20 mL de meio completo (200 μL/poço, placa de 96 poços).
- Depois disso, transferir o respectivo volume da suspensão celular para um reservatório reagente (estéril) e encher com o meio de cultura completo para ZFL ou ZEM2S até 20 mL. Usando uma pipeta multicanal, misture a solução suavemente para cima e para baixo.
NOTA: Tome cuidado para não formar espuma ou bolhas. - Adicionar 200 μL da suspensão celular a cada poço de uma placa transparente de poliestireno de 96 poços usando a micropipeta multicanal. Incubar as placas a 28 °C durante 24 h.
NOTA: A placa deve ter pelo menos três poços sem células para o controle em branco, e apenas meios completos devem ser adicionados a esses poços. O efeito de borda (causado por maior evaporação nos poços de borda) geralmente ocorre em ensaios de placas de 96 poços e pode afetar a viabilidade das células nos poços de borda da placa28. Esse efeito pode ser maior ou menor, dependendo da marca e do design da placa de 96 poços28. Embora não tenhamos notado nenhum distúrbio de crescimento/viabilidade celular para ZFL e ZEM2S nos poços de borda, sugerimos selar a placa com parafilme ou folha de vedação adesiva para evitar esse efeito, ou cultivar as células apenas nos 60 poços internos e encher os poços de borda com PBS.
4. Exposição das células ao produto químico em estudo
- Descarte cuidadosamente a mídia gasta dos poços usando uma micropipeta multicanal.
- Expor as células a produtos químicos de teste em diferentes concentrações. Preparar as soluções das concentrações químicas em estudo nos meios de cultura para ZFL ou ZEM2S sem soro fetal bovino (FBS) (meio de exposição). Em seguida, adicione 100 μL por poço dessas soluções em triplicado técnico (ou seja, três poços/concentração química de teste).
- Para os controlos, colocar os grupos de controlo na mesma placa que o produto químico em estudo em triplicados técnicos (três alvéolos/grupo de controlo). Assim, para o controle em branco (B), adicione 100 μL do meio de exposição nos poços livres de células, para o controle negativo (NC), adicione 100 μL do meio de exposição aos poços com células e, para o controle positivo (PC), exponha as células a uma solução de 1% de Triton X-100 preparada no meio de exposição. Em alguns casos, um controle de solvente (SC) deve ser incluído na placa, considerando uma concentração claramente não citotóxica como uma concentração final de solvente.
NOTA: Recomenda-se o uso de DMSO a 0,5% como solvente; O DMSO pode ser usado até 1% como solvente nessas linhagens celulares sem exceder o limiar de citotoxicidade de 10% relacionado ao controle negativo. - Incubar as placas a 28 °C durante 24 h. Sele as placas com parafilme ou folha de vedação adesiva para evitar a evaporação do meio de cultura.
NOTA: Certos produtos químicos podem ter absorvância de fundo intrínseca ou fluorescência que podem interferir com a absorvância ou fluorescência do(s) corante(s) indicador(es) (por exemplo, compostos com cor podem influenciar a absorvência, albumina sérica29 e compostos que interferem com enzimas de redução30,31). Neste caso, a placa deve incluir um controlo adicional, adicionando soluções químicas de ensaio nos poços sem células. Isto é para verificar a possível interferência da auto-absorvência/autofluorescência química com os corantes. Se a interferência for detectada, deve-se avaliar se ela pode ser excluída para obter uma previsão correta da citotoxicidade.
5. Ensaios de citotoxicidade
NOTA: Prepare todas as soluções de acordo com a Tabela 1. Todas as etapas descritas abaixo (Figura 1) são realizadas em condições estéreis. O uso de uma pipeta para descartar o meio de exposição não é recomendado, porque as células podem facilmente se desprender dos poços após o tratamento químico.
- Ensaios AB e CFDA-AM
- Após 24 h de exposição ao produto químico em estudo, deitar cuidadosamente fora o meio de exposição, despejando o conteúdo numa bandeja de recolha.
- Lave a placa com 200 μL de PBS. Remova cuidadosamente o PBS despejando-o em uma bandeja de coleta para evitar a perda de células.
- Adicionar 100 μL por poço de solução AB/CFDA-AM. Incubar a placa durante 30 min no escuro a 28 °C.
- Meça a fluorescência em um leitor de placas de fluorescência a 530 nm (excitação) e 595 nm (emissão) para AB, e a 493 nm (excitação) e 541 nm (emissão) para CFDA-AM.
- Ensaio NR
NOTA: As etapas para o ensaio de NR são realizadas imediatamente após os ensaios AB e CFDA-AM (Figura 1).- Centrifugar a solução de trabalho NR (40 μg/mL) a 600 × g por 10 min.
NOTA: A precipitação de NR no tubo não deve ser transferida para as placas. Assim, após a centrifugação da solução de trabalho NR, coletar o sobrenadante usando uma pipeta sem aspirar os precipitados NR. Transfira o sobrenadante para um reservatório de reagente. - Remova cuidadosamente a solução AB/CFDA-AM despejando o conteúdo em uma bandeja de coleta.
- Adicione 100 μL por poço da solução de trabalho NR usando uma micropipeta multicanal. Incubar a placa a 28 °C durante 3 h.
NOTA: Após a incubação de 3 h, observe se ocorreu precipitação de NR nas placas utilizando um microscópio. Os precipitados NR podem interferir na quantificação da viabilidade celular, portanto, não devem estar presentes. - Remova cuidadosamente a solução NR despejando o conteúdo em uma bandeja de coleta. Lave os poços adicionando 150 μL de PBS por poço.
- Adicionar 150 μL por poço da solução de extração NR e incubar a placa em um agitador de placas por 10 minutos para agitar suavemente. Medir a absorvância a 540 nm num leitor de placas.
NOTA: Deve ser efectuada uma segunda leitura a 690 nm para excluir qualquer absorvância de impressões digitais de fundo na placa.
- Centrifugar a solução de trabalho NR (40 μg/mL) a 600 × g por 10 min.
- Ensaio MTT
NOTA: O ensaio MTT deve ser efectuado separadamente dos ensaios acima descritos (numa nova placa) (figura 2).- Remova cuidadosamente a mídia de exposição despejando o conteúdo em uma bandeja de coleta.
- Adicione 100 μL de solução de trabalho MTT por poço usando uma micropipeta multicanal. Incubar a placa a 28 °C durante 4 h.
- Descarte a solução de MTT despejando o conteúdo em uma bandeja de coleta.
- Adicionar 100 μL por poço de DMSO para extrair os cristais formazan, incubando a placa em um agitador de placas por 10 min. Medir a absorvância a 570 nm utilizando um leitor de placas.
NOTA: Deve ser efectuada uma segunda leitura a 690 nm para excluir qualquer absorvância de impressões digitais de fundo na placa. É importante ressaltar que os produtos químicos em estudo podem interferir no MTT, que deve ser avaliado para garantir a qualidade dos dados gerados32. Para isso, poços livres de células contendo as concentrações de teste e MTT (0,5 mg/mL) devem ser expostos, seguidos de incubação para observar qualquer mudança de cor nos poços que possa aumentar a absorvância e levar a falsos resultados de viabilidade. Os produtos químicos que interagem com o MTT devem ser evitados neste ensaio.
6. Cálculo da viabilidade/citotoxicidade celular
NOTA: A absorvância bruta ou a fluorescência adquirida é utilizada para calcular a viabilidade celular em percentagem relacionada com o controlo negativo (para produtos químicos de ensaio preparados directamente em meios de exposição) ou com o controlo de solventes (para produtos químicos de ensaio preparados com solventes, tais como DMSO). Antes de determinar a porcentagem de viabilidade da célula, os dados brutos devem ser normalizados pelo controle em branco.
- Calcular a absorvância ou fluorescência média para cada concentração química de ensaio e grupo de controlo (três alvéolos/tratamento).
- Para determinar a percentagem de viabilidade celular em relação ao controlo (negativo ou solvente), utilize a equação (2):
 (2)
(2)
NOTA: As unidades de absorvância (abs) ou fluorescência (fluo) representam a média da absorbância ou fluorescência medida nos três poços por concentração; em branco representa poços sem células.
Resultados
A Figura 3 mostra as placas dos ensaios AB, CFDA-AM, NR e MTT. Para o ensaio AB (Figura 3A), os poços em branco e os poços com nenhum ou menor número de células viáveis apresentam coloração azul e baixa fluorescência, enquanto os poços com alto número de células viáveis são rosados e apresentam altos valores de fluorescência devido à transformação da resazurina (AB) em resorufina (substância rosada) pelas células viáveis. Para o ensaio CFDA-A...
Discussão
Os ensaios de citotoxicidade são amplamente utilizados para avaliação de toxicidade in vitro, e este artigo de protocolo apresenta quatro ensaios de citotoxicidade comumente utilizados modificados para serem realizados em linhagens celulares de peixe-zebra (ou seja, densidade celular para placa de 96 poços, tempo de incubação no ensaio MTT, depleção de FBS durante a condição de exposição química e concentração máxima aceitável para o SC). Como esses ensaios quantificam a citotoxicidade por difer...
Divulgações
Os autores declaram não haver conflito de interesses.
Agradecimentos
Em memória do Dr. Márcio Lorencini, coautor deste trabalho, excelente pesquisador na área de cosméticos e dedicado à promoção da pesquisa cosmética no Brasil. Os autores agradecem ao Laboratório Multiusuário do Departamento de Fisiologia (UFPR) pela disponibilidade de equipamentos e pelo apoio financeiro da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES, Brasil) (Código Financeiro 001) e do Grupo Boticário.
Materiais
| Name | Company | Catalog Number | Comments |
| 5-CFDA, AM (5-Carboxyfluorescein Diacetate, Acetoxymethyl Ester) | Invitrogen | C1345 | |
| Cell culture plate, 96 well plate | Sarstedt | 83.3924 | Surface: Standard, flat base |
| DMEM | Gibco | 12800-017 | Powder, high glucose, pyruvate |
| FBS - Fetal Bovine Serum, qualified, USDA-approved regions | Gibco | 12657-029 | |
| Ham's F-12 Nutrient Mix, powder | Gibco | 21700026 | Powder |
| HEPES (1 M) | Gibco | 15630080 | |
| Leibovitz's L-15 Medium | Gibco | 41300021 | Powder |
| Neutral red | Sigma-Aldrich | N4638 | Powder, BioReagent, suitable for cell culture |
| Orbital shaker | Warmnest | KLD-350-BI | 22 mm rotation diameter |
| Dulbeccos PBS (10X) with calcium and magnesium | Invitrogen | 14080055 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| Resazurin sodium salt | Sigma-Aldrich | R7017 | Powder, BioReagent, suitable for cell culture |
| RPMI 1640 Medium | Gibco | 31800-014 | Powder |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | Powder, bioreagent for molecular biology |
| Thiazolyl Blue Tetrazolium Bromide 98% | Sigma-Aldrich | M2128 | |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Trypsin-EDTA (0.5%), no phenol red | Gibco | 15400054 | |
| ZEM2S cell line | ATCC | CRL-2147 | This cell line was kindly donated by Professor Dr. Michael J. Carvan (University of Wisconsin, Milwaukee, USA) |
| ZFL cell line | BCRJ | 256 |
Referências
- ECHA. Non-Animal Approaches-Current Status of Regulatory Applicability Under the REACH, CLP and Biocidal Products Regulations. ECHA. , (2017).
- Alternative Methods Accepted by US Agencies. National Toxicology Program, and US Department of Health and Human Services Available from: https://ntp.niehs.nih.gov/whatwestudy/niceatm/accept-methods/index.html (2022)
- Schirmer, K. Proposal to improve vertebrate cell cultures to establish them as substitutes for the regulatory testing of chemicals and effluents using fish. Toxicology. 224 (3), 163-183 (2006).
- Scholz, S., et al. Alternatives to in vivo tests to detect endocrine disrupting chemicals (EDCs) in fish and amphibians-screening for estrogen, androgen and thyroid hormone disruption. Critical Reviews in Toxicology. 43 (1), 45-72 (2013).
- Tanneberger, K., et al. Predicting fish acute toxicity using a fish gill cell line-based toxicity assay. Environmental Science & Technology. 47 (2), 1110-1119 (2013).
- Roesler, R., Lorencini, M., Pastore, G. Brazilian cerrado antioxidant sources: cytotoxicity and phototoxicity in vitro. Food Science and Technology. 30, 814-821 (2010).
- Ruyra, A., et al. Zebrafish liver (ZFL) cells are able to mount an anti-viral response after stimulation with Poly (I:C). Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology. 182, 55-63 (2015).
- Natsch, A., Laue, H., Haupt, T., von Niederhäusen, V., Sanders, G. Accurate prediction of acute fish toxicity of fragrance chemicals with the RTgill-W1 cell assay. Environmental Toxicology and Chemistry. 37 (3), 931-941 (2018).
- Freshney, R. I. Cytotoxicity. Culture of Animal Cells: A Manual of Basic Technique. , (2005).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- O'Brien, J., Wilson, I., Orton, T., Pognan, F. Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity. European Journal of Biochemistry. 267 (17), 5421-5426 (2000).
- Gonzalez, R. J., Tarloff, J. B. Evaluation of hepatic subcellular fractions for Alamar blue and MTT reductase activity. Toxicology In Vitro. 15 (3), 257-259 (2001).
- Borenfreund, E., Puerner, J. A. Toxicity determined in vitro by morphological alterations and neutral red absorption. Toxicology Letters. 24 (2-3), 119-124 (1985).
- Repetto, G., del Peso, A., Zurita, J. L. Neutral red uptake assay for the estimation of cell viability/cytotoxicity. Nature Protocols. 3 (7), 1125-1131 (2008).
- Kamiloglu, S., Sari, G., Ozdal, T., Capanoglue, E. Guidelines for cell viability assays. Food Frontiers. 1 (3), 332-349 (2020).
- Water Quality-Determination of Acute Toxicity of Water Samples and Chemicals to a Fish Gill Cell Line (RTgill-W1) (ISO 21115:2019). International Organization for Standardization Available from: https://www.iso.org/standar/69933.html (2019)
- Organisation for Economic Co-operation and Development. . Test Guideline No. 249: Fish Cell Line Acute Toxicity-The RTgill-W1 Cell Line Assay. OECD Guidelines for the Testing of Chemicals, Section 2. Effects on Biotic Systems. , (2021).
- Lungu-Mitea, S., Lundqvist, J. Potentials and pitfalls of transient in vitro reporter bioassays: interference by vector geometry and cytotoxicity in recombinant zebrafish cell lines. Archives of Toxicology. 94 (8), 2769-2784 (2020).
- Lungu-Mitea, S., Han, Y., Lundqvist, J. Development, scrutiny, and modulation of transient reporter gene assays of the xenobiotic metabolism pathway in zebrafish hepatocytes. Cell Biology and Toxicology. , 1-23 (2021).
- Schirmer, K., Chan, A. G., Greenberg, B. M., Dixon, D. G., Bols, N. C. Methodology for demonstrating and measuring the photocytotoxicity of fluoranthene to fish cells in culture. Toxicology In Vitro. 11 (1-2), 107-119 (1997).
- Lungu-Mitea, S., et al. Modeling bioavailable concentrations in zebrafish cell lines and embryos increases the correlation of toxicity potencies across test systems. Environmental Science & Technology. 55 (1), 447-457 (2021).
- Cavalcante, D. G. S. M., et al. Cytotoxic, biochemical and genotoxic effects of biodiesel produced by different routes on ZFL cell line. Toxicology In Vitro. 28 (6), 1117-1125 (2014).
- Meng, Q., Yeung, K., Chan, K. M. Toxic effects of octocrylene on zebrafish larvae and liver cell line (ZFL). Aquatic Toxicology. 236, 105843 (2021).
- Kwok, M. L., Chan, K. M. Oxidative stress and apoptotic effects of copper and cadmium in the zebrafish liver cell line ZFL. Toxicology Reports. 7, 822-835 (2020).
- Yang, J., Chan, K. M. Evaluation of the toxic effects of brominated compounds (BDE-47, 99, 209, TBBPA) and bisphenol A (BPA) using a zebrafish liver cell line, ZFL. Aquatic Toxicology. 159, 138-147 (2015).
- Bradford, C. S., Sun, L., Collodi, P., Barnes, D. W. Cell cultures from zebrafish embryos and adult tissues. Journal of Tissue Culture Methods. 16 (2), 99-107 (1994).
- He, S., et al. Genetic and transcriptome characterization of model zebrafish cell lines. Zebrafish. 3 (4), 441-453 (2006).
- Mansoury, M., Hamed, M., Karmustaji, R., Al Hannan, F., Safrany, S. T. The edge effect: A global problem. The trouble with culturing cells in 96-well plates. Biochemistry and Biophysics Reports. 26, 100987 (2021).
- Funk, D., Schrenk, H. -. H., Frei, E. Serum albumin leads to false-positive results in the XTT and the MTT assay. BioTechniques. 43 (2), 178 (2007).
- Dayeh, V. R., Bols, N. C., Tanneberger, K., Schirmer, K., Lee, L. E. J. The use of fish-derived cell lines for investigation of environmental contaminants: An update following OECD's fish toxicity testing framework no. 171. Current Protocols in Toxicology. 1, (2013).
- Stepanenko, A. A., Dmitrenko, V. V. Pitfalls of the MTT assay: Direct and off-target effects of inhibitors can result in over/underestimation of cell viability. Gene. 574 (2), 193-203 (2015).
- Ulukaya, E., Colakogullari, M., Wood, E. J. Interference by anti-cancer chemotherapeutic agents in the MTT-tumor chemosensitivity assay. Chemotherapy. 50 (1), 43-50 (2004).
- Sebaugh, J. L. Guidelines for accurate EC50/IC50 estimation. Pharmaceutical Statistics. 10 (2), 128-134 (2011).
- Weimer, M., et al. The impact of data transformations on concentration-response modeling. Toxicology Letters. 213 (2), 292-298 (2012).
- Green, J. W., Holbech, T. A., Henrik, Chapter 4: Analysis of Continuous Data (Regression). Statistical Analysis of Ecotoxicity Studies. , (2018).
- Proença, S., et al. Effective exposure of chemicals in in vitro cell systems: A review of chemical distribution models. Toxicology In Vitro. 73, 105133 (2021).
- Guidony, N. S., et al. ABC proteins activity and cytotoxicity in zebrafish hepatocytes exposed to triclosan. Environmental Pollution. 271, 116368 (2021).
- da Silva, N. D. G., et al. Interference of goethite in the effects of glyphosate and Roundup® on ZFL cell line. Toxicology In Vitro. 65, 104755 (2020).
- Yang, Y., et al. Temperature is a key factor influencing the invasion and proliferation of Toxoplasma gondii in fish cells. Experimental Parasitology. 217, 107966 (2020).
- Lopes, F. M., Sandrini, J. Z., Souza, M. M. Toxicity induced by glyphosate and glyphosate-based herbicides in the zebrafish hepatocyte cell line (ZF-L). Ecotoxicology and Environmental Safety. 162, 201-207 (2018).
- Lachner, D., Oliveira, L. F., Martinez, C. B. R. Effects of the water soluble fraction of gasoline on ZFL cell line: Cytotoxicity, genotoxicity and oxidative stress. Toxicology In Vitro. 30, 225-230 (2015).
- Morozesk, M., et al. Effects of multiwalled carbon nanotubes co-exposure with cadmium on zebrafish cell line: Metal uptake and accumulation, oxidative stress, genotoxicity and cell cycle. Ecotoxicology and Environmental Safety. 202, 110892 (2020).
- Dognani, G., et al. Nanofibrous membranes for low-concentration Cr VI adsorption: kinetic, thermodynamic and the influence on ZFL cells viability. Materials Research. , 24 (2021).
- ZEM2S (ATCC®CRL-2147™). American Type Culture Collection Available from: https://www.atcc.org/products/crl-2147 (2023)
- Chen, Y., et al. Acute toxicity of the cationic surfactant C12-benzalkonium in different bioassays: how test design affects bioavailability and effect concentrations. Environmental Toxicology and Chemistry. 33 (3), 606-615 (2014).
- Pomponio, G., et al. In vitro kinetics of amiodarone and its major metabolite in two human liver cell models after acute and repeated treatments. Toxicology In Vitro. 30, 36-51 (2015).
- Mori, M., Wakabayashi, M. Cytotoxicity evaluation of chemicals using cultured fish cells. Water Science and Technology. 42 (7-8), 277-282 (2000).
- Caminada, D., Escher, C., Fent, K. Cytotoxicity of pharmaceuticals found in aquatic systems: comparison of PLHC-1 and RTG-2 fish cell lines. Aquatic Toxicology. 79 (2), 114-123 (2006).
- Giltrap, M., et al. In vitro screening of organotin compounds and sediment extracts for cytotoxicity to fish cells. Environmental Toxicology and Chemistry. 30 (1), 154-161 (2011).
- Hollert, H., Duerr, M., Erdinger, L., Braunbeck, T. Cytotoxicity of settling particulate matter and sediments of the Neckar River (Germany) during a winter flood. Environmental Toxicology and Chemistry. 19 (3), 528-534 (2000).
- Pannetier, P., et al. Toxicity assessment of pollutants sorbed on environmental sample microplastics collected on beaches: Part I-adverse effects on fish cell line. Environmental Pollution. 248, 1088-1097 (2019).
- Ternjej, I., Srček, V. G., Mihaljević, Z., Kopjar, N. Cytotoxic and genotoxic effects of water and sediment samples from gypsum mining area in channel catfish ovary (CCO) cells. Ecotoxicology and Environmental Safety. 98, 119-127 (2013).
- Hamid, R., Rotshteyn, Y., Rabadi, L., Parikh, R., Bullock, P. Comparison of alamar blue and MTT assays for high throughput screening. Toxicology In Vitro. 18 (5), 703-710 (2004).
- Vistica, D. T., et al. Tetrazolium-based assays for cellular viability: a critical examination of selected parameters affecting formazan production. Cancer Research. 51 (10), 2515-2520 (1991).
- Knauer, K., Lampert, C., Gonzalez-Valero, J. Comparison of in vitro and in vivo acute fish toxicity in relation to toxicant mode of action. Chemosphere. 68 (8), 1435-1441 (2007).
- Stadnicka-Michalak, J., Tanneberger, K., Schirmer, K., Ashauer, R. Measured and modeled toxicokinetics in cultured fish cells and application to in vitro-in vivo toxicity extrapolation. PLoS One. 9 (3), 92303 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados