Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Ensayos de citotoxicidad con líneas celulares de pez cebra
En este artículo
Resumen
Este protocolo presenta ensayos de citotoxicidad de uso común (ensayos Alamar Blue [AB], CFDA-AM, Neutral Red y MTT) adaptados para la evaluación de la citotoxicidad en líneas celulares de embrión de pez cebra (ZEM2S) e hígado (ZFL) en placas de 96 pocillos.
Resumen
Las líneas celulares de peces se han utilizado cada vez más en estudios de ecotoxicidad, y los ensayos de citotoxicidad se han propuesto como métodos para predecir la toxicidad aguda de los peces. Por lo tanto, este protocolo presenta ensayos de citotoxicidad modificados para evaluar la viabilidad celular en líneas celulares de embrión de pez cebra (Danio rerio) (ZEM2S) e hígado (ZFL) en placas de 96 pocillos. Los criterios de valoración de citotoxicidad evaluados son la integridad mitocondrial (ensayos Alamar Blue [AB] y MTT), la integridad de la membrana a través de la actividad de la esterasa (ensayo CFDA-AM) y la integridad de la membrana lisosomal (ensayo Neutral Red [NR]). Después de la exposición de las sustancias de ensayo en una placa de 96 pocillos, se realizan los ensayos de citotoxicidad; aquí, AB y CFDA-AM se llevan a cabo simultáneamente, seguidos de NR en la misma placa, mientras que el ensayo MTT se realiza en una placa separada. Las lecturas para estos ensayos se toman por fluorescencia para AB y CFDA-AM, y absorbancia para MTT y NR. Los ensayos de citotoxicidad realizados con estas líneas celulares de peces se pueden utilizar para estudiar la toxicidad aguda de sustancias químicas en peces.
Introducción
Las sustancias químicas deben ser probadas en cuanto a su seguridad para la salud humana y el medio ambiente. Los biomarcadores moleculares y celulares se han considerado cada vez más en las evaluaciones de seguridad para predecir los efectos en los organismos vivos por parte de las agencias reguladoras y/o legislaciones (por ejemplo, REACH, OCDE, US EPA)1,2, ya que pueden preceder al resultado adverso in vivo (por ejemplo, alteración endocrina, respuesta inmunológica, toxicidad aguda, fototoxicidad)3,4,5,6,7 . En este contexto, la citotoxicidad ha sido tomada como medida para predecir la toxicidad aguda de los peces 5,8; Sin embargo, puede tener muchas otras aplicaciones en estudios de ecotoxicidad, como la definición de concentraciones subcitotóxicas de sustancias químicas para estudiar su conjunto más diverso de efectos en los peces (por ejemplo, efectos de alteración endocrina).
En los sistemas de cultivo celular (sistemas in vitro ), la citotoxicidad de las sustancias químicas puede determinarse mediante métodos que difieren en los tipos de criterios de valoración. Por ejemplo, un método de citotoxicidad puede basarse en un punto final relacionado con la morfología específica observada durante el proceso de muerte celular, mientras que otro puede determinar la citotoxicidad mediante la medición de la muerte celular, la viabilidad y funcionalidad, la morfología, el metabolismo energético y la unión y proliferación celular. Las sustancias químicas pueden afectar la viabilidad celular a través de diferentes mecanismos, por lo que la evaluación de la citotoxicidad que cubre diferentes criterios de valoración de la viabilidad celular es necesaria para predecir los efectos químicos9.
MTT y Alamar Blue (AB) son ensayos que determinan los efectos sobre la viabilidad celular en función de la actividad metabólica celular. El ensayo MTT evalúa la actividad de la enzima mitocondrial succinato deshidrogenasa10. La reducción del bromuro amarillento de 3-[4,5-dimetiltiazol-2il]-2,5-difeniltetrazolio (MTT) a azul de formazán ocurre solo en células viables, y su densidad óptica es directamente proporcional al número de células viables10. El ensayo AB es un indicador sensible de oxidación-reducción, mediado por enzimas mitocondriales que emiten fluorescencia y cambian de color al reducir la resazurina a resorufina por las células vivas11; sin embargo, las enzimas citosólicas y microsomales también contribuyen a la reducción de AB y MTT12. Estas enzimas pueden incluir varias reductasas, como alcohol y aldehído oxidorreductasas, NAD(P)H: quinona oxidorreductasa, flavina reductasa, NADH deshidrogenasa y citocromos11.
El ensayo Neutral Red (NR) es un ensayo de viabilidad celular basado en la incorporación de este colorante en los lisosomas de células viables13. La absorción de NR depende de la capacidad de las células para mantener gradientes de pH. El gradiente de protones dentro de los lisosomas mantiene un pH más bajo que el citoplasma. A pH fisiológico normal, el NR presenta una carga neta de aproximadamente cero, lo que le permite penetrar en las membranas celulares. Por lo tanto, el tinte se carga y se retiene dentro de los lisosomas. En consecuencia, cuanto mayor es la cantidad de NR retenida, mayor es el número de células viables14. Las sustancias químicas que dañan la superficie celular o las membranas lisosomales perjudican la absorción de este colorante.
El ensayo CFDA-AM es un ensayo de viabilidad celular fluorométrica basado en la retención de éster acetoxymetilo de diacetato de 5-carboxifluoresceína (CFDA-AM)15. La 5-CFDA-AM, sustrato de esterasa, se convierte en carboxifluoresceína, sustancia fluorescente que es polar y no permeable por las membranas de las células vivas15; Por lo tanto, se retiene en el lado interno de una membrana celular intacta, lo que indica células viables.
Recientemente, se combinaron tres ensayos de citotoxicidad (ensayos CFDA-AM, NR y AB) en una guía ISO (Organización Internacional de Normalización) validada (ISO 21115: 2019)16 y un método de prueba de la OCDE (Organización para la Cooperación y el Desarrollo Económicos) (OCDE TG 249) para evaluar la toxicidad aguda de los peces utilizando la línea celular RTgill-W1 (línea celular permanente de trucha arco iris [Oncorhynchus mykiss] branquia) en placas de 24 pocillos17 . Aunque existe un método basado en células para predecir la toxicidad aguda de los peces, se han invertido esfuerzos en desarrollar métodos similares con otras especies de peces y aumentar el rendimiento del método. Algunos ejemplos incluyen el desarrollo de líneas celulares ZFL transfectadas con genes reporteros para vías de toxicidad específicas18,19, pruebas de fototoxicidad en la línea celular RTgill-W1 20, y el uso de líneas celulares ZFL y ZF4 (fibroblástico de pez cebra derivado de embriones de 1 día de edad) para evaluar la toxicidad mediante varios ensayos de citotoxicidad21.
Danio rerio (pez cebra) es una de las principales especies de peces utilizadas en estudios de toxicidad acuática; Por lo tanto, los métodos basados en células con líneas celulares de pez cebra para pruebas de toxicidad de peces pueden ser extremadamente útiles. La línea celular ZFL es una línea celular de hepatocitos epiteliales de pez cebra que presenta las principales características de las células del parénquima hepático y puede metabolizar xenobióticos 7,22,23,24,25. Mientras tanto, la línea celular ZEM2S es una línea celular fibroblástica embrionaria de pez cebra derivada de la etapa de blástula que puede usarse para investigar los efectos del desarrollo en peces26,27. Por lo tanto, este protocolo describe cuatro ensayos de citotoxicidad (ensayos MTT, AB, NR y CFDA-AM), con modificaciones que se realizarán con líneas celulares ZFL y ZEM2S en placas de 96 pocillos.
Protocolo
NOTA: Consulte la Tabla de materiales para obtener la lista de materiales utilizados en este protocolo y la Tabla 1 para la composición de soluciones y medios utilizados en este protocolo.
1. Preparación de células ZFL y ZEM2S
- Comenzar con un matraz T75 de células ZFL o ZEM2S con 80% de confluencia, cultivadas en el medio completo respectivo a 28 °C sinCO2.
- Retirar el medio de cultivo del matraz y lavar las células añadiendo 10 ml de solución salina tamponada con fosfato (PBS) (0,01 M). Añadir 3 ml de tripsina 1x (0,05% v/v; 0,5 mM tripsina-EDTA) a los matraces de cultivo. Incubar a 28 °C durante 3 min.
- Golpee suavemente el matraz para liberar las células y luego detenga la digestión de tripsina agregando 3 ml de medio de cultivo completo al matraz.
- Transfiera la suspensión celular a un tubo de centrífuga cónica de 15 ml y centrifuga a 100 × g durante 5 min.
- Después de la centrifugación, retire con cuidado el sobrenadante, agregue 1 ml de medio completo para células ZFL o ZEM2S y vuelva a suspender el pellet con una micropipeta.
2. Conteo celular por exclusión del colorante azul de tripano
- Agregue 10 μL de la suspensión celular y 10 μL de colorante azul de tripano a un microtubo para contar las células y evaluar su viabilidad. Mezclar la suspensión celular y el tinte con una pipeta.
- Luego, transfiera 10 μL de esta mezcla (suspensión celular + azul de tripano) a una cámara de Neubauer y cuente las celdas en los cuatro cuadrados grandes (cuadrantes Q) colocados en las esquinas de la cámara, considerando que las células viables son aquellas que no absorben azul de tripano. Determina el número de celdas viables usando la ecuación (1):
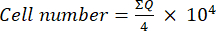 (1)
(1) - Calcule el número de celda final en la suspensión celular multiplicando el número de celdas determinado usando la ecuación (1) por dos (el factor de dilución debido al uso de azul de tripano).
NOTA: Alternativamente, se puede utilizar un sistema automatizado de recuento celular (por ejemplo, un citómero con función de recuento celular y viabilidad).
3. Recubrimiento celular en placas de 96 pocillos
- Calcular el volumen de suspensión celular necesario para obtener el número de células necesarias para realizar los ensayos de citotoxicidad. El número de células viables para cada línea celular se indica a continuación:
- Placa 60.000 células ZEM2S viables por pocillo; por lo tanto, para toda la placa, use seis millones de células en 20 ml de medio completo (200 μL / pocillo, placa de 96 pocillos).
- Placa 40.000 células ZFL viables por pozo; por lo tanto, para toda la placa, use cuatro millones de células en 20 ml de medio completo (200 μL / pocillo, placa de 96 pocillos).
- Después de eso, transfiera el volumen respectivo de la suspensión celular a un depósito de reactivo (estéril) y llénelo con el medio de cultivo completo para ZFL o ZEM2S a 20 ml. Con una pipeta multicanal, mezcle la solución suavemente hacia arriba y hacia abajo.
NOTA: Tenga cuidado de no formar espuma o burbujas. - Añadir 200 μL de la suspensión celular a cada pocillo de una placa transparente de poliestireno de 96 pocillos utilizando la micropipeta multicanal. Incubar las placas a 28 °C durante 24 h.
NOTA: La placa debe tener al menos tres pocillos sin celdas para el control en blanco, y solo se deben agregar medios completos a estos pocillos. El efecto borde (causado por una mayor evaporación en los pocillos de borde) ocurre comúnmente en ensayos de placas de 96 pocillos y puede afectar la viabilidad de las células en los pocillos de borde de la placa28. Este efecto puede ser mayor o menor dependiendo de la marca y el diseño de la placa de 96 pocillos28. Aunque no notamos ninguna alteración del crecimiento celular / viabilidad para ZFL y ZEM2S en los pozos de borde, sugerimos sellar la placa con parafilm o lámina de sellado adhesiva para evitar este efecto, o cultivar las células solo en los 60 pozos interiores y llenar los pozos de borde con PBS.
4. Exposición de las células a la sustancia de ensayo
- Deseche cuidadosamente los medios gastados de los pocillos utilizando una micropipeta multicanal.
- Exponga las células para probar sustancias químicas en diferentes concentraciones. Preparar las soluciones de las concentraciones químicas de ensayo en los medios de cultivo para ZFL o ZEM2S sin suero fetal bovino (FBS) (medios de exposición). Luego, agregue 100 μL por pocillo de estas soluciones en triplicado técnico (es decir, tres pocillos/concentración química de prueba).
- Para los controles, coloque los grupos de control en la misma placa que la sustancia problema en triplicados técnicos (tres pocillos/grupo de control). Por lo tanto, para el control en blanco (B), agregue 100 μL de los medios de exposición en los pocillos libres de células, para el control negativo (NC), agregue 100 μL del medio de exposición a los pocillos con células, y para el control positivo (PC), exponga las células a una solución de Triton X-100 al 1% preparada en el medio de exposición. En algunos casos, se debe incluir un control de disolvente (SC) en la placa, considerando una concentración claramente no citotóxica como concentración final de disolvente.
NOTA: Se recomienda utilizar DMSO al 0,5% como disolvente; El DMSO se puede utilizar hasta un 1% como disolvente en estas líneas celulares sin exceder el umbral de citotoxicidad del 10% relacionado con el control negativo. - Incubar las placas a 28 °C durante 24 h. Selle las placas con parafilm o lámina de sellado adhesiva para evitar la evaporación del medio de cultivo.
NOTA: Ciertos productos químicos pueden tener absorbancia de fondo intrínseca o fluorescencia que puede interferir con la absorbancia o fluorescencia de los colorantes indicadores (por ejemplo, los compuestos con color pueden influir en la absorbancia, la albúmina sérica29 y los compuestos que interfieren con las enzimas reductoras30,31). En este caso, la placa debe incluir un control adicional mediante la adición de soluciones químicas de prueba en los pocillos sin células. Esto es para verificar la posible interferencia de la auto-absorbancia química / autofluorescencia con los tintes. Si se detecta interferencia, se debe evaluar si se puede excluir para obtener una predicción correcta de la citotoxicidad.
5. Ensayos de citotoxicidad
NOTA: Prepare todas las soluciones de acuerdo con la Tabla 1. Todos los pasos descritos a continuación (Figura 1) se llevan a cabo en condiciones estériles. No se recomienda el uso de una pipeta para desechar los medios de exposición, ya que las células pueden desprenderse fácilmente de los pocillos después del tratamiento químico.
- Ensayos AB y CFDA-AM
- Después de 24 h de exposición química de prueba, deseche cuidadosamente los medios de exposición vertiendo el contenido en una bandeja de recolección.
- Lave el plato con 200 μL de PBS. Retire con cuidado el PBS vertiéndolo en una bandeja de recolección para evitar la pérdida de células.
- Añadir 100 μL por pocillo de solución AB/CFDA-AM. Incubar la placa durante 30 minutos en la oscuridad a 28 °C.
- Mida la fluorescencia en un lector de placas de fluorescencia a 530 nm (excitación) y 595 nm (emisión) para AB, y a 493 nm (excitación) y 541 nm (emisión) para CFDA-AM.
- Ensayo NR
NOTA: Los pasos para el ensayo NR se llevan a cabo inmediatamente después de los ensayos AB y CFDA-AM (Figura 1).- Centrifugar la solución de trabajo NR (40 μg/ml) a 600 × g durante 10 min.
NOTA: La precipitación de NR en el tubo no debe transferirse a las placas. Por lo tanto, después de la centrifugación de la solución de trabajo NR, recoger el sobrenadante con una pipeta sin aspirar los precipitados NR. Transfiera el sobrenadante a un depósito de reactivo. - Retire con cuidado la solución AB/CFDA-AM vertiendo el contenido en una bandeja de recolección.
- Añadir 100 μL por pocillo de la solución de trabajo NR utilizando una micropipeta multicanal. Incubar la placa a 28 °C durante 3 h.
NOTA: Después de la incubación de 3 h, observe si se produjo precipitación de NR en las placas con un microscopio. Los precipitados de NR pueden interferir con la cuantificación de la viabilidad celular, por lo tanto, no deben estar presentes. - Retire con cuidado la solución NR vertiendo el contenido en una bandeja de recolección. Lave los pocillos agregando 150 μL de PBS por pocillo.
- Añadir 150 μL por pocillo de la solución de extracción NR e incubar la placa en un agitador de placas durante 10 minutos para agitar suavemente. Mida la absorbancia a 540 nm en un lector de placas.
NOTA: Se debe realizar una segunda lectura a 690 nm para excluir cualquier absorbancia de huellas dactilares de fondo en la placa.
- Centrifugar la solución de trabajo NR (40 μg/ml) a 600 × g durante 10 min.
- Ensayo MTT
NOTA: El ensayo MTT debe realizarse por separado de los ensayos descritos anteriormente (en una placa nueva) (Figura 2).- Retire con cuidado los medios de exposición vertiendo el contenido en una bandeja de recolección.
- Añadir 100 μL de solución de trabajo MTT por pocillo utilizando una micropipeta multicanal. Incubar la placa a 28 °C durante 4 h.
- Deseche la solución MTT vertiendo el contenido en una bandeja de recolección.
- Añadir 100 μL por pocillo de DMSO para extraer los cristales de formazan, incubando la placa en un agitador de placas durante 10 min. Mida la absorbancia a 570 nm utilizando un lector de placas.
NOTA: Se debe realizar una segunda lectura a 690 nm para excluir cualquier absorbancia de huellas dactilares de fondo en la placa. Es importante señalar que los productos químicos de ensayo pueden interferir con el MTT, que debe ser evaluado para garantizar la calidad de los datos generados32. Para ello, se deben exponer pocillos libres de células que contengan las concentraciones de prueba y MTT (0,5 mg / ml), seguidos de incubación para observar cualquier cambio de color en los pocillos que pueda aumentar la absorbancia y conducir a resultados de viabilidad falsos. Los productos químicos que interactúan con MTT deben evitarse en esta prueba.
6. Cálculo de la viabilidad celular/citotoxicidad
NOTA: La absorbancia bruta o fluorescencia adquirida se utiliza para calcular la viabilidad celular como un porcentaje relacionado con el control negativo (para sustancias de ensayo preparadas directamente en medios de exposición) o el control de disolventes (para sustancias químicas de ensayo preparadas con disolventes, como el DMSO). Antes de determinar el porcentaje de viabilidad celular, los datos sin procesar deben ser normalizados por el control en blanco.
- Calcular la absorbancia o fluorescencia media para cada concentración química de ensayo y grupo de control (tres pocillos/tratamiento).
- Para determinar el porcentaje de viabilidad celular en relación con el control (negativo o solvente), use la ecuación (2):
 (2)
(2)
NOTA: Las unidades de absorbancia (abs) o fluorescencia (fluo) representan la media de absorbancia o fluorescencia medida en los tres pocillos por concentración; El blanco representa pozos sin celdas.
Resultados
La figura 3 muestra las placas de los ensayos AB, CFDA-AM, NR y MTT. Para el ensayo AB (Figura 3A), los pocillos en blanco y los pocillos sin células viables o con un número reducido de ellas muestran color azul y baja fluorescencia, mientras que los pocillos con un alto número de células viables son rosados y presentan altos valores de fluorescencia debido a la transformación de resazurina (AB) en resorufina (sustancia rosada) por las células viables. Par...
Discusión
Los ensayos de citotoxicidad son ampliamente utilizados para la evaluación de toxicidad in vitro, y este artículo del protocolo presenta cuatro ensayos de citotoxicidad comúnmente utilizados modificados para ser realizados en líneas celulares de pez cebra (es decir, densidad celular para placa de 96 pocillos, tiempo de incubación en el ensayo MTT, agotamiento de FBS durante la condición de exposición química y concentración máxima aceptable para el SC). Como estos ensayos cuantifican la citotoxicidad p...
Divulgaciones
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
En memoria del Dr. Márcio Lorencini, coautor de este trabajo, excelente investigador en el campo de la cosmética y dedicado a promover la investigación cosmética en Brasil. Los autores agradecen al Laboratorio Multiusuario del Departamento de Fisiología (UFPR) por la disponibilidad de equipos y por el apoyo financiero de la Coordinación para el Perfeccionamiento del Personal de Enseñanza Superior (CAPES, Brasil) (Código de Finanzas 001) y del Grupo Boticario.
Materiales
| Name | Company | Catalog Number | Comments |
| 5-CFDA, AM (5-Carboxyfluorescein Diacetate, Acetoxymethyl Ester) | Invitrogen | C1345 | |
| Cell culture plate, 96 well plate | Sarstedt | 83.3924 | Surface: Standard, flat base |
| DMEM | Gibco | 12800-017 | Powder, high glucose, pyruvate |
| FBS - Fetal Bovine Serum, qualified, USDA-approved regions | Gibco | 12657-029 | |
| Ham's F-12 Nutrient Mix, powder | Gibco | 21700026 | Powder |
| HEPES (1 M) | Gibco | 15630080 | |
| Leibovitz's L-15 Medium | Gibco | 41300021 | Powder |
| Neutral red | Sigma-Aldrich | N4638 | Powder, BioReagent, suitable for cell culture |
| Orbital shaker | Warmnest | KLD-350-BI | 22 mm rotation diameter |
| Dulbeccos PBS (10X) with calcium and magnesium | Invitrogen | 14080055 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| Resazurin sodium salt | Sigma-Aldrich | R7017 | Powder, BioReagent, suitable for cell culture |
| RPMI 1640 Medium | Gibco | 31800-014 | Powder |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | Powder, bioreagent for molecular biology |
| Thiazolyl Blue Tetrazolium Bromide 98% | Sigma-Aldrich | M2128 | |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Trypsin-EDTA (0.5%), no phenol red | Gibco | 15400054 | |
| ZEM2S cell line | ATCC | CRL-2147 | This cell line was kindly donated by Professor Dr. Michael J. Carvan (University of Wisconsin, Milwaukee, USA) |
| ZFL cell line | BCRJ | 256 |
Referencias
- ECHA. Non-Animal Approaches-Current Status of Regulatory Applicability Under the REACH, CLP and Biocidal Products Regulations. ECHA. , (2017).
- Alternative Methods Accepted by US Agencies. National Toxicology Program, and US Department of Health and Human Services Available from: https://ntp.niehs.nih.gov/whatwestudy/niceatm/accept-methods/index.html (2022)
- Schirmer, K. Proposal to improve vertebrate cell cultures to establish them as substitutes for the regulatory testing of chemicals and effluents using fish. Toxicology. 224 (3), 163-183 (2006).
- Scholz, S., et al. Alternatives to in vivo tests to detect endocrine disrupting chemicals (EDCs) in fish and amphibians-screening for estrogen, androgen and thyroid hormone disruption. Critical Reviews in Toxicology. 43 (1), 45-72 (2013).
- Tanneberger, K., et al. Predicting fish acute toxicity using a fish gill cell line-based toxicity assay. Environmental Science & Technology. 47 (2), 1110-1119 (2013).
- Roesler, R., Lorencini, M., Pastore, G. Brazilian cerrado antioxidant sources: cytotoxicity and phototoxicity in vitro. Food Science and Technology. 30, 814-821 (2010).
- Ruyra, A., et al. Zebrafish liver (ZFL) cells are able to mount an anti-viral response after stimulation with Poly (I:C). Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology. 182, 55-63 (2015).
- Natsch, A., Laue, H., Haupt, T., von Niederhäusen, V., Sanders, G. Accurate prediction of acute fish toxicity of fragrance chemicals with the RTgill-W1 cell assay. Environmental Toxicology and Chemistry. 37 (3), 931-941 (2018).
- Freshney, R. I. Cytotoxicity. Culture of Animal Cells: A Manual of Basic Technique. , (2005).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- O'Brien, J., Wilson, I., Orton, T., Pognan, F. Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity. European Journal of Biochemistry. 267 (17), 5421-5426 (2000).
- Gonzalez, R. J., Tarloff, J. B. Evaluation of hepatic subcellular fractions for Alamar blue and MTT reductase activity. Toxicology In Vitro. 15 (3), 257-259 (2001).
- Borenfreund, E., Puerner, J. A. Toxicity determined in vitro by morphological alterations and neutral red absorption. Toxicology Letters. 24 (2-3), 119-124 (1985).
- Repetto, G., del Peso, A., Zurita, J. L. Neutral red uptake assay for the estimation of cell viability/cytotoxicity. Nature Protocols. 3 (7), 1125-1131 (2008).
- Kamiloglu, S., Sari, G., Ozdal, T., Capanoglue, E. Guidelines for cell viability assays. Food Frontiers. 1 (3), 332-349 (2020).
- Water Quality-Determination of Acute Toxicity of Water Samples and Chemicals to a Fish Gill Cell Line (RTgill-W1) (ISO 21115:2019). International Organization for Standardization Available from: https://www.iso.org/standar/69933.html (2019)
- Organisation for Economic Co-operation and Development. . Test Guideline No. 249: Fish Cell Line Acute Toxicity-The RTgill-W1 Cell Line Assay. OECD Guidelines for the Testing of Chemicals, Section 2. Effects on Biotic Systems. , (2021).
- Lungu-Mitea, S., Lundqvist, J. Potentials and pitfalls of transient in vitro reporter bioassays: interference by vector geometry and cytotoxicity in recombinant zebrafish cell lines. Archives of Toxicology. 94 (8), 2769-2784 (2020).
- Lungu-Mitea, S., Han, Y., Lundqvist, J. Development, scrutiny, and modulation of transient reporter gene assays of the xenobiotic metabolism pathway in zebrafish hepatocytes. Cell Biology and Toxicology. , 1-23 (2021).
- Schirmer, K., Chan, A. G., Greenberg, B. M., Dixon, D. G., Bols, N. C. Methodology for demonstrating and measuring the photocytotoxicity of fluoranthene to fish cells in culture. Toxicology In Vitro. 11 (1-2), 107-119 (1997).
- Lungu-Mitea, S., et al. Modeling bioavailable concentrations in zebrafish cell lines and embryos increases the correlation of toxicity potencies across test systems. Environmental Science & Technology. 55 (1), 447-457 (2021).
- Cavalcante, D. G. S. M., et al. Cytotoxic, biochemical and genotoxic effects of biodiesel produced by different routes on ZFL cell line. Toxicology In Vitro. 28 (6), 1117-1125 (2014).
- Meng, Q., Yeung, K., Chan, K. M. Toxic effects of octocrylene on zebrafish larvae and liver cell line (ZFL). Aquatic Toxicology. 236, 105843 (2021).
- Kwok, M. L., Chan, K. M. Oxidative stress and apoptotic effects of copper and cadmium in the zebrafish liver cell line ZFL. Toxicology Reports. 7, 822-835 (2020).
- Yang, J., Chan, K. M. Evaluation of the toxic effects of brominated compounds (BDE-47, 99, 209, TBBPA) and bisphenol A (BPA) using a zebrafish liver cell line, ZFL. Aquatic Toxicology. 159, 138-147 (2015).
- Bradford, C. S., Sun, L., Collodi, P., Barnes, D. W. Cell cultures from zebrafish embryos and adult tissues. Journal of Tissue Culture Methods. 16 (2), 99-107 (1994).
- He, S., et al. Genetic and transcriptome characterization of model zebrafish cell lines. Zebrafish. 3 (4), 441-453 (2006).
- Mansoury, M., Hamed, M., Karmustaji, R., Al Hannan, F., Safrany, S. T. The edge effect: A global problem. The trouble with culturing cells in 96-well plates. Biochemistry and Biophysics Reports. 26, 100987 (2021).
- Funk, D., Schrenk, H. -. H., Frei, E. Serum albumin leads to false-positive results in the XTT and the MTT assay. BioTechniques. 43 (2), 178 (2007).
- Dayeh, V. R., Bols, N. C., Tanneberger, K., Schirmer, K., Lee, L. E. J. The use of fish-derived cell lines for investigation of environmental contaminants: An update following OECD's fish toxicity testing framework no. 171. Current Protocols in Toxicology. 1, (2013).
- Stepanenko, A. A., Dmitrenko, V. V. Pitfalls of the MTT assay: Direct and off-target effects of inhibitors can result in over/underestimation of cell viability. Gene. 574 (2), 193-203 (2015).
- Ulukaya, E., Colakogullari, M., Wood, E. J. Interference by anti-cancer chemotherapeutic agents in the MTT-tumor chemosensitivity assay. Chemotherapy. 50 (1), 43-50 (2004).
- Sebaugh, J. L. Guidelines for accurate EC50/IC50 estimation. Pharmaceutical Statistics. 10 (2), 128-134 (2011).
- Weimer, M., et al. The impact of data transformations on concentration-response modeling. Toxicology Letters. 213 (2), 292-298 (2012).
- Green, J. W., Holbech, T. A., Henrik, Chapter 4: Analysis of Continuous Data (Regression). Statistical Analysis of Ecotoxicity Studies. , (2018).
- Proença, S., et al. Effective exposure of chemicals in in vitro cell systems: A review of chemical distribution models. Toxicology In Vitro. 73, 105133 (2021).
- Guidony, N. S., et al. ABC proteins activity and cytotoxicity in zebrafish hepatocytes exposed to triclosan. Environmental Pollution. 271, 116368 (2021).
- da Silva, N. D. G., et al. Interference of goethite in the effects of glyphosate and Roundup® on ZFL cell line. Toxicology In Vitro. 65, 104755 (2020).
- Yang, Y., et al. Temperature is a key factor influencing the invasion and proliferation of Toxoplasma gondii in fish cells. Experimental Parasitology. 217, 107966 (2020).
- Lopes, F. M., Sandrini, J. Z., Souza, M. M. Toxicity induced by glyphosate and glyphosate-based herbicides in the zebrafish hepatocyte cell line (ZF-L). Ecotoxicology and Environmental Safety. 162, 201-207 (2018).
- Lachner, D., Oliveira, L. F., Martinez, C. B. R. Effects of the water soluble fraction of gasoline on ZFL cell line: Cytotoxicity, genotoxicity and oxidative stress. Toxicology In Vitro. 30, 225-230 (2015).
- Morozesk, M., et al. Effects of multiwalled carbon nanotubes co-exposure with cadmium on zebrafish cell line: Metal uptake and accumulation, oxidative stress, genotoxicity and cell cycle. Ecotoxicology and Environmental Safety. 202, 110892 (2020).
- Dognani, G., et al. Nanofibrous membranes for low-concentration Cr VI adsorption: kinetic, thermodynamic and the influence on ZFL cells viability. Materials Research. , 24 (2021).
- ZEM2S (ATCC®CRL-2147™). American Type Culture Collection Available from: https://www.atcc.org/products/crl-2147 (2023)
- Chen, Y., et al. Acute toxicity of the cationic surfactant C12-benzalkonium in different bioassays: how test design affects bioavailability and effect concentrations. Environmental Toxicology and Chemistry. 33 (3), 606-615 (2014).
- Pomponio, G., et al. In vitro kinetics of amiodarone and its major metabolite in two human liver cell models after acute and repeated treatments. Toxicology In Vitro. 30, 36-51 (2015).
- Mori, M., Wakabayashi, M. Cytotoxicity evaluation of chemicals using cultured fish cells. Water Science and Technology. 42 (7-8), 277-282 (2000).
- Caminada, D., Escher, C., Fent, K. Cytotoxicity of pharmaceuticals found in aquatic systems: comparison of PLHC-1 and RTG-2 fish cell lines. Aquatic Toxicology. 79 (2), 114-123 (2006).
- Giltrap, M., et al. In vitro screening of organotin compounds and sediment extracts for cytotoxicity to fish cells. Environmental Toxicology and Chemistry. 30 (1), 154-161 (2011).
- Hollert, H., Duerr, M., Erdinger, L., Braunbeck, T. Cytotoxicity of settling particulate matter and sediments of the Neckar River (Germany) during a winter flood. Environmental Toxicology and Chemistry. 19 (3), 528-534 (2000).
- Pannetier, P., et al. Toxicity assessment of pollutants sorbed on environmental sample microplastics collected on beaches: Part I-adverse effects on fish cell line. Environmental Pollution. 248, 1088-1097 (2019).
- Ternjej, I., Srček, V. G., Mihaljević, Z., Kopjar, N. Cytotoxic and genotoxic effects of water and sediment samples from gypsum mining area in channel catfish ovary (CCO) cells. Ecotoxicology and Environmental Safety. 98, 119-127 (2013).
- Hamid, R., Rotshteyn, Y., Rabadi, L., Parikh, R., Bullock, P. Comparison of alamar blue and MTT assays for high throughput screening. Toxicology In Vitro. 18 (5), 703-710 (2004).
- Vistica, D. T., et al. Tetrazolium-based assays for cellular viability: a critical examination of selected parameters affecting formazan production. Cancer Research. 51 (10), 2515-2520 (1991).
- Knauer, K., Lampert, C., Gonzalez-Valero, J. Comparison of in vitro and in vivo acute fish toxicity in relation to toxicant mode of action. Chemosphere. 68 (8), 1435-1441 (2007).
- Stadnicka-Michalak, J., Tanneberger, K., Schirmer, K., Ashauer, R. Measured and modeled toxicokinetics in cultured fish cells and application to in vitro-in vivo toxicity extrapolation. PLoS One. 9 (3), 92303 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados