JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Zebrafish 세포주를 이용한 세포독성 분석
요약
이 프로토콜은 96웰 플레이트에서 제브라피쉬 배아(ZEM2S) 및 간(ZFL) 세포주의 세포독성 평가에 적합한 일반적으로 사용되는 세포독성 분석(Alamar Blue[AB], CFDA-AM, Neutral Red 및 MTT 분석)을 제시합니다.
초록
어류 세포주는 생태 독성 연구에 점점 더 많이 사용되고 있으며, 어류 급성 독성을 예측하는 방법으로 세포 독성 분석이 제안되었습니다. 따라서 이 프로토콜은 96웰 플레이트에서 제브라피쉬(Danio rerio) 배아(ZEM2S) 및 간(ZFL) 세포주에서 세포 생존율을 평가하기 위해 수정된 세포독성 분석을 제시합니다. 평가된 세포독성 종점은 미토콘드리아 완전성(Alamar Blue[AB] 및 MTT 분석), 에스테라아제 활성을 통한 막 완전성(CFDA-AM 분석) 및 리소좀 막 완전성(Neutral Red[NR] 분석)입니다. 96-웰 플레이트에서 시험 물질을 노출시킨 후, 세포독성 분석이 수행되고; 여기서, AB 및 CFDA-AM은 동시에 수행되고, 동일한 플레이트에서 NR이 수행되고, MTT 분석은 별도의 플레이트에서 수행된다. 이러한 분석에 대한 판독값은 AB 및 CFDA-AM에 대한 형광과 MTT 및 NR에 대한 흡광도로 측정됩니다. 이러한 어류 세포주로 수행된 세포독성 분석은 어류에 대한 화학 물질의 급성 독성을 연구하는 데 사용할 수 있습니다.
서문
화학 물질은 인체 건강 및 환경에 대한 안전성에 대해 테스트해야합니다. 분자 및 세포 바이오마커는 생체 내 부작용(예: 내분비 교란, 면역학적 반응, 급성 독성, 광독성)3,4,5,6,7 에 선행할 수 있기 때문에 규제 기관 및/또는 법률(예: REACH, OECD, US EPA)에 의해 살아있는 유기체에 대한 영향을 예측하기 위한 안전성 평가에서 점점 더 많이 고려되고 있습니다 . 이러한 맥락에서, 세포 독성은 어류 급성 독성을 예측하기위한 측정으로 취해졌다 5,8; 그러나 어류에 대한 가장 다양한 영향 (예 : 내분비 교란 효과)을 연구하기 위해 화학 물질의 아 세포 독성 농도를 정의하는 것과 같은 생태 독성 연구에서 많은 다른 응용 프로그램을 가질 수 있습니다.
세포 배양 시스템 (시험관 내 시스템)에서 화학 물질의 세포 독성은 종점 유형이 다른 방법으로 결정할 수 있습니다. 예를 들어, 세포독성 방법은 세포 사멸 과정 동안 관찰된 특정 형태와 관련된 종말점을 기반으로 할 수 있는 반면, 다른 방법은 세포 사멸, 생존력 및 기능, 형태, 에너지 대사, 세포 부착 및 증식의 측정에 의해 세포독성을 결정할 수 있습니다. 화학 물질은 다양한 메커니즘을 통해 세포 생존율에 영향을 미칠 수 있으므로 화학적 효과를 예측하기 위해서는 다양한 세포 생존 종점을 포괄하는 세포 독성 평가가 필요하다9.
MTT 및 Alamar Blue(AB)는 세포 대사 활성에 따라 세포 생존율에 미치는 영향을 결정하는 분석법입니다. 상기 MTT 분석은 미토콘드리아 효소인 숙시네이트 탈수소효소10의 활성을 평가한다. 황색을 띤 3-[4,5-디메틸티아졸-2일]-2,5-디페닐테트라졸륨 브로마이드(MTT)가 포르마잔 블루로 환원되는 것은 생존 세포에서만 발생하며, 광학 밀도는 생존 세포 수에 정비례한다(10). AB 분석은 살아있는 세포에 의해 레사주린을 레소루핀으로 환원시킬 때 형광을 발하고 색을 변화시키는 미토콘드리아 효소에 의해 매개되는 민감한 산화-환원 지표입니다11; 그러나 세포질 및 마이크로솜 효소도 AB 및 MTT12의 감소에 기여합니다. 이러한 효소에는 알코올 및 알데히드 산화환원효소, NAD(P)H: 퀴논 산화환원효소, 플라빈 환원효소, NADH 탈수소효소 및 시토크롬과 같은 여러 환원효소가 포함될 수 있다11.
중성 적색(NR) 분석은 이 염료를 생존 세포의 리소좀에 혼입시키는 것을 기초로 하는 세포 생존율 분석이다13. NR의 흡수는 pH 구배를 유지하는 세포의 능력에 달려 있습니다. 리소좀 내부의 양성자 구배는 세포질보다 낮은 pH를 유지합니다. 정상적인 생리학적 pH에서 NR은 세포막을 투과할 수 있는 약 0의 순 전하를 나타냅니다. 따라서 염료는 전하를 띠고 리소좀 내부에 유지됩니다. 결과적으로, 잔류 NR의 양이 많을수록, 생존 가능한 세포(14)의 수가 많아진다. 세포 표면이나 리소좀 막을 손상시키는 화학 물질은이 염료의 흡수를 손상시킵니다.
CFDA-AM 분석은 5-카르복시플루오레세인 디아세테이트 아세톡시메틸 에스테르(CFDA-AM)15의 보존을 기반으로 하는 형광 측정 세포 생존율 분석법입니다. 에스테라제 기질인 5-CFDA-AM은 살아있는 세포의 막에 의해 극성이고 불투과성인 형광 물질인 카르복시플루오레세인으로 전환됩니다15; 따라서 손상되지 않은 세포막의 안쪽에 유지되어 생존 가능한 세포를 나타냅니다.
최근에는 검증된 ISO(국제표준화기구) 가이드라인(ISO 21115:2019)16 및 OECD(경제협력개발기구) 시험법(OECD TG 249)에서 3가지 세포독성 분석법(CFDA-AM, NR, AB 분석법)을 결합하여 24웰 플레이트에서 RTgill-W1 세포주(무지개 송어[Oncorhynchus mykiss] 아가미의 영구 세포주)를 사용하여 어류 급성 독성을 평가했습니다17 . 어류의 급성 독성을 예측하는 기존의 세포 기반 방법이 있지만 다른 어종과 유사한 방법을 개발하고 방법의 처리량을 늘리기 위해 노력했습니다. 몇 가지 예로는 특정 독성 경로18,19에 대한 리포터 유전자로 형질감염된 ZFL 세포주의 개발, RTgill-W1 세포주에서의 광독성 테스트(20), ZFL 및 ZF4 세포주(1일 된 배아에서 유래한 제브라피쉬 섬유아세포)의 사용을 포함하여 여러 세포독성 분석에 의한 독성을 평가한다21.
Danio rerio (제브라 피쉬)는 수생 독성 연구에 사용되는 주요 어종 중 하나입니다. 따라서 어류 독성 테스트를 위해 제브라피쉬 세포주를 사용한 세포 기반 방법이 매우 유용할 수 있습니다. ZFL 세포주는 간 실질 세포의 주요 특징을 나타내며 생체 이물을 대사할 수 있는 제브라피쉬 상피 간세포 세포주입니다 7,22,23,24,25. 한편, ZEM2S 세포주는 어류26,27에 대한 발달 효과를 조사하는 데 사용할 수 있는 배아 배반포 단계에서 유래한 배아 제브라피쉬 섬유아세포 세포주입니다. 따라서 이 프로토콜은 96웰 플레이트에서 ZFL 및 ZEM2S 세포주로 수행할 수정과 함께 4가지 세포독성 분석(MTT, AB, NR 및 CFDA-AM 분석)을 설명합니다.
프로토콜
참고: 이 프로토콜에 사용된 재료 목록은 재료 표를 참조하고 이 프로토콜에 사용된 용액 및 매체의 구성은 표 1 을 참조하십시오.
1. ZFL 및 ZEM2S 세포 준비
- 80% 합류도를 갖는 ZFL 또는 ZEM2S 세포의 T75 플라스크로 시작하여,CO2 없이 28°C에서 각각의 완전한 배지에서 배양하였다.
- 플라스크에서 배양 배지를 제거하고 10mL의 1x 인산염 완충 식염수(PBS)(0.01M)를 첨가하여 세포를 세척합니다. 3mL의 1x 트립신(0.05% v/v, 0.5mM 트립신-EDTA)을 배양 플라스크에 추가합니다. 28°C에서 3분 동안 배양합니다.
- 플라스크를 가볍게 두드려 세포를 방출한 다음 플라스크에 완전한 배양 배지 3mL를 추가하여 트립신 소화를 중지합니다.
- 세포 현탁액을 15mL 원추형 원심분리 튜브로 옮기고 100× g 에서 5분 동안 원심분리합니다.
- 원심분리 후 상층액을 조심스럽게 제거하고 ZFL 또는 ZEM2S 세포용 완전 배지 1mL를 추가하고 마이크로피펫을 사용하여 펠릿을 재현탁합니다.
2. 트리판 블루 염료 배제에 의한 세포 계수
- 세포 현탁액 10μL와 트리판 블루 염료 10μL를 마이크로튜브에 추가하여 세포 수를 세고 생존력을 평가합니다. 세포 현탁액을 혼합하고 피펫을 사용하여 염색합니다.
- 그런 다음 이 혼합물(세포 현탁액 + 트리판 블루) 10μL를 노이바우어 챔버로 옮기고 생존 가능한 세포가 트리판 블루를 차지하지 않는 세포로 간주하여 챔버 모서리에 배치된 4개의 큰 사각형(사분면 Q)의 세포 수를 세습니다. 방정식 (1)을 사용하여 생존 가능한 세포의 수를 결정하십시오.
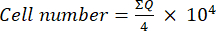 (1개)
(1개) - 식 (1)을 사용하여 결정된 세포 번호에 2 (트리판 블루 사용으로 인한 희석 계수)를 곱하여 세포 현탁액의 최종 세포 수를 계산합니다.
참고: 대안으로, 자동화된 세포 계수 시스템(예: 세포 계수 및 생존 기능이 있는 세포량체)을 사용할 수 있습니다.
3. 96웰 플레이트의 세포 도금
- 세포독성 분석을 수행하는 데 필요한 세포 수를 얻는 데 필요한 세포 현탁액 부피를 계산합니다. 각 세포주에 대한 생존 가능한 세포의 수는 다음과 같습니다.
- 웰 당 60,000개의 생존 가능한 ZEM2S 세포를 플레이트; 따라서 전체 플레이트에 대해 20mL의 완전 배지(200μL/웰, 96웰 플레이트)에 600만 개의 세포를 사용합니다.
- 웰 당 40,000개의 생존 가능한 ZFL 세포를 플레이트; 따라서 전체 플레이트에 대해 20mL의 완전 배지(200μL/웰, 96웰 플레이트)에 400만 개의 세포를 사용합니다.
- 그 후, 각 부피의 세포 현탁액을 시약 저장소(멸균)로 옮기고 ZFL 또는 ZEM2S용 완전 배양액을 20 mL로 채웁니다. 다중 채널 피펫을 사용하여 용액을 위아래로 부드럽게 혼합하십시오.
알림: 거품이나 기포가 생기지 않도록 주의하십시오. - 다채널 마이크로피펫을 사용하여 투명 폴리스티렌 96웰 플레이트의 각 웰에 세포 현탁액 200μL를 추가합니다. 플레이트를 28°C에서 24시간 동안 배양합니다.
알림: 플레이트에는 블랭크 컨트롤을 위한 셀이 없는 웰이 3개 이상 있어야 하며 이 웰에는 완전한 매체만 추가해야 합니다. 에지 효과(에지 웰에서의 더 높은 증발에 의해 야기됨)는 96-웰 플레이트 분석에서 통상적으로 발생하며, 플레이트(28)의 에지 웰 내의 세포의 생존력에 영향을 미칠 수 있다. 이 효과는 96-웰 플레이트 브랜드 및 설계(28)에 따라 더 높거나 낮을 수 있다. 가장자리 웰에서 ZFL 및 ZEM2S에 대한 세포 성장/생존 교란을 발견하지 못했지만, 이 효과를 방지하기 위해 플레이트를 파라필름 또는 접착 밀봉 호일로 밀봉하거나 60개의 내부 웰에서만 세포를 배양하고 가장자리 웰을 PBS로 채우는 것이 좋습니다.
4. 화학 물질을 시험하기 위한 세포 노출
- 다중 채널 마이크로 피펫을 사용하여 우물에서 사용한 배지를 조심스럽게 버립니다.
- 세포를 다른 농도의 화학 물질에 노출시킵니다. 소태아혈청(FBS) 없이 ZFL 또는 ZEM2S용 배양 배지(exposure media)에서 시험 화학물질 농도의 용액을 준비한다. 그런 다음 이러한 용액을 웰당 100μL를 기술적으로 삼중(즉, 3웰/테스트 화학 물질 농도)으로 추가합니다.
- 대조군의 경우 대조군을 테스트 화학 물질과 동일한 플레이트에 기술 삼중(3개의 웰/대조군)으로 배치합니다. 따라서, 블랭크 대조군(B)의 경우, 무세포 웰에 100 μL의 노출 배지를 추가하고, 음성 대조군(NC)의 경우, 100 μL의 노출 배지를 세포가 있는 웰에 추가하고, 양성 대조군(PC)의 경우, 노출 배지에서 제조된 1% Triton X-100의 용액에 세포를 노출시킨다. 일부 경우에, 용매 대조군 (SC)은 최종 용매 농도로서 명백히 비 세포 독성 농도를 고려하여 플레이트에 포함되어야한다.
참고: 0.5% DMSO를 용매로 사용하는 것이 좋습니다. DMSO는 음성 대조군과 관련된 세포독성 역치인 10%를 초과하지 않고 이들 세포주에서 용매로서 최대 1%까지 사용할 수 있다. - 플레이트를 28°C에서 24시간 동안 배양합니다. 배양 배지 증발을 방지하기 위해 파라필름 또는 접착 밀봉 호일로 플레이트를 밀봉합니다.
참고: 특정 화학 물질은 지표 염료의 흡광도 또는 형광을 방해할 수 있는 고유한 배경 흡광도 또는 형광을 가질 수 있습니다(예: 색이 있는 화합물은 흡광도, 혈청 알부민29 및 환원 효소를 방해하는 화합물에 영향을 미칠 수 있습니다30,31). 이 경우, 플레이트는 세포가없는 우물에 시험 화학 용액을 첨가하여 추가 제어를 포함해야합니다. 이는 염료와 화학적 자동 흡광도/자가 형광의 간섭 가능성을 확인하기 위한 것입니다. 간섭이 감지되면 세포 독성의 정확한 예측을 얻기 위해 간섭을 배제 할 수 있는지 여부를 평가해야합니다.
5. 세포독성 분석
알림: 표 1에 따라 모든 용액을 준비합니다. 아래에 설명 된 모든 단계 (그림 1)는 멸균 조건에서 수행됩니다. 피펫을 사용하여 노출 배지를 버리는 것은 화학 처리 후 세포가 웰에서 쉽게 분리될 수 있기 때문에 권장되지 않습니다.
- AB 및 CFDA-AM 어세이
- 테스트 화학 물질에 24시간 노출된 후 내용물을 수집 트레이에 부어 노출 매체를 조심스럽게 폐기합니다.
- 플레이트를 200 μL의 PBS로 세척한다. 세포 손실을 방지하기 위해 PBS를 수집 트레이에 부어 조심스럽게 제거합니다.
- AB/CFDA-AM 용액의 웰당 100 μL를 추가합니다. 플레이트를 28°C의 암실에서 30분 동안 인큐베이션한다.
- AB의 경우 530nm(여기) 및 595nm(방출), CFDA-AM의 경우 493nm(여기) 및 541nm(방출)에서 형광 플레이트 판독기의 형광을 측정합니다.
- NR 분석
참고: NR 분석 단계는 AB 및 CFDA-AM 분석 직후에 수행됩니다(그림 1).- NR 작업 용액(40μg/mL)을 600 ×g 에서 10분 동안 원심분리합니다.
알림: 튜브의 NR 침전이 플레이트로 전달되어서는 안 됩니다. 따라서, NR 작동 용액을 원심분리한 후, NR 침전물을 흡인하지 않고 피펫을 이용하여 상층액을 수집한다. 상청액을 시약 저장소로 옮깁니다. - 내용물을 수집 트레이에 부어 AB/CFDA-AM 용액을 조심스럽게 제거합니다.
- 멀티채널 마이크로피펫을 사용하여 NR 작업 용액의 웰당 100 μL를 추가합니다. 플레이트를 28°C에서 3시간 동안 인큐베이션합니다.
참고: 3시간 배양 후 현미경을 사용하여 플레이트에서 NR 침전이 발생했는지 관찰합니다. NR 침전물은 세포 생존율의 정량화를 방해할 수 있으며, 따라서, 이들은 존재해서는 안 된다. - 내용물을 수집 트레이에 부어 NR 용액을 조심스럽게 제거합니다. 웰 당 150 μL의 PBS를 첨가하여 웰을 세척한다.
- NR 추출 용액을 웰 당 150 μL를 첨가하고 플레이트 쉐이커에서 10분 동안 인큐베이션하여 부드럽게 진탕합니다. 플레이트 리더에서 540nm에서 흡광도를 측정합니다.
알림: 플레이트의 배경 지문 흡광도를 배제하기 위해 690nm에서 두 번째 판독을 수행해야 합니다.
- NR 작업 용액(40μg/mL)을 600 ×g 에서 10분 동안 원심분리합니다.
- MTT 어세이
참고: MTT 분석은 위에서 설명한 분석과 별도로 수행해야 합니다(새 플레이트에서)(그림 2).- 내용물을 수집 트레이에 부어 노출 미디어를 조심스럽게 제거합니다.
- 멀티채널 마이크로피펫을 사용하여 웰당 100μL의 MTT 작업 용액을 추가합니다. 플레이트를 28°C에서 4시간 동안 배양합니다.
- MTT 용액을 수거 트레이에 쏟아 부어 폐기합니다.
- 웰 당 100 μL의 DMSO를 첨가하여 포르마잔 결정을 추출하고, 플레이트를 플레이트 쉐이커에서 10분 동안 인큐베이션한다. 플레이트 리더를 사용하여 570nm에서 흡광도를 측정합니다.
알림: 플레이트의 배경 지문 흡광도를 배제하기 위해 690nm에서 두 번째 판독을 수행해야 합니다. 테스트 화학물질이 MTT를 방해할 수 있다는 점에 유의하는 것이 중요하며, 이는 생성된 데이터(32)의 품질을 보장하기 위해 평가되어야 한다. 이를 위해 테스트 농도와 MTT(0.5mg/mL)가 포함된 cell-free 웰을 노출시킨 다음 배양하여 흡광도를 증가시키고 잘못된 생존 결과를 초래할 수 있는 웰의 색상 변화를 관찰해야 합니다. 이 테스트에서는 MTT와 상호 작용하는 화학 물질을 피해야 합니다.
6. 세포 생존율/세포독성 계산
참고: 획득한 원시 흡광도 또는 형광은 음성 대조군(노출 배지에서 직접 준비된 테스트 화학 물질의 경우) 또는 용매 제어(DMSO와 같은 용매를 사용하여 준비된 테스트 화학 물질의 경우)와 관련된 백분율로 세포 생존율을 계산하는 데 사용됩니다. 세포 생존율 백분율을 결정하기 전에 원시 데이터는 블랭크 컨트롤에 의해 정규화되어야 합니다.
- 각 테스트 화학 물질 농도 및 대조군(3개의 웰/처리)에 대한 평균 흡광도 또는 형광을 계산합니다.
- 세포 생존율을 결정하려면tage 대조군(음성 또는 용매)과 비교하여 방정식 (2)를 사용합니다.
 (2개)
(2개)
참고: 흡광도(abs) 또는 형광(fluo) 단위는 농도당 3개의 웰에서 측정된 흡광도 또는 형광의 평균을 나타냅니다. 공백은 세포가 없는 웰을 나타냅니다.
결과
그림 3은 AB, CFDA-AM, NR 및 MTT 분석의 플레이트를 보여줍니다. AB 분석(그림 3A)의 경우, 생존 세포가 없거나 감소된 블랭크 웰 및 웰은 청색과 낮은 형광을 나타내는 반면, 생존 세포 수가 많은 웰은 분홍빛을 띠고 생존 세포에 의해 레사주린(AB)이 레소루핀(분홍빛이 도는 물질)으로 변환되어 높은 형광 값을 나타냅니다. CFDA-AM 분석의 경우 플레이트의 웰 색...
토론
세포독성 분석은 시험관 내 독성 평가에 널리 사용되며, 이 프로토콜 기사에서는 제브라피쉬 세포주에서 수행되도록 변형된 4가지 일반적으로 사용되는 세포독성 분석(즉, 96웰 플레이트의 세포 밀도, MTT 분석의 배양 시간, 화학 노출 조건 동안의 FBS 고갈 및 SC에 대한 최대 허용 농도)을 제시합니다. 이러한 분석은 다양한 세포 생존 종점(대사 기능, 리소좀 막 무결성 및 세포막 무결성)에 의?...
공개
저자는 이해 상충을 선언하지 않습니다.
감사의 말
이 연구의 공동 저자 인 Márcio Lorencini 박사를 기리기 위해 화장품 분야의 우수한 연구원이자 브라질에서 화장품 연구를 촉진하는 데 전념했습니다. 저자는 장비 가용성에 대한 생리학과 (UFPR)의 다중 사용자 실험실과 고등 교육 인력 개선 조정 (CAPES, 브라질) (재정 코드 001) 및 Grupo Boticario의 재정 지원에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 5-CFDA, AM (5-Carboxyfluorescein Diacetate, Acetoxymethyl Ester) | Invitrogen | C1345 | |
| Cell culture plate, 96 well plate | Sarstedt | 83.3924 | Surface: Standard, flat base |
| DMEM | Gibco | 12800-017 | Powder, high glucose, pyruvate |
| FBS - Fetal Bovine Serum, qualified, USDA-approved regions | Gibco | 12657-029 | |
| Ham's F-12 Nutrient Mix, powder | Gibco | 21700026 | Powder |
| HEPES (1 M) | Gibco | 15630080 | |
| Leibovitz's L-15 Medium | Gibco | 41300021 | Powder |
| Neutral red | Sigma-Aldrich | N4638 | Powder, BioReagent, suitable for cell culture |
| Orbital shaker | Warmnest | KLD-350-BI | 22 mm rotation diameter |
| Dulbeccos PBS (10X) with calcium and magnesium | Invitrogen | 14080055 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| Resazurin sodium salt | Sigma-Aldrich | R7017 | Powder, BioReagent, suitable for cell culture |
| RPMI 1640 Medium | Gibco | 31800-014 | Powder |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | Powder, bioreagent for molecular biology |
| Thiazolyl Blue Tetrazolium Bromide 98% | Sigma-Aldrich | M2128 | |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Trypsin-EDTA (0.5%), no phenol red | Gibco | 15400054 | |
| ZEM2S cell line | ATCC | CRL-2147 | This cell line was kindly donated by Professor Dr. Michael J. Carvan (University of Wisconsin, Milwaukee, USA) |
| ZFL cell line | BCRJ | 256 |
참고문헌
- ECHA. Non-Animal Approaches-Current Status of Regulatory Applicability Under the REACH, CLP and Biocidal Products Regulations. ECHA. , (2017).
- Alternative Methods Accepted by US Agencies. National Toxicology Program, and US Department of Health and Human Services Available from: https://ntp.niehs.nih.gov/whatwestudy/niceatm/accept-methods/index.html (2022)
- Schirmer, K. Proposal to improve vertebrate cell cultures to establish them as substitutes for the regulatory testing of chemicals and effluents using fish. Toxicology. 224 (3), 163-183 (2006).
- Scholz, S., et al. Alternatives to in vivo tests to detect endocrine disrupting chemicals (EDCs) in fish and amphibians-screening for estrogen, androgen and thyroid hormone disruption. Critical Reviews in Toxicology. 43 (1), 45-72 (2013).
- Tanneberger, K., et al. Predicting fish acute toxicity using a fish gill cell line-based toxicity assay. Environmental Science & Technology. 47 (2), 1110-1119 (2013).
- Roesler, R., Lorencini, M., Pastore, G. Brazilian cerrado antioxidant sources: cytotoxicity and phototoxicity in vitro. Food Science and Technology. 30, 814-821 (2010).
- Ruyra, A., et al. Zebrafish liver (ZFL) cells are able to mount an anti-viral response after stimulation with Poly (I:C). Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology. 182, 55-63 (2015).
- Natsch, A., Laue, H., Haupt, T., von Niederhäusen, V., Sanders, G. Accurate prediction of acute fish toxicity of fragrance chemicals with the RTgill-W1 cell assay. Environmental Toxicology and Chemistry. 37 (3), 931-941 (2018).
- Freshney, R. I. Cytotoxicity. Culture of Animal Cells: A Manual of Basic Technique. , (2005).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- O'Brien, J., Wilson, I., Orton, T., Pognan, F. Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity. European Journal of Biochemistry. 267 (17), 5421-5426 (2000).
- Gonzalez, R. J., Tarloff, J. B. Evaluation of hepatic subcellular fractions for Alamar blue and MTT reductase activity. Toxicology In Vitro. 15 (3), 257-259 (2001).
- Borenfreund, E., Puerner, J. A. Toxicity determined in vitro by morphological alterations and neutral red absorption. Toxicology Letters. 24 (2-3), 119-124 (1985).
- Repetto, G., del Peso, A., Zurita, J. L. Neutral red uptake assay for the estimation of cell viability/cytotoxicity. Nature Protocols. 3 (7), 1125-1131 (2008).
- Kamiloglu, S., Sari, G., Ozdal, T., Capanoglue, E. Guidelines for cell viability assays. Food Frontiers. 1 (3), 332-349 (2020).
- Water Quality-Determination of Acute Toxicity of Water Samples and Chemicals to a Fish Gill Cell Line (RTgill-W1) (ISO 21115:2019). International Organization for Standardization Available from: https://www.iso.org/standar/69933.html (2019)
- Organisation for Economic Co-operation and Development. . Test Guideline No. 249: Fish Cell Line Acute Toxicity-The RTgill-W1 Cell Line Assay. OECD Guidelines for the Testing of Chemicals, Section 2. Effects on Biotic Systems. , (2021).
- Lungu-Mitea, S., Lundqvist, J. Potentials and pitfalls of transient in vitro reporter bioassays: interference by vector geometry and cytotoxicity in recombinant zebrafish cell lines. Archives of Toxicology. 94 (8), 2769-2784 (2020).
- Lungu-Mitea, S., Han, Y., Lundqvist, J. Development, scrutiny, and modulation of transient reporter gene assays of the xenobiotic metabolism pathway in zebrafish hepatocytes. Cell Biology and Toxicology. , 1-23 (2021).
- Schirmer, K., Chan, A. G., Greenberg, B. M., Dixon, D. G., Bols, N. C. Methodology for demonstrating and measuring the photocytotoxicity of fluoranthene to fish cells in culture. Toxicology In Vitro. 11 (1-2), 107-119 (1997).
- Lungu-Mitea, S., et al. Modeling bioavailable concentrations in zebrafish cell lines and embryos increases the correlation of toxicity potencies across test systems. Environmental Science & Technology. 55 (1), 447-457 (2021).
- Cavalcante, D. G. S. M., et al. Cytotoxic, biochemical and genotoxic effects of biodiesel produced by different routes on ZFL cell line. Toxicology In Vitro. 28 (6), 1117-1125 (2014).
- Meng, Q., Yeung, K., Chan, K. M. Toxic effects of octocrylene on zebrafish larvae and liver cell line (ZFL). Aquatic Toxicology. 236, 105843 (2021).
- Kwok, M. L., Chan, K. M. Oxidative stress and apoptotic effects of copper and cadmium in the zebrafish liver cell line ZFL. Toxicology Reports. 7, 822-835 (2020).
- Yang, J., Chan, K. M. Evaluation of the toxic effects of brominated compounds (BDE-47, 99, 209, TBBPA) and bisphenol A (BPA) using a zebrafish liver cell line, ZFL. Aquatic Toxicology. 159, 138-147 (2015).
- Bradford, C. S., Sun, L., Collodi, P., Barnes, D. W. Cell cultures from zebrafish embryos and adult tissues. Journal of Tissue Culture Methods. 16 (2), 99-107 (1994).
- He, S., et al. Genetic and transcriptome characterization of model zebrafish cell lines. Zebrafish. 3 (4), 441-453 (2006).
- Mansoury, M., Hamed, M., Karmustaji, R., Al Hannan, F., Safrany, S. T. The edge effect: A global problem. The trouble with culturing cells in 96-well plates. Biochemistry and Biophysics Reports. 26, 100987 (2021).
- Funk, D., Schrenk, H. -. H., Frei, E. Serum albumin leads to false-positive results in the XTT and the MTT assay. BioTechniques. 43 (2), 178 (2007).
- Dayeh, V. R., Bols, N. C., Tanneberger, K., Schirmer, K., Lee, L. E. J. The use of fish-derived cell lines for investigation of environmental contaminants: An update following OECD's fish toxicity testing framework no. 171. Current Protocols in Toxicology. 1, (2013).
- Stepanenko, A. A., Dmitrenko, V. V. Pitfalls of the MTT assay: Direct and off-target effects of inhibitors can result in over/underestimation of cell viability. Gene. 574 (2), 193-203 (2015).
- Ulukaya, E., Colakogullari, M., Wood, E. J. Interference by anti-cancer chemotherapeutic agents in the MTT-tumor chemosensitivity assay. Chemotherapy. 50 (1), 43-50 (2004).
- Sebaugh, J. L. Guidelines for accurate EC50/IC50 estimation. Pharmaceutical Statistics. 10 (2), 128-134 (2011).
- Weimer, M., et al. The impact of data transformations on concentration-response modeling. Toxicology Letters. 213 (2), 292-298 (2012).
- Green, J. W., Holbech, T. A., Henrik, Chapter 4: Analysis of Continuous Data (Regression). Statistical Analysis of Ecotoxicity Studies. , (2018).
- Proença, S., et al. Effective exposure of chemicals in in vitro cell systems: A review of chemical distribution models. Toxicology In Vitro. 73, 105133 (2021).
- Guidony, N. S., et al. ABC proteins activity and cytotoxicity in zebrafish hepatocytes exposed to triclosan. Environmental Pollution. 271, 116368 (2021).
- da Silva, N. D. G., et al. Interference of goethite in the effects of glyphosate and Roundup® on ZFL cell line. Toxicology In Vitro. 65, 104755 (2020).
- Yang, Y., et al. Temperature is a key factor influencing the invasion and proliferation of Toxoplasma gondii in fish cells. Experimental Parasitology. 217, 107966 (2020).
- Lopes, F. M., Sandrini, J. Z., Souza, M. M. Toxicity induced by glyphosate and glyphosate-based herbicides in the zebrafish hepatocyte cell line (ZF-L). Ecotoxicology and Environmental Safety. 162, 201-207 (2018).
- Lachner, D., Oliveira, L. F., Martinez, C. B. R. Effects of the water soluble fraction of gasoline on ZFL cell line: Cytotoxicity, genotoxicity and oxidative stress. Toxicology In Vitro. 30, 225-230 (2015).
- Morozesk, M., et al. Effects of multiwalled carbon nanotubes co-exposure with cadmium on zebrafish cell line: Metal uptake and accumulation, oxidative stress, genotoxicity and cell cycle. Ecotoxicology and Environmental Safety. 202, 110892 (2020).
- Dognani, G., et al. Nanofibrous membranes for low-concentration Cr VI adsorption: kinetic, thermodynamic and the influence on ZFL cells viability. Materials Research. , 24 (2021).
- ZEM2S (ATCC®CRL-2147™). American Type Culture Collection Available from: https://www.atcc.org/products/crl-2147 (2023)
- Chen, Y., et al. Acute toxicity of the cationic surfactant C12-benzalkonium in different bioassays: how test design affects bioavailability and effect concentrations. Environmental Toxicology and Chemistry. 33 (3), 606-615 (2014).
- Pomponio, G., et al. In vitro kinetics of amiodarone and its major metabolite in two human liver cell models after acute and repeated treatments. Toxicology In Vitro. 30, 36-51 (2015).
- Mori, M., Wakabayashi, M. Cytotoxicity evaluation of chemicals using cultured fish cells. Water Science and Technology. 42 (7-8), 277-282 (2000).
- Caminada, D., Escher, C., Fent, K. Cytotoxicity of pharmaceuticals found in aquatic systems: comparison of PLHC-1 and RTG-2 fish cell lines. Aquatic Toxicology. 79 (2), 114-123 (2006).
- Giltrap, M., et al. In vitro screening of organotin compounds and sediment extracts for cytotoxicity to fish cells. Environmental Toxicology and Chemistry. 30 (1), 154-161 (2011).
- Hollert, H., Duerr, M., Erdinger, L., Braunbeck, T. Cytotoxicity of settling particulate matter and sediments of the Neckar River (Germany) during a winter flood. Environmental Toxicology and Chemistry. 19 (3), 528-534 (2000).
- Pannetier, P., et al. Toxicity assessment of pollutants sorbed on environmental sample microplastics collected on beaches: Part I-adverse effects on fish cell line. Environmental Pollution. 248, 1088-1097 (2019).
- Ternjej, I., Srček, V. G., Mihaljević, Z., Kopjar, N. Cytotoxic and genotoxic effects of water and sediment samples from gypsum mining area in channel catfish ovary (CCO) cells. Ecotoxicology and Environmental Safety. 98, 119-127 (2013).
- Hamid, R., Rotshteyn, Y., Rabadi, L., Parikh, R., Bullock, P. Comparison of alamar blue and MTT assays for high throughput screening. Toxicology In Vitro. 18 (5), 703-710 (2004).
- Vistica, D. T., et al. Tetrazolium-based assays for cellular viability: a critical examination of selected parameters affecting formazan production. Cancer Research. 51 (10), 2515-2520 (1991).
- Knauer, K., Lampert, C., Gonzalez-Valero, J. Comparison of in vitro and in vivo acute fish toxicity in relation to toxicant mode of action. Chemosphere. 68 (8), 1435-1441 (2007).
- Stadnicka-Michalak, J., Tanneberger, K., Schirmer, K., Ashauer, R. Measured and modeled toxicokinetics in cultured fish cells and application to in vitro-in vivo toxicity extrapolation. PLoS One. 9 (3), 92303 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유