A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
توليد كرويات الورم 3D لدراسات تقييم المخدرات
* These authors contributed equally
In This Article
Summary
توضح هذه المقالة طريقة موحدة لبناء كرويات الورم ثلاثية الأبعاد. كما تم وصف استراتيجية للمراقبة الكروية وتحليل التعلم العميق القائم على الصور باستخدام نظام التصوير الآلي.
Abstract
في العقود الأخيرة ، بالإضافة إلى الخلايا المستزرعة أحادية الطبقة ، تم تطوير كرويات الورم ثلاثية الأبعاد كأداة قوية محتملة لتقييم الأدوية المضادة للسرطان. ومع ذلك ، فإن طرق الاستزراع التقليدية تفتقر إلى القدرة على التعامل مع كرويات الورم بطريقة متجانسة على المستوى ثلاثي الأبعاد. لمعالجة هذا القيد ، في هذه الورقة ، نقدم طريقة مريحة وفعالة لبناء كرويات الورم متوسطة الحجم. بالإضافة إلى ذلك ، نصف طريقة للتحليل القائم على الصور باستخدام برنامج التحليل القائم على الذكاء الاصطناعي الذي يمكنه مسح اللوحة بأكملها والحصول على بيانات عن كرويات ثلاثية الأبعاد. تمت دراسة العديد من المعلمات. باستخدام طريقة قياسية لبناء كروي الورم ونظام تصوير وتحليل عالي الإنتاجية ، يمكن زيادة فعالية ودقة اختبارات الأدوية التي يتم إجراؤها على كرويات ثلاثية الأبعاد بشكل كبير.
Introduction
السرطان هو أحد الأمراض التي يخشاها البشر ، لأسباب ليس أقلها ارتفاع معدل الوفيات1. في السنوات الأخيرة ، زادت إمكانية علاج السرطان حيث تم إدخال علاجات جديدة2،3،4،5. تستخدم النماذج ثنائية الأبعاد (2D) وثلاثية الأبعاد (3D) في المختبر لدراسة السرطان في بيئة معملية. ومع ذلك ، لا يمكن لنماذج 2D تقييم جميع المعلمات المهمة التي تشير إلى حساسية مضادة للأورام على الفور وبدقة ؛ لذلك ، فشلوا في التمثيل الكامل للتفاعلات في الجسم الحي في اختبار العلاج الدوائي6.
منذ عام 2020 ، تم تعزيز سوق الثقافة العالمية ثلاثية الأبعاد (3D) بشكل كبير. وفقا لأحد التقارير الصادرة عن NASDAQ OMX ، ستتجاوز القيمة العالمية لسوق زراعة الخلايا ثلاثية الأبعاد 2.7 مليار دولار أمريكي بحلول نهاية عام 2025. بالمقارنة مع طرق الثقافة 2D ، فإن زراعة الخلايا ثلاثية الأبعاد تعرض خصائص مفيدة ، والتي يمكن تحسينها ليس فقط للانتشار والتمايز ولكن أيضا للبقاء على المدى الطويل 7,8. بهذه الوسائل ، يمكن محاكاة البيئات الدقيقة الخلوية في الجسم الحي للحصول على توصيف أكثر دقة للورم ، وكذلك التنميط الأيضي ، بحيث يمكن فهم التغيرات الجينومية والبروتينية بشكل أفضل. ونتيجة لذلك ، يجب الآن تضمين أنظمة اختبار 3D في عمليات تطوير الأدوية السائدة ، خاصة تلك التي تركز على فحص وتقييم الأدوية الجديدة المضادة للأورام. تمتلك النموات ثلاثية الأبعاد لخطوط الخلايا الراسخة الخالدة أو مزارع الخلايا الأولية في الهياكل الكروية في الجسم الحي سمات الأورام مثل نقص الأكسجة واختراق الأدوية ، بالإضافة إلى تفاعل الخلايا والاستجابة والمقاومة ، ويمكن اعتبارها نموذجا صارما وتمثيليا لأداء فحص المخدرات في المختبر 9،10،11.
ومع ذلك ، فإن نماذج ثقافة 3D هذه تعاني أيضا من العديد من المشكلات التي قد تستغرق بعض الوقت لحلها. يمكن تشكيل كرويات الخلية باستخدام هذه البروتوكولات ، لكنها تختلف في تفاصيل معينة ، مثل وقت المزرعة أو تضمين المواد الهلامية12 ، لذلك لا يمكن التحكم في هذه الكرويات الخلوية المبنية بشكل جيد في نطاق حجم محدود. قد يؤثر حجم الأجسام الكروية على اتساق اختبار الجدوى وتحليل التصوير. تختلف أيضا البيئات الدقيقة للنمو وعوامل النمو ، مما قد يؤدي إلى أشكال مختلفة بسبب الاختلافات في التمايز بين الخلايا13. هناك الآن حاجة واضحة لطريقة قياسية وبسيطة وفعالة من حيث التكلفة لبناء جميع أنواع الأورام بأحجام خاضعة للرقابة.
من منظور آخر ، على الرغم من تطوير المقايسات المتجانسة وأساليب التصوير عالية المحتوى لتقييم التشكل والجدوى ومعدل النمو ، إلا أن الفحص عالي الإنتاجية لنماذج 3D لا يزال يمثل تحديا لأسباب مختلفة تم الإبلاغ عنها في الأدبيات ، مثل عدم التوحيد في موضع وحجم ومورفولوجيا كرويات الورم14،15،16.
في البروتوكول المقدم هنا ، ندرج كل خطوة في بناء كرويات الورم 3D ونصف طريقة لمراقبة وتحليل كروية باستخدام نظام تصوير عالي الإنتاجية وعالي المحتوى يتضمن التركيز التلقائي والتصوير التلقائي والتحليل ، من بين خصائص مفيدة أخرى. نظهر كيف يمكن لهذه الطريقة إنتاج كرويات الورم 3D ذات الحجم الموحد المناسبة للتصوير عالي الإنتاجية. تظهر هذه الكرويات أيضا حساسية عالية لعلاج أدوية السرطان ، ويمكن مراقبة التغيرات المورفولوجية في الكائنات الكروية باستخدام التصوير عالي المحتوى. باختصار ، نظهر متانة هذه المنهجية كوسيلة لتوليد تركيبات الورم 3D لأغراض تقييم المخدرات.
Protocol
1. بناء كروي
- معالجة مضادة للالتصاق للوحة الثقافة
- ماصة 100 ميكرولتر من الكاشف المضاد للالتصاق في كل بئر من صفيحة 48 بئر مع قاع بئر على شكل حرف U ، واحتفظ بها لمدة 10 دقائق. بعد 10 دقائق ، قم بشفط كاشف الطلاء ، واغسله مرتين باستخدام برنامج تلفزيوني معقم.
- ضع لوحة الاستزراع في حاضنة (37 درجة مئوية في الهواء المرطب مع 5٪ CO2) حتى الاستخدام.
- تحضير الخلايا وجمعها وعدها
- استخدم وسط المزرعة الخاص بالخلايا لزراعة الخلايا في قوارير زراعة الخلايا (الجدول التكميلي 2). على سبيل المثال ، يتم استزراع خلايا NCI-H23 و CT-26 في RPMI 1640 ، ويتم زراعة خلايا HT-29 في وسط McCoy's 5A. يتم استكمال هاتين الوسائطين بنسبة 10٪ FBS معطلة بالحرارة و 1٪ P / S ، على التوالي.
- الحفاظ على جميع الخلايا في ظروف الاستزراع القياسية (37 درجة مئوية في الهواء المرطب مع 5٪ CO2) أثناء الانتشار. هنا ، يتم استخدام خط الخلية NCI-H23 كمثال في الخطوات التالية.
- اغسل الخلايا المزروعة في قارورة T25 مرتين باستخدام 1x PBS لإزالة وسط الثقافة (من الأفضل اختيار الخلايا في المرحلة اللوغاريتمية وتمرير الخلايا عند التقاء 80٪ -90٪).
- عالج الخلايا الموسعة ب 1 مل من 0.25٪ تربسين / EDTA لمدة 1-2 دقيقة في حاضنة عند 37 درجة مئوية ، 5٪ CO2. قم بتأكيد شكل الخلية (عادة ما يكون دائريا في هذه الحالة) تحت المجهر ، ثم أوقف علاج التربسين. للقيام بذلك ، قم بشفط معلق التربسين / EDTA المستخدم في قارورة T25 ، واغسل الخلايا ب 4 مل من الوسط الطازج.
- انقل كل المعلق (5 مل) إلى أنبوب سعة 15 مل. استخدم 1 مل من الوسط الطازج لغسل الخلايا المتبقية وإضافتها إلى الأنبوب. أجهزة الطرد المركزي الخلايا في 186.48 × ز لمدة 5 دقائق في درجة حرارة الغرفة.
- قم بإزالة المادة الطافية وأضف 10 مل من الوسط الطازج إلى حبيبات الخلية ، متبوعا بسحب لطيف حتى تصبح الخلايا في تعليق متجانس.
- نضح 0.1 مل من تعليق الخلية في أنبوب طرد مركزي جديد ، أضف 0.9 مل من الوسط الطازج ، ثم ماصة التعليق جيدا.
- استخراج 10 ميكرولتر من تعليق الخلية لعد الخلايا. نفذ هذه العملية مرتين أو ثلاث مرات وخذ قيمة متوسطة.
- قم بتخفيف المعلق للوصول إلى كثافة بذر نهائية تبلغ 50000 خلية / مل ، وفقا للتركيز الذي تم الحصول عليه من عملية عد الخلايا في الخطوة 1.2.7.
- زراعة الخلايا وتشكيل كروية
- أضف 200 ميكرولتر من تعليق الخلية إلى كل بئر من صفيحة قاع U ذات 48 بئرا.
- لف فيلم الختم حول اللوحة وجهاز الطرد المركزي عند 119.35 × جم لمدة 5 دقائق في درجة حرارة الغرفة.
- أخرج اللوحة بعناية من جهاز الطرد المركزي واسحب الفيلم الواقي. ثم أضف 5-8 مل من الماء المعقم إلى قناة المياه المحيطة بالآبار (لمنع التبخر) واحتضانها عند 37 درجة مئوية لمدة 5 أيام. لا تقم بتغيير / تكملة أي مياه إلى قناة المياه خلال هذه الفترة.
- مراقبة تجميع الخلايا خلال أيام 5 التالية.
ملاحظة: بشكل عام ، تبدأ الخلايا في التكتل كمستعمرات في غضون 5 أيام. ومع ذلك ، قد تكون عملية البناء الكروي أسرع أو أبطأ مع أنواع الخلايا المختلفة وكثافات الخلايا. نتيجة لهذا ، يجب مراقبة الخلايا كل يوم باستخدام إحدى الطرق الثلاث الممكنة. أولا ، يمكن ملاحظة الخلايا من خلال الجزء السفلي من لوحة البئر. عندما لا تكون الخلايا كروية بعد ، يمكن رؤية طبقة واحدة من الخلايا في الأسفل. عندما تشكل الخلايا كروية ، يمكن ملاحظة بنية 3D كثيفة في قاع U لكل بئر. طريقة أخرى تنطوي على فحص الخلايا تحت المجهر. عندما تصبح الخلايا ورم كروي ، يتضمن البناء ثلاث طبقات (طبقة متكاثرة ، طبقة غير نشطة ، ونواة نخرية ، من الخارج إلى داخل الكروية) ، والتي لها تدرج شفاف. أخيرا ، يمكن أيضا استخدام لون وسط الثقافة لأغراض الملاحظة. يمكن أن يكون هذا مفيدا عندما لا يمكن رؤية الهيكل ثلاثي الطبقات بوضوح ، حتى باستخدام المجهر الرقمي. عندما يتحول الوسيط من اللون الأرجواني والأحمر إلى الأصفر ، يمكن أن تبدأ عملية تضمين الأجسام الكروية في الجل. لا ينبغي استبدال الوسيط خلال فترة تجميع الخلايا.
- جل التضمين
ملاحظة: يجب تخزين المواد الهلامية عند درجة حرارة أقل من -20 درجة مئوية. على وجه الخصوص ، يجب وضع المواد الهلامية بعيدا عن باب الثلاجة لتجنب تقلبات درجات الحرارة. لاحظ أن المواد الهلامية في حالة مجمدة في هذه المرحلة من العملية.- خذ الجل المجمد من الثلاجة -20 درجة مئوية وضعه على صندوق ثلج طوال الوقت أثناء التجربة.
- مراقبة كرويات الخلية تحت المجهر. قبل أن يبدأ تضمين الجل ، يجب فحص حالة الأجسام الكروية مرة أخرى باستخدام مجهر رقمي.
- قم بإزالة 150 ميكرولتر من الوسط بعناية. يجب أيضا وضع اللوحة على صندوق الثلج.
- قم بتضمين كل كروي في الجل عن طريق إضافة الجل السائل ببطء من جانب جدار البئر أثناء تحريك طرف الماصة المبرد مسبقا حول البئر وداخله. انتظر لمدة 5 دقائق وإذا لم ينتشر الجل بالتساوي ، ماصة الجل برفق بطرف ماصة 10 ميكرولتر. يحتوي كل بئر على ورم كروي ، 25 ميكرولتر من 3.5 ملغ / مل هلام ، و 50 ميكرولتر من وسط الاستزراع الكامل. أضف 75 ميكرولتر من الوسط إلى عناصر التحكم أيضا.
ملاحظة: يحتوي كل بئر على كروي واحد. - احتضان الطبق على حرارة 37 درجة مئوية لمدة 30 دقيقة حتى يكتمل الهلام المائي بالكامل. تأكيد حالة الهلام تحت المجهر.
- تراكب 125 ميكرولتر من الوسط الطازج على كل عينة.
- ثقافة كروية لمدة 7-10 أيام أخرى. قم بإعداد مجموعات من الأجسام الكروية مع أربعة إلى ستة آبار لكل منها واختر ثلاثة منها على الأقل للتحليل.
ملاحظة: في حالة إجراء اختبار المخدرات ، قم بإعداد مجموعتين لعينة واحدة. يتم استخدام مجموعة واحدة لاختبار الجدوى ، بينما يتم استخدام المجموعة الأخرى لالتقاط الصور وتحليلها.
2. العلاج من تعاطي المخدرات
- حل الدواء وفقا لتعليمات الشركة الصانعة. إعداد حلول عمل 100x باستخدام DMSO. تحضير ما لا يقل عن خمس جرعات من الدواء في التخفيف التسلسلي. هنا ، يتم استخدام الدواء العلاجي لسرطان الرئة ، AMG 510 ، كمثال. ويرد التكوين في الجدول التكميلي 1.
- استخدم 0.1٪ DMSO كعنصر تحكم إيجابي.
- أضف 125 ميكرولتر من الوسط المعالج بالأدوية إلى كل بئر وضع اللوحة مرة أخرى في الحاضنة (37 درجة مئوية في الهواء المرطب مع 5٪ CO2). في هذه المرحلة ، يحتوي كل بئر على ورم كروي ، 25 ميكرولتر من 3.5 مجم / مل جل ، و 175 ميكرولتر من الوسط. تحتوي عناصر التحكم على 200 ميكرولتر من الوسط.
3. جدوى كروية
- قم بقياس صلاحية الكروية باستخدام مجموعة مقايسة Alamar Blue وفقا لإرشادات الشركة المصنعة. قم بقياس الصلاحية باستخدام مقياس ضوئي للصفائح الدقيقة (امتصاص عند 570 نانومتر و 600 نانومتر) بعد إجراء معالجة Alamar Blue.
- قم بقياس الصلاحية في اليوم 1 واليوم 4 واليوم 7 واليوم 10 بعد تضمين الكائنات الكروية في الجل ، على التوالي ، أو كما هو موضح.
ملاحظة: عند استخدام مقايسة Alamar Blue ، يلزم 16 ساعة على الأقل من وقت التفاعل. لذلك ، أضف 20 ميكرولتر من Alamar Blue في فترة ما بعد الظهر من اليوم 0 واليوم 3 واليوم 6 واليوم 9. - نضح 100 ميكرولتر من الوسط الطافي من كل بئر إلى لوحة اختبار جديدة وإضافة 80 ميكرولتر من الوسط الطازج إلى كل بئر من لوحة الاستزراع. ثم استبدل 100 ميكرولتر أخرى من الوسط المعالج بالعقاقير. تأكد من عدم وجود بقايا من العمار الأزرق في البئر.
ملاحظة: يتم إجراء استبدال متوسط في كل مرة يتم فيها اختبار الصلاحية ، ويجب استبدال الوسط المعالج بالعقاقير لمجموعات تحليل التصوير في نفس اليوم.
4. مراقبة كروية وتحليل التعلم العميق من خلال الصور في اختبار المخدرات
- التصوير
- نضح 100 ميكرولتر من الوسط قبل التصوير.
- ضع اللوحة على المسرح. احصل على صور رقمية للكرويات باستخدام مجهر آلي بهدف 10x (هدف 2x أولا). يمكن للمجهر تركيز هذه الكرويات ومركزيتها تلقائيا.
ملاحظة: تم الإبلاغ سابقا عن وظيفة التركيز البؤري التلقائي والخوارزمية المستخدمة بواسطة Yazdanfar et al.17. - انتظر التصوير التلقائي. يتم الحصول على أربع صور لكل كروي. يتم تشكيل صورة متكاملة ومعالجتها باستخدام البرنامج المتصل بنظام التصوير عالي المحتوى.
- انقر فوق الزر "عملية تصحيح الصورة" واختر الصور المدمجة في البرنامج.
- اختر "نموذج U-NET" ، واكتب معدل التحويل (الصور الموضوعية 10x لها معدل تحويل 3.966). انقر في الجزء السفلي من الشاشة أدناه ، لبدء معالجة الصور. بعد ذلك ، احفظ بيانات القطر والمحيط والخشونة في برنامج جداول البيانات.
- احسب مؤشر المحيط الزائد (EPI). EPI هي النسبة بين المحيط الكروي (P 0) والمحيط المكافئ (Pe) ، كما تم حسابه بواسطة Eq. 1. قم بقياس مساحة الكرة عند المستوى البؤري (S) باستخدام الصورة J. ثم احسب المحيط المكافئ للكرة باستخدام مكافئ 2.
EPI = (P o− P e)/Pe (مكافئ 1)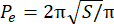 (مكافئ 2)
(مكافئ 2)
ملاحظة: يتم إنشاء محيط كروي بواسطة البرنامج باستخدام خوارزميات التعلم العميق بناء على نموذج U-NET المطور. - أضف 100 ميكرولتر من الوسط الطازج مع الدواء وضع اللوحة مرة أخرى في الحاضنة (37 درجة مئوية في الهواء المرطب مع 5٪ CO2).
- تثبيط كروي
- احسب تثبيط نمو الورم (TGI) باستخدام مكافئ 3. الحجم الكروي النسبي (RTV) هو الحجم الطرفي على الحجم الأصلي (مكافئ 4). يتم حساب حجم الكرة (V) تلقائيا بواسطة البرنامج باستخدام Eq. 5 وفقا لخرج قطر الكرة الأرضية.
TGI = (التحكم في RTV -معالجة RTV) /التحكم في RTV × 100٪ (مكافئ 3)
RTV =طرف V /V أصلي (مكافئ 4)
V = 4/3π (د / 2) 3 (مكافئ 5)
ملاحظة: يتم الحصول على TGI بالإشارة إلى تثبيط النمو في الجسم الحي ، ويتم استبدال أوزان الورم ب RTV. التحكم في RTV هو الحجم الكروي النسبي للمجموعة الضابطة ،وعلاج RTV هو الحجم الكروي النسبي للمجموعة التي تم اختبارها ،ومحطة V هي حجم الكروي في اليوم الأخير ، و Vالأصلي هو حجم الكروي في يوم الثقافة الأول ، و d يمثل قطر الكرة الأرضية.
- احسب تثبيط نمو الورم (TGI) باستخدام مكافئ 3. الحجم الكروي النسبي (RTV) هو الحجم الطرفي على الحجم الأصلي (مكافئ 4). يتم حساب حجم الكرة (V) تلقائيا بواسطة البرنامج باستخدام Eq. 5 وفقا لخرج قطر الكرة الأرضية.
النتائج
يوضح الشكل 1 أ ، ب العملية المستخدمة لبناء كرويات الورم في هذه الدراسة. قمنا أولا بزرع الخلايا في صفيحة قاع U ذات 48 بئرا. هذه الخطوة هي تقريبا نفس الخطوة المستخدمة في ثقافة الخلايا 2D. احتفظنا بالصفيحة في حاضنة مشتركة مع المياه المحيطة بالآبار بحيث بدأت الخلايا المتر...
Discussion
تلعب البيئة المكروية دورا مهما في نمو الورم. قد يؤثر على توفير المصفوفات خارج الخلية ، وتدرجات الأكسجين ، والتغذية ، والتفاعل الميكانيكي ، وبالتالي يؤثر على التعبير الجيني ، ومسارات الإشارة ، والعديد من وظائف الخلايا السرطانية19،20،21. في ?...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
نشكر جميع أعضاء مختبراتنا على مدخلاتهم واقتراحاتهم الهامة. تم دعم هذا البحث من قبل المشروع الرئيسي للجنة جيانغسو للصحة (K2019030). تم إجراء التصور من قبل C.W. و Z.C. ، وتم تنفيذ المنهجية بواسطة W.H. و M.L. ، وتم إجراء التحقيق بواسطة W.H. و M.L. ، وتم تنفيذ تنظيم البيانات بواسطة W.H. ، Z.Z. ، S.X. ، و M.L. ، وتم تنفيذ إعداد المسودة الأصلية بواسطة Z.Z. ، J.Z. ، S.X. ، W.H. ، و X.L. ، تم إجراء المراجعة والتحرير بواسطة Z.C. ، وتم تنفيذ إدارة المشروع بواسطة C.W. و Z.C. ، وتم إجراء الاستحواذ على التمويل بواسطة C.W. قرأ جميع المؤلفين النسخة المنشورة من المخطوطة ووافقوا عليها.
Materials
| Name | Company | Catalog Number | Comments |
| 0.5-10 μL Pipette tips | AXYGEN | T-300 | |
| 1.5 mL Boil proof microtubes | Axygen | MCT-150-C | |
| 100-1000μL Pipette tips | KIRGEN | KG1313 | |
| 15 mL Centrifuge Tube | Nest | 601052 | |
| 200 μL Pipette tips | AXYGEN | T-200-Y | |
| 3D gel | Avatarget | MA02 | |
| 48-well U bottom Plate | Avatarget | P02-48UWP | |
| 50 mL Centrifuge Tube | Nest | 602052 | |
| Alamar Blue | Thermo | DAL1100 | |
| Anti-Adherence Rinsing Solution | STEMCELL | #07010 | |
| Certified FBS | BI | 04-001-1ACS | |
| Deionized water | aladdin | W433884-500ml | |
| DMEM (Dulbecco's Modified Eagle Medium) | Gibco | 11965-092 | |
| DMSO | sigma | D2650-100ML | |
| Excel sofware | Microsoft office | ||
| Graphpad prism sofware | GraphPad software | ||
| High Content Imager and SMART system | Avatarget | 1-I01 | |
| Image J software | National Institutes of Health | ||
| Insulin-Transferrin-Selenium-A Supplement (100X) | Gibco | 51300-044 | |
| Parafilm | Bemis | PM-996 | |
| PBS | Solarbio | P1020 | |
| Penicillin/streptomycin Sol | Gibco | 15140-122 | |
| RPMI 1640 | Gibco | 11875-093 | |
| Scientific Fluoroskan Ascent | Thermo | Fluoroskan Ascent | |
| T25 Flask | JET Biofil | TCF012050 | |
| Trypsin, 0.25% (1X) | Hyclone | SH30042.01 |
References
- Carioli, G., et al. European cancer mortality predictions for the year 2021 with focus on pancreatic and female lung cancer. Annals of Oncology. 32 (4), 478-487 (2021).
- Katti, A., Diaz, B. J., Caragine, C. M., Sanjana, N. E., Dow, L. E. CRISPR in cancer biology and therapy. Nature Reviews Cancer. 22 (5), 259-279 (2022).
- Abrantes, R., Duarte, H. O., Gomes, C., Walchili, S., Reis, C. A. CAR-Ts: New perspectives in cancer therapy. FEBS Letter. 596 (4), 403-416 (2022).
- Shokooohi, A., et al. Effect of targeted therapy and immunotherapy on advanced nonsmall-cell lung cancer outcomes in the real world. Cancer Medicine. 11 (1), 86-93 (2022).
- Chen, K., Zhang, Y., Qian, L., Wang, P. Emerging strategies to target RAS signaling in human cancer therapy. Journal of Hematology & Oncology. 14 (1), 116 (2021).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Qin, Y., Hu, X., Fan, W., Yan, J. A stretchable scaffold with electrochemical sensing for 3D culture, mechanical loading, and real-time monitoring of cells. Advanced Science. 8 (13), 2003738 (2021).
- Wartenberg, M., et al. Regulation of the multidrug resistance transporter P-glycoprotein in multicellular tumor spheroids by hypoxia-inducible factor (HIF-1) ad reactive oxygen species. FASEB Journal. 17 (3), 503-505 (2003).
- Minchinton, A. I., Tannock, I. F. Drug penetration in solid tumours. Nature Reviews Cancer. 6 (8), 583-592 (2006).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension: How 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Brüningk, S. C., Rivens, I., Box, C., Oelfke, U., Ter Haar, G. 3D tumour spheroids for the prediction of the effects of radiation and hyperthermia treatments. Scientific Reports. 10, 1653 (2020).
- Graves, E. E., Maity, A., Thu Le, Q. The tumor microenvironment in non-small-cell lung cancer. Seminars in Radiation Oncology. 20 (3), 156-163 (2010).
- Kunz-Schughart, L. A., Frreyer, J. P., Ebner, R. The use of 3-D cultures for high-throughput screening: The multicellular spheroid model. Journal of Biomolecular Screening. 9 (4), 273-285 (2004).
- Carragher, N., et al. Concerns, challenges and promises of high-content analysis of 3D cellular models. Nature Review Drug Discovery. 17 (8), 606 (2018).
- Huang, Y., et al. Longitudinal morphological and physiological monitoring of three-dimensional tumor spheroids using optical coherence tomography. Journal of Visualized Experiments. (144), e59020 (2019).
- Yazdanfar, S., et al. Simple and robust image-baed autofocusing for digital microscopy. Optics Express. 16 (12), 8670-8677 (2008).
- Chen, Z., et al. Automated evaluation of tumor spheroid behavior in 3D culture using deep learning-based recognition. Biomaterials. 22 (272), 120770 (2021).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Frontiers in Immunology. 11, 603640 (2020).
- Anastasiou, D., et al. Microenvironment factors shaping the cancer metabolism landscape. British Journal of Cancer. 116 (3), 277-286 (2017).
- Zhou, H., et al. Functions and clinical significance of mechanical tumor microenvironment: Cancer cell sensing, mechanobiology and metastasis. Cancer Communications. 43 (5), 374-400 (2022).
- Zhu, G. G., et al. Targeting KRAS cancers: From druggable therapy to druggable resistance. Molecular Cancer. 21 (1), 159 (2022).
- Ando, Y., Mariano, C., Shen, K. Engineered in vitro tumor models for cell-based immunotherapy. Acta Biomaterialia. 132, 345-359 (2021).
- Timmins, N. E., Dietmair, S., Nielsen, L. K. Hanging-drop multicellular spheroids as a model of tumor angiogenesis. Angiogenesis. 7 (2), 97-103 (2004).
- Costa, E. C., et al. 3D tumor spheroids: An overview on the tools and techniques used for their analysis. Biotechnology Advances. 34 (8), 1427-1441 (2016).
- Sant, S., Johnston, P. A. The production of 3D tumor spheroids for cancer drug discovery. Drug Discovery Today. Technologies. 23, 27-36 (2017).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Scientific Reports. 6, 19103 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved