Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İlaç Değerlendirme Çalışmaları için 3D Tümör Sferoidlerinin Üretimi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu makalede, üç boyutlu tümör sferoidlerinin oluşturulması için standartlaştırılmış bir yöntem gösterilmektedir. Otomatik bir görüntüleme sistemi kullanarak küresel gözlem ve görüntü tabanlı derin öğrenme analizi için bir strateji de açıklanmaktadır.
Özet
Son yıllarda, tek katmanlı kültürlü hücrelere ek olarak, üç boyutlu tümör sferoidleri, antikanser ilaçların değerlendirilmesi için potansiyel olarak güçlü bir araç olarak geliştirilmiştir. Bununla birlikte, geleneksel kültür yöntemleri, tümör sferoidlerini üç boyutlu düzeyde homojen bir şekilde manipüle etme yeteneğinden yoksundur. Bu sınırlamayı ele almak için, bu yazıda, ortalama büyüklükteki tümör sferoidlerini oluşturmak için uygun ve etkili bir yöntem sunuyoruz. Ek olarak, tüm plakayı tarayabilen ve üç boyutlu sferoidler hakkında veri elde edebilen yapay zeka tabanlı analiz yazılımı kullanarak görüntü tabanlı bir analiz yöntemini açıklıyoruz. Çeşitli parametreler üzerinde çalışıldı. Standart bir tümör sferoid yapım yöntemi ve yüksek verimli bir görüntüleme ve analiz sistemi kullanılarak, üç boyutlu sferoidler üzerinde yapılan ilaç testlerinin etkinliği ve doğruluğu önemli ölçüde artırılabilir.
Giriş
Kanser, insanlar tarafından en çok korkulan hastalıklardan biridir, özellikle de yüksek ölüm oranı nedeniyle1. Son yıllarda, yeni tedavilerin tanıtılmasıyla kanseri tedavi etme olasılığı artmıştır 2,3,4,5. İki boyutlu (2D) ve üç boyutlu (3D) in vitro modeller, kanseri laboratuvar ortamında incelemek için kullanılır. Bununla birlikte, 2D modeller, antitümör duyarlılığını gösteren tüm önemli parametreleri hemen ve doğru bir şekilde değerlendiremez; Bu nedenle, ilaç tedavisi testinde in vivo etkileşimleri tam olarak temsil edemezler6.
2020'den bu yana, küresel üç boyutlu (3D) kültür pazarı büyük ölçüde artırıldı. NASDAQ OMX'in bir raporuna göre, 3D hücre kültürü pazarının küresel değeri 2025 yılı sonuna kadar 2,7 milyar doları aşacak. 2D kültür yöntemleri ile karşılaştırıldığında, 3D hücre kültürü, sadece çoğalma ve farklılaşma için değil, aynı zamanda uzun süreli sağkalım için de optimize edilebilen avantajlı özellikler sergiler 7,8. Bu sayede, genomik ve protein değişikliklerinin daha iyi anlaşılabilmesi için metabolik profillemenin yanı sıra daha doğru tümör karakterizasyonu elde etmek için in vivo hücresel mikro ortamlar simüle edilebilir. Bu nedenle, 3D test sistemleri artık ana akım ilaç geliştirme operasyonlarına, özellikle de yeni antitümör ilaçların taranması ve değerlendirilmesine odaklananlara dahil edilmelidir. Ölümsüzleştirilmiş yerleşik hücre hatlarının veya primer hücre kültürlerinin küresel yapılardaki üç boyutlu büyümeleri, hipoksi ve ilaç penetrasyonu gibi tümörlerin in vivo özelliklerinin yanı sıra hücre etkileşimi, yanıtı ve direncine sahiptir ve in vitro ilaç taraması 9,10,11 gerçekleştirmek için sıkı ve temsili bir model olarak kabul edilebilir.
Bununla birlikte, bu 3D kültür modelleri, çözülmesi biraz zaman alabilecek çeşitli problemlerden de muzdariptir. Hücre sferoidleri bu protokoller kullanılarak oluşturulabilir, ancak kültür zamanı veya jellerin gömülmesi12 gibi belirli ayrıntılarda farklılık gösterirler, bu nedenle bu yapılandırılmış hücre sferoidleri sınırlı bir boyut aralığında iyi kontrol edilemez. Sferoidlerin boyutu, canlılık testinin ve görüntüleme analizinin tutarlılığını etkileyebilir. Büyüme mikro ortamları ve büyüme faktörleri de değişir, bu da hücreler arasındaki farklılaşmadaki farklılıklar nedeniyle farklı morfolojilere yol açabilir13. Artık kontrollü boyutlarda her türlü tümörü oluşturmak için standart, basit ve uygun maliyetli bir yönteme ihtiyaç duyulmaktadır.
Başka bir açıdan bakıldığında, morfolojiyi, canlılığı ve büyüme hızını değerlendirmek için homojen tahliller ve yüksek içerikli görüntüleme yaklaşımları geliştirilmiş olmasına rağmen, 3D modellerin yüksek verimli taraması, tümör sferoidlerinin pozisyonunda, boyutunda ve morfolojisinde tekdüzelik eksikliği gibi literatürde bildirilen çeşitli nedenlerden dolayı bir zorluk olmaya devam etmektedir14,15,16.
Burada sunulan protokolde, 3D tümör sferoidlerinin yapımındaki her adımı listeliyoruz ve diğer avantajlı özelliklerin yanı sıra otomatik odaklama, otomatik görüntüleme ve analizi içeren yüksek verimli, yüksek içerikli bir görüntüleme sistemi kullanarak küresel gözlem ve analiz için bir yöntem açıklıyoruz. Bu yöntemin, yüksek verimli görüntüleme için uygun olan tek tip boyutta 3D tümör sferoidlerini nasıl üretebileceğini gösteriyoruz. Bu sferoidler ayrıca kanser ilacı tedavisine karşı yüksek duyarlılık gösterir ve sferoidlerdeki morfolojik değişiklikler yüksek içerikli görüntüleme kullanılarak izlenebilir. Özetle, bu metodolojinin sağlamlığını, ilaç değerlendirme amacıyla 3D tümör yapıları üretmenin bir aracı olarak gösteriyoruz.
Protokol
1. Küresel yapı
- Kültür plağının yapışma önleyici tedavisi
- U şeklinde kuyu tabanına sahip 48 delikli bir plakanın her bir kuyucuğuna 100 μL yapışma önleyici reaktif pipet edin ve 10 dakika bekletin. 10 dakika sonra, kaplama reaktifini aspire edin ve sterilize edilmiş PBS ile iki kez yıkayın.
- Kültür plakasını kullanıma kadar bir inkübatöre (% 5 CO2 ile nemlendirilmiş havada 37 ° C) koyun.
- Hücre hazırlama, toplama ve sayma
- Hücre kültürü şişelerindeki hücreleri kültürlemek için hücrelere özgü kültür ortamını kullanın (Ek Tablo 2). Örneğin, NCI-H23, CT-26 hücreleri RPMI 1640'ta kültürlenir ve HT-29 hücreleri McCoy'un 5A ortamında kültürlenir. Bu iki ortam sırasıyla% 10 ısı ile inaktive FBS ve% 1 P / S ile desteklenir.
- Proliferasyon sırasında tüm hücreleri standart kültür koşullarında (%5 CO2 ile nemlendirilmiş havada 37 °C) muhafaza edin. Burada, NCI-H23 hücre satırı aşağıdaki adımlarda örnek olarak kullanılmıştır.
- Kültür ortamını çıkarmak için bir T25 şişesinde kültürlenmiş hücreleri 1x PBS ile iki kez yıkayın (logaritmik fazdaki hücreleri seçmek ve hücreleri% 80 -% 90'lık bir birleşimde geçmek daha iyidir).
- Genişlemiş hücreleri 1 mL% 0.25 tripsin / EDTA ile 37 ° C'de bir inkübatörde 1-2 dakika boyunca,% 5 CO2 ile tedavi edin. Mikroskop altında hücre şeklini (bu durumda normalde dairesel) onaylayın ve ardından tripsin tedavisini durdurun. Bunu yapmak için, kullanılan tripsin / EDTA süspansiyonunu T25 şişesinde aspire edin ve hücreleri 4 mL taze ortam ile yıkayın.
- Tüm süspansiyonu (5 mL) 15 mL'lik bir tüpe aktarın. Artık hücreleri yıkamak ve tüpe eklemek için 1 mL taze ortam kullanın. Hücreleri oda sıcaklığında 5 dakika boyunca 186.48 x g'de santrifüj edin.
- Süpernatantı çıkarın ve hücre peletine 10 mL taze ortam ekleyin, ardından hücreler homojen bir süspansiyona girene kadar nazik pipetleme yapın.
- 0,1 mL hücre süspansiyonunu yeni bir santrifüj tüpüne aspire edin, 0,9 mL taze ortam ekleyin ve ardından süspansiyonu iyice pipetin.
- Hücre sayımı için hücre süspansiyonunun 10 μL'sini ayıklayın. Bu işlemi iki veya üç kez gerçekleştirin ve ortalama bir değer alın.
- Adım 1.2.7'deki hücre sayım işleminden elde edilen konsantrasyona göre, 50.000 hücre/mL'lik nihai tohumlama yoğunluğuna ulaşmak için süspansiyonu seyreltin.
- Hücre kültürü ve sferoid oluşumu
- 48 delikli bir U-taban plakasının her bir kuyucuğuna 200 μL hücre süspansiyonu ekleyin.
- Sızdırmazlık filmini plakanın etrafına sarın ve oda sıcaklığında 5 dakika boyunca 119.35 x g'de santrifüjleyin.
- Plakayı dikkatlice santrifüjden çıkarın ve koruyucu filmi çıkarın. Daha sonra, kuyuları çevreleyen su kanalına 5-8 mL sterilize su ekleyin (buharlaşmayı önlemek için) ve 5 gün boyunca 37 ° C'de inkübe edin. Bu süre zarfında su kanalına herhangi bir su değiştirmeyin/takviye etmeyin.
- Takip eden 5 gün boyunca hücre agregasyonunu gözlemleyin.
NOT: Genel olarak, hücreler 5 gün içinde koloniler halinde kümelenmeye başlar. Bununla birlikte, sferoid yapı süreci, farklı hücre tipleri ve hücre yoğunlukları ile daha hızlı veya daha yavaş olabilir. Bu nedenle, hücreler her gün üç olası yöntemden biri kullanılarak gözlemlenmelidir. İlk olarak, hücreler kuyu plakasının dibinden gözlemlenebilir. Hücreler henüz bir küre oluşturmadığında, altta tek bir hücre tabakası görülebilir. Hücreler bir küre oluşturduğunda, her bir kuyucuğun U-dibinde yoğun bir 3D yapı gözlemlenebilir. Başka bir yöntem, hücreleri mikroskop altında kontrol etmeyi içerir. Hücreler bir tümör sferoidi haline geldiğinde, yapı, şeffaflık gradyanına sahip üç katmanı (çoğalan bir tabaka, aktif olmayan bir tabaka ve sferoidin dışından içine nekrotik bir çekirdek) içerir. Son olarak, kültür ortamının rengi gözlemsel amaçlar için de kullanılabilir. Bu, üç katmanlı yapı dijital mikroskop kullanılarak bile açıkça görülemediğinde yardımcı olabilir. Ortam mor-kırmızıdan sarıya döndüğünde, sferoidleri jele gömme işlemi başlayabilir. Hücre agregasyon döneminde ortam değiştirilmemelidir.
- Jel gömme
NOT: Jellerin -20 °C'nin altındaki bir sıcaklıkta saklanması gerekir. Özellikle, sıcaklık dalgalanmalarını önlemek için jeller buzdolabı kapısından uzağa yerleştirilmelidir. Jellerin işlemin bu aşamasında donmuş halde olduğunu unutmayın.- Dondurulmuş jeli -20 ° C buzdolabından alın ve deney sırasında tüm süre boyunca bir buz kutusuna yerleştirin.
- Hücre sferoidlerini mikroskop altında gözlemleyin. Jel gömme başlamadan önce, sferoidlerin durumu tekrar dijital mikroskopla kontrol edilmelidir.
- Ortamın 150 μL'sini dikkatlice çıkarın. Plaka ayrıca buz kutusuna yerleştirilmelidir.
- Önceden soğutulmuş pipet ucunu kuyunun etrafında ve içinde hareket ettirirken sıvı jeli kuyunun duvar tarafından yavaşça ekleyerek her bir küreyi jelin içine gömün. 5 dakika bekleyin ve jel eşit şekilde yayılmazsa, jeli 10 μL pipet ucuyla hafifçe pipetin. Her kuyucuk bir tümör sferoidi, 25 μL 3.5 mg / mL jel ve 50 μL tam kültür ortamı içerir. Kontrollere 75 μL ortam da ekleyin.
NOT: Her kuyucuk bir küre içerir. - Hidrojelasyon tamamen tamamlanana kadar plakayı 37 ° C'de 30 dakika boyunca inkübe edin. Jelasyon durumunu mikroskop altında onaylayın.
- Her numune üzerine 125 μL taze ortam yerleştirin.
- Sferoidleri 7-10 gün daha kültürleyin. Her biri dört ila altı kuyucuklu sferoid grupları hazırlayın ve analiz için bunlardan en az üçünü seçin.
NOT: Bir uyuşturucu testi yapıyorsanız, bir numune için iki grup hazırlayın. Bir grup canlılık testi için kullanılırken, diğeri görüntü yakalama ve analiz için kullanılır.
2. İlaç tedavisi
- İlacı üreticinin talimatlarına göre çözün. DMSO ile 100x çalışma çözümleri hazırlayın. Seri seyreltmede ilacın en az beş dozunu hazırlayın. Burada, akciğer kanseri terapötik ilacı, AMG 510, örnek olarak kullanılmıştır. Kompozisyon Ek Tablo 1'de gösterilmiştir.
- Pozitif kontrol olarak% 0.1 DMSO kullanın.
- Her bir oyuğa 125 μL ilaçla muamele edilmiş ortam ekleyin ve plakayı tekrar inkübatöre yerleştirin (% 5 CO2 ile nemlendirilmiş havada 37 ° C). Bu aşamada, her kuyucuk bir tümör sferoidi, 25 μL 3.5 mg / mL jel ve 175 μL ortam içerir. Kontroller 200 μL ortam içerir.
3. Küresel canlılık
- Üreticinin yönergelerine göre bir Alamar Blue tahlil kiti kullanarak küresel canlılığı ölçün. Alamar Blue işlemi yapıldıktan sonra bir mikroplaka fotometre (570 nm ve 600 nm'de absorbans) kullanarak canlılığı ölçün.
- Sferoidleri jele gömdükten sonra veya belirtildiği gibi sırasıyla 1. gün, 4. gün, 7. gün ve 10. günde canlılığı ölçün.
NOT: Bir Alamar Blue testi kullanırken, en az 16 saat reaksiyona girme süresi gereklidir. Bu nedenle, 0. gün, 3. gün, 6. gün ve 9. günün öğleden sonralarına 20 μL Alamar Mavisi ekleyin. - Her bir kuyucuktan 100 μL süpernatant ortamı yeni bir test plakasına aspire edin ve kültür plakasının her bir kuyucuğuna 80 μL taze ortam ekleyin. Ardından, ilaçla muamele edilen ortamın başka bir 100 μL'sini değiştirin. Kuyuda Alamar Mavisi'nden kalıntı olmadığından emin olun.
NOT: Canlılığın test edildiği her durumda orta replasman yapılır ve görüntüleme-analiz gruplarının ilaçla tedavi edilen ortamının aynı gün içinde değiştirilmesi gerekir.
4. Uyuşturucu testindeki görüntüler aracılığıyla küresel gözlem ve derin öğrenme analizi
- Görüntüleme
- Görüntülemeden önce ortamın 100 μL'sini aspire edin.
- Plakayı sahneye yerleştirin. 10x objektife sahip otomatik bir mikroskop kullanarak sferoidlerin dijital görüntülerini elde edin (önce 2x hedef). Mikroskop bu küreleri otomatik olarak odaklayabilir ve merkezileştirebilir.
NOT: Otomatik odaklama fonksiyonu ve kullanılan algoritma daha önce Yazdanfar ve ark.17 tarafından bildirilmiştir. - Otomatik görüntülemeyi bekleyin. Her küre için dört görüntü elde edilir. Yüksek içerikli görüntüleme sistemine bağlı yazılım ile entegre bir görüntü oluşturulur ve işlenir.
- "Görüntü yama işlemi" düğmesine tıklayın ve yazılımdaki entegre görüntüleri seçin.
- "U-NET modeli"ni seçin ve dönüşüm oranını yazın (10x reklam verme amacı görsellerin dönüşüm oranı 3,966'dır). Görüntü işlemeyi başlatmak için aşağıdaki ekranın altına tıklayın. Ardından, çap, çevre ve pürüzlülük verilerini elektronik tablo yazılımına kaydedin.
- Fazla çevre indeksini (EPI) hesaplayın. EPI, Eq. 1 tarafından hesaplandığı gibi, küresel çevre (P 0) ve eşdeğer çevre (Pe) arasındaki orandır. Görüntü J'yi kullanarak odak düzlemindeki (S) küre alanını ölçün. Ardından, Eq. 2'yi kullanarak sferoidin eşdeğer çevresini hesaplayın.
EPI = (P o− P e)/Pe (Ek. 1)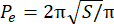 (Ek. 2)
(Ek. 2)
NOT: Küresel çevre, geliştirilen U-NET modeline dayanan derin öğrenme algoritmalarına sahip yazılım tarafından oluşturulur. - İlaçla birlikte 100 μL taze ortam ekleyin ve plakayı inkübatöre geri yerleştirin (% 5 CO2 ile nemlendirilmiş havada 37 ° C).
- Sferoid inhibisyon
- Eq 3 kullanarak tümör büyüme inhibisyonunu (TGI) hesaplayın. Göreli küresel hacim (RTV), orijinal birimin üzerindeki terminal hacmidir (Eq. 4). Küresel hacim (V), küresel çap çıkışına göre Eq. 5 kullanılarak yazılım tarafından otomatik olarak hesaplanır.
TGI = (RTV kontrolü− RTVtedavisi)/RTVkontrolü × %100 (Ek. 3)
RTV = Vterminali/Vorijinal (Ek. 4)
V = 4/3π(d/2)3 (Ek. 5)
NOT: TGI, in vivo büyüme inhibisyonuna atıfta bulunularak elde edilir ve tümör ağırlıkları RTV ile değiştirilir. RTVkontrolü , kontrol grubunun göreceli sferoid hacmidir, RTVtedavisi ilaç testi yapılan grubun göreceli sferoid hacmidir, Vterminali son gün sferoidin hacmidir, Vorijinali ilk kültür gününde sferoidin hacmidir ve d küresel çapı temsil eder.
- Eq 3 kullanarak tümör büyüme inhibisyonunu (TGI) hesaplayın. Göreli küresel hacim (RTV), orijinal birimin üzerindeki terminal hacmidir (Eq. 4). Küresel hacim (V), küresel çap çıkışına göre Eq. 5 kullanılarak yazılım tarafından otomatik olarak hesaplanır.
Sonuçlar
Şekil 1A,B, bu çalışmada tümör sferoidlerinin yapımında kullanılan süreci göstermektedir. İlk önce hücreleri 48 delikli bir U-dip plakasına tohumladık. Bu adım, 2D hücre kültüründe kullanılanla neredeyse aynıdır. Plakayı, kuyucukları çevreleyen su ile ortak bir inkübatörde tuttuk, böylece biriken hücreler kendi kendine montaj işleminde küreler oluşturmaya başladı. Normal çalışma koşulları altında, çoğu tümör sferoid tipi, hedefl...
Tartışmalar
Mikro çevre tümör büyümesinde önemli bir rol oynar. Hücre dışı matrislerin, oksijen gradyanlarının, beslenmenin ve mekanik etkileşimin sağlanmasını etkileyebilir ve böylece gen ekspresyonunu, sinyal yollarını ve tümör hücrelerinin birçok fonksiyonunu etkileyebilir 19,20,21. Birçok durumda, 2D hücreler bu tür etkiler üretmez, hatta zıt etkiler üretir, bu nedenle ilaç tedavilerinin değerlendirilmesin...
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Laboratuvarlarımızın tüm üyelerine eleştirel katkı ve önerileri için teşekkür ederiz. Bu araştırma, Jiangsu Sağlık Komisyonu Anahtar Projesi (K2019030) tarafından desteklenmiştir. Kavramsallaştırma C.W. ve Z.C. tarafından, metodoloji W.H. ve M.L. tarafından, araştırma W.H. ve M.L. tarafından, veri kürasyonu W.H., Z.Z., S.X. ve M.L. tarafından, orijinal taslak hazırlığı Z.Z., J.Z., S.X., W.H. tarafından gerçekleştirilmiştir. ve X.L., inceleme ve düzenleme Z.C. tarafından, proje yönetimi C.W. ve Z.C. tarafından gerçekleştirilmiş ve finansman alımı C.W. tarafından gerçekleştirilmiştir. Tüm yazarlar makalenin yayınlanmış versiyonunu okumuş ve kabul etmişlerdir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.5-10 μL Pipette tips | AXYGEN | T-300 | |
| 1.5 mL Boil proof microtubes | Axygen | MCT-150-C | |
| 100-1000μL Pipette tips | KIRGEN | KG1313 | |
| 15 mL Centrifuge Tube | Nest | 601052 | |
| 200 μL Pipette tips | AXYGEN | T-200-Y | |
| 3D gel | Avatarget | MA02 | |
| 48-well U bottom Plate | Avatarget | P02-48UWP | |
| 50 mL Centrifuge Tube | Nest | 602052 | |
| Alamar Blue | Thermo | DAL1100 | |
| Anti-Adherence Rinsing Solution | STEMCELL | #07010 | |
| Certified FBS | BI | 04-001-1ACS | |
| Deionized water | aladdin | W433884-500ml | |
| DMEM (Dulbecco's Modified Eagle Medium) | Gibco | 11965-092 | |
| DMSO | sigma | D2650-100ML | |
| Excel sofware | Microsoft office | ||
| Graphpad prism sofware | GraphPad software | ||
| High Content Imager and SMART system | Avatarget | 1-I01 | |
| Image J software | National Institutes of Health | ||
| Insulin-Transferrin-Selenium-A Supplement (100X) | Gibco | 51300-044 | |
| Parafilm | Bemis | PM-996 | |
| PBS | Solarbio | P1020 | |
| Penicillin/streptomycin Sol | Gibco | 15140-122 | |
| RPMI 1640 | Gibco | 11875-093 | |
| Scientific Fluoroskan Ascent | Thermo | Fluoroskan Ascent | |
| T25 Flask | JET Biofil | TCF012050 | |
| Trypsin, 0.25% (1X) | Hyclone | SH30042.01 |
Referanslar
- Carioli, G., et al. European cancer mortality predictions for the year 2021 with focus on pancreatic and female lung cancer. Annals of Oncology. 32 (4), 478-487 (2021).
- Katti, A., Diaz, B. J., Caragine, C. M., Sanjana, N. E., Dow, L. E. CRISPR in cancer biology and therapy. Nature Reviews Cancer. 22 (5), 259-279 (2022).
- Abrantes, R., Duarte, H. O., Gomes, C., Walchili, S., Reis, C. A. CAR-Ts: New perspectives in cancer therapy. FEBS Letter. 596 (4), 403-416 (2022).
- Shokooohi, A., et al. Effect of targeted therapy and immunotherapy on advanced nonsmall-cell lung cancer outcomes in the real world. Cancer Medicine. 11 (1), 86-93 (2022).
- Chen, K., Zhang, Y., Qian, L., Wang, P. Emerging strategies to target RAS signaling in human cancer therapy. Journal of Hematology & Oncology. 14 (1), 116 (2021).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Qin, Y., Hu, X., Fan, W., Yan, J. A stretchable scaffold with electrochemical sensing for 3D culture, mechanical loading, and real-time monitoring of cells. Advanced Science. 8 (13), 2003738 (2021).
- Wartenberg, M., et al. Regulation of the multidrug resistance transporter P-glycoprotein in multicellular tumor spheroids by hypoxia-inducible factor (HIF-1) ad reactive oxygen species. FASEB Journal. 17 (3), 503-505 (2003).
- Minchinton, A. I., Tannock, I. F. Drug penetration in solid tumours. Nature Reviews Cancer. 6 (8), 583-592 (2006).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension: How 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Brüningk, S. C., Rivens, I., Box, C., Oelfke, U., Ter Haar, G. 3D tumour spheroids for the prediction of the effects of radiation and hyperthermia treatments. Scientific Reports. 10, 1653 (2020).
- Graves, E. E., Maity, A., Thu Le, Q. The tumor microenvironment in non-small-cell lung cancer. Seminars in Radiation Oncology. 20 (3), 156-163 (2010).
- Kunz-Schughart, L. A., Frreyer, J. P., Ebner, R. The use of 3-D cultures for high-throughput screening: The multicellular spheroid model. Journal of Biomolecular Screening. 9 (4), 273-285 (2004).
- Carragher, N., et al. Concerns, challenges and promises of high-content analysis of 3D cellular models. Nature Review Drug Discovery. 17 (8), 606 (2018).
- Huang, Y., et al. Longitudinal morphological and physiological monitoring of three-dimensional tumor spheroids using optical coherence tomography. Journal of Visualized Experiments. (144), e59020 (2019).
- Yazdanfar, S., et al. Simple and robust image-baed autofocusing for digital microscopy. Optics Express. 16 (12), 8670-8677 (2008).
- Chen, Z., et al. Automated evaluation of tumor spheroid behavior in 3D culture using deep learning-based recognition. Biomaterials. 22 (272), 120770 (2021).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Frontiers in Immunology. 11, 603640 (2020).
- Anastasiou, D., et al. Microenvironment factors shaping the cancer metabolism landscape. British Journal of Cancer. 116 (3), 277-286 (2017).
- Zhou, H., et al. Functions and clinical significance of mechanical tumor microenvironment: Cancer cell sensing, mechanobiology and metastasis. Cancer Communications. 43 (5), 374-400 (2022).
- Zhu, G. G., et al. Targeting KRAS cancers: From druggable therapy to druggable resistance. Molecular Cancer. 21 (1), 159 (2022).
- Ando, Y., Mariano, C., Shen, K. Engineered in vitro tumor models for cell-based immunotherapy. Acta Biomaterialia. 132, 345-359 (2021).
- Timmins, N. E., Dietmair, S., Nielsen, L. K. Hanging-drop multicellular spheroids as a model of tumor angiogenesis. Angiogenesis. 7 (2), 97-103 (2004).
- Costa, E. C., et al. 3D tumor spheroids: An overview on the tools and techniques used for their analysis. Biotechnology Advances. 34 (8), 1427-1441 (2016).
- Sant, S., Johnston, P. A. The production of 3D tumor spheroids for cancer drug discovery. Drug Discovery Today. Technologies. 23, 27-36 (2017).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Scientific Reports. 6, 19103 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır