A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
יצירת ספרואידים תלת ממדיים להערכת תרופות
* These authors contributed equally
In This Article
Summary
מאמר זה מדגים שיטה סטנדרטית לבניית ספרואידים תלת מימדיים של גידולים. כמו כן מתוארת אסטרטגיה לתצפית ספרואידית וניתוח למידה עמוקה מבוססת תמונה באמצעות מערכת הדמיה אוטומטית.
Abstract
בעשורים האחרונים, בנוסף לתאים חד-שכבתיים, פותחו ספרואידים סרטניים תלת-ממדיים ככלי רב עוצמה פוטנציאלי להערכת תרופות אנטי-סרטניות. עם זאת, שיטות התרבית הקונבנציונליות חסרות את היכולת לתפעל את ספרואידים הגידול באופן הומוגני ברמה התלת מימדית. כדי להתמודד עם מגבלה זו, במאמר זה, אנו מציגים שיטה נוחה ויעילה לבניית ספרואידים סרטניים בגודל ממוצע. בנוסף, אנו מתארים שיטה של ניתוח מבוסס תמונה באמצעות תוכנת ניתוח מבוססת בינה מלאכותית שיכולה לסרוק את כל הצלחת ולקבל נתונים על ספרואידים תלת מימדיים. נבדקו מספר פרמטרים. על ידי שימוש בשיטה סטנדרטית של בניית ספרואידים סרטניים ומערכת הדמיה וניתוח בתפוקה גבוהה, ניתן להגדיל באופן דרמטי את היעילות והדיוק של בדיקות תרופתיות המבוצעות על ספרואידים תלת מימדיים.
Introduction
סרטן הוא אחת המחלות המפחידות ביותר על ידי בני אדם, לא מעט בגלל שיעור התמותה הגבוה שלה1. בשנים האחרונות, האפשרות לטפל בסרטן גדלה כאשר טיפולים חדשים הוכנסו 2,3,4,5. מודלים דו-ממדיים (2D) ותלת ממדיים (3D) במבחנה משמשים לחקר סרטן בתנאי מעבדה. עם זאת, מודלים דו-ממדיים אינם יכולים להעריך באופן מיידי ומדויק את כל הפרמטרים החשובים המצביעים על רגישות אנטי-סרטנית; לכן, הם אינם מייצגים באופן מלא אינטראקציות in vivo בבדיקות טיפול תרופתי6.
מאז 2020, שוק התרבות התלת מימדי (3D) העולמי קיבל דחיפה משמעותית. על פי דיווח אחד של NASDAQ OMX, הערך העולמי של שוק תרביות התאים התלת-ממדיות יעלה על 2.7 מיליארד דולר עד סוף 2025. בהשוואה לשיטות תרבית דו-ממדיות, תרבית תאים תלת-ממדית מציגה תכונות מועילות, שניתן לייעל לא רק להתרבות והתמיינות אלא גם להישרדות ארוכת טווח 7,8. באמצעים כאלה, ניתן לדמות מיקרו-סביבות תאיות in vivo כדי להשיג אפיון מדויק יותר של הגידול, כמו גם פרופיל מטבולי, כך שניתן יהיה להבין טוב יותר שינויים גנומיים וחלבוניים. בשל כך, מערכות בדיקה תלת-ממדיות צריכות להיכלל כעת בפעולות פיתוח תרופות רגילות, במיוחד אלה המתמקדות בסינון והערכה של תרופות אנטי-סרטניות חדשות. גידולים תלת-ממדיים של קווי תאים מבוססים אימורטליים או תרביות תאים ראשוניות במבנים ספרואידים הם בעלי תכונות in vivo של גידולים כגון היפוקסיה וחדירת תרופות, כמו גם אינטראקציה בין תאים, תגובה ועמידות, וניתן לראות בהם מודל מחמיר ומייצג לביצוע בדיקות סקר לתרופות חוץ גופיות 9,10,11.
עם זאת, מודלים אלה של תרבות תלת ממדית סובלים גם ממספר בעיות שעשויות לקחת קצת זמן לפתור. ספרואידים של תאים יכולים להיווצר באמצעות פרוטוקולים אלה, אך הם נבדלים זה מזה בפרטים מסוימים, כגון זמן תרבית או הטמעת ג'לים12, כך שלא ניתן לשלוט היטב בכדורי תאים אלה תחת טווח גודל מוגבל. גודל הספרואידים עשוי להשפיע על עקביות בדיקת הכדאיות וניתוח ההדמיה. מיקרו-סביבות הגדילה וגורמי הגדילה משתנים גם הם, מה שעשוי להוביל למורפולוגיה שונה עקב הבדלים בהתמיינות בין תאים13. כיום יש צורך ברור בשיטה סטנדרטית, פשוטה וחסכונית לבניית כל סוגי הגידולים בגדלים מבוקרים.
מנקודת מבט אחרת, למרות שבדיקות הומוגניות וגישות הדמיה בעלות תוכן גבוה פותחו כדי להעריך מורפולוגיה, כדאיות וקצב צמיחה, הסינון בתפוקה גבוהה של מודלים תלת-ממדיים נותר אתגר מסיבות שונות שדווחו בספרות, כגון חוסר אחידות במיקום, בגודל ובמורפולוגיה של ספרואידים סרטניים14,15,16.
בפרוטוקול המוצג כאן, אנו מפרטים כל שלב בבניית ספרואידים גידוליים תלת-ממדיים ומתארים שיטה לתצפית וניתוח ספרואידים באמצעות מערכת הדמיה בעלת תפוקה גבוהה ותוכן גבוה הכוללת מיקוד אוטומטי, הדמיה אוטומטית וניתוח, בין מאפיינים מועילים אחרים. אנו מראים כיצד שיטה זו יכולה לייצר כדורי גידול תלת-ממדיים בגודל אחיד המתאימים להדמיה בתפוקה גבוהה. ספרואידים אלה מפגינים גם רגישות גבוהה לטיפול תרופתי בסרטן, וניתן לעקוב אחר שינויים מורפולוגיים בספרואידים באמצעות הדמיה בתוכן גבוה. לסיכום, אנו מדגימים את חוסנה של מתודולוגיה זו כאמצעי ליצירת מבנים תלת-ממדיים של גידולים למטרות הערכת תרופות.
Protocol
1. בנייה ספרואידית
- טיפול נגד הדבקה של צלחת התרבית
- פיפטה 100 μL של מגיב נגד הידבקות לתוך כל באר של צלחת 48 באר עם תחתית באר בצורת U, ולשמור במשך 10 דקות. לאחר 10 דקות, שאפו את מגיב הציפוי, ושטפו פעמיים עם PBS מעוקר.
- שים את צלחת התרבית באינקובטור (37 ° C באוויר לח עם 5% CO2) עד לשימוש.
- הכנה, איסוף וספירה של תאים
- השתמש בתווך התרבית הספציפי לתאים כדי לגדל את התאים בצלוחיות תרבית תאים (טבלה משלימה 2). לדוגמה, תאי NCI-H23, CT-26 מתורבתים בתרבית RPMI 1640, ותאי HT-29 מתורבתים בתווך 5A של McCoy. שני מדיות אלה מתווספים עם 10% FBS מנוטרל חום ו -1% P/S, בהתאמה.
- שמור על כל התאים בתנאי תרבית סטנדרטיים (37 ° C באוויר לח עם 5% CO2) במהלך ההתפשטות. כאן, קו התא NCI-H23 משמש כדוגמה בשלבים הבאים.
- יש לשטוף תאים בתרבית בבקבוק T25 פעמיים עם PBS 1x כדי להסיר את מדיום התרבית (עדיף לבחור תאים בשלב הלוגריתמי ולעבור את התאים במפגש של 80%-90%).
- יש לטפל בתאים המורחבים עם 1 מ"ל של 0.25% טריפסין/EDTA למשך 1-2 דקות באינקובטור בטמפרטורה של 37°C, 5% CO2. אשר את צורת התא (בדרך כלל מעגלית במקרה זה) מתחת למיקרוסקופ, ולאחר מכן להפסיק את הטיפול בטריפסין. כדי לעשות זאת, לשאוף את ההשעיה טריפסין / EDTA בשימוש בבקבוק T25, ולשטוף את התאים עם 4 מ"ל של מדיום טרי.
- העבירו את כל המתלים (5 מ"ל) לצינור של 15 מ"ל. השתמש 1 מ"ל של מדיום טרי כדי לשטוף את התאים שיורית ולהוסיף אותו לצינור. צנטריפוגה את התאים ב 186.48 x גרם במשך 5 דקות בטמפרטורת החדר.
- מוציאים את הסופרנאטנט ומוסיפים 10 מ"ל מדיום טרי לכדורית התא, ולאחר מכן פיפטינג עדין עד שהתאים נמצאים בתרחיף הומוגני.
- שואפים 0.1 מ"ל של תרחיף התא לתוך צינור צנטריפוגה חדש, מוסיפים 0.9 מ"ל של מדיום טרי, ולאחר מכן פיפטה את המתלה היטב.
- חלץ 10 μL של תרחיף התא לספירת תאים. בצע תהליך זה פעמיים או שלוש ולקחת ערך ממוצע.
- דללו את התרחיף כדי להגיע לצפיפות זריעה סופית של 50,000 תאים למ"ל, בהתאם לריכוז המתקבל מתהליך ספירת התאים בשלב 1.2.7.
- תרבית תאים והיווצרות כדורית
- הוסף 200 μL של תרחיף התא לכל באר של צלחת U-bottom 48 באר.
- עטפו את סרט האיטום סביב הצלחת וצנטריפוגו אותו במהירות של 119.35 x גרם למשך 5 דקות בטמפרטורת החדר.
- בזהירות להוציא את הצלחת מתוך הצנטריפוגה ולמשוך את סרט המגן. לאחר מכן, להוסיף 5-8 מ"ל של מים מעוקרים לתוך תעלת המים המקיפה את הבארות (כדי למנוע אידוי) לדגור ב 37 ° C במשך 5 ימים. אין להחליף/להוסיף מים לתעלת המים במהלך התקופה.
- התבונן בצבירת התאים במהלך 5 הימים הבאים.
הערה: באופן כללי, התאים מתחילים להתגבש כמושבות תוך 5 ימים. עם זאת, תהליך בניית הספרואידים עשוי להיות מהיר או איטי יותר עם סוגי תאים שונים וצפיפויות תאים. בשל כך, התאים חייבים להיות נצפו כל יום באמצעות אחת משלוש שיטות אפשריות. ראשית, ניתן לראות את התאים דרך תחתית צלחת הבאר. כאשר התאים עדיין לא יצרו ספרואיד, ניתן לראות שכבה אחת של תאים בתחתית. כאשר התאים יוצרים ספרואיד, ניתן לראות מבנה תלת-ממדי צפוף בתחתית ה-U של כל באר. שיטה נוספת כוללת בדיקת התאים תחת מיקרוסקופ. כאשר התאים הופכים לספרואיד גידולי, הבנייה מערבת שלוש שכבות (שכבה מתפשטת, שכבה לא פעילה, וליבה נמקית, מבחוץ לחלק הפנימי של הספרואיד), שיש להן שיפוע שקיפות. לבסוף, הצבע של מדיום התרבות יכול לשמש גם למטרות תצפית. זה יכול להיות מועיל כאשר לא ניתן לראות בבירור את המבנה התלת-שכבתי, אפילו באמצעות מיקרוסקופ דיגיטלי. כאשר המדיום הופך מסגול-אדום לצהוב, תהליך הטמעת הספרואידים בג'ל יכול להתחיל. אין להחליף את המדיום במהלך תקופת צבירת התא.
- הטבעה בג'ל
הערה: הג'לים צריכים להיות מאוחסנים בטמפרטורה מתחת ל -20 מעלות צלזיוס. בפרט, ג'לים צריכים להיות ממוקמים הרחק מדלת המקרר כדי למנוע תנודות טמפרטורה. שימו לב שהג'לים נמצאים במצב קפוא בשלב זה של התהליך.- קחו את הג'ל הקפוא מהמקרר בטמפרטורה של 20°C והניחו אותו על קופסת קרח למשך כל הזמן במהלך הניסוי.
- התבוננו בכדורי התא מתחת למיקרוסקופ. לפני תחילת הטבעה בג'ל, יש לבדוק שוב את מצב הספרואידים במיקרוסקופ דיגיטלי.
- בזהירות להסיר 150 μL של המדיום. הצלחת צריכה להיות מונחת גם על ארגז הקרח.
- הטמיעו כל ספרואיד בג'ל על ידי הוספת הג'ל הנוזלי באיטיות מצד דופן הבאר תוך הזזת קצה הפיפטה המקורר מראש סביב הבאר ובתוכה. המתן 5 דקות ואם הג'ל אינו מתפשט באופן שווה, פיפטה עדינה את הג'ל עם קצה פיפטה 10 μL. כל באר מכילה ספרואיד גידולי, 25 μL של 3.5 מ"ג/מ"ל ג'ל, ו-50 μL של מדיום תרבית שלם. הוסף 75 μL של בינוני לפקדים גם כן.
הערה: כל באר מכילה ספרואיד אחד. - לדגור את הצלחת ב 37 ° C במשך 30 דקות עד הידרוגלציה מלאה הושלמה. אשר את מצב הג'לציה מתחת למיקרוסקופ.
- כיסוי 125 μL של המדיום הטרי על כל דגימה.
- תרבית את הספרואידים עוד 7-10 ימים. הכינו קבוצות של ספרואידים עם ארבע עד שש בארות כל אחת ובחרו לפחות שלוש מהן לניתוח.
הערה: בעת ביצוע בדיקת סמים, הכינו שתי קבוצות לדגימה אחת. קבוצה אחת משמשת לבדיקת כדאיות, ואילו השנייה משמשת ללכידת תמונות וניתוחן.
2. טיפול תרופתי
- להמיס את התרופה על פי הוראות היצרן. הכן פתרונות עבודה פי 100 עם DMSO. להכין לפחות חמש מנות של התרופה בדילול סדרתי. כאן, התרופה הטיפולית לסרטן ריאות, AMG 510, משמשת כדוגמה. ההרכב מוצג בטבלה משלימה 1.
- השתמש ב- 0.1% DMSO כבקרה חיובית.
- הוסף 125 μL של מדיום מטופל בתרופות לכל באר והחזיר את הצלחת לאינקובטור (37 ° C באוויר לח עם 5% CO2). בשלב זה, כל באר מכילה ספרואיד גידול, 25 μL של 3.5 מ"ג / מ"ל ג'ל, ו 175 μL של המדיום. הפקדים מכילים 200 μL של המדיום.
3. כדאיות ספרואידית
- יש למדוד את הכדאיות הספרואידית באמצעות ערכת בדיקה Alamar Blue בהתאם להנחיות היצרן. למדוד את הכדאיות באמצעות פוטומטר microplate (ספיגה ב 570 ננומטר ו 600 ננומטר) לאחר טיפול Alamar Blue מתבצע.
- מדוד את הכדאיות ביום 1, יום 4, יום 7 ויום 10 לאחר הטמעת הספרואידים בג'ל, בהתאמה, או כפי שצוין.
הערה: בעת שימוש בבדיקת Alamar Blue, נדרשות לפחות 16 שעות של זמן תגובה. לכן, יש להוסיף 20 μL של Alamar Blue בשעות אחר הצהריים של יום 0, יום 3, יום 6 ויום 9. - שואפים 100 μL של המדיום הסופרנאטנטי מכל באר לצלחת בדיקה חדשה ומוסיפים 80 μL של מדיום טרי לכל באר של צלחת התרבית. לאחר מכן, להחליף עוד 100 μL של המדיום שטופל בתרופה. ודאו שאין שרידים של Alamar Blue בבאר.
הערה: החלפה בינונית מתבצעת בכל פעם שהכדאיות נבדקת, ויש להחליף את המדיום המטופל בתרופות של קבוצות ניתוח הדימות באותו יום.
4. תצפית ספרואידית וניתוח למידה עמוקה באמצעות תמונות בבדיקת הסמים
- דימות
- יש לשאוף החוצה 100 מיקרוליטר של התווך לפני ההדמיה.
- מניחים את הצלחת על הבמה. קבל תמונות דיגיטליות של הספרואידים באמצעות מיקרוסקופ אוטומטי עם מטרה של 10x (2x מטרה תחילה). המיקרוסקופ יכול למקד ולרכז את הספרואידים הללו באופן אוטומטי.
הערה: פונקציית המיקוד האוטומטי והאלגוריתם שבו נעשה שימוש דווחו בעבר על ידי Yazdanfar et al.17. - המתן להדמיה האוטומטית. ארבע תמונות נרכשות עבור כל ספרואיד. תמונה משולבת נוצרת ומעובדת עם התוכנה המחוברת למערכת ההדמיה בעלת התוכן הגבוה.
- לחץ על כפתור "תהליך תיקון תמונה" ובחר את התמונות המשולבות בתוכנה.
- בחר "דגם U-NET", והקלד את יחס ההמרה (10x תמונות אובייקטיביות יש יחס המרה של 3.966). לחץ בתחתית המסך למטה, כדי להתחיל בעיבוד התמונה. לאחר מכן, שמור את נתוני הקוטר, ההיקף והחספוס בתוכנת גיליון אלקטרוני.
- חישוב האינדקס ההיקפי העודף (EPI). EPI הוא היחס בין היקף הספרואיד (P 0) לבין ההיקף המקביל (Pe), כפי שחושב על ידי Eq. 1. מדדו את שטח הספרואיד במישור המוקד (S) באמצעות תמונה J. לאחר מכן, חשב את ההיקף המקביל של הספרואיד באמצעות Eq. 2.
EPI = (P o− P e)/Pe (Eq. 1)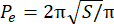 (Eq. 2)
(Eq. 2)
הערה: היקף הספרואיד נוצר על ידי התוכנה עם אלגוריתמים של למידה עמוקה המבוססים על מודל U-NET שפותח. - מוסיפים 100 μL של מדיום טרי עם התרופה ומניחים את הצלחת בחזרה לתוך האינקובטור (37 ° C באוויר לח עם 5% CO2).
- עיכוב ספרואידי
- חשב את עיכוב צמיחת הגידול (TGI) באמצעות Eq. 3. הנפח הספרואידי היחסי (RTV) הוא נפח המסוף מעל הנפח המקורי (Eq. 4). נפח הספרואיד (V) מחושב אוטומטית על ידי התוכנה באמצעות Eq. 5 בהתאם לפלט קוטר הספרואידים.
TGI = (בקרת RTV -טיפול RTV) /בקרת RTV × 100% (Eq. 3)
RTV = VTerminal / Vהמקורי (Eq. 4)
V = 4/3π(d/2)3 (Eq. 5)
הערה: TGI מתקבל עם התייחסות לעיכוב גדילה in vivo , ומשקלי הגידול מוחלפים ב- RTV. בקרת RTV היא נפח הספרואיד היחסי של קבוצת הביקורת,טיפול RTV הוא נפח הספרואיד היחסי של הקבוצה שנבדקה,מסוף V הוא נפח הספרואיד ביום האחרון, Vהמקורי הוא נפח הספרואיד ביום התרבית הראשון, ו - d מייצג את קוטר הספרואידים.
- חשב את עיכוב צמיחת הגידול (TGI) באמצעות Eq. 3. הנפח הספרואידי היחסי (RTV) הוא נפח המסוף מעל הנפח המקורי (Eq. 4). נפח הספרואיד (V) מחושב אוטומטית על ידי התוכנה באמצעות Eq. 5 בהתאם לפלט קוטר הספרואידים.
תוצאות
איור 1A,B מראה במחקר זה את התהליך המשמש לבניית ספרואידים סרטניים. תחילה זרענו את התאים בצלחת U-bottom בעלת 48 בארות. שלב זה כמעט זהה לזה המשמש בתרבית תאים דו-ממדית. שמרנו את הצלחת באינקובטור משותף עם מים המקיפים את הבארות, כך שהתאים שהושקעו החלו ליצור ספרואידים בתהליך הר?...
Discussion
המיקרו-סביבה ממלאת תפקיד חשוב בצמיחת הגידול. הוא עשוי להשפיע על מתן מטריצות חוץ-תאיות, שיפועי חמצן, תזונה ואינטראקציה מכנית, ובכך להשפיע על ביטוי גנים, מסלולי אותות ותפקודים רבים של תאי הגידול 19,20,21. במקרים רבים, תאים דו-ממדיים אינם מייצרים...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לכל חברי המעבדות שלנו על תרומתם והצעותיהם הקריטיות. מחקר זה נתמך על ידי פרויקט המפתח של ועדת הבריאות של ג'יאנגסו (K2019030). ההמשגה בוצעה על ידי C.W. ו- Z.C., המתודולוגיה בוצעה על ידי W.H. ו- M.L., החקירה בוצעה על ידי W.H. ו- M.L., איסוף הנתונים בוצע על ידי W.H., Z.Z., S.X. ו- M.L., הכנת הטיוטה המקורית בוצעה על ידי Z.Z., J.Z., S.X., W.H., ו-X.L., הסקירה והעריכה בוצעו על ידי Z.C., ניהול הפרויקט בוצע על ידי C.W. ו-Z.C., ורכישת המימון בוצעה על ידי C.W. כל המחברים קראו והסכימו לגרסה שפורסמה של כתב היד.
Materials
| Name | Company | Catalog Number | Comments |
| 0.5-10 μL Pipette tips | AXYGEN | T-300 | |
| 1.5 mL Boil proof microtubes | Axygen | MCT-150-C | |
| 100-1000μL Pipette tips | KIRGEN | KG1313 | |
| 15 mL Centrifuge Tube | Nest | 601052 | |
| 200 μL Pipette tips | AXYGEN | T-200-Y | |
| 3D gel | Avatarget | MA02 | |
| 48-well U bottom Plate | Avatarget | P02-48UWP | |
| 50 mL Centrifuge Tube | Nest | 602052 | |
| Alamar Blue | Thermo | DAL1100 | |
| Anti-Adherence Rinsing Solution | STEMCELL | #07010 | |
| Certified FBS | BI | 04-001-1ACS | |
| Deionized water | aladdin | W433884-500ml | |
| DMEM (Dulbecco's Modified Eagle Medium) | Gibco | 11965-092 | |
| DMSO | sigma | D2650-100ML | |
| Excel sofware | Microsoft office | ||
| Graphpad prism sofware | GraphPad software | ||
| High Content Imager and SMART system | Avatarget | 1-I01 | |
| Image J software | National Institutes of Health | ||
| Insulin-Transferrin-Selenium-A Supplement (100X) | Gibco | 51300-044 | |
| Parafilm | Bemis | PM-996 | |
| PBS | Solarbio | P1020 | |
| Penicillin/streptomycin Sol | Gibco | 15140-122 | |
| RPMI 1640 | Gibco | 11875-093 | |
| Scientific Fluoroskan Ascent | Thermo | Fluoroskan Ascent | |
| T25 Flask | JET Biofil | TCF012050 | |
| Trypsin, 0.25% (1X) | Hyclone | SH30042.01 |
References
- Carioli, G., et al. European cancer mortality predictions for the year 2021 with focus on pancreatic and female lung cancer. Annals of Oncology. 32 (4), 478-487 (2021).
- Katti, A., Diaz, B. J., Caragine, C. M., Sanjana, N. E., Dow, L. E. CRISPR in cancer biology and therapy. Nature Reviews Cancer. 22 (5), 259-279 (2022).
- Abrantes, R., Duarte, H. O., Gomes, C., Walchili, S., Reis, C. A. CAR-Ts: New perspectives in cancer therapy. FEBS Letter. 596 (4), 403-416 (2022).
- Shokooohi, A., et al. Effect of targeted therapy and immunotherapy on advanced nonsmall-cell lung cancer outcomes in the real world. Cancer Medicine. 11 (1), 86-93 (2022).
- Chen, K., Zhang, Y., Qian, L., Wang, P. Emerging strategies to target RAS signaling in human cancer therapy. Journal of Hematology & Oncology. 14 (1), 116 (2021).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Qin, Y., Hu, X., Fan, W., Yan, J. A stretchable scaffold with electrochemical sensing for 3D culture, mechanical loading, and real-time monitoring of cells. Advanced Science. 8 (13), 2003738 (2021).
- Wartenberg, M., et al. Regulation of the multidrug resistance transporter P-glycoprotein in multicellular tumor spheroids by hypoxia-inducible factor (HIF-1) ad reactive oxygen species. FASEB Journal. 17 (3), 503-505 (2003).
- Minchinton, A. I., Tannock, I. F. Drug penetration in solid tumours. Nature Reviews Cancer. 6 (8), 583-592 (2006).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension: How 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Brüningk, S. C., Rivens, I., Box, C., Oelfke, U., Ter Haar, G. 3D tumour spheroids for the prediction of the effects of radiation and hyperthermia treatments. Scientific Reports. 10, 1653 (2020).
- Graves, E. E., Maity, A., Thu Le, Q. The tumor microenvironment in non-small-cell lung cancer. Seminars in Radiation Oncology. 20 (3), 156-163 (2010).
- Kunz-Schughart, L. A., Frreyer, J. P., Ebner, R. The use of 3-D cultures for high-throughput screening: The multicellular spheroid model. Journal of Biomolecular Screening. 9 (4), 273-285 (2004).
- Carragher, N., et al. Concerns, challenges and promises of high-content analysis of 3D cellular models. Nature Review Drug Discovery. 17 (8), 606 (2018).
- Huang, Y., et al. Longitudinal morphological and physiological monitoring of three-dimensional tumor spheroids using optical coherence tomography. Journal of Visualized Experiments. (144), e59020 (2019).
- Yazdanfar, S., et al. Simple and robust image-baed autofocusing for digital microscopy. Optics Express. 16 (12), 8670-8677 (2008).
- Chen, Z., et al. Automated evaluation of tumor spheroid behavior in 3D culture using deep learning-based recognition. Biomaterials. 22 (272), 120770 (2021).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Frontiers in Immunology. 11, 603640 (2020).
- Anastasiou, D., et al. Microenvironment factors shaping the cancer metabolism landscape. British Journal of Cancer. 116 (3), 277-286 (2017).
- Zhou, H., et al. Functions and clinical significance of mechanical tumor microenvironment: Cancer cell sensing, mechanobiology and metastasis. Cancer Communications. 43 (5), 374-400 (2022).
- Zhu, G. G., et al. Targeting KRAS cancers: From druggable therapy to druggable resistance. Molecular Cancer. 21 (1), 159 (2022).
- Ando, Y., Mariano, C., Shen, K. Engineered in vitro tumor models for cell-based immunotherapy. Acta Biomaterialia. 132, 345-359 (2021).
- Timmins, N. E., Dietmair, S., Nielsen, L. K. Hanging-drop multicellular spheroids as a model of tumor angiogenesis. Angiogenesis. 7 (2), 97-103 (2004).
- Costa, E. C., et al. 3D tumor spheroids: An overview on the tools and techniques used for their analysis. Biotechnology Advances. 34 (8), 1427-1441 (2016).
- Sant, S., Johnston, P. A. The production of 3D tumor spheroids for cancer drug discovery. Drug Discovery Today. Technologies. 23, 27-36 (2017).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Scientific Reports. 6, 19103 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved