É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Geração de esferoides tumorais 3D para estudos de avaliação de fármacos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este artigo demonstra um método padronizado para a construção de esferoides tumorais tridimensionais. Uma estratégia para observação esferoide e análise de aprendizagem profunda baseada em imagens usando um sistema de imagem automatizado também é descrita.
Resumo
Nas últimas décadas, além das células cultivadas em monocamadas, esferoides tumorais tridimensionais têm sido desenvolvidos como uma ferramenta potencialmente poderosa para a avaliação de drogas antineoplásicas. No entanto, os métodos convencionais de cultura não têm a capacidade de manipular os esferoides tumorais de forma homogênea em nível tridimensional. Para abordar essa limitação, neste artigo, apresentamos um método conveniente e eficaz de construção de esferoides tumorais de tamanho médio. Adicionalmente, descrevemos um método de análise baseado em imagens usando software de análise baseado em inteligência artificial que pode escanear toda a placa e obter dados sobre esferoides tridimensionais. Vários parâmetros foram estudados. Usando um método padrão de construção esferoide tumoral e um sistema de imagem e análise de alto rendimento, a eficácia e a precisão dos testes de drogas realizados em esferoides tridimensionais podem ser dramaticamente aumentadas.
Introdução
O câncer é uma das doenças mais temidas pelo ser humano, principalmente por sua alta taxa demortalidade1. Nos últimos anos, a possibilidade de tratamento do câncer tem aumentado à medida que novas terapias têm sido introduzidas2,3,4,5. Modelos in vitro bidimensionais (2D) e tridimensionais (3D) são usados para estudar o câncer em laboratório. No entanto, os modelos 2D não podem avaliar imediata e precisamente todos os parâmetros importantes que indicam sensibilidade antitumoral; portanto, não conseguem representar completamente as interações in vivo nos testes de terapia medicamentosa6.
Desde 2020, o mercado global de cultura tridimensional (3D) foi muito impulsionado. De acordo com um relatório da NASDAQ OMX, o valor global do mercado de cultura de células 3D excederá US$ 2,7 bilhões até o final de 2025. Comparada aos métodos de cultivo 2D, a cultura de células 3D apresenta propriedades vantajosas, que podem ser otimizadas não só para proliferação e diferenciação, mas também para sobrevivência a longo prazo 7,8. Por esse meio, microambientes celulares in vivo podem ser simulados para obter uma caracterização tumoral mais precisa, bem como o perfil metabólico, para que as alterações genômicas e proteicas possam ser melhor compreendidas. Devido a isso, os sistemas de teste 3D devem agora ser incluídos nas principais operações de desenvolvimento de medicamentos, especialmente aqueles com foco na triagem e avaliação de novas drogas antitumorais. Crescimentos tridimensionais de linhagens celulares estabelecidas imortalizadas ou culturas de células primárias em estruturas esferoides possuem características in vivo de tumores, como hipóxia e penetração de drogas, bem como interação, resposta e resistência celular, e podem ser considerados um modelo rigoroso e representativo para a triagem in vitro de fármacos9,10,11.
No entanto, esses modelos de cultura 3D também sofrem de vários problemas que podem levar algum tempo para serem resolvidos. Os esferoides celulares podem ser formados usando esses protocolos, mas diferem em certos detalhes, como tempo de cultura ou gel de incorporação12, de modo que esses esferoides celulares construídos não podem ser bem controlados sob uma faixa de tamanho restrita. O tamanho dos esferoides pode influenciar a consistência do teste de viabilidade e da análise de imagem. Os microambientes de crescimento e os fatores de crescimento também variam, o que pode levar a diferentes morfologias devido a diferenças na diferenciação entre as células13. Existe agora uma necessidade óbvia de um método padrão, simples e custo-efetivo para a construção de todos os tipos de tumores com tamanhos controlados.
Em outra perspectiva, embora ensaios homogêneos e abordagens de imagem de alto conteúdo tenham sido desenvolvidos para avaliar morfologia, viabilidade e taxa de crescimento, a triagem em larga escala de modelos 3D permanece um desafio por várias razões relatadas na literatura, como a falta de uniformidade na posição, tamanho e morfologia dos esferoides tumorais14,15,16.
No protocolo aqui apresentado, listamos cada etapa da construção de esferoides tumorais 3D e descrevemos um método de observação e análise esferoide usando um sistema de imagem de alto rendimento e alto conteúdo que envolve foco automático, autoimagem e análise, entre outras características vantajosas. Mostramos como este método pode produzir esferoides tumorais 3D de tamanho uniforme que são adequados para imagens de alto rendimento. Esses esferoides também demonstram uma alta sensibilidade ao tratamento medicamentoso do câncer, e alterações morfológicas nos esferoides podem ser monitoradas usando imagens de alto conteúdo. Em resumo, demonstramos a robustez desta metodologia como meio de gerar construtos tumorais 3D para fins de avaliação de fármacos.
Protocolo
1. Construção esferoide
- Tratamento antiaderente da placa de cultura
- Pipetar 100 μL de reagente antiaderência em cada poço de uma placa de 48 poços com fundo de poço em forma de U e manter por 10 min. Após 10 min, aspirar o reagente de revestimento e lavar duas vezes com PBS esterilizado.
- Colocar a placa de cultura em estufa (37 °C em ar umidificado com 5% de CO2) até à sua utilização.
- Preparação, coleta e contagem de células
- Utilizar o meio de cultura específico das células para cultura das células em frascos de cultura celular (Tabela Suplementar 2). Por exemplo, células NCI-H23, CT-26 são cultivadas em RPMI 1640, e células HT-29 são cultivadas em meio McCoy's 5A. Esses dois meios são suplementados com 10% de SFB inativado pelo calor e 1% de P/S, respectivamente.
- Manter todas as células em condições de cultura padrão (37 °C em ar umidificado com 5% de CO2) durante a proliferação. Aqui, a linha celular NCI-H23 é usada como exemplo nas etapas a seguir.
- Lavar as células cultivadas em frasco T25 duas vezes com 1x PBS para remover o meio de cultura (é melhor escolher células na fase logarítmica e passar as células em uma confluência de 80%-90%).
- Tratar as células expandidas com 1 mL de tripsina/EDTA a 0,25% por 1-2 min em incubadora a 37 °C, 5% CO2. Confirme a forma da célula (normalmente circular neste caso) ao microscópio e, em seguida, pare o tratamento com tripsina. Para isso, aspirar a suspensão de tripsina/EDTA utilizada no frasco T25 e lavar as células com 4 mL de meio fresco.
- Transfira toda a suspensão (5 mL) para um tubo de 15 mL. Use 1 mL de meio fresco para lavar as células residuais e adicioná-lo ao tubo. Centrifugar as células a 186,48 x g durante 5 min à temperatura ambiente.
- Retirar o sobrenadante e adicionar 10 ml de meio fresco ao pellet celular, seguido de pipetagem suave até que as células estejam em suspensão homogénea.
- Aspirar 0,1 mL de suspensão celular em um novo tubo de centrífuga, adicionar 0,9 mL de meio fresco e, em seguida, pipetar bem a suspensão.
- Extrair 10 μL da suspensão celular para contagem celular. Realize esse processo duas ou três vezes e pegue um valor médio.
- Diluir a suspensão até atingir uma densidade final de semeadura de 50.000 células/mL, de acordo com a concentração obtida do processo de contagem celular na etapa 1.2.7.
- Cultura celular e formação de esferoides
- Adicionar 200 μL da suspensão celular a cada poço de uma placa de fundo em U de 48 poços.
- Enrole a película de vedação em torno da placa e centrifugue-a a 119,35 x g por 5 min à temperatura ambiente.
- Retire cuidadosamente a placa da centrífuga e retire a película protetora. Em seguida, adicione 5-8 mL de água esterilizada no canal de água ao redor dos poços (para evitar evaporação) e incube a 37 °C por 5 dias. Não troque/suplemente nenhuma água do canal de água durante o período.
- Observe a agregação celular durante os 5 dias seguintes.
NOTA: Em geral, as células começam a se aglomerar como colônias dentro de 5 dias. No entanto, o processo de construção esferoide pode ser mais rápido ou mais lento com diferentes tipos celulares e densidades celulares. Devido a isso, as células devem ser observadas todos os dias usando um dos três métodos possíveis. Primeiro, as células podem ser observadas através do fundo da placa do poço. Quando as células ainda não formaram um esferoide, uma única camada de células pode ser vista na parte inferior. Quando as células formam um esferoide, uma construção 3D densa pode ser observada no fundo em U de cada poço. Outro método envolve a verificação das células sob um microscópio. Quando as células se tornam um esferoide tumoral, a construção envolve três camadas (uma camada proliferante, uma camada inativa e um núcleo necrótico, de fora para dentro do esferoide), que têm um gradiente de transparência. Finalmente, a cor do meio de cultura também pode ser usada para fins observacionais. Isso pode ser útil quando a estrutura de três camadas não pode ser claramente vista, mesmo usando um microscópio digital. Quando o meio passa de roxo-vermelho para amarelo, o processo de incorporação dos esferoides no gel pode começar. O meio não deve ser substituído durante o período de agregação celular.
- Incorporação de gel
NOTA: Os géis precisam ser armazenados a uma temperatura inferior a -20 °C. Em particular, os géis devem ser colocados longe da porta do frigorífico para evitar flutuações de temperatura. Observe que os géis estão em um estado congelado nesta fase do processo.- Retire o gel congelado da geladeira de -20 °C e coloque-o em uma caixa de gelo durante todo o tempo durante o experimento.
- Observe os esferoides celulares ao microscópio. Antes do início da incorporação do gel, o status dos esferoides deve ser novamente verificado com um microscópio digital.
- Retire cuidadosamente 150 μL do meio. A placa também deve ser colocada na caixa de gelo.
- Incorpore cada esferoide no gel adicionando o gel líquido lentamente do lado da parede do poço enquanto move a ponta da pipeta pré-resfriada ao redor e dentro do poço. Aguarde 5 min e, se o gel não se espalhar uniformemente, pipetar suavemente o gel com uma ponta de pipeta de 10 μL. Cada poço contém um esferoide tumoral, 25 μL de 3,5 mg/mL de gel e 50 μL de meio de cultura completo. Adicione 75 μL de meio aos controles também.
NOTA: Cada poço contém um esferoide. - Incubar a placa a 37 °C durante 30 minutos até que a hidrogelificação esteja totalmente concluída. Confirme o estado de gelificação ao microscópio.
- Sobrepor 125 μL do meio fresco em cada amostra.
- Cultivar os esferoides por mais 7-10 dias. Prepare grupos de esferoides com quatro a seis poços cada e escolha pelo menos três deles para análise.
NOTA: Se estiver realizando um teste de drogas, prepare dois grupos para uma amostra. Um grupo é usado para testes de viabilidade, enquanto o outro é usado para captura e análise de imagens.
2. Tratamento medicamentoso
- Dissolva a droga de acordo com as instruções do fabricante. Prepare soluções de trabalho 100x com DMSO. Prepare pelo menos cinco doses do medicamento em diluição seriada. Aqui, o medicamento terapêutico para câncer de pulmão, AMG 510, é usado como exemplo. A composição é mostrada na Tabela Suplementar 1.
- Utilizar DMSO 0,1% como controle positivo.
- Adicionar 125 μL de meio tratado com droga a cada poço e colocar a placa de volta na incubadora (37 °C em ar umidificado com 5% de CO2). Nesta fase, cada poço contém um esferoide tumoral, 25 μL de 3,5 mg/mL de gel e 175 μL do meio. Os controles contêm 200 μL do meio.
3. Viabilidade esferoide
- Meça a viabilidade do esferoide usando um kit de ensaio Alamar Blue de acordo com as diretrizes do fabricante. Medir a viabilidade utilizando um fotômetro de microplacas (absorbância a 570 nm e 600 nm) após o tratamento com Alamar Blue.
- Medir a viabilidade no dia 1, dia 4, dia 7 e dia 10 após a incorporação dos esferoides no gel, respectivamente, ou conforme indicado.
NOTA: Ao usar um ensaio Alamar Blue, pelo menos 16 h de tempo de reação é necessário. Portanto, adicione 20 μL de Alamar Blue nas tardes do dia 0, dia 3, dia 6 e dia 9. - Aspirar 100 μL do meio sobrenadante de cada poço para uma nova placa de ensaio e adicionar 80 μL de meio fresco a cada poço da placa de cultura. Em seguida, substitua mais 100 μL do meio tratado com a droga. Certifique-se de que não há restos de Alamar Blue no poço.
NOTA: A substituição do meio é realizada em cada ocasião em que a viabilidade é testada, e o meio tratado com medicamentos dos grupos de análise de imagem precisa ser substituído no mesmo dia.
4. Observação esferoide e análise de aprendizagem profunda através de imagens no teste de drogas
- Imagiologia
- Aspirar 100 μL do meio para fora antes da aquisição de imagens.
- Coloque o prato no palco. Obter imagens digitais dos esferoides usando um microscópio automatizado com objetiva de 10x (objetiva de 2x primeiro). O microscópio pode focar e centralizar esses esferoides automaticamente.
NOTA: A função de foco automático e o algoritmo utilizado foram previamente relatados por Yazdanfar et al.17. - Aguarde a imagem automática. São adquiridas quatro imagens para cada esferoide. Uma imagem integrada é formada e processada com o software conectado ao sistema de imagem de alto conteúdo.
- Clique no botão "Processo de correção de imagem" e escolha as imagens integradas no software.
- Escolha "U-NET model" e digite a taxa de conversão (10x imagens objetivas têm uma taxa de conversão de 3,966). Clique na parte inferior da tela abaixo, para iniciar o processamento da imagem. Em seguida, salve os dados de diâmetro, perímetro e rugosidade no software de planilha.
- Calcule o índice de perímetro excedente (EPI). O EPI é a razão entre o perímetro esferoide (P 0) e o perímetro equivalente (Pe), calculado pela Eq. 1. Medir a área do esferoide no plano focal (S) usando a Imagem J. Em seguida, calcule o perímetro equivalente do esferoide usando a Eq. 2.
EPI = (P o− P e)/Pe (Eq. 1)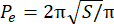 (Eq. 2)
(Eq. 2)
NOTA: O perímetro esferoide é gerado pelo software com algoritmos de aprendizagem profunda baseados no modelo U-NET desenvolvido. - Adicionar 100 μL de meio fresco com o fármaco e colocar a placa de volta na incubadora (37 °C em ar umidificado com 5% de CO2).
- Inibição esferoide
- Calcular a inibição do crescimento tumoral (TGI) usando a Eq. 3. O volume esferoide relativo (RTV) é o volume terminal sobre o volume original (Eq. 4). O volume esferoide (V) é calculado automaticamente pelo software usando a Eq. 5 de acordo com a saída do diâmetro esferoide.
TGI = (controle RTV −tratamento RTV)/controle RTV × 100% (Eq. 3)
RTV =V terminal/Voriginal (Eq. 4)
V = 4/3π(d/2)3 (Eq. 5)
NOTA: O TGI é obtido com referência à inibição do crescimento in vivo , e os pesos do tumor são substituídos por RTV. O controle do RTV é o volume esferoide relativo do grupo controle, otratamento do RTV é o volume esferoide relativo do grupo do fármaco testado, o Vterminal é o volume do esferoide no último dia, o Voriginal é o volume do esferoide no primeiro dia de cultura e o d representa o diâmetro do esferoide.
- Calcular a inibição do crescimento tumoral (TGI) usando a Eq. 3. O volume esferoide relativo (RTV) é o volume terminal sobre o volume original (Eq. 4). O volume esferoide (V) é calculado automaticamente pelo software usando a Eq. 5 de acordo com a saída do diâmetro esferoide.
Resultados
A Figura 1A,B mostra o processo de construção dos esferoides tumorais neste estudo. Primeiro semeamos as células em uma placa de fundo em U de 48 poços. Esta etapa é quase a mesma usada em cultura de células 2D. Mantivemos a placa em uma incubadora comum com água ao redor dos poços para que as células depositadas começassem a formar esferoides em um processo de auto-montagem. Em condições operacionais normais, a maioria dos tipos de esferoides tumorais foi compl...
Discussão
O microambiente desempenha um papel importante no crescimento tumoral. Pode afetar o fornecimento de matrizes extracelulares, gradientes de oxigênio, nutrição e interação mecânica e, assim, afetar a expressão gênica, as vias de sinal e várias funções das células tumorais19,20,21. Em muitos casos, as células 2D não produzem tais efeitos ou mesmo produzem efeitos opostos, afetando a avaliação dos tratamentos medica...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos a todos os membros de nossos laboratórios por suas contribuições críticas e sugestões. Esta pesquisa foi apoiada pelo Projeto Chave da Comissão de Saúde de Jiangsu (K2019030). A conceituação foi conduzida por C.W. e Z.C., a metodologia foi realizada por W.H. e M.L., a investigação foi realizada por W.H. e M.L., a curadoria dos dados foi realizada por W.H., Z.Z., S.X. e M.L., a elaboração do rascunho original foi realizada por Z.Z., J.Z., S.X., W.H., e X.L., a revisão e edição foi realizada por Z.C., a administração do projeto foi realizada por C.W. e Z.C., e a aquisição de financiamento foi conduzida por C.W. Todos os autores leram e concordaram com a versão publicada do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.5-10 μL Pipette tips | AXYGEN | T-300 | |
| 1.5 mL Boil proof microtubes | Axygen | MCT-150-C | |
| 100-1000μL Pipette tips | KIRGEN | KG1313 | |
| 15 mL Centrifuge Tube | Nest | 601052 | |
| 200 μL Pipette tips | AXYGEN | T-200-Y | |
| 3D gel | Avatarget | MA02 | |
| 48-well U bottom Plate | Avatarget | P02-48UWP | |
| 50 mL Centrifuge Tube | Nest | 602052 | |
| Alamar Blue | Thermo | DAL1100 | |
| Anti-Adherence Rinsing Solution | STEMCELL | #07010 | |
| Certified FBS | BI | 04-001-1ACS | |
| Deionized water | aladdin | W433884-500ml | |
| DMEM (Dulbecco's Modified Eagle Medium) | Gibco | 11965-092 | |
| DMSO | sigma | D2650-100ML | |
| Excel sofware | Microsoft office | ||
| Graphpad prism sofware | GraphPad software | ||
| High Content Imager and SMART system | Avatarget | 1-I01 | |
| Image J software | National Institutes of Health | ||
| Insulin-Transferrin-Selenium-A Supplement (100X) | Gibco | 51300-044 | |
| Parafilm | Bemis | PM-996 | |
| PBS | Solarbio | P1020 | |
| Penicillin/streptomycin Sol | Gibco | 15140-122 | |
| RPMI 1640 | Gibco | 11875-093 | |
| Scientific Fluoroskan Ascent | Thermo | Fluoroskan Ascent | |
| T25 Flask | JET Biofil | TCF012050 | |
| Trypsin, 0.25% (1X) | Hyclone | SH30042.01 |
Referências
- Carioli, G., et al. European cancer mortality predictions for the year 2021 with focus on pancreatic and female lung cancer. Annals of Oncology. 32 (4), 478-487 (2021).
- Katti, A., Diaz, B. J., Caragine, C. M., Sanjana, N. E., Dow, L. E. CRISPR in cancer biology and therapy. Nature Reviews Cancer. 22 (5), 259-279 (2022).
- Abrantes, R., Duarte, H. O., Gomes, C., Walchili, S., Reis, C. A. CAR-Ts: New perspectives in cancer therapy. FEBS Letter. 596 (4), 403-416 (2022).
- Shokooohi, A., et al. Effect of targeted therapy and immunotherapy on advanced nonsmall-cell lung cancer outcomes in the real world. Cancer Medicine. 11 (1), 86-93 (2022).
- Chen, K., Zhang, Y., Qian, L., Wang, P. Emerging strategies to target RAS signaling in human cancer therapy. Journal of Hematology & Oncology. 14 (1), 116 (2021).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Qin, Y., Hu, X., Fan, W., Yan, J. A stretchable scaffold with electrochemical sensing for 3D culture, mechanical loading, and real-time monitoring of cells. Advanced Science. 8 (13), 2003738 (2021).
- Wartenberg, M., et al. Regulation of the multidrug resistance transporter P-glycoprotein in multicellular tumor spheroids by hypoxia-inducible factor (HIF-1) ad reactive oxygen species. FASEB Journal. 17 (3), 503-505 (2003).
- Minchinton, A. I., Tannock, I. F. Drug penetration in solid tumours. Nature Reviews Cancer. 6 (8), 583-592 (2006).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension: How 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Brüningk, S. C., Rivens, I., Box, C., Oelfke, U., Ter Haar, G. 3D tumour spheroids for the prediction of the effects of radiation and hyperthermia treatments. Scientific Reports. 10, 1653 (2020).
- Graves, E. E., Maity, A., Thu Le, Q. The tumor microenvironment in non-small-cell lung cancer. Seminars in Radiation Oncology. 20 (3), 156-163 (2010).
- Kunz-Schughart, L. A., Frreyer, J. P., Ebner, R. The use of 3-D cultures for high-throughput screening: The multicellular spheroid model. Journal of Biomolecular Screening. 9 (4), 273-285 (2004).
- Carragher, N., et al. Concerns, challenges and promises of high-content analysis of 3D cellular models. Nature Review Drug Discovery. 17 (8), 606 (2018).
- Huang, Y., et al. Longitudinal morphological and physiological monitoring of three-dimensional tumor spheroids using optical coherence tomography. Journal of Visualized Experiments. (144), e59020 (2019).
- Yazdanfar, S., et al. Simple and robust image-baed autofocusing for digital microscopy. Optics Express. 16 (12), 8670-8677 (2008).
- Chen, Z., et al. Automated evaluation of tumor spheroid behavior in 3D culture using deep learning-based recognition. Biomaterials. 22 (272), 120770 (2021).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Frontiers in Immunology. 11, 603640 (2020).
- Anastasiou, D., et al. Microenvironment factors shaping the cancer metabolism landscape. British Journal of Cancer. 116 (3), 277-286 (2017).
- Zhou, H., et al. Functions and clinical significance of mechanical tumor microenvironment: Cancer cell sensing, mechanobiology and metastasis. Cancer Communications. 43 (5), 374-400 (2022).
- Zhu, G. G., et al. Targeting KRAS cancers: From druggable therapy to druggable resistance. Molecular Cancer. 21 (1), 159 (2022).
- Ando, Y., Mariano, C., Shen, K. Engineered in vitro tumor models for cell-based immunotherapy. Acta Biomaterialia. 132, 345-359 (2021).
- Timmins, N. E., Dietmair, S., Nielsen, L. K. Hanging-drop multicellular spheroids as a model of tumor angiogenesis. Angiogenesis. 7 (2), 97-103 (2004).
- Costa, E. C., et al. 3D tumor spheroids: An overview on the tools and techniques used for their analysis. Biotechnology Advances. 34 (8), 1427-1441 (2016).
- Sant, S., Johnston, P. A. The production of 3D tumor spheroids for cancer drug discovery. Drug Discovery Today. Technologies. 23, 27-36 (2017).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Scientific Reports. 6, 19103 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados