需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
生成用于药物评估研究的 3D 肿瘤微球
* 这些作者具有相同的贡献
摘要
本文演示了一种构建三维肿瘤球体的标准化方法。还描述了使用自动成像系统进行球体观察和基于图像的深度学习分析的策略。
摘要
近几十年来,除了单层培养细胞外,三维肿瘤球状体已被开发为评估抗癌药物的潜在强大工具。然而,传统的培养方法缺乏在三维水平上以均匀方式操纵肿瘤球状体的能力。为了解决这一局限性,在本文中,我们提出了一种构建平均大小的肿瘤球体的方便有效的方法。此外,我们描述了一种使用基于人工智能的分析软件进行基于图像的分析方法,该软件可以扫描整个板并获得三维球体的数据。研究了几个参数。通过使用肿瘤球体构建的标准方法和高通量成像和分析系统,可以显着提高对三维球状体进行的药物测试的有效性和准确性。
引言
癌症是人类最害怕的疾病之一,尤其是因为它的高死亡率1。近年来,随着新疗法的引入,治疗癌症的可能性有所增加2,3,4,5。二维(2D)和三维(3D)体外模型用于在实验室环境中研究癌症。然而,2D模型不能立即准确地评估指示抗肿瘤敏感性的所有重要参数;因此,它们无法完全代表药物治疗测试中的体内相互作用6。
自2020年以来,全球三维(3D)文化市场得到了极大的推动。根据纳斯达克OMX的一份报告,到2025年底,3D细胞培养市场的全球价值将超过27亿美元。与2D培养方法相比,3D细胞培养表现出有利的特性,不仅可以优化增殖和分化,还可以优化长期存活7,8。通过这种方法,可以模拟体内细胞微环境以获得更准确的肿瘤表征,以及代谢分析,从而可以更好地了解基因组和蛋白质的改变。因此,3D测试系统现在应该被纳入主流药物开发业务,特别是那些专注于筛选和评估新型抗肿瘤药物的操作。永生化已建立的细胞系或原代细胞培养物在球状结构中的三维生长具有肿瘤的缺氧和药物渗透等体内特征,以及细胞相互作用、反应和耐药性,可被视为进行体外药物筛选的严格和代表性模型9,10,11。
然而,这些3D文化模型也存在一些可能需要一些时间才能解决的问题。可以使用这些方案形成细胞球状体,但它们在某些细节上有所不同,例如培养时间或包埋凝胶12,因此这些构建的细胞球体不能在有限的尺寸范围内得到很好的控制。微球的大小可能会影响活力测试和成像分析的一致性。生长微环境和生长因子也不同,由于细胞间分化的差异,可能导致不同的形态13。现在显然需要一种标准、简单且具有成本效益的方法来构建具有受控大小的所有类型的肿瘤。
从另一个角度来看,尽管已经开发了均质测定和高内涵成像方法来评估形态、活力和生长速率,但由于文献中报道的各种原因,例如肿瘤球体的位置、大小和形态缺乏均匀性,3D 模型的高通量筛选仍然是一个挑战14,15,16。
在这里介绍的协议中,我们列出了构建3D肿瘤微球的每个步骤,并描述了一种使用高通量,高内涵成像系统的球状体观察和分析方法,该系统涉及自动聚焦,自动成像和分析,以及其他有利特征。我们展示了这种方法如何产生适用于高通量成像的均匀大小的3D肿瘤球体。这些微球还表现出对癌症药物治疗的高敏感性,并且可以使用高内涵成像监测微球的形态变化。总之,我们证明了这种方法作为生成用于药物评估目的的3D肿瘤构建体的手段的稳健性。
研究方案
1. 球体结构
- 培养板的抗粘连处理
- 将 100 μL 抗粘附试剂移液到具有 U 形孔底的 48 孔板的每个孔中,并保持 10 分钟。10分钟后,吸出涂层试剂,并用无菌PBS洗涤两次。
- 将培养板放入培养箱(37°C在加湿空气中,5%CO2)直至使用。
- 细胞制备、收集和计数
- 使用细胞特异性培养基在细胞培养瓶中培养细胞(补充表2)。例如,NCI-H23,CT-26细胞在RPMI 1640中培养,HT-29细胞在McCoy的5A培养基中培养。这两种培养基分别补充了10%的热灭活FBS和1%的P / S。
- 在增殖过程中将所有细胞保持在标准培养条件(37°C在含5%CO2的潮湿空气中)。在这里,NCI-H23细胞系在以下步骤中用作示例。
- 用1x PBS洗涤在T25烧瓶中培养两次的细胞以除去培养基(最好选择对数期的细胞并以80%-90%的汇合度传代细胞)。
- 用1mL的0.25%胰蛋白酶/ EDTA在37°C,5%CO 2的培养箱中处理扩增的细胞1-2分钟。在显微镜下确认细胞形状(在这种情况下通常是圆形),然后停止胰蛋白酶处理。为此,将用过的胰蛋白酶/EDTA悬浮液吸出在T25烧瓶中,并用4mL新鲜培养基洗涤细胞。
- 将所有悬浮液 (5 mL) 转移到 15 mL 管中。使用 1 mL 新鲜培养基冲洗残留细胞并将其添加到试管中。在室温下以186.48× g 离心细胞5分钟。
- 除去上清液,向细胞沉淀中加入10mL新鲜培养基,然后轻轻移液,直到细胞处于均匀的悬浮液中。
- 将 0.1 mL 细胞悬液吸入新的离心管中,加入 0.9 mL 新鲜培养基,然后充分移液悬浮液。
- 提取 10 μL 细胞悬液进行细胞计数。执行此过程两到三次并取平均值。
- 根据步骤1.2.7中从细胞计数过程中获得的浓度,稀释悬浮液以达到50,000个细胞/ mL的最终接种密度。
- 细胞培养和球状体形成
- 向 48 孔 U 底板的每个孔中加入 200 μL 细胞悬液。
- 将密封膜缠绕在板上,并在室温下以119.35× g 离心5分钟。
- 小心地将板从离心机中取出并拉下保护膜。然后,将5-8mL灭菌水加入孔周围的水通道中(以防止蒸发),并在37°C下孵育5天。在此期间,请勿更换/补充水道的任何水。
- 在接下来的5天内观察细胞聚集。
注意:一般来说,细胞在5天内开始结块为集落。然而,对于不同的细胞类型和细胞密度,球状体构建的过程可能更快或更慢。因此,必须每天使用三种可能的方法之一观察细胞。首先,可以通过孔板底部观察细胞。当细胞尚未形成球体时,可以在底部看到单层细胞。当细胞形成球状体时,可以在每个孔的U底部观察到密集的3D构建体。另一种方法是在显微镜下检查细胞。当细胞变成肿瘤球体时,结构涉及三层(增殖层,非活性层和坏死核心,从球体的外部到内部),它们具有透明梯度。最后,培养基的颜色也可用于观察目的。当三层结构无法清晰看到时,即使使用数码显微镜,这也很有用。当培养基从紫红色变为黄色时,可以将球状体包埋在凝胶中。在细胞聚集期间不应更换培养基。
- 凝胶包埋
注意:凝胶需要在低于-20°C的温度下储存。 特别是,凝胶应远离冰箱门放置,以避免温度波动。请注意,凝胶在该过程的这一阶段处于冷冻状态。- 从-20°C冰箱中取出冷冻凝胶,并在实验过程中将其整个时间放在冰盒上。
- 在显微镜下观察细胞球状体。在凝胶包埋开始之前,应再次用数码显微镜检查球体的状态。
- 小心地去除 150 μL 培养基。盘子也应放在保温箱上。
- 通过从孔壁侧缓慢添加液体凝胶,同时移动预冷的移液器吸头在孔内和孔内,将每个球状体嵌入凝胶中。等待 5 分钟,如果凝胶扩散不均匀,则用 10 μL 移液器吸头轻轻移液凝胶。每个孔包含一个肿瘤球体、25 μL 3.5 mg/mL 凝胶和 50 μL 完全培养基。向对照中加入 75 μL 培养基。
注意:每个孔包含一个球体。 - 将板在37°C孵育30分钟,直到水凝胶完全完成。在显微镜下确认凝胶状态。
- 在每个样品上叠加 125 μL 新鲜培养基。
- 将球状体再培养7-10天。准备每组有四到六个孔的球体,并选择至少三个进行分析。
注意:如果进行药物测试,请为一个样本准备两组。一组用于活性测试,而另一组用于图像捕获和分析。
2. 药物治疗
- 按照制造商的说明溶解药物。使用 DMSO 准备 100 倍的工作解决方案。准备至少五剂连续稀释的药物。这里以肺癌治疗药物AMG 510为例。组成如 补充表1所示。
- 使用0.1%DMSO作为阳性对照。
- 向每个孔中加入 125 μL 药物治疗的培养基,并将板放回培养箱中(37 °C 在加湿空气中,含 5% CO2)。在此阶段,每个孔包含一个肿瘤球体、25 μL 3.5 mg/mL 凝胶和 175 μL 培养基。质控品含有 200 μL 培养基。
3. 球体活力
- 根据制造商的指南,使用Alamar Blue检测试剂盒测量球体活力。在进行Alamar Blue处理后,使用微孔板光度计(570nm和600nm处的吸光度)测量活性。
- 分别在将微球包埋在凝胶中的第1天、第4天、第7天和第10天测量活力,或按指示测量活力。
注意:使用Alamar Blue测定时,至少需要16小时的反应时间。因此,在第 0 天、第 3 天、第 6 天和第 9 天的下午加入 20 μL 阿拉马尔蓝。 - 从每个孔中吸取 100 μL 上清液培养基到新的测试板中,并向培养板的每个孔中加入 80 μL 新鲜培养基。然后,更换另外 100 μL 药物治疗的培养基。确保井中没有阿拉马尔蓝的残留物。
注意:每次测试活力时都要进行培养基更换,并且成像分析组的药物治疗培养基需要在同一天更换。
4. 药物测试中通过图像进行球状体观察和深度学习分析
- 成像
- 成像前吸出 100 μL 培养基。
- 将盘子放在舞台上。使用具有10倍物镜(首先是2倍物镜)的自动显微镜获得微球的数字图像。显微镜可以自动聚焦和集中这些球体。
注意:自动对焦功能和使用的算法之前已由Yazdanfar等人报道过17。 - 等待自动成像。为每个微球获取四个图像。使用连接到高内涵成像系统的软件形成和处理集成图像。
- 单击"映像修补过程"按钮,然后在软件中选择集成映像。
- 选择"U-NET模型",然后输入转换率(10倍客观图像的转化率为3.966)。单击下方屏幕底部,开始图像处理。然后,将直径、周长和粗糙度数据保存在电子表格软件中。
- 计算超额周长指数 (EPI)。EPI 是球体周长 (P 0) 和等效周长 (Pe) 之间的比率,由公式 1 计算。使用图像J测量焦平面(S)处的球体面积。然后,使用公式 2 计算椭球体的等效周长。
EPI = (P o− P e)/Pe (公式 1)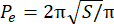 (公式2)
(公式2)
注意:球体周长由软件使用基于开发的 U-NET 模型的深度学习算法生成。 - 用药物加入100μL新鲜培养基,并将板放回培养箱中(37°C在加湿空气中,5%CO2)。
- 球状体抑制
- 使用公式3计算肿瘤生长抑制(TGI)。相对球体体积 (RTV) 是原始体积(公式 4)上的终端体积。球体体积 (V) 由软件使用公式 5 根据球体直径输出自动计算。
TGI = (室温控制−室温治疗)/室温控制 × 100%(等式3)
RTV = V端子/V原件(等式 4)
V = 4/3π(d/2)3 (公式 5)
注意:TGI是参考 体内 生长抑制获得的,肿瘤重量用RTV替换。RTV对照是对照 组的相对球体体积,RTV处理 是药物测试组的相对球体体积,V端 是最后一天球体的体积,V原 是第一个培养日的球体体积, d 代表球体直径。
- 使用公式3计算肿瘤生长抑制(TGI)。相对球体体积 (RTV) 是原始体积(公式 4)上的终端体积。球体体积 (V) 由软件使用公式 5 根据球体直径输出自动计算。
结果
图1A,B显示了本研究中用于构建肿瘤球体的过程。 我们首先将细胞接种在48孔U底板中。此步骤与2D细胞培养中使用的步骤几乎相同。我们将板保存在一个公共培养箱中,孔周围有水,以便沉积的细胞在自组装过程中开始形成球状体。在正常操作条件下,大多数类型的肿瘤球状体在使用靶向培养基5天后完全形成(补充表2)。我们在5天内用数码显微镜...
讨论
微环境在肿瘤生长中起着重要作用。它可能影响细胞外基质、氧梯度、营养和机械相互作用的提供,从而影响肿瘤细胞的基因表达、信号通路和许多功能19,20,21。在许多情况下,2D细胞不会产生这种效果,甚至不会产生相反的效果,从而影响药物治疗的评估。然而,3D模型的出现解决了这个问题。例如,我们使用3D方法完成了对A...
披露声明
作者没有什么可透露的。
致谢
我们感谢实验室的所有成员的重要意见和建议。本研究得到了江苏省卫生健康委员会重点项目(K2019030)的支持。概念化由C.W.和Z.C.进行,方法由W.H.和M.L.执行,调查由W.H.和M.L.执行,数据管理由W.H.,Z.Z.,S.X.和M.L.执行,原始草稿准备由Z.Z.,J.Z.,S.X.,W.H.执行, 和X.L.,审查和编辑由Z.C.执行,项目管理由C.W.和Z.C.执行,资金获取由C.W.进行。所有作者均已阅读并同意该手稿的已出版版本。
材料
| Name | Company | Catalog Number | Comments |
| 0.5-10 μL Pipette tips | AXYGEN | T-300 | |
| 1.5 mL Boil proof microtubes | Axygen | MCT-150-C | |
| 100-1000μL Pipette tips | KIRGEN | KG1313 | |
| 15 mL Centrifuge Tube | Nest | 601052 | |
| 200 μL Pipette tips | AXYGEN | T-200-Y | |
| 3D gel | Avatarget | MA02 | |
| 48-well U bottom Plate | Avatarget | P02-48UWP | |
| 50 mL Centrifuge Tube | Nest | 602052 | |
| Alamar Blue | Thermo | DAL1100 | |
| Anti-Adherence Rinsing Solution | STEMCELL | #07010 | |
| Certified FBS | BI | 04-001-1ACS | |
| Deionized water | aladdin | W433884-500ml | |
| DMEM (Dulbecco's Modified Eagle Medium) | Gibco | 11965-092 | |
| DMSO | sigma | D2650-100ML | |
| Excel sofware | Microsoft office | ||
| Graphpad prism sofware | GraphPad software | ||
| High Content Imager and SMART system | Avatarget | 1-I01 | |
| Image J software | National Institutes of Health | ||
| Insulin-Transferrin-Selenium-A Supplement (100X) | Gibco | 51300-044 | |
| Parafilm | Bemis | PM-996 | |
| PBS | Solarbio | P1020 | |
| Penicillin/streptomycin Sol | Gibco | 15140-122 | |
| RPMI 1640 | Gibco | 11875-093 | |
| Scientific Fluoroskan Ascent | Thermo | Fluoroskan Ascent | |
| T25 Flask | JET Biofil | TCF012050 | |
| Trypsin, 0.25% (1X) | Hyclone | SH30042.01 |
参考文献
- Carioli, G., et al. European cancer mortality predictions for the year 2021 with focus on pancreatic and female lung cancer. Annals of Oncology. 32 (4), 478-487 (2021).
- Katti, A., Diaz, B. J., Caragine, C. M., Sanjana, N. E., Dow, L. E. CRISPR in cancer biology and therapy. Nature Reviews Cancer. 22 (5), 259-279 (2022).
- Abrantes, R., Duarte, H. O., Gomes, C., Walchili, S., Reis, C. A. CAR-Ts: New perspectives in cancer therapy. FEBS Letter. 596 (4), 403-416 (2022).
- Shokooohi, A., et al. Effect of targeted therapy and immunotherapy on advanced nonsmall-cell lung cancer outcomes in the real world. Cancer Medicine. 11 (1), 86-93 (2022).
- Chen, K., Zhang, Y., Qian, L., Wang, P. Emerging strategies to target RAS signaling in human cancer therapy. Journal of Hematology & Oncology. 14 (1), 116 (2021).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Qin, Y., Hu, X., Fan, W., Yan, J. A stretchable scaffold with electrochemical sensing for 3D culture, mechanical loading, and real-time monitoring of cells. Advanced Science. 8 (13), 2003738 (2021).
- Wartenberg, M., et al. Regulation of the multidrug resistance transporter P-glycoprotein in multicellular tumor spheroids by hypoxia-inducible factor (HIF-1) ad reactive oxygen species. FASEB Journal. 17 (3), 503-505 (2003).
- Minchinton, A. I., Tannock, I. F. Drug penetration in solid tumours. Nature Reviews Cancer. 6 (8), 583-592 (2006).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension: How 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Brüningk, S. C., Rivens, I., Box, C., Oelfke, U., Ter Haar, G. 3D tumour spheroids for the prediction of the effects of radiation and hyperthermia treatments. Scientific Reports. 10, 1653 (2020).
- Graves, E. E., Maity, A., Thu Le, Q. The tumor microenvironment in non-small-cell lung cancer. Seminars in Radiation Oncology. 20 (3), 156-163 (2010).
- Kunz-Schughart, L. A., Frreyer, J. P., Ebner, R. The use of 3-D cultures for high-throughput screening: The multicellular spheroid model. Journal of Biomolecular Screening. 9 (4), 273-285 (2004).
- Carragher, N., et al. Concerns, challenges and promises of high-content analysis of 3D cellular models. Nature Review Drug Discovery. 17 (8), 606 (2018).
- Huang, Y., et al. Longitudinal morphological and physiological monitoring of three-dimensional tumor spheroids using optical coherence tomography. Journal of Visualized Experiments. (144), e59020 (2019).
- Yazdanfar, S., et al. Simple and robust image-baed autofocusing for digital microscopy. Optics Express. 16 (12), 8670-8677 (2008).
- Chen, Z., et al. Automated evaluation of tumor spheroid behavior in 3D culture using deep learning-based recognition. Biomaterials. 22 (272), 120770 (2021).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Frontiers in Immunology. 11, 603640 (2020).
- Anastasiou, D., et al. Microenvironment factors shaping the cancer metabolism landscape. British Journal of Cancer. 116 (3), 277-286 (2017).
- Zhou, H., et al. Functions and clinical significance of mechanical tumor microenvironment: Cancer cell sensing, mechanobiology and metastasis. Cancer Communications. 43 (5), 374-400 (2022).
- Zhu, G. G., et al. Targeting KRAS cancers: From druggable therapy to druggable resistance. Molecular Cancer. 21 (1), 159 (2022).
- Ando, Y., Mariano, C., Shen, K. Engineered in vitro tumor models for cell-based immunotherapy. Acta Biomaterialia. 132, 345-359 (2021).
- Timmins, N. E., Dietmair, S., Nielsen, L. K. Hanging-drop multicellular spheroids as a model of tumor angiogenesis. Angiogenesis. 7 (2), 97-103 (2004).
- Costa, E. C., et al. 3D tumor spheroids: An overview on the tools and techniques used for their analysis. Biotechnology Advances. 34 (8), 1427-1441 (2016).
- Sant, S., Johnston, P. A. The production of 3D tumor spheroids for cancer drug discovery. Drug Discovery Today. Technologies. 23, 27-36 (2017).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Scientific Reports. 6, 19103 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。