JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
약물 평가 연구를 위한 3D 종양 스페로이드 생성
* 이 저자들은 동등하게 기여했습니다
요약
이 글에서는 3차원 종양 스페로이드를 구성하기 위한 표준화된 방법을 보여줍니다. 자동화된 이미징 시스템을 사용한 스페로이드 관찰 및 이미지 기반 딥러닝 분석을 위한 전략도 설명합니다.
초록
최근 수십 년 동안 단층 배양 세포 외에도 3차원 종양 스페로이드가 항암제 평가를 위한 잠재적으로 강력한 도구로 개발되었습니다. 그러나 종래의 배양 방법은 3차원 수준에서 균질한 방식으로 종양 스페로이드를 조작하는 능력이 부족합니다. 이러한 한계를 해결하기 위해 본 논문에서는 평균 크기의 종양 스페로이드를 구성하는 편리하고 효과적인 방법을 제시합니다. 또한 전체 플레이트를 스캔하고 3차원 스페로이드에 대한 데이터를 얻을 수 있는 인공 지능 기반 분석 소프트웨어를 사용한 이미지 기반 분석 방법에 대해 설명합니다. 몇 가지 매개 변수가 연구되었습니다. 표준 종양 스페로이드 구성 방법과 고처리량 이미징 및 분석 시스템을 사용하면 3차원 스페로이드에서 수행되는 약물 테스트의 효과와 정확성을 크게 높일 수 있습니다.
서문
암은 인간이 가장 두려워하는 질병 중 하나이며, 특히 높은 사망률때문에 1. 최근 몇 년 동안 새로운 치료법이 도입됨에 따라 암 치료 가능성이 높아졌습니다 2,3,4,5. 2차원(2D) 및 3차원(3D) 체외 모델은 실험실 환경에서 암을 연구하는 데 사용됩니다. 그러나 2D 모델은 항종양 민감도를 나타내는 모든 중요한 매개변수를 즉각적이고 정확하게 평가할 수 없습니다. 따라서 약물 치료 테스트에서 생체 내 상호작용을 완전히 나타내지 못한다6.
2020년부터 글로벌 3차원(3D) 문화 시장이 크게 성장했습니다. NASDAQ OMX의 한 보고서에 따르면 3D 세포 배양 시장의 글로벌 가치는 2025년 말까지 27억 달러를 초과할 것입니다. 2D 배양 방법과 비교하여 3D 세포 배양은 증식 및 분화뿐만 아니라 장기 생존을 위해 최적화할 수 있는 유리한 특성을 나타냅니다 7,8. 이러한 수단을 통해 생체 내 세포 미세 환경을 시뮬레이션하여 보다 정확한 종양 특성화와 대사 프로파일링을 얻을 수 있으므로 게놈 및 단백질 변화를 더 잘 이해할 수 있습니다. 이로 인해 3D 테스트 시스템은 이제 주류 약물 개발 작업, 특히 새로운 항암제 스크리닝 및 평가에 중점을 둔 작업에 포함되어야 합니다. 스페로이드 구조에서 불멸화된 확립된 세포주 또는 일차 세포 배양의 3차원 성장은 저산소증 및 약물 침투와 같은 종양의 생체 내 특징뿐만 아니라 세포 상호작용, 반응 및 내성을 가지며, 시험관 내 약물 스크리닝을 수행하기 위한 엄격하고 대표적인 모델로 간주될 수 있습니다 9,10,11.
그러나 이러한 3D 배양 모델에는 해결하는 데 시간이 걸릴 수 있는 몇 가지 문제가 있습니다. 세포 스페로이드는 이러한 프로토콜을 사용하여 형성될 수 있지만, 배양 시간 또는 매립 겔(12)과 같은 특정 세부사항에서 상이하므로, 이러한 구성된 세포 스페로이드는 제한된 크기 범위 하에서 잘 제어될 수 없다. 스페로이드의 크기는 생존력 테스트 및 이미징 분석의 일관성에 영향을 미칠 수 있습니다. 성장 미세 환경과 성장 인자 또한 다양하며, 이는 세포 간의 분화의 차이로 인해 다른 형태를 초래할 수 있다13. 이제 제어된 크기로 모든 유형의 종양을 구성하기 위한 표준적이고 간단하며 비용 효율적인 방법이 분명히 필요합니다.
또 다른 관점에서, 형태, 생존력 및 성장률을 평가하기 위해 균질한 분석 및 고함량 이미징 접근법이 개발되었지만, 종양 스페로이드의 위치, 크기 및 형태의 균일성 부족과 같은 문헌에 보고된 다양한 이유로 3D 모델의 고처리량 스크리닝은 여전히 도전 과제로 남아 있습니다14,15,16.
여기에 제시된 프로토콜에서는 3D 종양 스페로이드 구성의 각 단계를 나열하고 다른 유리한 특성 중에서 자동 초점, 자동 이미징 및 분석을 포함하는 고처리량, 고함량 이미징 시스템을 사용하여 스페로이드 관찰 및 분석 방법을 설명합니다. 우리는 이 방법이 어떻게 고처리량 이미징에 적합한 균일한 크기의 3D 종양 스페로이드를 생성할 수 있는지 보여줍니다. 이러한 스페로이드는 또한 암 약물 치료에 대한 높은 민감도를 나타내며 고함량 이미징을 사용하여 스페로이드의 형태학적 변화를 모니터링할 수 있습니다. 요약하면, 우리는 약물 평가 목적을 위한 3D 종양 구조를 생성하는 수단으로서 이 방법론의 견고성을 입증합니다.
프로토콜
1. 스페로이드 구조
- 배양 접시의 유착 방지 처리
- 유착방지제 시약 100 μL를 U자형 웰 바닥이 있는 48웰 플레이트의 각 웰에 피펫팅하고, 10분 동안 유지한다. 10분 후, 코팅 시약을 흡인하고, 멸균된 PBS로 2회 세척한다.
- 배양 접시를 사용할 때까지 인큐베이터(37°C, 5%CO2로 가습된 공기)에 넣는다.
- 세포 준비, 수집 및 계수
- 세포에 특이적인 배양 배지를 사용하여 세포 배양 플라스크에서 세포를 배양한다(보충표 2). 예를 들어, NCI-H23, CT-26 세포는 RPMI 1640에서 배양되고, HT-29 세포는 McCoy's 5A 배지에서 배양된다. 이 두 매체에는 각각 10% 열 비활성화 FBS 및 1% P/S가 보충됩니다.
- 증식 동안 모든 세포를 표준 배양 조건(5%CO2로 가습된 공기 중에서 37°C)으로 유지한다. 여기서, NCI-H23 세포주는 다음 단계의 예로서 사용된다.
- T25 플라스크에서 배양된 세포를 1x PBS로 두 번 세척하여 배양 배지를 제거합니다(대수 단계에서 세포를 선택하고 80%-90%의 밀도로 세포를 계대하는 것이 좋습니다).
- 확장된 세포를 1mL의 0.25% 트립신/EDTA로 37°C, 5%CO2의 인큐베이터에서 1-2분 동안 처리합니다. 현미경으로 세포 모양(이 경우 일반적으로 원형)을 확인한 다음 트립신 처리를 중지합니다. 이를 위해 T25 플라스크에서 사용된 트립신/EDTA 현탁액을 흡인하고 4mL의 신선한 배지로 세포를 세척합니다.
- 모든 현탁액(5mL)을 15mL 튜브로 옮깁니다. 1mL의 신선한 배지를 사용하여 잔류 세포를 씻어내고 튜브에 추가합니다. 세포를 실온에서 5분 동안 186.48 x g 로 원심분리합니다.
- 상층액을 제거하고 세포 펠릿에 10mL의 신선한 배지를 첨가한 다음 세포가 균질한 현탁액이 될 때까지 부드럽게 피펫팅합니다.
- 0.1mL의 세포 현탁액을 새 원심분리기 튜브에 흡인하고 0.9mL의 새로운 배지를 추가한 다음 현탁액을 잘 피펫팅합니다.
- 세포 계수를 위해 세포 현탁액 10 μL를 추출한다. 이 과정을 두세 번 수행하고 평균값을 취하십시오.
- 50,000 단계의 세포 계수 프로세스에서 얻은 농도에 따라 1.2.7 cells/mL의 최종 파종 밀도에 도달하도록 현탁액을 희석합니다.
- 세포 배양 및 스페로이드 형성
- 200μL의 세포 현탁액을 48웰 U자형 바닥 플레이트의 각 웰에 추가합니다.
- 플레이트 주위에 밀봉 필름을 감싸고 실온에서 5분 동안 119.35 x g 로 원심분리합니다.
- 원심분리기에서 플레이트를 조심스럽게 꺼내고 보호 필름을 당겨 빼냅니다. 그런 다음 5-8mL의 멸균수를 우물을 둘러싼 수로에 넣고(증발을 방지하기 위해) 37°C에서 5일 동안 배양합니다. 해당 기간 동안 수로에 물을 변경/보충하지 마십시오.
- 다음 5일 동안 세포 응집을 관찰합니다.
참고: 일반적으로 세포는 5일 이내에 집락으로 뭉치기 시작합니다. 그러나 스페로이드 구성 과정은 세포 유형과 세포 밀도가 다르면 더 빠르거나 느릴 수 있습니다. 이 때문에 가능한 세 가지 방법 중 하나를 사용하여 매일 세포를 관찰해야합니다. 먼저, 웰 플레이트의 바닥을 통해 세포를 관찰할 수 있다. 세포가 아직 스페로이드를 형성하지 않은 경우 바닥에 단일 세포 층을 볼 수 있습니다. 세포가 스페로이드를 형성하면 각 웰의 U-바닥에서 조밀한 3D 구조를 관찰할 수 있습니다. 또 다른 방법은 현미경으로 세포를 확인하는 것입니다. 세포가 종양 스페로이드가 되면 구조는 투명도 구배를 갖는 3개의 층(증식층, 비활성층, 괴사 코어, 스페로이드의 외부에서 내부까지)을 포함합니다. 마지막으로, 배양 배지의 색상은 관찰 목적으로도 사용될 수 있습니다. 이는 디지털 현미경을 사용해도 3층 구조를 명확하게 볼 수 없을 때 유용할 수 있습니다. 배지가 보라색-빨간색에서 노란색으로 바뀌면 젤에 스페로이드를 매립하는 과정이 시작될 수 있습니다. 세포 응집 기간 동안 배지를 교체해서는 안 됩니다.
- 젤 임베딩
참고: 젤은 -20°C 이하의 온도에서 보관해야 합니다. 특히 젤은 온도 변화를 피하기 위해 냉장고 문에서 멀리 떨어진 곳에 두어야 합니다. 젤은 공정의 이 단계에서 동결된 상태에 있습니다.- -20 °C 냉장고에서 냉동 젤을 꺼내 실험 기간 동안 전체 시간 동안 아이스 박스에 놓습니다.
- 현미경으로 세포 스페로이드를 관찰합니다. 젤 임베딩이 시작되기 전에 디지털 현미경으로 스페로이드의 상태를 다시 확인해야 합니다.
- 배지 150μL를 조심스럽게 제거합니다. 접시는 또한 아이스 박스 위에 놓아야합니다.
- 미리 냉각된 피펫 팁을 웰 주변과 내부로 이동하면서 웰의 벽 쪽에서 액체 젤을 천천히 추가하여 각 스페로이드를 젤에 삽입합니다. 5분 동안 기다렸다가 젤이 고르게 퍼지지 않으면 10μL 피펫 팁으로 젤을 부드럽게 피펫팅합니다. 각 웰에는 종양 스페로이드, 3.5mg/mL 겔 25μL 및 완전 배양 배지 50μL가 들어 있습니다. 대조군에도 75μL의 배지를 추가합니다.
참고: 각 웰에는 하나의 스페로이드가 포함되어 있습니다. - 플레이트를 37°C에서 30분 동안 하이드로겔화가 완전히 완료될 때까지 인큐베이션한다. 현미경으로 겔화 상태를 확인합니다.
- 각 샘플에 125 μL의 신선한 배지를 오버레이합니다.
- 스페로이드를 7-10일 더 배양합니다. 각각 4-6개의 웰이 있는 스페로이드 그룹을 준비하고 분석을 위해 그 중 최소 3개를 선택합니다.
참고: 약물 검사를 수행하는 경우 하나의 샘플에 대해 두 그룹을 준비합니다. 한 그룹은 생존성 테스트에 사용되고 다른 그룹은 이미지 캡처 및 분석에 사용됩니다.
2. 약물 치료
- 제조업체의 지침에 따라 약물을 용해하십시오. DMSO로 100x 작업 솔루션을 준비합니다. 연속 희석으로 최소 5 회 복용하십시오. 여기서, 폐암 치료제인 AMG 510을 예로 들 수 있다. 조성은 보충표 1에 제시되어 있다.
- 양성 대조군으로 0.1% DMSO를 사용하십시오.
- 125 μL의 약물 처리 배지를 각 웰에 첨가하고, 플레이트를 다시 인큐베이터(5%CO2로 가습된 공기 중에서 37°C)에 넣는다. 이 단계에서 각 웰에는 종양 스페로이드, 3.5mg/mL 겔 25μL 및 배지 175μL가 포함되어 있습니다. 대조군에는 200 μL의 배지가 포함되어 있습니다.
3. 스페로이드 생존력
- 제조업체의 지침에 따라 Alamar Blue 분석 키트를 사용하여 스페로이드 생존력을 측정합니다. Alamar Blue 처리가 수행된 후 마이크로플레이트 광도계(570 nm 및 600 nm에서의 흡광도)를 이용하여 생존율을 측정한다.
- 스페로이드를 겔에 각각 포매한 후 1일, 4일, 7일째 및 10일째에 또는 지시된 대로 생존율을 측정합니다.
참고: Alamar Blue 분석을 사용할 때 최소 16시간의 반응 시간이 필요합니다. 따라서 0일, 3일, 6일 및 9일 오후에 20μL의 Alamar Blue를 추가합니다. - 각 웰의 상청액 배지 100μL를 새 테스트 플레이트로 흡인하고 80μL의 신선한 배지를 배양 플레이트의 각 웰에 추가합니다. 그런 다음 약물 처리 배지 100μL를 추가로 교체합니다. 우물에 알라마르 블루의 잔해가 없는지 확인하십시오.
참고: 배지 교체는 생존력이 테스트될 때마다 수행되며, 이미징 분석 그룹의 약물 처리 배지는 같은 날 교체해야 합니다.
4. 약물 검사에서 이미지를 통한 스페로이드 관찰 및 딥러닝 분석
- 이미징
- 이미징 전에 배지 100μL를 흡인합니다.
- 접시를 무대에 놓습니다. 10x 대물렌즈(2x 대물렌즈 우선)의 자동 현미경을 사용하여 스페로이드의 디지털 이미지를 얻을 수 있습니다. 현미경은 이러한 스페로이드에 자동으로 초점을 맞추고 중앙 집중화할 수 있습니다.
참고: 자동 초점 기능과 사용된 알고리즘은 이전에 Yazdanfar et al.17에 의해 보고되었습니다. - 자동 이미징을 기다립니다. 각 스페로이드에 대해 4개의 이미지가 획득됩니다. 통합 이미지는 high-content imaging system에 연결된 소프트웨어로 형성되고 처리됩니다.
- "이미지 패치 프로세스" 버튼을 클릭하고 소프트웨어에서 통합된 이미지를 선택합니다.
- "U-NET 모델"을 선택하고 전환율을 입력합니다(10x 대물 이미지의 전환율은 3.966). 아래 화면 하단의 을 클릭하여 이미지 처리를 시작합니다. 그런 다음 지름, 둘레 및 거칠기 데이터를 스프레드시트 소프트웨어에 저장합니다.
- 초과 경계 지수(EPI)를 계산합니다. EPI는 식 1에 의해 계산된 바와 같이 스페로이드 둘레(P0)와 등가 둘레(Pe) 사이의 비율이다. Image J를 사용하여 초점면(S)에서 스페로이드의 면적을 측정합니다. 그런 다음 식 2를 사용하여 스페로이드의 등가 둘레를 계산합니다.
EPI = (P o− P e)/Pe (식 1)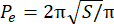 (식 2)
(식 2)
참고: 스페로이드 둘레는 개발된 U-NET 모델을 기반으로 하는 딥 러닝 알고리즘을 사용하여 소프트웨어에 의해 생성됩니다. - 약물과 함께 100 μL의 신선한 배지를 첨가하고 플레이트를 다시 인큐베이터(5%CO2로 가습된 공기에서 37°C)에 넣습니다.
- 스페로이드 억제
- 식 3을 사용하여 종양 성장 억제(TGI)를 계산합니다. 상대 스페로이드 부피(RTV)는 원래 부피에 대한 말단 부피입니다(식 4). 스페로이드 부피(V)는 스페로이드 직경 출력에 따라 식 5를 사용하여 소프트웨어에 의해 자동으로 계산됩니다.
TGI = (RTV 대조군− RTV처리)/RTV대조군 × 100% (식 3)
RTV = V단자/V오리지널 (수식 4)
V = 4/3π(d/2)3 (식 5)
참고: TGI는 생체 내 성장 억제를 참조하여 얻어지며 종양 무게는 RTV로 대체됩니다. RTV 대조군은대조군 의 상대적 스페로이드 부피, RTV처리 는 약물 시험군의 상대적 스페로이드 부피, V말단 은 마지막 날의 스페로이드 부피, V원 은 배양 1일의 스페로이드 부피, d 는 스페로이드 직경을 나타냅니다.
- 식 3을 사용하여 종양 성장 억제(TGI)를 계산합니다. 상대 스페로이드 부피(RTV)는 원래 부피에 대한 말단 부피입니다(식 4). 스페로이드 부피(V)는 스페로이드 직경 출력에 따라 식 5를 사용하여 소프트웨어에 의해 자동으로 계산됩니다.
결과
그림 1A,B는 이 연구에서 종양 스페로이드를 구성하는 데 사용된 프로세스를 보여줍니다. 우리는 먼저 48웰 U자형 바닥 플레이트에 세포를 시드했습니다. 이 단계는 2D 세포 배양에 사용되는 단계와 거의 동일합니다. 우리는 우물을 둘러싸고 있는 물이 있는 공통 인큐베이터에 플레이트를 보관하여 증착된 세포가 자가 조립 과정에서 스페로이드를 형성하기 시작?...
토론
미세 환경은 종양 성장에 중요한 역할을 합니다. 그것은 세포 외 기질, 산소 구배, 영양 및 기계적 상호 작용의 제공에 영향을 미칠 수 있으며, 따라서 유전자 발현, 신호 경로 및 종양 세포의 많은 기능에 영향을 미칠 수 있습니다 19,20,21. 많은 경우에, 2D 세포는 그러한 효과를 내지 못하거나 심지어 반대 효과를 생성하여, 약물 ...
공개
저자는 공개 할 것이 없습니다.
감사의 말
중요한 의견과 제안을 해주신 모든 실험실 구성원에게 감사드립니다. 이 연구는 Jiangsu Commission of Health (K2019030)의 핵심 프로젝트에 의해 지원되었습니다. 개념화는 C.W.와 Z.C.에 의해, 방법론은 W.H.와 M.L.에 의해 수행되었고, 조사는 W.H.와 M.L.에 의해 수행되었고, 데이터 큐레이션은 W.H., Z.Z., S.X., M.L.에 의해 수행되었고, 원래 초안 준비는 Z.Z., J.Z., S.X., W.H., 및 X.L., 검토 및 편집은 Z.C.에서, 프로젝트 관리는 C.W.와 Z.C.에서, 자금 조달은 C.W.에서 수행했습니다. 모든 저자는 출판된 버전의 원고를 읽고 동의했습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.5-10 μL Pipette tips | AXYGEN | T-300 | |
| 1.5 mL Boil proof microtubes | Axygen | MCT-150-C | |
| 100-1000μL Pipette tips | KIRGEN | KG1313 | |
| 15 mL Centrifuge Tube | Nest | 601052 | |
| 200 μL Pipette tips | AXYGEN | T-200-Y | |
| 3D gel | Avatarget | MA02 | |
| 48-well U bottom Plate | Avatarget | P02-48UWP | |
| 50 mL Centrifuge Tube | Nest | 602052 | |
| Alamar Blue | Thermo | DAL1100 | |
| Anti-Adherence Rinsing Solution | STEMCELL | #07010 | |
| Certified FBS | BI | 04-001-1ACS | |
| Deionized water | aladdin | W433884-500ml | |
| DMEM (Dulbecco's Modified Eagle Medium) | Gibco | 11965-092 | |
| DMSO | sigma | D2650-100ML | |
| Excel sofware | Microsoft office | ||
| Graphpad prism sofware | GraphPad software | ||
| High Content Imager and SMART system | Avatarget | 1-I01 | |
| Image J software | National Institutes of Health | ||
| Insulin-Transferrin-Selenium-A Supplement (100X) | Gibco | 51300-044 | |
| Parafilm | Bemis | PM-996 | |
| PBS | Solarbio | P1020 | |
| Penicillin/streptomycin Sol | Gibco | 15140-122 | |
| RPMI 1640 | Gibco | 11875-093 | |
| Scientific Fluoroskan Ascent | Thermo | Fluoroskan Ascent | |
| T25 Flask | JET Biofil | TCF012050 | |
| Trypsin, 0.25% (1X) | Hyclone | SH30042.01 |
참고문헌
- Carioli, G., et al. European cancer mortality predictions for the year 2021 with focus on pancreatic and female lung cancer. Annals of Oncology. 32 (4), 478-487 (2021).
- Katti, A., Diaz, B. J., Caragine, C. M., Sanjana, N. E., Dow, L. E. CRISPR in cancer biology and therapy. Nature Reviews Cancer. 22 (5), 259-279 (2022).
- Abrantes, R., Duarte, H. O., Gomes, C., Walchili, S., Reis, C. A. CAR-Ts: New perspectives in cancer therapy. FEBS Letter. 596 (4), 403-416 (2022).
- Shokooohi, A., et al. Effect of targeted therapy and immunotherapy on advanced nonsmall-cell lung cancer outcomes in the real world. Cancer Medicine. 11 (1), 86-93 (2022).
- Chen, K., Zhang, Y., Qian, L., Wang, P. Emerging strategies to target RAS signaling in human cancer therapy. Journal of Hematology & Oncology. 14 (1), 116 (2021).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Qin, Y., Hu, X., Fan, W., Yan, J. A stretchable scaffold with electrochemical sensing for 3D culture, mechanical loading, and real-time monitoring of cells. Advanced Science. 8 (13), 2003738 (2021).
- Wartenberg, M., et al. Regulation of the multidrug resistance transporter P-glycoprotein in multicellular tumor spheroids by hypoxia-inducible factor (HIF-1) ad reactive oxygen species. FASEB Journal. 17 (3), 503-505 (2003).
- Minchinton, A. I., Tannock, I. F. Drug penetration in solid tumours. Nature Reviews Cancer. 6 (8), 583-592 (2006).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension: How 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Brüningk, S. C., Rivens, I., Box, C., Oelfke, U., Ter Haar, G. 3D tumour spheroids for the prediction of the effects of radiation and hyperthermia treatments. Scientific Reports. 10, 1653 (2020).
- Graves, E. E., Maity, A., Thu Le, Q. The tumor microenvironment in non-small-cell lung cancer. Seminars in Radiation Oncology. 20 (3), 156-163 (2010).
- Kunz-Schughart, L. A., Frreyer, J. P., Ebner, R. The use of 3-D cultures for high-throughput screening: The multicellular spheroid model. Journal of Biomolecular Screening. 9 (4), 273-285 (2004).
- Carragher, N., et al. Concerns, challenges and promises of high-content analysis of 3D cellular models. Nature Review Drug Discovery. 17 (8), 606 (2018).
- Huang, Y., et al. Longitudinal morphological and physiological monitoring of three-dimensional tumor spheroids using optical coherence tomography. Journal of Visualized Experiments. (144), e59020 (2019).
- Yazdanfar, S., et al. Simple and robust image-baed autofocusing for digital microscopy. Optics Express. 16 (12), 8670-8677 (2008).
- Chen, Z., et al. Automated evaluation of tumor spheroid behavior in 3D culture using deep learning-based recognition. Biomaterials. 22 (272), 120770 (2021).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Frontiers in Immunology. 11, 603640 (2020).
- Anastasiou, D., et al. Microenvironment factors shaping the cancer metabolism landscape. British Journal of Cancer. 116 (3), 277-286 (2017).
- Zhou, H., et al. Functions and clinical significance of mechanical tumor microenvironment: Cancer cell sensing, mechanobiology and metastasis. Cancer Communications. 43 (5), 374-400 (2022).
- Zhu, G. G., et al. Targeting KRAS cancers: From druggable therapy to druggable resistance. Molecular Cancer. 21 (1), 159 (2022).
- Ando, Y., Mariano, C., Shen, K. Engineered in vitro tumor models for cell-based immunotherapy. Acta Biomaterialia. 132, 345-359 (2021).
- Timmins, N. E., Dietmair, S., Nielsen, L. K. Hanging-drop multicellular spheroids as a model of tumor angiogenesis. Angiogenesis. 7 (2), 97-103 (2004).
- Costa, E. C., et al. 3D tumor spheroids: An overview on the tools and techniques used for their analysis. Biotechnology Advances. 34 (8), 1427-1441 (2016).
- Sant, S., Johnston, P. A. The production of 3D tumor spheroids for cancer drug discovery. Drug Discovery Today. Technologies. 23, 27-36 (2017).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Scientific Reports. 6, 19103 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유