È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Generazione di sferoidi tumorali 3D per studi di valutazione dei farmaci
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo articolo dimostra un metodo standardizzato per la costruzione di sferoidi tumorali tridimensionali. Viene inoltre descritta una strategia per l'osservazione degli sferoidi e l'analisi di apprendimento profondo basata su immagini utilizzando un sistema di imaging automatizzato.
Abstract
Negli ultimi decenni, oltre alle cellule coltivate monostrato, gli sferoidi tumorali tridimensionali sono stati sviluppati come uno strumento potenzialmente potente per la valutazione dei farmaci antitumorali. Tuttavia, i metodi di coltura convenzionali non hanno la capacità di manipolare gli sferoidi tumorali in modo omogeneo a livello tridimensionale. Per affrontare questa limitazione, in questo articolo, presentiamo un metodo conveniente ed efficace per costruire sferoidi tumorali di medie dimensioni. Inoltre, descriviamo un metodo di analisi basato su immagini utilizzando un software di analisi basato sull'intelligenza artificiale in grado di scansionare l'intera lastra e ottenere dati sugli sferoidi tridimensionali. Sono stati studiati diversi parametri. Utilizzando un metodo standard di costruzione sferoidale tumorale e un sistema di imaging e analisi ad alto rendimento, l'efficacia e l'accuratezza dei test farmacologici eseguiti su sferoidi tridimensionali possono essere notevolmente aumentate.
Introduzione
Il cancro è una delle malattie più temute dagli esseri umani, anche a causa del suo alto tasso di mortalità1. Negli ultimi anni, la possibilità di curare il cancro è aumentata con l'introduzione di nuove terapie 2,3,4,5. I modelli in vitro bidimensionali (2D) e tridimensionali (3D) vengono utilizzati per studiare il cancro in un ambiente di laboratorio. Tuttavia, i modelli 2D non possono valutare immediatamente e accuratamente tutti i parametri importanti che indicano la sensibilità antitumorale; pertanto, non riescono a rappresentare pienamente le interazioni in vivo nei test di terapia farmacologica6.
Dal 2020, il mercato globale della cultura tridimensionale (3D) è stato notevolmente potenziato. Secondo un rapporto del NASDAQ OMX, il valore globale del mercato delle colture cellulari 3D supererà i 2,7 miliardi di dollari entro la fine del 2025. Rispetto ai metodi di coltura 2D, la coltura cellulare 3D presenta proprietà vantaggiose, che possono essere ottimizzate non solo per la proliferazione e la differenziazione, ma anche per la sopravvivenza a lungo termine 7,8. In questo modo, i microambienti cellulari in vivo possono essere simulati per ottenere una caratterizzazione più accurata del tumore, nonché un profilo metabolico, in modo che le alterazioni genomiche e proteiche possano essere meglio comprese. A causa di ciò, i sistemi di test 3D dovrebbero ora essere inclusi nelle operazioni di sviluppo di farmaci tradizionali, in particolare quelli con particolare attenzione allo screening e alla valutazione di nuovi farmaci antitumorali. Le crescite tridimensionali di linee cellulari consolidate immortalizzate o colture cellulari primarie in strutture sferoidi possiedono caratteristiche in vivo di tumori come ipossia e penetrazione di farmaci, nonché interazione, risposta e resistenza cellulare, e possono essere considerate un modello rigoroso e rappresentativo per eseguire lo screening farmacologico in vitro 9,10,11.
Tuttavia, questi modelli di cultura 3D soffrono anche di diversi problemi che potrebbero richiedere del tempo per essere risolti. Gli sferoidi cellulari possono essere formati utilizzando questi protocolli, ma differiscono in alcuni dettagli, come il tempo di coltura o l'incorporazione di gel12, quindi questi sferoidi cellulari costruiti non possono essere ben controllati in un intervallo di dimensioni limitato. La dimensione degli sferoidi può influenzare la coerenza del test di vitalità e dell'analisi di imaging. Anche i microambienti di crescita e i fattori di crescita variano, il che può portare a morfologie diverse a causa delle differenze nella differenziazione tra le cellule13. Ora c'è un'ovvia necessità di un metodo standard, semplice ed economico per la costruzione di tutti i tipi di tumori con dimensioni controllate.
Da un'altra prospettiva, sebbene siano stati sviluppati saggi omogenei e approcci di imaging ad alto contenuto per valutare morfologia, vitalità e tasso di crescita, lo screening ad alto rendimento dei modelli 3D rimane una sfida per vari motivi riportati in letteratura, come la mancanza di uniformità nella posizione, dimensione e morfologia degli sferoidi tumorali14,15,16.
Nel protocollo qui presentato, elenchiamo ogni fase nella costruzione di sferoidi tumorali 3D e descriviamo un metodo per l'osservazione e l'analisi sferoidale utilizzando un sistema di imaging ad alto rendimento e ad alto contenuto che coinvolge auto-focus, auto-imaging e analisi, tra le altre caratteristiche vantaggiose. Mostriamo come questo metodo può produrre sferoidi tumorali 3D di dimensioni uniformi che sono adatti per l'imaging ad alto rendimento. Questi sferoidi dimostrano anche un'elevata sensibilità al trattamento farmacologico del cancro e i cambiamenti morfologici negli sferoidi possono essere monitorati utilizzando l'imaging ad alto contenuto. In sintesi, dimostriamo la robustezza di questa metodologia come mezzo per generare costrutti tumorali 3D per scopi di valutazione dei farmaci.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Costruzione sferoidale
- Trattamento antiadesione della piastra di coltura
- Pipettare 100 μL di reagente anti-adesione in ciascun pozzetto di una piastra a 48 pozzetti con un fondo a forma di U e conservare per 10 minuti. Dopo 10 minuti, aspirare il reagente di rivestimento e lavare due volte con PBS sterilizzato.
- Mettere la piastra di coltura in un incubatore (37 °C in aria umidificata con 5% di CO2) fino all'uso.
- Preparazione, raccolta e conteggio delle cellule
- Utilizzare il terreno di coltura specifico delle cellule per la coltura delle cellule in palloni di coltura cellulare (tabella supplementare 2). Ad esempio, le cellule NCI-H23, CT-26 sono coltivate in RPMI 1640 e le cellule HT-29 sono coltivate nel mezzo 5A di McCoy. Questi due fluidi sono integrati con il 10% di FBS inattivato dal calore e l'1% di P/S, rispettivamente.
- Mantenere tutte le cellule in condizioni di coltura standard (37 °C in aria umidificata con 5% di CO2) durante la proliferazione. Qui, la linea cellulare NCI-H23 viene utilizzata come esempio nei seguenti passaggi.
- Lavare le cellule coltivate in un pallone T25 due volte con 1x PBS per rimuovere il terreno di coltura (è meglio scegliere le cellule nella fase logaritmica e far passare le cellule a una confluenza dell'80% -90%).
- Trattare le cellule espanse con 1 mL di tripsina/EDTA allo 0,25% per 1-2 minuti in un incubatore a 37 °C, 5% CO2. Confermare la forma della cellula (normalmente circolare in questo caso) al microscopio, quindi interrompere il trattamento con tripsina. Per fare ciò, aspirare la sospensione di tripsina/EDTA usata nel pallone T25 e lavare le celle con 4 ml di terreno fresco.
- Trasferire tutta la sospensione (5 ml) in un tubo da 15 ml. Utilizzare 1 ml di terreno fresco per lavare le cellule residue e aggiungerlo al tubo. Centrifugare le celle a 186,48 x g per 5 minuti a temperatura ambiente.
- Rimuovere il surnatante e aggiungere 10 ml di terreno fresco al pellet cellulare, seguito da un delicato pipettaggio fino a quando le cellule sono in una sospensione omogenea.
- Aspirare 0,1 mL di sospensione cellulare in una nuova provetta da centrifuga, aggiungere 0,9 mL di mezzo fresco, quindi pipettare bene la sospensione.
- Estrarre 10 μL della sospensione cellulare per il conteggio delle cellule. Esegui questo processo due o tre volte e prendi un valore medio.
- Diluire la sospensione per raggiungere una densità finale di semina di 50.000 cellule/ml, secondo la concentrazione ottenuta dal processo di conteggio delle cellule nella fase 1.2.7.
- Coltura cellulare e formazione di sferoidi
- Aggiungere 200 μL della sospensione cellulare a ciascun pozzetto di una piastra inferiore a U a 48 pozzetti.
- Avvolgere la pellicola sigillante attorno alla piastra e centrifugarla a 119,35 x g per 5 minuti a temperatura ambiente.
- Estrarre con cautela la piastra dalla centrifuga e rimuovere la pellicola protettiva. Quindi, aggiungere 5-8 ml di acqua sterilizzata nel canale d'acqua che circonda i pozzetti (per evitare l'evaporazione) e incubare a 37 ° C per 5 giorni. Non cambiare/integrare l'acqua nel canale dell'acqua durante il periodo.
- Osservare l'aggregazione cellulare durante i seguenti 5 giorni.
NOTA: In generale, le cellule iniziano ad aggregarsi come colonie entro 5 giorni. Tuttavia, il processo di costruzione sferoidale può essere più veloce o più lento con diversi tipi di cellule e densità cellulari. A causa di ciò, le cellule devono essere osservate ogni giorno utilizzando uno dei tre metodi possibili. In primo luogo, le cellule possono essere osservate attraverso il fondo della piastra del pozzo. Quando le cellule non hanno ancora formato uno sferoide, un singolo strato di cellule può essere visto sul fondo. Quando le cellule formano uno sferoide, un denso costrutto 3D può essere osservato sul fondo a U di ciascun pozzetto. Un altro metodo prevede il controllo delle cellule al microscopio. Quando le cellule diventano uno sferoide tumorale, la costruzione coinvolge tre strati (uno strato proliferante, uno strato inattivo e un nucleo necrotico, dall'esterno all'interno dello sferoide), che hanno un gradiente di trasparenza. Infine, il colore del terreno di coltura può essere utilizzato anche per scopi osservativi. Questo può essere utile quando la struttura a tre strati non può essere vista chiaramente, anche usando un microscopio digitale. Quando il mezzo passa dal rosso porpora al giallo, può iniziare il processo di incorporazione degli sferoidi nel gel. Il mezzo non deve essere sostituito durante il periodo di aggregazione cellulare.
- Incorporazione di gel
NOTA: I gel devono essere conservati a una temperatura inferiore a -20 °C. In particolare, i gel devono essere posizionati lontano dallo sportello del frigorifero per evitare fluttuazioni di temperatura. Si noti che i gel sono in uno stato congelato in questa fase del processo.- Prelevare il gel congelato dal frigorifero a -20 °C e metterlo su una ghiacciaia per tutto il tempo durante l'esperimento.
- Osservare gli sferoidi cellulari al microscopio. Prima che inizi l'incorporazione del gel, lo stato degli sferoidi deve essere nuovamente controllato con un microscopio digitale.
- Rimuovere con cautela 150 μL del mezzo. La piastra dovrebbe anche essere posizionata sulla ghiacciaia.
- Incorporare ogni sferoide nel gel aggiungendo lentamente il gel liquido dal lato della parete del pozzetto mentre si sposta la punta della pipetta pre-raffreddata intorno e all'interno del pozzetto. Attendere 5 minuti e se il gel non si diffonde uniformemente, pipettare delicatamente il gel con una punta da 10 μL. Ogni pozzetto contiene uno sferoide tumorale, 25 μL di gel da 3,5 mg/ml e 50 μL di terreno di coltura completo. Aggiungere anche 75 μL di fluido ai controlli.
NOTA: Ogni pozzetto contiene uno sferoide. - Incubare la piastra a 37 °C per 30 minuti fino al completamento dell'idrogelazione. Confermare lo stato di gelificazione al microscopio.
- Sovrapporre 125 μL di terreno fresco su ciascun campione.
- Coltiva gli sferoidi per altri 7-10 giorni. Preparare gruppi di sferoidi con quattro o sei pozzetti ciascuno e sceglierne almeno tre per l'analisi.
NOTA: se si esegue un test antidroga, preparare due gruppi per un campione. Un gruppo viene utilizzato per i test di fattibilità, mentre l'altro viene utilizzato per l'acquisizione e l'analisi delle immagini.
2. Trattamento farmacologico
- Sciogliere il farmaco secondo le istruzioni del produttore. Prepara soluzioni di lavoro 100x con DMSO. Preparare almeno cinque dosi del farmaco in diluizione seriale. Qui, il farmaco terapeutico per il cancro del polmone, AMG 510, viene utilizzato come esempio. La composizione è riportata nella tabella supplementare 1.
- Utilizzare lo 0,1% di DMSO come controllo positivo.
- Aggiungere 125 μL di mezzo trattato con farmaco a ciascun pozzetto e riposizionare la piastra nell'incubatore (37 °C in aria umidificata con 5% di CO2). In questa fase, ogni pozzetto contiene uno sferoide tumorale, 25 μL di gel da 3,5 mg / ml e 175 μL del mezzo. I controlli contengono 200 μL del mezzo.
3. Vitalità sferoidale
- Misurare la vitalità dello sferoide utilizzando un kit di analisi Alamar Blue secondo le linee guida del produttore. Misurare la vitalità utilizzando un fotometro a micropiastre (assorbanza a 570 nm e 600 nm) dopo il trattamento Alamar Blue.
- Misurare la vitalità al giorno 1, giorno 4, giorno 7 e giorno 10 dopo aver incorporato gli sferoidi nel gel, rispettivamente, o come indicato.
NOTA: Quando si utilizza un test Alamar Blue, sono necessarie almeno 16 ore di tempo di reazione. Pertanto, aggiungere 20 μL di Alamar Blue nei pomeriggi del giorno 0, del giorno 3, del giorno 6 e del giorno 9. - Aspirare 100 μL del mezzo surnatante da ciascun pozzetto ad una nuova piastra di prova e aggiungere 80 μL di terreno fresco a ciascun pozzetto della piastra di coltura. Quindi, sostituire altri 100 μL del mezzo trattato con farmaco. Assicurati che non ci siano resti di Alamar Blue nel pozzo.
NOTA: la sostituzione del terreno viene effettuata ogni volta che viene testata la vitalità e il mezzo trattato con farmaco dei gruppi di analisi di imaging deve essere sostituito lo stesso giorno.
4. Osservazione sferoidale e analisi di deep learning attraverso immagini nel test antidroga
- Imaging
- Aspirare 100 μL del mezzo prima dell'imaging.
- Posiziona il piatto sul palco. Ottieni immagini digitali degli sferoidi utilizzando un microscopio automatico con un obiettivo 10x (obiettivo 2x prima). Il microscopio può focalizzare e centralizzare automaticamente questi sferoidi.
NOTA: La funzione di messa a fuoco automatica e l'algoritmo utilizzato sono stati precedentemente riportati da Yazdanfar et al.17. - Attendere l'imaging automatico. Per ogni sferoide vengono acquisite quattro immagini. Un'immagine integrata viene formata ed elaborata con il software collegato al sistema di imaging ad alto contenuto.
- Fare clic sul pulsante "Image patch process" e scegliere le immagini integrate nel software.
- Scegli "modello U-NET" e digita il tasso di conversione (le immagini obiettivo 10x hanno un tasso di conversione di 3,966). Fare clic nella parte inferiore dello schermo sottostante, per avviare l'elaborazione delle immagini. Quindi, salvare i dati relativi al diametro, al perimetro e alla rugosità nel software del foglio di calcolo.
- Calcolare l'indice perimetrale in eccesso (EPI). L'EPI è il rapporto tra il perimetro sferoidale (P 0) e il perimetro equivalente (Pe), calcolato dall'Eq. 1. Misurare l'area dello sferoide sul piano focale (S) utilizzando l'immagine J. Quindi, calcola il perimetro equivalente dello sferoide usando Eq. 2.
EPI = (P o− P e)/Pe (Eq. 1)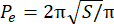 (Eq. 2)
(Eq. 2)
NOTA: Il perimetro sferoidale è generato dal software con algoritmi di deep learning basati sul modello U-NET sviluppato. - Aggiungere 100 μL di terreno fresco con il farmaco e riporre la piastra nell'incubatore (37 °C in aria umidificata con 5% di CO2).
- Inibizione sferoidale
- Calcolare l'inibizione della crescita tumorale (TGI) utilizzando l'Eq. 3. Il volume sferoide relativo (RTV) è il volume terminale sul volume originale (Eq. 4). Il volume sferoidale (V) viene calcolato automaticamente dal software utilizzando Eq. 5 in base all'uscita del diametro sferoide.
TGI = (controllo RTV−trattamento RTV)/controllo RTV × 100% (Eq. 3)
RTV = Vterminale/Voriginale (Eq. 4)
V = 4/3π(d/2)3 (Eq. 5)
NOTA: Il TGI si ottiene con riferimento all'inibizione della crescita in vivo , e i pesi tumorali sono sostituiti con RTV. Il controllo RTV è il volume sferoide relativo del gruppo dicontrollo , iltrattamento RTV è il volume sferoide relativo del gruppo sottoposto a test farmacologici, Vterminale è il volume dello sferoide l'ultimo giorno, Voriginale è il volume dello sferoide il primo giorno di coltura e d rappresenta il diametro sferoide.
- Calcolare l'inibizione della crescita tumorale (TGI) utilizzando l'Eq. 3. Il volume sferoide relativo (RTV) è il volume terminale sul volume originale (Eq. 4). Il volume sferoidale (V) viene calcolato automaticamente dal software utilizzando Eq. 5 in base all'uscita del diametro sferoide.
Access restricted. Please log in or start a trial to view this content.
Risultati
La Figura 1A,B mostra il processo utilizzato per la costruzione di sferoidi tumorali in questo studio. Per prima cosa abbiamo seminato le cellule in una piastra inferiore a U a 48 pozzetti. Questo passaggio è quasi lo stesso di quello utilizzato nella coltura cellulare 2D. Abbiamo tenuto la piastra in un incubatore comune con acqua che circonda i pozzi in modo che le cellule depositate iniziassero a formare sferoidi in un processo di auto-assemblaggio. In condizioni operat...
Access restricted. Please log in or start a trial to view this content.
Discussione
Il microambiente svolge un ruolo importante nella crescita del tumore. Può influenzare la fornitura di matrici extracellulari, gradienti di ossigeno, nutrizione e interazione meccanica e, quindi, influenzare l'espressione genica, le vie del segnale e molte funzioni delle cellule tumorali 19,20,21. In molti casi, le cellule 2D non producono tali effetti o addirittura producono effetti opposti, influenzando così la valutazione d...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo tutti i membri dei nostri laboratori per il loro contributo critico e suggerimenti. Questa ricerca è stata sostenuta dal Key Project della Jiangsu Commission of Health (K2019030). La concettualizzazione è stata condotta da C.W. e Z.C., la metodologia è stata eseguita da W.H. e M.L., l'indagine è stata eseguita da W.H. e M.L., la cura dei dati è stata eseguita da W.H., Z.Z., S.X. e M.L., la preparazione della bozza originale è stata eseguita da Z.Z., J.Z., S.X., W.H., e X.L., la revisione e l'editing sono stati eseguiti da Z.C., l'amministrazione del progetto è stata eseguita da C.W. e Z.C. e l'acquisizione dei finanziamenti è stata condotta da C.W. Tutti gli autori hanno letto e accettato la versione pubblicata del manoscritto.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.5-10 μL Pipette tips | AXYGEN | T-300 | |
| 1.5 mL Boil proof microtubes | Axygen | MCT-150-C | |
| 100-1000μL Pipette tips | KIRGEN | KG1313 | |
| 15 mL Centrifuge Tube | Nest | 601052 | |
| 200 μL Pipette tips | AXYGEN | T-200-Y | |
| 3D gel | Avatarget | MA02 | |
| 48-well U bottom Plate | Avatarget | P02-48UWP | |
| 50 mL Centrifuge Tube | Nest | 602052 | |
| Alamar Blue | Thermo | DAL1100 | |
| Anti-Adherence Rinsing Solution | STEMCELL | #07010 | |
| Certified FBS | BI | 04-001-1ACS | |
| Deionized water | aladdin | W433884-500ml | |
| DMEM (Dulbecco's Modified Eagle Medium) | Gibco | 11965-092 | |
| DMSO | sigma | D2650-100ML | |
| Excel sofware | Microsoft office | ||
| Graphpad prism sofware | GraphPad software | ||
| High Content Imager and SMART system | Avatarget | 1-I01 | |
| Image J software | National Institutes of Health | ||
| Insulin-Transferrin-Selenium-A Supplement (100X) | Gibco | 51300-044 | |
| Parafilm | Bemis | PM-996 | |
| PBS | Solarbio | P1020 | |
| Penicillin/streptomycin Sol | Gibco | 15140-122 | |
| RPMI 1640 | Gibco | 11875-093 | |
| Scientific Fluoroskan Ascent | Thermo | Fluoroskan Ascent | |
| T25 Flask | JET Biofil | TCF012050 | |
| Trypsin, 0.25% (1X) | Hyclone | SH30042.01 |
Riferimenti
- Carioli, G., et al. European cancer mortality predictions for the year 2021 with focus on pancreatic and female lung cancer. Annals of Oncology. 32 (4), 478-487 (2021).
- Katti, A., Diaz, B. J., Caragine, C. M., Sanjana, N. E., Dow, L. E. CRISPR in cancer biology and therapy. Nature Reviews Cancer. 22 (5), 259-279 (2022).
- Abrantes, R., Duarte, H. O., Gomes, C., Walchili, S., Reis, C. A. CAR-Ts: New perspectives in cancer therapy. FEBS Letter. 596 (4), 403-416 (2022).
- Shokooohi, A., et al. Effect of targeted therapy and immunotherapy on advanced nonsmall-cell lung cancer outcomes in the real world. Cancer Medicine. 11 (1), 86-93 (2022).
- Chen, K., Zhang, Y., Qian, L., Wang, P. Emerging strategies to target RAS signaling in human cancer therapy. Journal of Hematology & Oncology. 14 (1), 116(2021).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186(2020).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33(2020).
- Qin, Y., Hu, X., Fan, W., Yan, J. A stretchable scaffold with electrochemical sensing for 3D culture, mechanical loading, and real-time monitoring of cells. Advanced Science. 8 (13), 2003738(2021).
- Wartenberg, M., et al. Regulation of the multidrug resistance transporter P-glycoprotein in multicellular tumor spheroids by hypoxia-inducible factor (HIF-1) ad reactive oxygen species. FASEB Journal. 17 (3), 503-505 (2003).
- Minchinton, A. I., Tannock, I. F. Drug penetration in solid tumours. Nature Reviews Cancer. 6 (8), 583-592 (2006).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension: How 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Brüningk, S. C., Rivens, I., Box, C., Oelfke, U., Ter Haar, G. 3D tumour spheroids for the prediction of the effects of radiation and hyperthermia treatments. Scientific Reports. 10, 1653(2020).
- Graves, E. E., Maity, A., Thu Le, Q. The tumor microenvironment in non-small-cell lung cancer. Seminars in Radiation Oncology. 20 (3), 156-163 (2010).
- Kunz-Schughart, L. A., Frreyer, J. P., Ebner, R. The use of 3-D cultures for high-throughput screening: The multicellular spheroid model. Journal of Biomolecular Screening. 9 (4), 273-285 (2004).
- Carragher, N., et al. Concerns, challenges and promises of high-content analysis of 3D cellular models. Nature Review Drug Discovery. 17 (8), 606(2018).
- Huang, Y., et al. Longitudinal morphological and physiological monitoring of three-dimensional tumor spheroids using optical coherence tomography. Journal of Visualized Experiments. (144), e59020(2019).
- Yazdanfar, S., et al. Simple and robust image-baed autofocusing for digital microscopy. Optics Express. 16 (12), 8670-8677 (2008).
- Chen, Z., et al. Automated evaluation of tumor spheroid behavior in 3D culture using deep learning-based recognition. Biomaterials. 22 (272), 120770(2021).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Frontiers in Immunology. 11, 603640(2020).
- Anastasiou, D., et al. Microenvironment factors shaping the cancer metabolism landscape. British Journal of Cancer. 116 (3), 277-286 (2017).
- Zhou, H., et al. Functions and clinical significance of mechanical tumor microenvironment: Cancer cell sensing, mechanobiology and metastasis. Cancer Communications. 43 (5), 374-400 (2022).
- Zhu, G. G., et al. Targeting KRAS cancers: From druggable therapy to druggable resistance. Molecular Cancer. 21 (1), 159(2022).
- Ando, Y., Mariano, C., Shen, K. Engineered in vitro tumor models for cell-based immunotherapy. Acta Biomaterialia. 132, 345-359 (2021).
- Timmins, N. E., Dietmair, S., Nielsen, L. K. Hanging-drop multicellular spheroids as a model of tumor angiogenesis. Angiogenesis. 7 (2), 97-103 (2004).
- Costa, E. C., et al. 3D tumor spheroids: An overview on the tools and techniques used for their analysis. Biotechnology Advances. 34 (8), 1427-1441 (2016).
- Sant, S., Johnston, P. A. The production of 3D tumor spheroids for cancer drug discovery. Drug Discovery Today. Technologies. 23, 27-36 (2017).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Scientific Reports. 6, 19103(2016).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon