Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Generación de esferoides tumorales 3D para estudios de evaluación de fármacos
* Estos autores han contribuido por igual
En este artículo
Resumen
Este artículo demuestra un método estandarizado para construir esferoides tumorales tridimensionales. También se describe una estrategia para la observación de esferoides y el análisis de aprendizaje profundo basado en imágenes utilizando un sistema automatizado de imágenes.
Resumen
En las últimas décadas, además de las células cultivadas en monocapa, se han desarrollado esferoides tumorales tridimensionales como una herramienta potencialmente poderosa para la evaluación de medicamentos contra el cáncer. Sin embargo, los métodos de cultivo convencionales carecen de la capacidad de manipular los esferoides tumorales de manera homogénea a nivel tridimensional. Para abordar esta limitación, en este documento, presentamos un método conveniente y efectivo para construir esferoides tumorales de tamaño promedio. Además, describimos un método de análisis basado en imágenes utilizando un software de análisis basado en inteligencia artificial que puede escanear toda la placa y obtener datos sobre esferoides tridimensionales. Se estudiaron varios parámetros. Mediante el uso de un método estándar de construcción de esferoides tumorales y un sistema de imágenes y análisis de alto rendimiento, la eficacia y la precisión de las pruebas de drogas realizadas en esferoides tridimensionales se pueden aumentar drásticamente.
Introducción
El cáncer es una de las enfermedades más temidas por los seres humanos, sobre todo por su alta tasa de mortalidad1. En los últimos años, la posibilidad de tratar el cáncer ha aumentado a medida que se han introducido nuevas terapias 2,3,4,5. Los modelos in vitro bidimensionales (2D) y tridimensionales (3D) se utilizan para estudiar el cáncer en un entorno de laboratorio. Sin embargo, los modelos 2D no pueden evaluar de forma inmediata y precisa todos los parámetros importantes que indican sensibilidad antitumoral; por lo tanto, no logran representar completamente las interacciones in vivo en las pruebas de terapia farmacológica6.
Desde 2020, el mercado global de cultura tridimensional (3D) se ha impulsado enormemente. Según un informe de NASDAQ OMX, el valor global del mercado de cultivo celular 3D superará los USD 2.7 mil millones para fines de 2025. En comparación con los métodos de cultivo 2D, el cultivo celular 3D exhibe propiedades ventajosas, que pueden optimizarse no solo para la proliferación y diferenciación, sino también para la supervivencia a largo plazo 7,8. De esta manera, se pueden simular microambientes celulares in vivo para obtener una caracterización tumoral más precisa, así como perfiles metabólicos, de modo que se puedan comprender mejor las alteraciones genómicas y proteicas. Debido a esto, los sistemas de prueba 3D ahora deben incluirse en las operaciones convencionales de desarrollo de medicamentos, especialmente aquellos con un enfoque en la detección y evaluación de nuevos medicamentos antitumorales. Los crecimientos tridimensionales de líneas celulares establecidas inmortalizadas o cultivos celulares primarios en estructuras esferoides poseen características in vivo de tumores como hipoxia y penetración de fármacos, así como interacción celular, respuesta y resistencia, y pueden considerarse como un modelo estricto y representativo para realizar el cribado in vitro de drogas 9,10,11.
Sin embargo, estos modelos de cultura 3D también sufren de varios problemas que pueden tardar algún tiempo en resolverse. Los esferoides celulares se pueden formar utilizando estos protocolos, pero difieren en ciertos detalles, como el tiempo de cultivo o los geles de incrustación12, por lo que estos esferoides celulares construidos no pueden controlarse bien en un rango de tamaño restringido. El tamaño de los esferoides puede influir en la consistencia de la prueba de viabilidad y el análisis de imagen. Los microambientes de crecimiento y los factores de crecimiento también varían, lo que puede conducir a diferentes morfologías debido a las diferencias en la diferenciación entre las células13. Ahora existe una necesidad obvia de un método estándar, simple y rentable para construir todos los tipos de tumores con tamaños controlados.
Desde otra perspectiva, aunque se han desarrollado ensayos homogéneos y enfoques de imagen de alto contenido para evaluar la morfología, la viabilidad y la tasa de crecimiento, el cribado de alto rendimiento de los modelos 3D sigue siendo un desafío por varias razones reportadas en la literatura, como la falta de uniformidad en la posición, tamaño y morfología de los esferoides tumorales14,15,16.
En el protocolo presentado aquí, enumeramos cada paso en la construcción de esferoides tumorales 3D y describimos un método para la observación y el análisis de esferoides utilizando un sistema de imágenes de alto rendimiento y alto contenido que involucra enfoque automático, imágenes automáticas y análisis, entre otras características ventajosas. Mostramos cómo este método puede producir esferoides tumorales 3D de tamaño uniforme que son adecuados para imágenes de alto rendimiento. Estos esferoides también demuestran una alta sensibilidad al tratamiento farmacológico contra el cáncer, y los cambios morfológicos en los esferoides pueden ser monitoreados usando imágenes de alto contenido. En resumen, demostramos la robustez de esta metodología como un medio para generar construcciones tumorales 3D con fines de evaluación de fármacos.
Protocolo
1. Construcción esferoide
- Tratamiento antiadherencia de la placa de cultivo
- Pipetear 100 μL de reactivo antiadherencia en cada pocillo de una placa de 48 pocillos con un fondo de pozo en forma de U, y mantener durante 10 min. Después de 10 minutos, aspire el reactivo de recubrimiento y lávese dos veces con PBS esterilizado.
- Colocar la placa de cultivo en una incubadora (37 °C en aire humidificado con 5% deCO2) hasta su uso.
- Preparación, recolección y conteo de células
- Utilice el medio de cultivo específico de las células para cultivar las células en matraces de cultivo celular (Tabla complementaria 2). Por ejemplo, las células NCI-H23, CT-26 se cultivan en RPMI 1640, y las células HT-29 se cultivan en el medio 5A de McCoy. Estos dos medios se complementan con FBS inactivado por calor al 10% y P / S al 1%, respectivamente.
- Mantener todas las células en condiciones de cultivo estándar (37 °C en aire humidificado con 5% deCO2) durante la proliferación. Aquí, la línea celular NCI-H23 se utiliza como ejemplo en los siguientes pasos.
- Lavar dos veces las células cultivadas en un matraz T25 con 1x PBS para eliminar el medio de cultivo (es mejor elegir células en la fase logarítmica y pasar las células a una confluencia del 80%-90%).
- Tratar las células expandidas con 1 mL de tripsina/EDTA al 0,25% durante 1-2 min en una incubadora a 37 °C, 5% deCO2. Confirme la forma de la célula (normalmente circular en este caso) bajo el microscopio y luego detenga el tratamiento con tripsina. Para ello, aspirar la suspensión de tripsina/EDTA utilizada en el matraz T25 y lavar las células con 4 ml de medio fresco.
- Transfiera toda la suspensión (5 ml) a un tubo de 15 ml. Use 1 ml de medio fresco para lavar las células residuales y agregarlo al tubo. Centrifugar las células a 186,48 x g durante 5 min a temperatura ambiente.
- Retire el sobrenadante y agregue 10 ml de medio fresco al pellet celular, seguido de un pipeteo suave hasta que las células estén en una suspensión homogénea.
- Aspire 0.1 ml de suspensión celular en un nuevo tubo de centrífuga, agregue 0.9 ml de medio fresco y luego pipete bien la suspensión.
- Extraer 10 μL de la suspensión celular para el recuento celular. Realice este proceso dos o tres veces y tome un valor promedio.
- Diluir la suspensión para alcanzar una densidad de siembra final de 50.000 células/ml, de acuerdo con la concentración obtenida del proceso de recuento celular en el paso 1.2.7.
- Cultivo celular y formación de esferoides
- Agregue 200 μL de la suspensión celular a cada pocillo de una placa de fondo en U de 48 pocillos.
- Envuelva la película de sellado alrededor de la placa y centrifugarla a 119,35 x g durante 5 minutos a temperatura ambiente.
- Saque con cuidado la placa de la centrífuga y retire la película protectora. Luego, agregue 5-8 ml de agua esterilizada en el canal de agua que rodea los pozos (para evitar la evaporación) e incube a 37 ° C durante 5 días. No cambie / complemente el agua del canal de agua durante el período.
- Observe la agregación celular durante los siguientes 5 días.
NOTA: En general, las células comienzan a agruparse como colonias dentro de los 5 días. Sin embargo, el proceso de construcción de esferoides puede ser más rápido o más lento con diferentes tipos de células y densidades celulares. Debido a esto, las células deben observarse todos los días utilizando uno de los tres métodos posibles. Primero, las células se pueden observar a través del fondo de la placa del pozo. Cuando las células aún no han formado un esferoide, se puede ver una sola capa de células en la parte inferior. Cuando las células forman un esferoide, se puede observar una densa construcción 3D en el fondo en U de cada pozo. Otro método consiste en verificar las células bajo un microscopio. Cuando las células se convierten en un esferoide tumoral, la construcción involucra tres capas (una capa proliferante, una capa inactiva y un núcleo necrótico, desde el exterior hacia el interior del esferoide), que tienen un gradiente de transparencia. Finalmente, el color del medio de cultivo también se puede utilizar con fines de observación. Esto puede ser útil cuando la estructura de tres capas no se puede ver claramente, incluso con un microscopio digital. Cuando el medio cambia de rojo púrpura a amarillo, puede comenzar el proceso de incrustación de los esferoides en el gel. El medio no debe reemplazarse durante el período de agregación celular.
- Incrustación de gel
NOTA: Los geles deben almacenarse a una temperatura inferior a -20 °C. En particular, los geles deben colocarse lejos de la puerta del refrigerador para evitar fluctuaciones de temperatura. Tenga en cuenta que los geles están congelados en esta etapa del proceso.- Tome el gel congelado de la nevera a -20 °C y colóquelo en una nevera durante todo el tiempo durante el experimento.
- Observe los esferoides celulares bajo el microscopio. Antes de que comience la incrustación del gel, el estado de los esferoides debe verificarse nuevamente con un microscopio digital.
- Retire con cuidado 150 μL del medio. La placa también debe colocarse en la nevera.
- Incruste cada esferoide en el gel agregando el gel líquido lentamente desde el lado de la pared del pozo mientras mueve la punta de pipeta preenfriada alrededor y dentro del pozo. Espere 5 minutos y si el gel no se extiende uniformemente, pipetear suavemente el gel con una punta de pipeta de 10 μL. Cada pocillo contiene un esferoide tumoral, 25 μL de gel de 3,5 mg/ml y 50 μL de medio de cultivo completo. Agregue 75 μL de medio a los controles también.
NOTA: Cada pocillo contiene un esferoide. - Incubar la placa a 37 °C durante 30 minutos hasta que la hidrogelificación esté completamente completa. Confirme el estado de gelificación bajo el microscopio.
- Superponer 125 μL del medio fresco en cada muestra.
- Cultive los esferoides durante otros 7-10 días. Prepare grupos de esferoides con cuatro a seis pocillos cada uno y elija al menos tres de ellos para su análisis.
NOTA: Si realiza una prueba de drogas, prepare dos grupos para una muestra. Un grupo se utiliza para pruebas de viabilidad, mientras que el otro se utiliza para la captura y análisis de imágenes.
2. Tratamiento farmacológico
- Disuelva el medicamento de acuerdo con las instrucciones del fabricante. Prepare soluciones de trabajo 100x con DMSO. Prepare al menos cinco dosis del medicamento en dilución en serie. Aquí, el medicamento terapéutico para el cáncer de pulmón, AMG 510, se usa como ejemplo. La composición se muestra en la Tabla Suplementaria 1.
- Use DMSO al 0.1% como control positivo.
- Añadir 125 μL de medio tratado con fármaco a cada pocillo y volver a colocar la placa en la incubadora (37 °C en aire humidificado con 5% deCO2). En esta etapa, cada pocillo contiene un esferoide tumoral, 25 μL de gel de 3,5 mg/ml y 175 μL del medio. Los controles contienen 200 μL del medio.
3. Viabilidad esferoide
- Mida la viabilidad del esferoide utilizando un kit de ensayo Alamar Blue de acuerdo con las directrices del fabricante. Medir la viabilidad utilizando un fotómetro de microplaca (absorbancia a 570 nm y 600 nm) después de realizar el tratamiento con Alamar Blue.
- Mida la viabilidad en el día 1, día 4, día 7 y día 10 después de incrustar los esferoides en el gel, respectivamente, o como se indique.
NOTA: Cuando se utiliza un ensayo Alamar Blue, se requieren al menos 16 h de tiempo de reacción. Por lo tanto, agregue 20 μL de Alamar Blue en las tardes del día 0, día 3, día 6 y día 9. - Aspirar 100 μL del medio sobrenadante de cada pocillo a una nueva placa de ensayo y añadir 80 μL de medio fresco a cada pocillo de la placa de cultivo. Luego, reemplace otros 100 μL del medio tratado con medicamentos. Asegúrese de que no haya restos de Alamar Blue en el pozo.
NOTA: El reemplazo del medio se lleva a cabo en cada ocasión en que se prueba la viabilidad, y el medio tratado con medicamentos de los grupos de análisis de imágenes debe reemplazarse el mismo día.
4. Observación esferoide y análisis de aprendizaje profundo a través de imágenes en la prueba de drogas
- Imagenológico
- Aspirar 100 μL del medio antes de la toma de imágenes.
- Coloca el plato en el escenario. Obtenga imágenes digitales de los esferoides utilizando un microscopio automatizado con un objetivo de 10x (objetivo 2x primero). El microscopio puede enfocar y centralizar estos esferoides automáticamente.
NOTA: La función de enfoque automático y el algoritmo utilizado han sido previamente reportados por Yazdanfar et al.17. - Espere la imagen automática. Se adquieren cuatro imágenes para cada esferoide. Se forma y procesa una imagen integrada con el software conectado al sistema de imágenes de alto contenido.
- Haga clic en el botón "Proceso de parche de imagen" y elija las imágenes integradas en el software.
- Elija "modelo U-NET" y escriba la tasa de conversión (las imágenes objetivas 10x tienen una tasa de conversión de 3.966). Haga clic en la parte inferior de la pantalla de abajo, para iniciar el procesamiento de la imagen. Luego, guarde los datos de diámetro, perímetro y rugosidad en el software de hoja de cálculo.
- Calcule el índice de exceso de perímetro (EPI). El EPI es la relación entre el perímetro del esferoide (P 0) y el perímetro equivalente (Pe), calculado por la Partida 1. Mida el área del esferoide en el plano focal (S) utilizando la Imagen J. Luego, calcule el perímetro equivalente del esferoide usando la Ec. 2.
EPI = (P o− P e)/Pe (Ec. 1)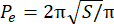 (Ec. 2)
(Ec. 2)
NOTA: El perímetro del esferoide es generado por el software con algoritmos de aprendizaje profundo basados en el modelo U-NET desarrollado. - Añadir 100 μL de medio fresco con el fármaco y volver a colocar la placa en la incubadora (37 °C en aire humidificado con 5% deCO2).
- Inhibición esferoide
- Calcule la inhibición del crecimiento tumoral (TGI) usando la Ec. 3. El volumen esferoide relativo (RTV) es el volumen terminal sobre el volumen original (Ec. 4). El volumen del esferoide (V) se calcula automáticamente mediante el software utilizando la Ec. 5 de acuerdo con la salida del diámetro del esferoide.
TGI = (control de RTV−tratamiento de RTV)/control de RTV × 100% (Ec. 3)
RTV = Vterminal/V original (Eq. 4)
V = 4/3π(d/2)3 (Ec. 5)
NOTA: El TGI se obtiene con referencia a la inhibición del crecimiento in vivo , y los pesos tumorales se reemplazan con RTV. El control de RTV es el volumen esferoide relativo del grupo decontrol , eltratamiento con RTV es el volumen esferoide relativo del grupo probado con fármacos, Vterminal es el volumen del esferoide en el último día, Voriginal es el volumen del esferoide en el primer día de cultivo y d representa el diámetro del esferoide.
- Calcule la inhibición del crecimiento tumoral (TGI) usando la Ec. 3. El volumen esferoide relativo (RTV) es el volumen terminal sobre el volumen original (Ec. 4). El volumen del esferoide (V) se calcula automáticamente mediante el software utilizando la Ec. 5 de acuerdo con la salida del diámetro del esferoide.
Resultados
La Figura 1A,B muestra el proceso utilizado para la construcción de esferoides tumorales en este estudio. Primero sembramos las células en una placa de fondo en U de 48 pocillos. Este paso es casi el mismo que el utilizado en el cultivo celular 2D. Mantuvimos la placa en una incubadora común con agua que rodea los pozos para que las células depositadas comenzaran a formar esferoides en un proceso de autoensamblaje. En condiciones operativas normales, la mayoría de los ...
Discusión
El microambiente juega un papel importante en el crecimiento del tumor. Puede afectar la provisión de matrices extracelulares, gradientes de oxígeno, nutrición e interacción mecánica y, por lo tanto, afectar la expresión génica, las vías de señalización y muchas funciones de las células tumorales 19,20,21. En muchos casos, las células 2D no producen tales efectos o incluso producen efectos opuestos, afectando así la...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a todos los miembros de nuestros laboratorios por sus aportes y sugerencias críticas. Esta investigación fue apoyada por el Proyecto Clave de la Comisión de Salud de Jiangsu (K2019030). La conceptualización fue realizada por C.W. y Z.C., la metodología fue realizada por W.H. y M.L., la investigación fue realizada por W.H. y M.L., la curación de datos fue realizada por W.H., Z.Z., S.X. y M.L., la preparación original del borrador fue realizada por Z.Z., J.Z., S.X., W.H., y X.L., la revisión y edición fue realizada por Z.C., la administración del proyecto fue realizada por C.W. y Z.C., y la adquisición de fondos fue realizada por C.W. Todos los autores han leído y aceptado la versión publicada del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.5-10 μL Pipette tips | AXYGEN | T-300 | |
| 1.5 mL Boil proof microtubes | Axygen | MCT-150-C | |
| 100-1000μL Pipette tips | KIRGEN | KG1313 | |
| 15 mL Centrifuge Tube | Nest | 601052 | |
| 200 μL Pipette tips | AXYGEN | T-200-Y | |
| 3D gel | Avatarget | MA02 | |
| 48-well U bottom Plate | Avatarget | P02-48UWP | |
| 50 mL Centrifuge Tube | Nest | 602052 | |
| Alamar Blue | Thermo | DAL1100 | |
| Anti-Adherence Rinsing Solution | STEMCELL | #07010 | |
| Certified FBS | BI | 04-001-1ACS | |
| Deionized water | aladdin | W433884-500ml | |
| DMEM (Dulbecco's Modified Eagle Medium) | Gibco | 11965-092 | |
| DMSO | sigma | D2650-100ML | |
| Excel sofware | Microsoft office | ||
| Graphpad prism sofware | GraphPad software | ||
| High Content Imager and SMART system | Avatarget | 1-I01 | |
| Image J software | National Institutes of Health | ||
| Insulin-Transferrin-Selenium-A Supplement (100X) | Gibco | 51300-044 | |
| Parafilm | Bemis | PM-996 | |
| PBS | Solarbio | P1020 | |
| Penicillin/streptomycin Sol | Gibco | 15140-122 | |
| RPMI 1640 | Gibco | 11875-093 | |
| Scientific Fluoroskan Ascent | Thermo | Fluoroskan Ascent | |
| T25 Flask | JET Biofil | TCF012050 | |
| Trypsin, 0.25% (1X) | Hyclone | SH30042.01 |
Referencias
- Carioli, G., et al. European cancer mortality predictions for the year 2021 with focus on pancreatic and female lung cancer. Annals of Oncology. 32 (4), 478-487 (2021).
- Katti, A., Diaz, B. J., Caragine, C. M., Sanjana, N. E., Dow, L. E. CRISPR in cancer biology and therapy. Nature Reviews Cancer. 22 (5), 259-279 (2022).
- Abrantes, R., Duarte, H. O., Gomes, C., Walchili, S., Reis, C. A. CAR-Ts: New perspectives in cancer therapy. FEBS Letter. 596 (4), 403-416 (2022).
- Shokooohi, A., et al. Effect of targeted therapy and immunotherapy on advanced nonsmall-cell lung cancer outcomes in the real world. Cancer Medicine. 11 (1), 86-93 (2022).
- Chen, K., Zhang, Y., Qian, L., Wang, P. Emerging strategies to target RAS signaling in human cancer therapy. Journal of Hematology & Oncology. 14 (1), 116 (2021).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Qin, Y., Hu, X., Fan, W., Yan, J. A stretchable scaffold with electrochemical sensing for 3D culture, mechanical loading, and real-time monitoring of cells. Advanced Science. 8 (13), 2003738 (2021).
- Wartenberg, M., et al. Regulation of the multidrug resistance transporter P-glycoprotein in multicellular tumor spheroids by hypoxia-inducible factor (HIF-1) ad reactive oxygen species. FASEB Journal. 17 (3), 503-505 (2003).
- Minchinton, A. I., Tannock, I. F. Drug penetration in solid tumours. Nature Reviews Cancer. 6 (8), 583-592 (2006).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension: How 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Brüningk, S. C., Rivens, I., Box, C., Oelfke, U., Ter Haar, G. 3D tumour spheroids for the prediction of the effects of radiation and hyperthermia treatments. Scientific Reports. 10, 1653 (2020).
- Graves, E. E., Maity, A., Thu Le, Q. The tumor microenvironment in non-small-cell lung cancer. Seminars in Radiation Oncology. 20 (3), 156-163 (2010).
- Kunz-Schughart, L. A., Frreyer, J. P., Ebner, R. The use of 3-D cultures for high-throughput screening: The multicellular spheroid model. Journal of Biomolecular Screening. 9 (4), 273-285 (2004).
- Carragher, N., et al. Concerns, challenges and promises of high-content analysis of 3D cellular models. Nature Review Drug Discovery. 17 (8), 606 (2018).
- Huang, Y., et al. Longitudinal morphological and physiological monitoring of three-dimensional tumor spheroids using optical coherence tomography. Journal of Visualized Experiments. (144), e59020 (2019).
- Yazdanfar, S., et al. Simple and robust image-baed autofocusing for digital microscopy. Optics Express. 16 (12), 8670-8677 (2008).
- Chen, Z., et al. Automated evaluation of tumor spheroid behavior in 3D culture using deep learning-based recognition. Biomaterials. 22 (272), 120770 (2021).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Frontiers in Immunology. 11, 603640 (2020).
- Anastasiou, D., et al. Microenvironment factors shaping the cancer metabolism landscape. British Journal of Cancer. 116 (3), 277-286 (2017).
- Zhou, H., et al. Functions and clinical significance of mechanical tumor microenvironment: Cancer cell sensing, mechanobiology and metastasis. Cancer Communications. 43 (5), 374-400 (2022).
- Zhu, G. G., et al. Targeting KRAS cancers: From druggable therapy to druggable resistance. Molecular Cancer. 21 (1), 159 (2022).
- Ando, Y., Mariano, C., Shen, K. Engineered in vitro tumor models for cell-based immunotherapy. Acta Biomaterialia. 132, 345-359 (2021).
- Timmins, N. E., Dietmair, S., Nielsen, L. K. Hanging-drop multicellular spheroids as a model of tumor angiogenesis. Angiogenesis. 7 (2), 97-103 (2004).
- Costa, E. C., et al. 3D tumor spheroids: An overview on the tools and techniques used for their analysis. Biotechnology Advances. 34 (8), 1427-1441 (2016).
- Sant, S., Johnston, P. A. The production of 3D tumor spheroids for cancer drug discovery. Drug Discovery Today. Technologies. 23, 27-36 (2017).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Scientific Reports. 6, 19103 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados