Method Article
قياسات تشتت رامان المعززة بالسطح أحادية الجزيء التي تم تمكينها بواسطة الهوائيات النانوية لأوريغامي الحمض النووي البلازموني
In This Article
Summary
يوضح هذا البروتوكول قياسات تشتت رامان المعززة بالسطح أحادية الجزيء (SERS) باستخدام هوائي نانوي أوريغامي الحمض النووي (DONA) جنبا إلى جنب مع مجهر القوة الذرية المتمركزة (AFM) وقياسات رامان.
Abstract
تشتت رامان المعزز بالسطح (SERS) لديه القدرة على اكتشاف الجزيئات المفردة التي تتطلب تحسين المجال العالي. SERS أحادي الجزيء (SM) قادر على توفير معلومات طيفية خاصة بالجزيئات حول الجزيئات الفردية ، وبالتالي ينتج معلومات كيميائية أكثر تفصيلا من تقنيات الكشف عن SM الأخرى. في الوقت نفسه ، هناك إمكانية لكشف المعلومات من قياسات SM التي تظل مخفية في قياسات رامان للمواد السائبة. يحدد هذا البروتوكول قياسات SM SERS باستخدام هوائي نانوي أوريغامي الحمض النووي (DONA) بالاشتراك مع مجهر القوة الذرية (AFM) والتحليل الطيفي لرامان. يتم الجمع بين بنية شوكة أوريغامي الحمض النووي وجسيمين نانويين من الذهب لتشكيل DONAs ، مع وجود فجوة 1.2-2.0 نانومتر بينهما. وهذا يسمح بتحسين إشارة SERS بما يصل إلى 10أضعاف 11 ضعفا ، مما يتيح قياسات الجزيئات المفردة. يوضح البروتوكول كذلك وضع جزيء تحليل واحد في نقطة ساخنة SERS ، وعملية تصوير AFM ، والتراكب اللاحق لتصوير رامان لقياس المادة المراد تحليلها في DONA واحد.
Introduction
أوريغامي الحمض النووي هي تقنية نانوية تتضمن طي خيوط الحمض النووي في أشكال وأنماط محددة. تعد القدرة على إنشاء هياكل ذات تحكم دقيق على المستوى النانوي إحدى المزايا الرئيسية لأوريغامي الحمض النووي1. القدرة على التعامل مع المادة على هذا النطاق الصغير لديها القدرة على إحداث ثورة في مجموعة واسعة من المجالات ، بما في ذلك الطب والإلكترونيات وعلوم المواد2. على سبيل المثال ، تم استخدام هياكل أوريغامي الحمض النووي لتوصيل الأدوية مباشرة إلى الخلايا السرطانية3,4 ، وإنشاء أجهزة استشعار نانوية للكشف عن الأمراض5,6 ، وإنشاء أنماط معقدة على أسطح المواد 6,7. علاوة على ذلك ، فإن القدرة على استخدام اوريغامي الحمض النووي لإنشاء هياكل نانوية معقدة قد خلقت فرصا جديدة لدراسة العمليات البيولوجية الأساسية على المستوى النانوي8.
تشتت رامان المحسن السطحي (SERS) هو تقنية تحليلية قوية تكتشف وتحدد الجزيئات بتركيزات منخفضة للغاية9. يعتمد على تأثير رامان ، وهو تغيير في الطول الموجي للضوء المتناثر10. يتطلب SERS ركيزة معدنية بلازمونية لتعزيز إشارة رامان للجزيئات الممتصة عليها. يمكن أن يصل هذا التحسين إلى 10 11 مرة أكبر من الإشارة التي تم الحصول عليها من نفس الجزيء الذي تم قياسه بواسطة مطيافية رامان التقليدية ، مما يجعل SERS طريقة حساسة للغاية لتحليل كميات ضئيلة من المواد11.
يرجع تعزيز إشارة رامان للجسيمات النانوية في الغالب إلى التحسين الكهرومغناطيسي القائم على إثارة رنين البلازمون السطحي الموضعي (LSPR) 12. في هذه الظاهرة ، تتذبذب الإلكترونات داخل الجسيمات النانوية المعدنية بشكل جماعي حول سطح الجسيمات النانوية المعدنية أثناء حدوث الضوء. ينتج عن هذا إنشاء موجة دائمة من الإلكترونات تعرف باسم البلازمون السطحي ، والتي يمكن أن يتردد صداها مع الضوء الساقط. يعزز LSPR بشكل كبير المجال الكهربائي بالقرب من سطح الجسيم ، ويكون الامتصاص البصري للجسيم هو الحد الأقصى عند تردد رنين البلازمون. تعتمد طاقة البلازمون السطحي على شكل وحجم الجسيمات النانوية المعدنية ، وكذلك خصائص الوسط المحيط13. يمكن تحقيق تحسين أعلى من خلال الوصلات البلازمونية ، مثل عندما يكون جسيمان نانويان قريبين من بعضهما البعض على مسافة تقارب 2.5 ضعف طول القطر أو أقلمن 14. يتسبب القرب في تفاعل LSPR لكلا الجسيمين النانويين مع بعضهما البعض ، مما يعزز المجال الكهربائي في الفجوة بين الجسيمات بعدة أوامر من حيث الحجم ، وهو ما يتجاوز بكثير تعزيز جسيم نانوي واحد15،16،17. يتناسب حجم التحسين عكسيا مع المسافة بين الجسيمات النانوية. مع انخفاض المسافة ، تظهر نقطة حرجة حيث يكون التحسين كافيا للكشف عن الجزيئات المفردة (SMs)18.
يمثل اوريغامي الحمض النووي تقنية رئيسية يمكنها ترتيب الجسيمات النانوية البلازمونية بكفاءة لاستغلال وتحسين اقتران البلازموني19. في الوقت نفسه ، يمكن وضع الجزيئات ذات الأهمية بدقة في المكان الذي يكون فيه الكشف البصري أكثر كفاءة. وقد تم إثبات ذلك باستخدام الهوائيات النانوية البلازمونية القائمة على الحمض النووي للكشف عن التألق20. على عكس الكشف عن الملصقات الفلورية ، يوفر SERS إمكانية اكتشاف بصمة كيميائية مباشرة للجزيء ، مما يجعل SERS أحادي الجزيء جذابا للغاية للاستشعار وكذلك مراقبة التفاعلات الكيميائية والدراسات الميكانيكية. يمكن أيضا استخدام اوريغامي الحمض النووي كقناع لتصنيع الهياكل النانوية البلازمونية بأشكال محددة جيدا21 ، على الرغم من فقدان إمكانية وضع الجزيئات المستهدفة بدقة في النقطة الساخنة.
باستخدام مجهر القوة الذرية الموضعية (AFM) وقياسات رامان ، يمكننا الحصول على أطياف رامان من هوائي نانوي واحد من الحمض النووي (DONA) وربما جزيء واحد إذا تم وضعه في موضع أعلى تعزيز للإشارة. يتكون DONA من شوكة أوريغامي الحمض النووي وجسيمين نانويين موضوعين بدقة ، مغلفين بالكامل بالحمض النووي المكمل لخيوط المواد الأساسية الممتدة المرتبطة بأوريغامي الحمض النووي. عند تهجين الحمض النووي ، ترتبط الجسيمات النانوية بشوكة أوريغامي الحمض النووي بفجوة 1.2-2.0 نانومتر بين أسطح الجسيمات النانوية22. يخلق هذا التجميع نقطة ساخنة بين الجسيمات النانوية مع تحسين إشارة يصل إلى 1011 ضعفا ، كما تم حسابه من محاكاة مجال الوقت المحدود (FDTD)22 ، مما يسمح بقياسات SM SERS. ومع ذلك ، فإن حجم أعلى تحسين صغير (في نطاق 1-10 نانومتر3 ) ، وبالتالي يجب وضع الجزيئات المستهدفة بدقة في هذه النقطة الساخنة. تسمح شوكة اوريغامي الحمض النووي بوضع جزيء واحد بين الجسيمين النانويين باستخدام جسر شوكة الحمض النووي وكيمياء اقتران مناسبة. ومع ذلك ، فإن مراقبة مثل هذه SMs في أطياف رامان يمثل تحديا كبيرا22. بدلا من ذلك ، يمكن طلاء الجسيمات النانوية بالكامل بالجزيء المستهدف ، مثل صبغة TAMRA ، للسماح بقياسات DONA مفردة بكثافة SERS أعلى21. في هذه الحالة ، يتم ربط TAMRA تساهميا بحبل طلاء الحمض النووي (الشكل 1).
Protocol
1. تجميع شوكة اوريغامي الحمض النووي
- التجميع الذاتي لهيكل اوريغامي الحمض النووي في وعاء واحد. أولا ، أضف 2.5 نانومتر سقالة دائرية M13mp18 (7249 نيوكليوتيدات ، انظر جدول المواد) و 100 نانومتر من 201 قليل النوكليوتيدات القصيرة (الجدول 1) في 1x TAE (tris [hydroxymethyl] aminomethane [tris] ، حمض الخليك ، حمض الخليك إيثيلين ديامين [EDTA]) المكمل ب 15 mM MgCl2 buffer. بعد ذلك ، اضبط الحجم الإجمالي على 100 ميكرولتر باستخدام ماء فائق النقاء.
- قم بتلدين المحلول لاحقا عن طريق تدرج درجة الحرارة في جهاز تدوير حراري ، أولا عن طريق التسخين السريع إلى 80 درجة مئوية ، ثم عن طريق التبريد من 80 درجة مئوية إلى 20 درجة مئوية عند 1 درجة مئوية / 12 دقيقة ، ثم من 20 درجة مئوية إلى 16 درجة مئوية عند 1 درجة مئوية / 6 دقائق ، يليه التبريد السريع من 16 درجة مئوية إلى 8 درجات مئوية.
- استخدم مرشحات Amicon ذات الوزن الجزيئي 100 كيلو دالتون (MWCO) (انظر جدول المواد) لتنقية الخليط من المواد الغذائية الزائدة.
- أضف 100 ميكرولتر من محلول أوريغامي الحمض النووي إلى مرشحات Amicon ، بالإضافة إلى 400 ميكرولتر من الماء عالي النقاء ، ثم أجهزة الطرد المركزي عند 6000 × جم لمدة 8 دقائق في درجة حرارة الغرفة (RT).
- تخلص من المرشح عن طريق إزالة الفلتر وقلب الأنبوب لإزالة الغسيل في الحوض ، ثم أضف 400 ميكرولتر من الماء عالي النقاء إلى المرشح وأجهزة الطرد المركزي مرة أخرى. كرر هذه الخطوة مرة أخرى.
- لجمع محلول البنية النانوية المنقى ، اقلب المرشح رأسا على عقب في أنبوب جديد وجهاز طرد مركزي (1000 × جم ، 2 دقيقة ، RT) باتباع تعليمات الشركة المصنعة (انظر جدول المواد). يمكن تخزين هذا المحلول في الثلاجة عند 8 درجات مئوية لمدة تصل إلى 2 أسابيع.
ملاحظة: استخدم 1x TAE buffer أو 1x TAE المكمل بمحلول 15 mM MgCl2 بدلا من الماء عالي النقاء لخطوة تنقية مرشح Amicon ، لأن الماء يقلل من الاستقرار ويقلل من تركيز شوكات اوريغامي الحمض النووي التي تم الحصول عليها. لقياس جزيء صبغة واحد ، يتم استبدال خليط حبلا الحمض النووي الأساسي بخليط حبلا معدل يحتوي على صبغة TAMRA في الطرف 5. يقع هذا الشريط المعدل في منتصف جسر nanofork (الجدول 2).
2. طلاء الجسيمات النانوية الذهبية (AuNP)
ملاحظة: تم استخدام نسخة معدلة من بروتوكول Liu et al.23 لتغليف AuNPs ، وتضمنت عملية الطلاء تجميد محلول AuNP-DNA.
- أجهزة الطرد المركزي (3500 × جم ، 5 دقائق ، RT) 400 ميكرولتر من محلول AuNP بقطر 60 نانومتر (تم الحصول عليه تجاريا ؛ انظر جدول المواد) ، وباستخدام ماصة ، قم بإزالة المادة الطافية. بعد ذلك ، قم بإعادة إذابة الحبيبات في 25 ميكرولتر من الماء عالي النقاء. التركيز النهائي ل AuNPs هو ~ 0.3 نانومتر.
- أضف 1 ميكرولتر من محلول تريس (2-كربوكسي إيثيل) فوسفين (TCEP) 100 مللي متر إلى 4 ميكرولتر من الحمض النووي المعدل بالثيول (100 ميكرومتر كما توفره الشركة المصنعة ؛ انظر جدول المواد) واحتضان لمدة 10 دقائق في RT.
- بعد الحضانة ، أضف خليط 5 ميكرولتر إلى محلول AuNP المركز (الخطوة 2.1) ، دوامة لمدة 5 ثوان ، وقم بتجميدها لمدة ساعتين على الأقل عند -20 درجة مئوية.
- بعد ذوبان الجليد في RT ، أجهزة الطرد المركزي (3500 × جم ، 5 دقائق ، RT) الخليط لإزالة الحمض النووي للطلاء المضاف بشكل مفرط. باستخدام ماصة ، قم بإزالة المادة الطافية ، وقم بإذابة الحبيبات في 10 ميكرولتر من الماء.
ملاحظة: يوجد خيطان طلاء لكل من AuNPs على الشوكة النانوية (الجدول 2). الخطوات هي نفسها باستثناء تسلسل شريط طلاء الحمض النووي. بمجرد طلاء الجسيمات ، تصبح مستقرة للغاية ؛ يمكن أن تبقى كما هي لعدة أشهر في الثلاجة ويمكن حتى تجميدها. بالنسبة للصبغة المطلية بالكامل AuNPs ، تحتوي خيوط الحمض النووي للطلاء على صبغة TAMRA داخلية.
3. جمعية دونا
- أضف محلول AuNP المطلي إلى محلول nanofork ، مع نسبة تركيز مولية تبلغ 1.5: 1.
- أضف MgCl2 إلى تركيز نهائي قدره 4 mM باستخدام محلول مخزون MgCl2 50 mM. اضبط الحجم النهائي على 20 ميكرولتر باستخدام ماء فائق النقاء.
- قم بتهجين DONAs باستخدام تدرج درجة الحرارة في جهاز تدوير حراري. أولا ، قم بالتسخين بسرعة إلى 40 درجة مئوية ، ثم تبرد من 40 درجة مئوية إلى 20 درجة مئوية عند 1 درجة مئوية / 10 دقائق ، ثم تبرد بسرعة من 20 درجة مئوية إلى 8 درجات مئوية.
4. هلام الكهربائي
ملاحظة: تتم إزالة الجسيمات النانوية غير المنضمة في محلول DONA عن طريق الرحلان الكهربائي لهلام الأغاروز.
- إعداد 1 ٪ هلام الاغاروز. لهذا ، قم بإذابة 0.8 غرام من الأغاروز في 80 مل من 1x TAE تستكمل مع 5 mM MgCl2.
- أضف 2.25 ميكرولتر من مخزن التحميل المؤقت (30٪ جلسرين ، 13 مللي مول MgCl 2 ؛ انظر جدول المواد) إلى 18 ميكرولتر من محلول DONA للوصول إلى تركيز نهائي قدره 5 mM MgCl 2 من 4 mM في الخطوة 3.2. يضمن المخزن المؤقت للتحميل أيضا بقاء العينة داخل جيب الجل.
- قم بتشغيل الجل لمدة 60 دقيقة عند 70 فولت في حمام ماء مثلج. المخزن المؤقت قيد التشغيل هو 1x TAE مكمل ب 5 mM MgCl2.
- اقطع الشريط محل الاهتمام وضعه على شريحة مجهرية ملفوفة بغشاء بلاستيكي بالبارافين ، ثم اضغط على المحلول باستخدام شريحة مجهرية ثانية ملفوفة بغشاء بلاستيكي من البارافين. باستخدام ماصة ، اجمع السائل المعصور في أنبوب سعة 500 ميكرولتر.
5. التمركز المشترك لقياسات AFM و Raman
- تعالج البلازما شريحة سيليكون (انظر جدول المواد) لمدة 10 دقائق ، ثم تحتضن 10 ميكرولتر من محلول DONA المنقى بالإضافة إلى 10 ميكرولتر من 100 mM MgCl2 على الشريحة لمدة 3 ساعات. بعد ذلك ، اغسل الشريحة مرتين بمزيج 1: 1 (من حيث الحجم) من الإيثانول والماء وجففها بالهواء المضغوط. ثم قم بلصق الشريحة على قرص مغناطيسي وأدخلها في الجهاز للتصوير.
ملاحظة: قبل بدء القياسات ، يتم ضبط موضع ليزر إثارة رامان ليكون أعلى طرف مسبار AFM. في العمل الحالي ، تم استخدام مجهر HORIBA LabRAM HR Evolution Raman المقترن ب HORIBA Omegascope AFM. يتم التحكم في الأداة باستخدام برنامج LabSpec و AIST. - لقياس AFM ، استخدم وضع النقر (وضع التيار المتردد) مع أطراف ACCESS-NC-A (تردد الرنين: 300 كيلو هرتز ؛ ثابت الزنبرك: 45 نيوتن / م)24. يتحكم وضع التيار المتردد تلقائيا في جميع المعلمات باستثناء معدل المسح ، والذي تم ضبطه على 1 هرتز.
ملاحظة: بعد تصوير AFM ، يتم سحب طرف AFM بحيث لا يكون في مسار ليزر رامان. يتم ذلك باستخدام وظيفة ماكرو ، "التحقيق بعيدا" ، المبرمجة في النظام. بهذه الطريقة ، لأي نقطة مختارة في صورة AFM ، سيكون الليزر في نفس الموضع بدون إزاحة مقارنة ب AFM. - اختر الطول الموجي المطلوب لليزر والطاقة ووقت التراكم لقياسات رامان ، حيث تعتمد كل هذه المعلمات على العينة المقاسة.
- استخدم المعلمات المذكورة لقياس TAMRA AuNP المطلي بالكامل: ليزر 633 نانومتر ، طاقة 100 ميكروواط ، ووقت تكامل 1 ثانية.
- استخدم المعلمات المذكورة لقياس TAMRA واحد: ليزر 633 نانومتر ، طاقة 400 ميكروواط ، ووقت تكامل 4 ثوان.
- بعد ضبط المعلمات ، ضع المؤشر أعلى DONA المطلوب في صورة AFM ؛ تقوم وظيفة "تحريك المؤشر" في البرنامج بذلك. ثم ابدأ قياس رامان.
ملاحظة: هناك طرق مختلفة للحصول على الأطياف: قياس نقطة واحدة - رسم خرائط زمنية أحادية البعد - حيث يتم قياس نقطة واحدة على مدار الوقت25 ؛ ورسم خرائط منطقة XY ثنائية الأبعاد ، حيث يتم تحريك مرحلة آلية تحت الليزر للحصول على أطياف من مجموعة من النقاط في شبكة XY26.
النتائج
باتباع البروتوكول ، يجب على المرء التأكد من تجميع شوكة اوريغامي الحمض النووي بشكل صحيح ؛ الطريقة المفضلة لفحص هيكل الشوكات هي تصوير AFM. من المتوقع أن تكون معظم الشوكات صلبة ، بدون أذرع مكسورة. من ناحية أخرى ، يصعب تصوير الجسر بين الذراعين بسبب قطره الصغير ومرونته العالية. كما يتطلب طرف AFM حاد جدا (الشكل 2).
يشير تغيير لون المحلول في كل خطوة من خطوات عملية طلاء AuNP إلى أن كل شيء يعمل بشكل صحيح. يبدأ اللون باللون الأحمر الغامق مع AuNPs فقط ، ولكن بمجرد إضافة الحمض النووي ، يتغير إلى اللون الأحمر الأرجواني الداكن. يغير التجميد اللون إلى اللون الأرجواني ، وبعد ذوبان الجليد ، يعيده إلى اللون الأحمر الغامق (الشكل 3 أ). يصور الشكل 3B أطياف الامتصاص ل AuNPs العارية و AuNPs المغلفة بالحمض النووي.
بعد ذلك ، في خطوات تجميع DONA ، يظل اللون أحمر غامق طوال العملية برمتها. أثناء تنقية هلام الأغاروز ، يظهر شريط دايمر فوق نطاق AuNP المجاني ، وهو النطاق الأسرع تشغيلا في العينة. يتوافق شريط dimer هذا مع DONAs ويتم قطعه وضغطه لاحقا لاستخراج العينة (الشكل 4).
أخيرا ، بالنسبة لقياسات التموضع المشترك ، يتم إجراء تصوير AFM للعينة بحثا عن DONAs (الشكل 5). بعد ذلك ، يتم جمع أطياف رامان من DONAs الفردية ومقارنتها للتأكد من أن الأطياف التي تم الحصول عليها هي من جزيئات TAMRA (الشكل 6).

الشكل 1: تمثيل تخطيطي لشوكة اوريغامي الحمض النووي (DNA) و DONA المجمعة بالكامل. أ: أبعاد شوكة اوريغامي الحمض النووي (DNA) بجسر طوله 90 نيوكليوتيد. (ب) منظر جانبي تخطيطي ل DONA مجمع ، مع اثنين من AuNPs وشوكة اوريغامي الحمض النووي بينهما. (ج) منظر علوي تخطيطي ل DONA المجمع يوضح موضع SM في منتصف الجسر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
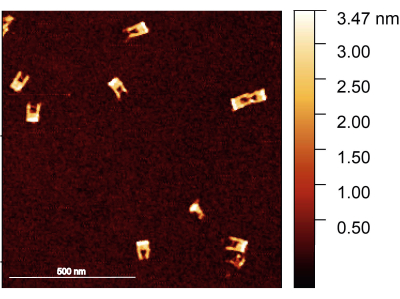
الشكل 2: صورة AFM لشوكات اوريغامي الحمض النووي بعد التجميع. تم تشكيل الشوكات بشكل جيد ، مع ظهور الجسر في بعض الشوكات. يتراوح ارتفاع الشوكات بين 1.5-2 نانومتر. شريط المقياس = 500 نانومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
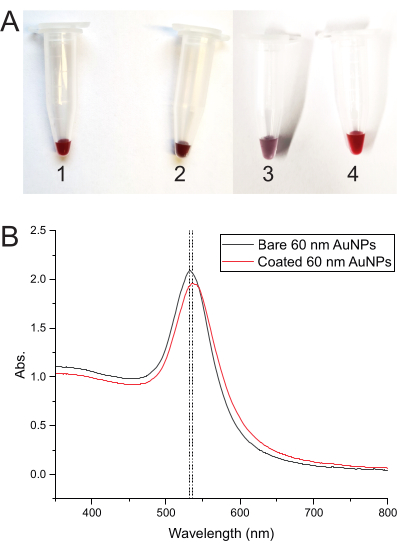
الشكل 3: تطور اللون وأطياف الامتصاص ل AuNPs . (أ) أنابيب توضح لون محلول AuNP في خطوات مختلفة. (1) اللون الأحمر الغامق لمحلول AuNP العاري. (2) أحمر أرجواني داكن بعد إضافة الحمض النووي للطلاء إلى AuNPs. (3) اللون الأرجواني بعد تجميد خليط طلاء DNA-AuNP. (4) يعود اللون إلى اللون الأحمر الغامق بعد ذوبان الخليط. (ب) أطياف الامتصاص ل 60 نانومتر AuNPs ، مما يدل على التحول في ذروة الامتصاص من AuNPs العارية (الأنبوب 1) إلى AuNPs المغلفة بالحمض النووي (الأنبوب 4). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
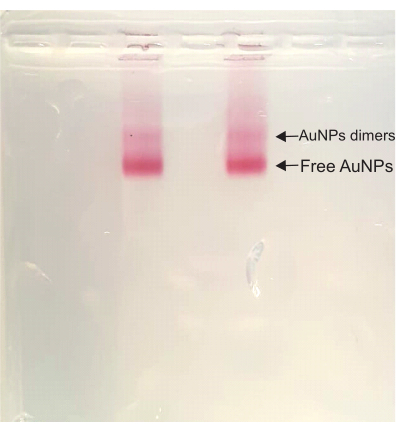
الشكل 4: هلام الأغاروز من محلول دونا. كلا المسارين لهما نفس العينة ، وكل من النطاق الخافت (DONA) ونطاق AuNP المجاني مرئيان بوضوح. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: صورة AFM ل DONAs. (أ) تظهر الصورة هياكل DONA متعددة ؛ يتم استخدام صورة AFM هذه لقياسات colocalization. (ب) صورة مكبرة ل DONA المحاطة بدائرة والمقطع العرضي الرأسي ل DONA. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
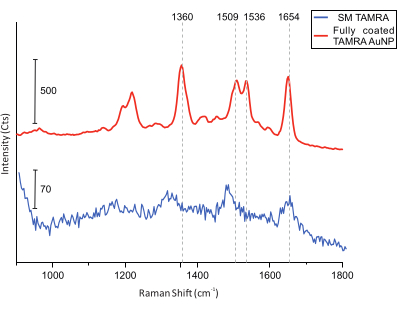
الشكل 6: أطياف SERS من DONAs المجهزة ب TAMRA AuNPs المطلية بالكامل وبجزيء TAMRA واحد. تشير خطوط الشبكة الرأسية إلى قمم TAMRA الرئيسية. يمكن رؤية قمم TAMRA الرئيسية في TAMRA AuNP المطلي بالكامل. على الرغم من أن نسبة الإشارة إلى الضوضاء لأطياف SM TAMRA أقل ، إلا أنه يمكن تحديد القمم الرئيسية: 1360 سم -1: تمدد C-C ؛ 1,509 سم -1: C = C تمتد ؛ 1,536 سم -1: C = C تمتد ؛ 1,654 سم -1: C = O تمتد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: قائمة المواد الغذائية الأساسية لشوكة اوريغامي الحمض النووي. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 2: قائمة خيوط الحمض النووي المعدلة. الرجاء الضغط هنا لتنزيل هذا الجدول.
Discussion
SM SERS هي أداة قوية تسمح للباحثين بدراسة سلوك وتفاعلات الجزيئات الفردية داخل العينة1. تسمح هذه التقنية بتحليل الأنظمة على مستوى غير مسبوق من الحساسية ، مما يوفر رؤى جديدة حول السلوك الأساسي للجزيئات المفردة وتوزيع الخصائص الكيميائية أو الفيزيائية على مجموعة من الجزيئات ، ويساعد على تحديد الوسائط ذات الصلة في العمليات الكيميائية. ومع ذلك ، فإن وضع جزيء واحد في النقطة الساخنة مع التأكد أيضا من أن البقعة الساخنة لديها ما يكفي من تحسين السطح يمكن أن يكون صعبا للغاية27. يمكن ل DONAs الموصوفة في هذا البروتوكول وضع جزيء واحد بدقة في النقطة الساخنة بين جسيمين نانويين من الذهب مع ضمان الوصول إلى تحسين السطح بمقدار 1011 ضعفا.
الفجوة بين الجسيمات النانوية أمر بالغ الأهمية لتجميع DONA للوصول إلى تحسين السطح المطلوب لدراسات SM SERS. تم تحسين DONAs للجسيمات النانوية الكروية ذات الأحجام بين 60 و 80 نانومتر. علاوة على ذلك ، يمكن أن تؤثر جودة الجسيمات النانوية بشكل كبير على تهجين الجسيمات النانوية باستخدام شوكات أوريغامي الحمض النووي. عندما تكون الجسيمات النانوية المستخدمة في خطوة الطلاء أقدم من 6 أشهر ، تبدأ كفاءة التهجين في الانخفاض.
جانب آخر مهم من البروتوكول هو أن الخطوات التي تتطلب نسبة دقيقة بين المكونات يجب اتباعها بدقة ، وإلا فلن يتم تشكيل DONAs بشكل صحيح. شوكة اوريغامي الحمض النووي حساسة للغاية لبروتوكول زيادة درجة الحرارة ، مع تغييرات تؤثر على سلامة الهيكل أو تمنع تكون الشوكات.
يعد توليد الكربون غير المتبلور مشكلة كبيرة أثناء قياسات SERS لأن قممه عادة ما تكون في نفس نطاق منطقة بصمات الأصابع للعديد من الجزيئات (1,200-1,700 سم -1). في حين أن التكوين لم يتم فهمه بالكامل بعد ، إلا أنه يرتبط عادة بقوة ليزر عالية أو أوقات تكامل طويلة28. كإجراء احترازي ، يجب استخدام أقل طاقة ليزر وأقصر وقت تكامل ممكن. ومع ذلك ، لا يمكن تحقيق ذلك بسهولة لأنه يجب تحقيق توازن بين الحصول على إشارة SERS المطلوبة وتجنب توليد الكربون غير المتبلور.
تعتبر DONAs متعددة الاستخدامات للغاية كنظام SM فيما يتعلق بالأنواع والأشكال المختلفة للجسيمات النانوية التي يمكن استخدامها ، مثل الكرات الفضية أو الزهور الذهبية أو النجوم. بالإضافة إلى ذلك ، يمكن استبدال الجزيء قيد الفحص بسهولة عن طريق تغيير شريط الحمض النووي فقط في منتصف الجسر ، دون أي تغييرات على الإجراء. يمكن التحول إلى البروتينات مثل السيتوكروم C عن طريق وجود شريط التقاط الحمض النووي المعدل بالبيريدين في الجسر ، والذي من شأنه أن يربط السيتوكروم C ويضمن وجوده في النقطة الساخنة لقياسات SM SERS22. يترجم هذا أيضا إلى اختيار الليزر بمرونة للإشعاع ، وربما باستخدام ليزر يوفر أقصى قدر من التحسين.
باختصار ، هذه الطريقة موثوقة لتجميع هياكل DONA واستخدامها لقياسات مطيافية رامان المعززة بالسطح أحادية الجزء.
Disclosures
ليس للمؤلفين مصالح مالية متنافسة أو تضارب مصالح آخر.
Acknowledgements
تم دعم هذا البحث من قبل مجلس البحوث الأوروبي (ERC ؛ المنحة الموحدة رقم 772752).
Materials
| Name | Company | Catalog Number | Comments |
| 100 kDa MWCO Amicon filters, 0.5 mL | Merck | UFC5100BK | |
| 10x TAE buffer (0.4 M Tris, 0.2 M acetic acid, 0.01 M EDTA) | SIGMA Aldrich | T9650 | |
| 60 nm goldspheres, bare (citrate) | NanoComposix | AUCN60 | |
| ACCESS-NC-A AFM probes | SCHAEFER-TEC | ||
| Agarose powder | SIGMA Aldrich | 9012-36-6 | |
| AuNP DNA coating strands | IDT | ||
| AuNP DNA coating strands (TAMRA) | SIGMA Aldrich | ||
| Glycerol | SIGMA Aldrich | 56-81-5 | |
| Heraeus Fresco 17 centrifuge | Thermo Fisher Scientific | ||
| HORIBA OmegaScope with a LabRAM HR evolution | HORIBA | ||
| Magnesium chloride | SIGMA Aldrich | 7786-30-3 | |
| Nanofork DNA bridge strand (TAMRA) | Metabion | ||
| Nanofork DNA staple strands | SIGMA Aldrich | ||
| ParafilmM | Carl Roth | CNP8.1 | |
| Primus 25 Thermocycler | Peqlab/VWR | ||
| Silicon wafer | Siegert wafer | BW14076 | |
| Single-stranded scaffold DNA, type p7249 (M13mp18) | Tilibit nanosystems | ||
| TCEP solution | SIGMA Aldrich | 51805-45-9 |
References
- Heck, C., Kanehira, Y., Kneipp, J., Bald, I. Placement of single proteins within the SERS hot spots of self-assembled silver nanolenses. Angewandte Chemie. 57 (25), 7444-7447 (2018).
- Dey, S., et al. DNA origami. Nature Reviews Methods Primers. 1 (1), 13 (2021).
- Tasciotti, E. Smart cancer therapy with DNA origami. Nature Biotechnology. 36 (3), 234-235 (2018).
- Ijäs, H., et al. Unraveling the interaction between doxorubicin and DNA origami nanostructures for customizable chemotherapeutic drug release. Nucleic Acids Research. 49 (6), 3048-3062 (2021).
- Wang, S., et al. DNA origami-enabled biosensors. Sensors. 20 (23), 6899 (2020).
- Kabusure, K. M., et al. Optical characterization of DNA origami-shaped silver nanoparticles created through biotemplated lithography. Nanoscale. 14 (27), 9648-9654 (2022).
- Kershner, R. J., et al. Placement and orientation of individual DNA shapes on lithographically patterned surfaces. Nature Nanotechnology. 4 (9), 557-561 (2009).
- Dutta, A., et al. Molecular states and spin crossover of hemin studied by DNA origami enabled single-molecule surface-enhanced Raman scattering. Nanoscale. 14 (44), 16467-16478 (2022).
- Langer, J., et al. Present and future of surface-enhanced Raman scattering. ACS Nano. 14 (1), 28-117 (2020).
- Jones, R. R., Hooper, D. C., Zhang, L., Wolverson, D., Valev, V. K. Raman techniques: fundamentals and frontiers. Nanoscale Research Letters. 14 (1), 231 (2019).
- Blackie, E. J., Le Ru, E. C., Etchegoin, P. G. Single-molecule surface-enhanced Raman spectroscopy of nonresonant molecules. Journal of the American Chemical Society. 131 (40), 14466-14472 (2009).
- Sepúlveda, B., Angelomé, P. C., Lechuga, L. M., Liz-Marzán, L. M. LSPR-based nanobiosensors. Nano Today. 4 (3), 244-251 (2009).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The optical properties of metal nanoparticles: The influence of size, shape, and dielectric environment. The Journal of Physical Chemistry B. 107 (3), 668-677 (2003).
- Funston, A. M., Novo, C., Davis, T. J., Mulvaney, P. Plasmon coupling of gold nanorods at short distances and in different geometries. Nano Letters. 9 (4), 1651-1658 (2009).
- Niu, R., et al. DNA origami-based nanoprinting for the assembly of plasmonic nanostructures with single-molecule surface-enhanced Raman scattering. Angewandte Chemie. 60 (21), 11695-11701 (2021).
- Fang, W., et al. Quantizing single-molecule surface-enhanced Raman scattering with DNA origami metamolecules. Science Advances. 5 (9), (2019).
- Zhan, P., et al. DNA origami directed assembly of gold bowtie nanoantennas for single-molecule surface-enhanced Raman scattering. Angewandte Chemie. 57 (11), 2846-2850 (2018).
- Choi, H. K., et al. Single-molecule surface-enhanced Raman scattering as a probe of single-molecule surface reactions: promises and current challenges. Accounts of Chemical Research. 52 (11), 3008-3017 (2019).
- Liu, N., Liedl, T. DNA-assembled advanced plasmonic architectures. Chemical Reviews. 118 (6), 3032-3053 (2018).
- Acuna, G. P., et al. Fluorescence enhancement at docking sites of DNA-directed self-assembled nanoantennas. Science. 338 (6106), 506-510 (2012).
- Shen, B., Kostiainen, M. A., Linko, V. DNA origami nanophotonics and plasmonics at interfaces. Langmuir. 34 (49), 14911-14920 (2018).
- Tapio, K., et al. A versatile DNA origami-based plasmonic nanoantenna for label-free single-molecule surface-enhanced Raman spectroscopy. ACS Nano. 15 (4), 7065-7077 (2021).
- Liu, B., Liu, J. Freezing-driven DNA adsorption on gold nanoparticles: tolerating extremely low salt concentration but requiring high DNA concentration. Langmuir. 35 (19), 6476-6482 (2019).
- Aliano, A., et al. AFM, tapping mode. Encyclopedia of Nanotechnology. , 99 (2012).
- Recording Raman spectral images and profiles. Horiba Scientific Available from: https://www.horiba.com/int/scientific/technologies/raman-imaging-and-spcetroscopy/recording-spectral-images-and=profiles/ (2023)
- Raman Images Explained. Renishaw Available from: https://www.renishaw.com/en/raman-images-explained-25810 (2023)
- Kogikoski, S., Tapio, K., von Zander, R. E., Saalfrank, P., Bald, I. Raman enhancement of nanoparticle dimers self-assembled using DNA origami nanotriangles. Molecules. 26 (6), 1684 (2021).
- Heck, C., Kanehira, Y., Kneipp, J., Bald, I. Amorphous carbon generation as a photocatalytic reaction on DNA-assembled gold and silver nanostructures. Molecules. 24 (12), 2324 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved