Method Article
Измерения комбинационного рассеяния света с поверхностным усилением одной молекулы с помощью плазмонных наноантенн оригами ДНК
В этой статье
Резюме
Этот протокол демонстрирует измерения комбинационного рассеяния света с поверхностным усилением одной молекулы (SERS) с использованием наноантенны ДНК-оригами (DONA) в сочетании с колокализованной атомно-силовой микроскопией (АСМ) и рамановскими измерениями.
Аннотация
Поверхностно-усиленное комбинационное рассеяние (SERS) способно обнаруживать отдельные молекулы, для которых требуется усиление высокого поля. Одномолекулярный (SM) SERS способен предоставлять специфическую для молекул спектроскопическую информацию об отдельных молекулах и, следовательно, дает более подробную химическую информацию, чем другие методы обнаружения SM. В то же время существует потенциал для разгадки информации из измерений SM, которая остается скрытой в рамановских измерениях сыпучего материала. В этом протоколе описываются измерения SM SERS с использованием наноантенны ДНК-оригами (DONA) в сочетании с атомно-силовой микроскопией (АСМ) и рамановской спектроскопией. Вилочная структура ДНК-оригами и две наночастицы золота объединяются, образуя DONA с зазором 1,2-2,0 нм между ними. Это позволяет в 10 раз увеличить сигнал SERS в11 раз, что позволяет измерять отдельные молекулы. Протокол также демонстрирует размещение одной молекулы аналита в горячей точке SERS, процесс визуализации АСМ и последующее наложение рамановской визуализации для измерения аналита в одном DONA.
Введение
ДНК-оригами — это нанотехнологический метод, который включает в себя складывание нитей ДНК в определенные формы и узоры. Возможность создания структур с точным контролем на наноуровне является одним из ключевых преимуществ ДНК-оригами1. Способность манипулировать материей в таком малом масштабе может произвести революцию в широком спектре областей, включая медицину, электронику и материаловедение2. Например, структуры ДНК-оригами использовались для доставки лекарств непосредственно к раковым клеткам3,4, создания наноразмерных датчиков для обнаружения заболеваний5,6 и создания замысловатых узоров на поверхностях материалов 6,7. Кроме того, возможность использовать ДНК-оригами для создания сложных наноразмерных структур создала новые возможности для изучения фундаментальных биологических процессов на наноуровне8.
Поверхностное комбинационное рассеяние света (SERS) — это надежный аналитический метод, который обнаруживает и идентифицирует молекулы при чрезвычайно низких концентрациях9. Он основан на эффекте комбинационного рассеяния, который представляет собой изменение длины волны рассеянного света10. SERS требуется плазмонная металлическая подложка для усиления рамановского сигнала адсорбированных на ней молекул. Это усиление может быть в 10-11 раз больше, чем сигнал, полученный от той же молекулы, измеренный с помощью обычной рамановской спектроскопии, что делает SERS высокочувствительным методом анализа следовых количеств веществ11.
Усиление рамановского сигнала наночастиц в основном связано с электромагнитным усилением, основанным на возбуждении локализованного поверхностного плазмонного резонанса (LSPR)12. В этом явлении электроны внутри наночастицы металла коллективно колеблются вокруг поверхности наночастицы металла во время падения света. Это приводит к созданию стоячей волны электронов, известной как поверхностный плазмон, который может резонировать с падающим светом. LSPR значительно усиливает электрическое поле вблизи поверхности частицы, и оптическое поглощение частицы является максимальным на резонансной частоте плазмонов. Энергия поверхностного плазмона зависит от формы и размера наночастицы металла, а также от свойств окружающей среды13. Более высокое усиление может быть дополнительно достигнуто плазмонными связями, например, когда две наночастицы находятся близко друг к другу на расстоянии, примерно в 2,5 раза превышающем длину диаметра или менее14. Близость заставляет LSPR обеих наночастиц взаимодействовать друг с другом, усиливая электрическое поле в промежутке между частицами на несколько порядков, намного превышая усиление одной наночастицы15,16,17. Величина усиления обратно пропорциональна расстоянию между наночастицами; по мере уменьшения расстояния появляется критическая точка, в которой усиления достаточно для обнаружения одиночных молекул (SM)18.
ДНК-оригами представляет собой ключевую технологию, которая может эффективно упорядочивать плазмонные наночастицы для использования и оптимизации плазмонной связи19. В то же время интересующие молекулы могут быть размещены именно в том месте, где оптическое обнаружение наиболее эффективно. Это было продемонстрировано с помощью плазмонных наноантенн на основе ДНК-оригами для обнаружения флуоресценции20. В отличие от обнаружения флуоресцентных меток, SERS обеспечивает возможность обнаружения прямого химического отпечатка молекулы, что делает одномолекулярный SERS очень привлекательным для зондирования, а также для мониторинга химических реакций и механистических исследований. ДНК-оригами также может быть использована в качестве маски для изготовления плазмонных наноструктур с четко определенными формами21, хотя в этом случае теряется возможность позиционировать молекулы-мишени точно в горячей точке.
Используя колокализованную атомно-силовую микроскопию (АСМ) и рамановские измерения, мы можем получить спектры комбинационного рассеяния из одной наноантенны ДНК-оригами (DONA) и, возможно, одной молекулы, если поместить ее в положение с наибольшим усилением сигнала. DONA состоит из вилки ДНК-оригами и двух точно расположенных наночастиц, полностью покрытых ДНК, комплементарной расширенным штапельным нитям, прикрепленным к ДНК-оригами. При гибридизации ДНК наночастицы связываются с вилкой ДНК-оригами с зазором 1,2-2,0 нм между поверхностяминаночастиц 22. Такая сборка создает горячую точку между наночастицами с усилением сигнала до 10 в11 раз, что вычисляется на основе моделирования22 в конечной разностной временной области (FDTD), что позволяет проводить измерения SM SERS. Однако объем наибольшего усиления невелик (в диапазоне 1-10нм3 ), и, следовательно, молекулы-мишени должны быть расположены точно в этой горячей точке. Вилка ДНК-оригами позволяет позиционировать одну молекулу между двумя наночастицами с помощью вилочного моста ДНК и подходящей химии связи. Тем не менее, наблюдение таких SM в рамановских спектрах является очень сложной задачей22. Альтернативно, наночастицы могут быть полностью покрыты целевой молекулой, такой как краситель TAMRA, чтобы обеспечить единичные измерения DONA с более высокой интенсивностью SERS21. В этом случае TAMRA ковалентно прикрепляется к цепи покрытия ДНК (рис. 1).
протокол
1. Сборка вилки ДНК оригами
- Самостоятельно соберите структуру ДНК оригами в одном горшке. Во-первых, добавьте 2,5 нМ кольцевую цепь каркаса M13mp18 (7,249 нуклеотидов, см. Таблицу материалов) и 100 нМ 201 коротких олигонуклеотидов (таблица 1) в 1x TAE (трис [гидроксиметил] аминометан [трис], уксусная кислота, этилендиаминуксусная кислота [ЭДТА]) с добавлением 15 мМ буфера MgCl2 . Затем отрегулируйте общий объем до 100 мкл с помощью сверхчистой воды.
- Затем отжигают раствор с помощью температурного градиента в термоциклере, сначала путем быстрого нагрева до 80 °C, затем путем охлаждения от 80 °C до 20 °C при 1 °C / 12 мин, затем от 20 °C до 16 °C при 1 °C / 6 мин с последующим быстрым охлаждением с 16 °C до 8 °C.
- Используйте фильтры Amicon с молекулярной массой 100 кДа (MWCO) (см. Таблицу материалов) для очистки смеси от излишков скоб.
- Добавьте 100 мкл раствора ДНК-оригами в фильтры Amicon, а также 400 мкл сверхчистой воды, затем центрифугу при 6000 x g в течение 8 мин при комнатной температуре (RT).
- Откажитесь от фильтрата, сняв фильтр и перевернув трубку, чтобы удалить смыв в раковине, затем добавьте 400 мкл сверхчистой воды в фильтр и снова центрифугу. Повторите этот шаг еще раз.
- Чтобы собрать очищенный раствор наноструктуры, переверните фильтр вверх дном в новой пробирке и центрифуге (1000 x g, 2 мин., RT) в соответствии с инструкциями производителя (см. Таблицу материалов). Этот раствор можно хранить в холодильнике при температуре 8 °C до 2 недель.
ПРИМЕЧАНИЕ: Используйте 1x буфер TAE или 1x TAE с добавлением буфера 15 мМ MgCl2 вместо сверхчистой воды для этапа очистки фильтра Amicon, так как вода снижает стабильность и снижает концентрацию полученных вилок ДНК-оригами. Для измерения одной молекулы красителя смесь штапельной цепи ДНК заменяется модифицированной смесью цепей, содержащей краситель TAMRA на 5'-конце. Эта модифицированная нить находится в середине моста нановилки (таблица 2).
2. Покрытие наночастицами золота (AuNP)
ПРИМЕЧАНИЕ: Модифицированная версия протокола Liu et al.23 использовалась для покрытия AuNPs, а процесс нанесения покрытия включал замораживание раствора AuNP-ДНК.
- Центрифугу (3,500 x g, 5 мин, RT) 400 мкл раствора AuNP диаметром 60 нм (коммерчески полученного; см. Таблицу материалов) и с помощью пипетки удалите надосадочную жидкость. Затем растворите гранулу в 25 мкл сверхчистой воды. Конечная концентрация AuNP составляет ~ 0,3 нМ.
- Добавьте 1 мкл 100 мМ раствора трис-(2-карбоксиэтил)фосфина (TCEP) к 4 мкл тиол-модифицированной ДНК (100 мкМ в соответствии с поставкой производителя; см. Таблицу материалов) и инкубируйте в течение 10 мин при RT.
- После инкубации добавляют смесь объемом 5 мкл к концентрированному раствору AuNP (этап 2.1), перемешивают в течение 5 с и замораживают не менее 2 ч при -20 °C.
- После размораживания при РТ центрифугу (3,500 х г, 5 мин, РТ) смесь удаляют с избыточно добавленной ДНК покрытия. С помощью пипетки удалите надосадочную жидкость и растворите гранулу в 10 мкл воды.
ПРИМЕЧАНИЕ: Для каждого из AuNP на нанофорке есть две нити покрытия (таблица 2). Этапы одинаковы, за исключением последовательности нити покрытия ДНК. После того, как частицы покрыты, они очень стабильны; Они могут месяцами храниться в холодильнике и даже могут быть заморожены. Для полностью покрытых красителей AuNP нити ДНК покрытия имеют внутренний краситель TAMRA.
3. Сборка DONA
- Добавьте покрытый покрытием раствор AuNP в раствор нановилки с молярным соотношением концентраций 1,5:1.
- Добавьте MgCl 2 к конечной концентрации 4 мМ, используя исходный раствор MgCl2 50 мМ. Отрегулируйте конечный объем до 20 мкл с помощью сверхчистой воды.
- Гибридизируйте DONA с помощью температурного градиента в термоциклере. Сначала быстро нагрейте до 40 °C, затем охладите от 40 °C до 20 °C при 1 °C / 10 мин, а затем быстро охладите от 20 °C до 8 °C.
4. Гель-электрофорез
ПРИМЕЧАНИЕ: Несвязанные наночастицы в растворе DONA удаляются электрофорезом в агарозном геле.
- Приготовьте 1% агарозный гель. Для этого растворите 0,8 г агарозы в 80 мл 1x TAE с добавлением 5 мМ MgCl2.
- Добавьте 2,25 мкл загрузочного буфера (30% глицерина, 13 мМ MgCl 2; см. Таблицу материалов) к 18 мкл раствора DONA для достижения конечной концентрации 5 мМ MgCl 2 из 4 мМ на этапе 3.2. Загрузочный буфер также гарантирует, что образец останется внутри кармана геля.
- Запустите гель в течение 60 мин при 70 В на водяной бане. Рабочий буфер представляет собой 1x TAE, дополненный 5 мМ MgCl2.
- Вырежьте интересующую полосу и поместите ее на предметное стекло для микроскопии, обернутое парафиновой пластиковой пленкой, а затем выдавите раствор с помощью второго предметного стекла для микроскопии, обернутого парафиновой пластиковой пленкой. С помощью пипетки соберите выжатую жидкость в пробирку объемом 500 мкл.
5. Колокализация измерений АСМ и комбинационного рассеяния света
- Плазменную обработку кремниевого чипа (см. Таблицу материалов) в течение 10 мин, затем инкубируют 10 мкл очищенного раствора DONA плюс 10 мкл 100 мМ MgCl2на чипе в течение 3 ч. Затем дважды промойте чип смесью этанола и воды в соотношении 1:1 (по объему) и высушите феном сжатым воздухом. Затем заклейте чип на магнитный диск и вставьте его в прибор для визуализации.
ПРИМЕЧАНИЕ: Перед началом измерений положение рамановского возбуждающего лазера регулируется так, чтобы оно находилось поверх наконечника зонда АСМ. В настоящей работе используется рамановский микроскоп HORIBA LabRAM HR Evolution в сочетании с АСМ HORIBA Omegascope. Управление прибором осуществляется с помощью программного обеспечения LabSpec и AIST. - Для измерения АСМ используйте режим постукивания (режим переменного тока) с наконечниками ACCESS-NC-A (резонансная частота: 300 кГц; постоянная пружины: 45 Н/м)24. Режим переменного тока автоматически контролирует все параметры, кроме частоты сканирования, которая установлена на 1 Гц.
ПРИМЕЧАНИЕ: После АСМ-визуализации наконечник АСМ отводится так, чтобы он не находился на пути рамановского лазера. Это делается с помощью макрофункции «Probe away», запрограммированной в системе. Таким образом, для любой выбранной точки на изображении АСМ лазер будет находиться в том же положении без смещения по сравнению с АСМ. - Выберите желаемую длину волны лазера, мощность и время накопления для рамановских измерений, так как все эти параметры зависят от измеряемого образца.
- Используйте указанные параметры для измерения TAMRA AuNP с полным покрытием: лазер 633 нм, мощность 100 мкВт и время интегрирования 1 с.
- Используйте указанные параметры для одного измерения TAMRA: лазер 633 нм, мощность 400 мкВт и время интегрирования 4 с.
- После настройки параметров поместите курсор поверх нужного DONA на изображении AFM; Функция «переместить курсор» в программном обеспечении делает это. Затем начните рамановское измерение.
ПРИМЕЧАНИЕ: Существуют различные режимы получения спектров: одноточечное измерение - одномерное отображение времени - когда одна точка измеряется во времени25; и двумерное картографирование областей XY, при котором моторизованный столик перемещается под лазером для получения спектров из массива точек в сетке26 XY.
Результаты
Следуя протоколу, следует убедиться, что вилка ДНК оригами правильно собрана; предпочтительным методом исследования структуры вилок является АСМ-визуализация. Ожидается, что большинство вилок будут прочными, без сломанных рук. С другой стороны, мост между плечами трудно изобразить из-за его небольшого диаметра и высокой гибкости; для этого также требуется очень острый наконечник АСМ (рис. 2).
Изменение цвета раствора на каждом этапе процесса нанесения покрытия AuNP указывает на то, что все работает правильно. Цвет начинается темно-красным только с AuNP, но как только добавляется ДНК, он меняется на темно-пурпурно-красный. Замораживание меняет цвет на фиолетовый и после оттаивания возвращает его к темно-красному (рис. 3А). На рисунке 3B показаны спектры поглощения голых AuNP и покрытых ДНК AuNP.
После этого на этапах сборки DONA цвет остается темно-красным на протяжении всего процесса. Во время очистки агарозного геля над свободной полосой AuNP появляется димерная полоса, самая быстро работающая полоса в образце. Эта димерная полоса соответствует DONA и впоследствии вырезается и сжимается для извлечения образца (рис. 4).
Наконец, для измерений колокализации выполняется АСМ-визуализация образца в поисках DONA (рис. 5). После этого рамановские спектры из отдельных DONA собираются и сравниваются, чтобы убедиться, что полученные спектры получены из молекул TAMRA (рис. 6).

Рисунок 1: Схематическое изображение вилки ДНК оригами и полностью собранной DONA. (A) Размеры вилки ДНК-оригами с мостиком длиной 90 нуклеотидов. (B) Схематический вид сбоку собранного DONA с двумя AuNP и вилкой ДНК-оригами между ними. (C) Схематический вид сверху собранного DONA, показывающий положение размещения SM в середине моста. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
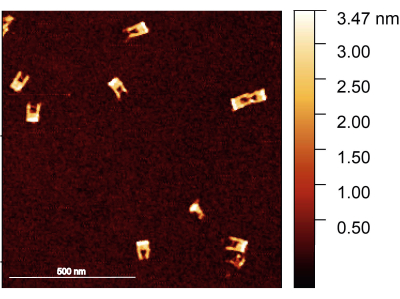
Рисунок 2: АСМ-изображение вилок ДНК оригами после сборки. Вилки хорошо сформированы, при этом в некоторых вилках виден мост. Вилки имеют высоту от 1,5 до 2 нм. Масштабная линейка = 500 нм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
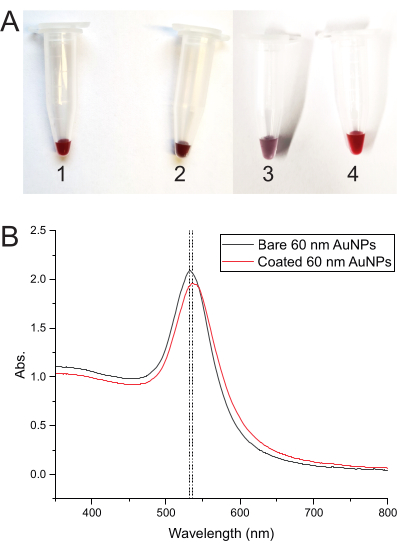
Рисунок 3: Спектры развития цвета и поглощения AuNP. (A) Пробирки, показывающие цвет раствора AuNP на разных этапах. (1) Темно-красный цвет голого раствора AuNP. (2) Темно-пурпурно-красный после добавления ДНК покрытия к AuNPs. (3) Фиолетовый цвет после замораживания смеси ДНК-AuNP покрытия. (4) Цвет возвращается к темно-красному после оттаивания смеси. (B) Спектры поглощения AuNP 60 нм, показывающие сдвиг пика поглощения от голых AuNP (трубка 1) к покрытым ДНК AuNP (трубка 4). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
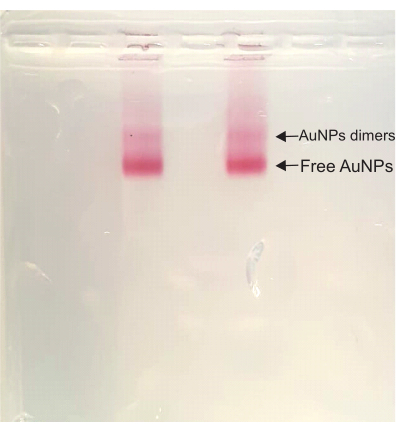
Рисунок 4: Агарозный гель раствора DONA. Обе полосы имеют один и тот же образец, и хорошо видны как димерная полоса (DONA), так и свободная полоса AuNP. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: АСМ-изображение DONA. (A) На изображении показано несколько структур DANNA; это АСМ-изображение используется для измерений колокализации. (B) Увеличенное изображение обведенной DONA и вертикального поперечного сечения DONA. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
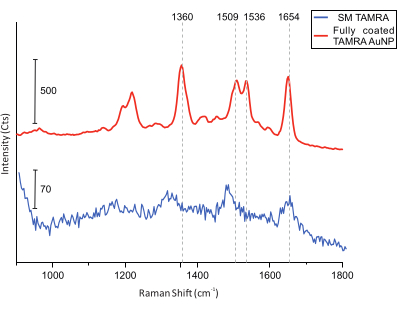
Рисунок 6: SERS спектры DONA, оснащенные полностью покрытыми TAMRA AuNP и одной молекулой TAMRA. Вертикальные линии сетки обозначают основные пики TAMRA. Основные пики TAMRA видны в TAMRA AuNP с полным покрытием. Хотя отношение сигнал/шум для спектров SM TAMRA ниже, основные пики можно идентифицировать: 1,360 см-1: растяжение C-C; 1,509 см-1: растяжение C = C; 1,536 см-1: растяжка C = C; 1,654 см-1: растяжение C = O. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Список скоб вилки ДНК оригами. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 2: Список модифицированных нитей ДНК. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
SM SERS — это мощный инструмент, который позволяет исследователям изучать поведение и взаимодействия отдельных молекул в образце1. Такой метод позволяет анализировать системы на беспрецедентном уровне чувствительности, обеспечивая новое понимание фундаментального поведения отдельных молекул и распределения химических или физических свойств по ансамблю молекул, а также помогает идентифицировать соответствующие промежуточные продукты в химических процессах. Тем не менее, размещение одной молекулы в горячей точке, а также обеспечение того, чтобы горячая точка имела достаточное улучшение поверхности, может быть довольно сложной задачей27. Описанные DONA в этом протоколе могут точно помещать одну молекулу в горячую точку между двумя наночастицами золота, обеспечивая при этом10-11-кратное улучшение поверхности.
Зазор между наночастицами имеет решающее значение для того, чтобы сборка DONA достигла требуемого улучшения поверхности для исследований SM SERS. DONA оптимизированы для сферических наночастиц размером от 60 до 80 нм. Кроме того, качество наночастиц может существенно повлиять на гибридизацию наночастиц с вилками ДНК-оригами; Когда наночастицы, которые используются на стадии нанесения покрытия, старше 6 месяцев, эффективность гибридизации начинает снижаться.
Еще один важный аспект протокола заключается в том, что шаги, требующие точного соотношения между компонентами, должны выполняться точно, иначе DONA не будут сформированы правильно. Вилка ДНК-оригами чрезвычайно чувствительна к протоколу повышения температуры, при этом изменения влияют на целостность структуры или препятствуют образованию вилок.
Генерация аморфного углерода является серьезной проблемой во время измерений SERS, потому что его пики обычно находятся в том же диапазоне, что и область отпечатков пальцев для многих молекул (1,200-1,700 см-1). Хотя образование еще не полностью изучено, оно обычно связано с высокой мощностью лазера или длительным временем интеграции28. В качестве меры предосторожности следует использовать наименьшую мощность лазера и минимально возможное время интеграции. Однако это нелегко сделать, потому что должен быть достигнут баланс между получением желаемого сигнала SERS и предотвращением образования аморфного углерода.
DONA очень универсальны в качестве системы SM в отношении различных типов и форм наночастиц, которые могут быть использованы, таких как серебряные сферы, золотые цветы или звезды. Кроме того, исследуемая молекула может быть легко заменена путем изменения только цепи ДНК в середине моста, без каких-либо изменений в процедуре. Переключение на белки, такие как цитохром С, может быть осуществлено путем наличия модифицированной пиридином цепи захвата ДНК в мостике, которая связывает цитохром С и гарантирует, что он находится в горячей точке для измерений SM SERS22. Это также приводит к гибкому выбору лазера для облучения, потенциально используя лазер, который дает максимальное улучшение.
Таким образом, этот метод надежен для сборки структур DONA и использования их для измерений одномолекулярной поверхностно-усиленной рамановской спектроскопии.
Раскрытие информации
У авторов нет конкурирующих финансовых интересов или других конфликтов интересов.
Благодарности
Исследование было поддержано Европейским исследовательским советом (ERC; консолидатор гранта No 772752).
Материалы
| Name | Company | Catalog Number | Comments |
| 100 kDa MWCO Amicon filters, 0.5 mL | Merck | UFC5100BK | |
| 10x TAE buffer (0.4 M Tris, 0.2 M acetic acid, 0.01 M EDTA) | SIGMA Aldrich | T9650 | |
| 60 nm goldspheres, bare (citrate) | NanoComposix | AUCN60 | |
| ACCESS-NC-A AFM probes | SCHAEFER-TEC | ||
| Agarose powder | SIGMA Aldrich | 9012-36-6 | |
| AuNP DNA coating strands | IDT | ||
| AuNP DNA coating strands (TAMRA) | SIGMA Aldrich | ||
| Glycerol | SIGMA Aldrich | 56-81-5 | |
| Heraeus Fresco 17 centrifuge | Thermo Fisher Scientific | ||
| HORIBA OmegaScope with a LabRAM HR evolution | HORIBA | ||
| Magnesium chloride | SIGMA Aldrich | 7786-30-3 | |
| Nanofork DNA bridge strand (TAMRA) | Metabion | ||
| Nanofork DNA staple strands | SIGMA Aldrich | ||
| ParafilmM | Carl Roth | CNP8.1 | |
| Primus 25 Thermocycler | Peqlab/VWR | ||
| Silicon wafer | Siegert wafer | BW14076 | |
| Single-stranded scaffold DNA, type p7249 (M13mp18) | Tilibit nanosystems | ||
| TCEP solution | SIGMA Aldrich | 51805-45-9 |
Ссылки
- Heck, C., Kanehira, Y., Kneipp, J., Bald, I. Placement of single proteins within the SERS hot spots of self-assembled silver nanolenses. Angewandte Chemie. 57 (25), 7444-7447 (2018).
- Dey, S., et al. DNA origami. Nature Reviews Methods Primers. 1 (1), 13(2021).
- Tasciotti, E. Smart cancer therapy with DNA origami. Nature Biotechnology. 36 (3), 234-235 (2018).
- Ijäs, H., et al. Unraveling the interaction between doxorubicin and DNA origami nanostructures for customizable chemotherapeutic drug release. Nucleic Acids Research. 49 (6), 3048-3062 (2021).
- Wang, S., et al. DNA origami-enabled biosensors. Sensors. 20 (23), 6899(2020).
- Kabusure, K. M., et al. Optical characterization of DNA origami-shaped silver nanoparticles created through biotemplated lithography. Nanoscale. 14 (27), 9648-9654 (2022).
- Kershner, R. J., et al. Placement and orientation of individual DNA shapes on lithographically patterned surfaces. Nature Nanotechnology. 4 (9), 557-561 (2009).
- Dutta, A., et al. Molecular states and spin crossover of hemin studied by DNA origami enabled single-molecule surface-enhanced Raman scattering. Nanoscale. 14 (44), 16467-16478 (2022).
- Langer, J., et al. Present and future of surface-enhanced Raman scattering. ACS Nano. 14 (1), 28-117 (2020).
- Jones, R. R., Hooper, D. C., Zhang, L., Wolverson, D., Valev, V. K. Raman techniques: fundamentals and frontiers. Nanoscale Research Letters. 14 (1), 231(2019).
- Blackie, E. J., Le Ru, E. C., Etchegoin, P. G. Single-molecule surface-enhanced Raman spectroscopy of nonresonant molecules. Journal of the American Chemical Society. 131 (40), 14466-14472 (2009).
- Sepúlveda, B., Angelomé, P. C., Lechuga, L. M., Liz-Marzán, L. M. LSPR-based nanobiosensors. Nano Today. 4 (3), 244-251 (2009).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The optical properties of metal nanoparticles: The influence of size, shape, and dielectric environment. The Journal of Physical Chemistry B. 107 (3), 668-677 (2003).
- Funston, A. M., Novo, C., Davis, T. J., Mulvaney, P. Plasmon coupling of gold nanorods at short distances and in different geometries. Nano Letters. 9 (4), 1651-1658 (2009).
- Niu, R., et al. DNA origami-based nanoprinting for the assembly of plasmonic nanostructures with single-molecule surface-enhanced Raman scattering. Angewandte Chemie. 60 (21), 11695-11701 (2021).
- Fang, W., et al. Quantizing single-molecule surface-enhanced Raman scattering with DNA origami metamolecules. Science Advances. 5 (9), (2019).
- Zhan, P., et al. DNA origami directed assembly of gold bowtie nanoantennas for single-molecule surface-enhanced Raman scattering. Angewandte Chemie. 57 (11), 2846-2850 (2018).
- Choi, H. K., et al. Single-molecule surface-enhanced Raman scattering as a probe of single-molecule surface reactions: promises and current challenges. Accounts of Chemical Research. 52 (11), 3008-3017 (2019).
- Liu, N., Liedl, T. DNA-assembled advanced plasmonic architectures. Chemical Reviews. 118 (6), 3032-3053 (2018).
- Acuna, G. P., et al. Fluorescence enhancement at docking sites of DNA-directed self-assembled nanoantennas. Science. 338 (6106), 506-510 (2012).
- Shen, B., Kostiainen, M. A., Linko, V. DNA origami nanophotonics and plasmonics at interfaces. Langmuir. 34 (49), 14911-14920 (2018).
- Tapio, K., et al. A versatile DNA origami-based plasmonic nanoantenna for label-free single-molecule surface-enhanced Raman spectroscopy. ACS Nano. 15 (4), 7065-7077 (2021).
- Liu, B., Liu, J. Freezing-driven DNA adsorption on gold nanoparticles: tolerating extremely low salt concentration but requiring high DNA concentration. Langmuir. 35 (19), 6476-6482 (2019).
- Aliano, A., et al. AFM, tapping mode. Encyclopedia of Nanotechnology. , 99(2012).
- Recording Raman spectral images and profiles. Horiba Scientific. , Available from: https://www.horiba.com/int/scientific/technologies/raman-imaging-and-spcetroscopy/recording-spectral-images-and=profiles/ (2023).
- Raman Images Explained. Renishaw. , Available from: https://www.renishaw.com/en/raman-images-explained-25810 (2023).
- Kogikoski, S., Tapio, K., von Zander, R. E., Saalfrank, P., Bald, I. Raman enhancement of nanoparticle dimers self-assembled using DNA origami nanotriangles. Molecules. 26 (6), 1684(2021).
- Heck, C., Kanehira, Y., Kneipp, J., Bald, I. Amorphous carbon generation as a photocatalytic reaction on DNA-assembled gold and silver nanostructures. Molecules. 24 (12), 2324(2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены