Method Article
플라즈몬 DNA 종이접기 나노안테나로 구현되는 단일 분자 표면 강화 라만 산란 측정
요약
이 프로토콜은 공국소화 원자력 현미경(AFM) 및 라만 측정과 결합된 DNA 종이접기 나노안테나(DONA)를 사용한 단일 분자 표면 강화 라만 산란(SERS) 측정을 보여줍니다.
초록
표면 강화 라만 산란(SERS)은 높은 자기장 강화가 필요한 단일 분자를 검출할 수 있습니다. 단일 분자(SM) SERS는 개별 분자에 대한 분자별 분광 정보를 제공할 수 있으므로 다른 SM 검출 기술보다 더 자세한 화학 정보를 얻을 수 있습니다. 동시에 벌크 물질의 라만 측정에 숨겨져 있는 SM 측정의 정보를 밝힐 수 있는 가능성이 있습니다. 이 프로토콜은 원자력 현미경(AFM) 및 라만 분광법과 함께 DNA 종이접기 나노안테나(DONA)를 사용한 SM SERS 측정의 개요를 설명합니다. DNA 종이 접기 포크 구조와 두 개의 금 나노 입자가 결합되어 1.2-2.0 nm 간격의 DONA를 형성합니다. 이를 통해 최대 10개의11배 SERS 신호 향상이 가능하여 단일 분자를 측정할 수 있습니다. 이 프로토콜은 SERS 핫스팟에 단일 분석물 분자를 배치하는 방법, AFM 이미징 프로세스, 단일 DONA에서 분석물을 측정하기 위한 라만 이미징의 후속 오버레이를 추가로 보여줍니다.
서문
DNA 종이 접기는 DNA 가닥을 특정 모양과 패턴으로 접는 나노 기술 기술입니다. 나노 스케일에서 정밀하게 제어하여 구조를 만들 수 있는 능력은 DNA 종이접기1의 주요 장점 중 하나입니다. 이렇게 작은 규모로 물질을 조작할 수 있는 능력은 의학, 전자공학, 재료과학을 포함한 광범위한 분야에 혁명을 일으킬 수 있는 잠재력을 가지고 있다2. 예를 들어, DNA 종이접기 구조는 약물을 암세포에 직접 전달하고(3,4), 질병을 검출하기 위한 나노스케일 센서를 생성하고(5,6), 재료(6,7)의 표면에 복잡한 패턴을 생성하는 데 사용되어 왔다. 또한, DNA 종이접기를 사용하여 복잡한 나노스케일 구조를 생성할 수 있는 능력은 나노스케일8에서 기본적인 생물학적 과정을 연구할 수 있는 새로운 기회를 창출했다.
표면 강화 라만 산란(SERS)은 매우 낮은 농도의 분자를 검출하고 식별하는 강력한 분석 기법이다9. 이는 산란광(10)의 파장 변화인 라만 효과(Raman effect)를 기반으로 한다. SERS는 흡착된 분자의 라만 신호를 향상시키기 위해 플라즈몬 금속 기판이 필요합니다. 이러한 향상은 종래의 라만 분광법으로 측정된 동일한 분자로부터 얻어진 신호보다 최대10배까지 11 배 더 클 수 있어, SERS는 미량의 물질을 분석하는 데 매우 민감한 방법이다11.
나노 입자의 라만 신호 향상은 주로 국소 표면 플라즈몬 공명(LSPR)12의 여기를 기반으로 하는 전자기 향상에 기인합니다. 이 현상에서 금속 나노 입자 내의 전자는 광 입사 동안 금속 나노 입자의 표면 주위를 집합 적으로 진동합니다. 그 결과 입사광과 공명할 수 있는 표면 플라즈몬으로 알려진 전자의 정상파가 생성됩니다. LSPR은 입자 표면 근처의 전기장을 크게 향상시키고 입자의 광학 흡수는 플라즈몬 공진 주파수에서 최대입니다. 표면 플라즈몬의 에너지는 금속 나노입자의 형상 및 크기뿐만 아니라 주변 매질(13)의 특성에 따라 달라진다. 플라즈몬 커플링에 의해 더 높은 향상이 달성될 수 있는데, 예를 들어 두 나노입자가 직경 길이의 약 2.5배 이하의 거리에서 서로 가까이 있을 때와 같다(14). 근접성은 두 나노 입자의 LSPR이 서로 상호 작용하게하여 입자 사이의 갭에서 전기장을 몇 배 더 향상시켜 단일 나노 입자15,16,17의 향상을 훨씬 초과합니다. 증강의 크기는 나노입자 사이의 거리에 반비례한다; 거리가 감소함에 따라 단일 분자(SM)18를 감지하기에 충분한 향상이 있는 임계점이 나타납니다.
DNA 종이접기는 플라즈몬 결합을 이용하고 최적화하기 위해 플라즈몬 나노입자를 효율적으로 배열할 수 있는 핵심 기술을 나타낸다(19). 동시에 관심 분자는 광학 검출이 가장 효율적인 위치에 정확하게 배치될 수 있습니다. 이것은 형광 검출을 위한 DNA 종이접기 기반 플라즈몬 나노안테나로 입증되었다20. 형광 라벨의 검출과 달리 SERS는 분자의 직접적인 화학적 지문을 검출할 수 있는 가능성을 제공하므로 단일 분자 SERS는 화학 반응 및 기계론적 연구를 감지하고 모니터링하는 데 매우 매력적입니다. DNA 종이접기는 또한 잘 정의된 형상(21)을 갖는 플라즈몬 나노구조를 제조하기 위한 마스크로서 사용될 수 있지만, 표적 분자를 핫스팟 내로 정확하게 위치시킬 가능성은 상실된다.
공국소화 원자력 현미경(AFM)과 라만 측정을 사용하여 단일 DNA 종이접기 나노안테나(DONA)에서 라만 스펙트럼을 얻을 수 있으며, 신호가 가장 높은 위치에 배치되면 잠재적으로 단일 분자를 얻을 수 있습니다. DONA는 DNA 종이접기 포크와 정밀하게 배치된 두 개의 나노입자로 구성되며, DNA 종이접기에 부착된 확장된 스테이플 가닥에 상보적인 DNA로 완전히 코팅되어 있습니다. DNA 혼성화 시, 나노입자는 나노입자 표면(22) 사이에 1.2-2.0 nm 갭을 갖는 DNA 종이접기 포크에 결합된다. 이러한 조립은 유한 차분 시간 영역(FDTD) 시뮬레이션(22)으로부터 계산된 바와 같이, 최대 1011배의 신호 향상을 갖는 나노입자 사이에 핫 스폿을 생성하여, SM SERS 측정을 허용한다. 그러나 가장 높은 향상의 부피는 작기 때문에(1-10nm3 범위에서) 결과적으로 표적 분자를 이 핫스팟에 정확하게 배치해야 합니다. DNA 종이 접기 포크는 DNA 포크 브릿지와 적절한 결합 화학을 사용하여 두 나노 입자 사이에 단일 분자를 위치 지정할 수 있습니다. 그럼에도 불구하고 라만 스펙트럼에서 이러한 SM을 관찰하는 것은 매우 어려운일입니다 22. 대안적으로, 나노입자는 더 높은 SERS 강도(21)로 단일 DONA 측정을 허용하기 위해 TAMRA 염료와 같은 표적 분자로 완전히 코팅될 수 있다. 이 경우 TAMRA는 DNA 코팅 가닥에 공유 결합됩니다(그림 1).
프로토콜
1. DNA 종이 접기 포크 어셈블리
- 하나의 냄비에 DNA 종이 접기 구조를 자체 조립합니다. 먼저, 15 mMMgCl2 완충액으로 보충된 1x TAE (트리스[히드록시메틸]아미노메탄[트리스], 아세트산, 에틸렌디아민 아세트산[EDTA])에 2.5 nM 원형 스캐폴드 가닥 M13mp18 (7,249 뉴클레오티드, 재료 표 참조) 및 100 nM의 201 짧은 올리고뉴클레오티드 (표 1)를 추가한다. 그런 다음 초순수를 사용하여 총 부피를 100μL로 조정합니다.
- 용액을 열순환기에서 온도 구배에 의해 연속적으로 어닐링하고, 먼저 80°C로 급속히 가열한 다음, 1°C/12분에서 80°C에서 20°C로 냉각한 다음, 1°C/6분에서 20°C에서 16°C로 냉각한 다음, 16°C에서 8°C로 급속히 냉각합니다.
- 100kDa 분자량 차단(MWCO) Amicon 필터( 재료 표 참조)를 사용하여 과도한 스테이플에서 혼합물을 정제합니다.
- DNA 종이접기 용액 100μL와 초순수 400μL를 Amicon 필터에 넣은 다음 실온(RT)에서 6,000x g 에서 8분 동안 원심분리합니다.
- 필터를 제거하고 튜브를 뒤집어 싱크대의 세척액을 제거하여 여과액을 버린 다음 필터에 초순수 400μL를 넣고 다시 원심분리합니다. 이 단계를 한 번 더 반복합니다.
- 정제된 나노구조 용액을 수집하려면 제조업체의 지침에 따라 새 튜브와 원심분리기(1,000 x g, 2분, RT)에서 필터를 거꾸로 뒤집습니다( 재료 표 참조). 이 용액은 8°C의 냉장고에 최대 2주 동안 보관할 수 있습니다.
참고: 물은 안정성을 감소시키고 얻은 DNA 종이접기 포크의 농도를 낮추기 때문에 Amicon 필터 정제 단계를 위해 초순수 대신 1x TAE 완충액 또는 15mM MgCl2 완충액으로 보충된 1x TAE를 사용하십시오. 단일 염료 분자 측정을 위해 DNA 스테이플 가닥 혼합물은 5' 말단에 TAMRA 염료를 포함하는 변형된 가닥 혼합물로 대체됩니다. 이 변형된 가닥은 나노포크 브리지의 중간에 있습니다(표 2).
2. 금 나노 입자 (AuNP) 코팅
참고: Liu et al.23 프로토콜의 수정된 버전이 AuNP를 코팅하는 데 사용되었으며 코팅 공정에는 AuNP-DNA 용액을 동결하는 작업이 포함되었습니다.
- 원심분리(3,500 x g, 5분, RT)를 400 μL의 60 nm 직경 AuNP 용액(상업적으로 입수됨; 표 of Materials를 참조)하고, 피펫을 사용하여, 상청액을 제거하였다. 그런 다음 펠릿을 초순수 25μL에 재용해합니다. AuNPs의 최종 농도는 ~0.3 nM이다.
- 1 μL의 100 mM 트리스-(2-카르복시에틸)포스핀(TCEP) 용액을 4 μL의 티올-변형된 DNA(제조업체에서 제공한 100 μM, 재료 표 참조)에 추가하고 RT에서 10분 동안 배양합니다.
- 인큐베이션 후, 5 μL 혼합물을 농축 AuNP 용액 (단계 2.1)에 첨가하고, 5 초 동안 와동시키고, -20 °C에서 적어도 2 시간 동안 동결시킨다.
- 상기 혼합물을 RT에서 해동한 후, 상기 혼합물을 원심분리(3,500 x g, 5분, RT)하여 과량 첨가된 코팅 DNA를 제거하였다. 피펫을 사용하여 상청액을 제거하고 펠릿을 물 10μL에 재용해시킵니다.
참고: 나노포크의 각 AuNP에는 두 개의 코팅 가닥이 있습니다(표 2). 상기 단계들은 DNA 코팅 가닥의 서열을 제외하고는 동일하다. 입자가 코팅되면 매우 안정적입니다. 냉장고에 몇 달 동안 그대로 보관할 수 있으며 냉동할 수도 있습니다. 완전히 코팅된 염료 AuNP의 경우, 코팅 DNA 가닥에는 내부 TAMRA 염료가 있습니다.
3. 도나 어셈블리
- 코팅된 AuNP 용액을 나노포크 용액에 1.5:1의 농도 몰비로 첨가합니다.
- 50 mM MgCl2 원액을 사용하여MgCl2를 4 mM의 최종 농도로 첨가한다. 초순수를 사용하여 최종 부피를 20μL로 조정합니다.
- 열순환기에서 온도 구배를 사용하여 DONA를 혼성화합니다. 먼저 40°C로 급속히 가열한 다음 1°C/10분에 40°C에서 20°C로 냉각한 다음 20°C에서 8°C로 급속 냉각합니다.
4. 겔 전기영동
참고: DONA 용액의 결합되지 않은 나노입자는 아가로스 겔 전기영동에 의해 제거됩니다.
- 1 % 아가로스 겔을 준비하십시오. 이를 위해, 0.8 g의 아가로스를 5 mMMgCl2로 보충된 80 mL의 1x TAE에 용해시킨다.
- 2.25 μL의 로딩 완충액(30% 글리세롤, 13 mM MgCl2; 재료 표 참조)을 18 μL의 DONA 용액에 첨가하여 3.2 단계에서 4 mM에서 5 mM MgCl2의 최종 농도에 도달합니다. 로딩 버퍼는 또한 샘플이 젤 포켓 안에 머물도록 합니다.
- 얼음물 수조에서 60V에서 70분 동안 젤을 실행합니다. 러닝 버퍼는 5 mMMgCl2로 보충된 1x TAE이다.
- 관심 밴드를 잘라내어 파라핀 플라스틱 필름으로 감싼 현미경 슬라이드에 놓은 다음 두 번째 파라핀 플라스틱 필름으로 감싼 현미경 슬라이드를 사용하여 용액을 짜냅니다. 피펫을 사용하여 압착된 액체를 500μL 튜브에 수집합니다.
5. AFM 및 라만 측정의 Colocalization
- 실리콘 칩(재료 표 참조)을 10분 동안 플라즈마 처리한 다음, 정제된 DONA 용액 10μL와 100mM MgCl2 10μL를 칩 상에서 3시간 동안 배양합니다. 그런 다음 에탄올과 물의 1:1 혼합물(부피 기준)로 칩을 두 번 세척하고 압축 공기로 블로우 건조합니다. 그런 다음 칩을 자기 디스크에 테이프로 붙이고 이미징을 위해 기기에 삽입합니다.
알림: 측정을 시작하기 전에 라만 여기 레이저의 위치가 AFM 프로브 팁 위에 오도록 조정됩니다. 본 연구에서는 HORIBA Omegascope AFM에 결합된 HORIBA LabRAM HR Evolution 라만 현미경을 사용합니다. 기기는 소프트웨어 LabSpec 및 AIST를 사용하여 제어됩니다. - AFM 측정의 경우 ACCESS-NC-A(공진 주파수: 300kHz, 스프링 상수: 45N/m) 팁24와 함께 태핑 모드(AC 모드)를 사용하십시오. AC 모드는 1Hz로 설정된 스캔 속도를 제외한 모든 매개변수를 자동으로 제어합니다.
참고: AFM 이미징 후 AFM 팁이 라만 레이저의 경로에 있지 않도록 빼냅니다. 이것은 시스템에 프로그래밍된 매크로 기능인 "Probe away"를 사용하여 수행됩니다. 이러한 방식으로 AFM 이미지에서 선택한 지점에 대해 레이저는 AFM과 비교하여 오프셋 없이 동일한 위치에 있게 됩니다. - 라만 측정을 위해 원하는 레이저 파장, 출력 및 축적 시간을 선택하십시오., 이러한 모든 매개변수는 측정된 샘플에 따라 달라지므로 말입니다.
- 완전히 코팅된 TAMRA AuNP 측정을 위해 언급된 파라미터(633nm 레이저, 100μW 전력 및 1초 통합 시간)를 사용합니다.
- 단일 TAMRA 측정에 언급된 파라미터(633nm 레이저, 400μW 출력 및 4초 통합 시간)를 사용합니다.
- 매개변수를 조정한 후 AFM 이미지에서 원하는 DONA 위에 커서를 놓습니다. 소프트웨어의 "커서 이동" 기능이 이 작업을 수행합니다. 그런 다음 라만 측정을 시작합니다.
참고: 스펙트럼을 획득하기 위한 다양한 모드가 있습니다: 단일 지점 측정-1차원 시간 매핑-단일 지점이 시간에 걸쳐 측정되는경우 25; 및 2차원 XY 영역 맵핑(2-dimensional XY area mapping)을 포함하는데, 여기서 전동화된 스테이지는 레이저 아래로 이동되어 XY 그리드(26)의 점들의 배열로부터 스펙트럼을 획득한다.
결과
프로토콜에 따라 DNA 종이 접기 포크가 올바르게 조립되었는지 확인해야 합니다. 포크의 구조를 검사하는 데 선호되는 방법은 AFM 이미징입니다. 대부분의 포크는 팔이 부러지지 않고 견고해야 합니다. 반면에 팔 사이의 다리는 직경이 작고 유연성이 높기 때문에 이미지화하기 어렵습니다. 또한 매우 날카로운 AFM 팁이 필요합니다(그림 2).
AuNP 코팅 공정의 각 단계에서 용액 색상 변화는 모든 것이 올바르게 작동함을 나타냅니다. 색상은 AuNP만으로 짙은 빨간색으로 시작하지만 DNA가 추가되자마자 짙은 자줏빛을 띤 빨간색으로 바뀝니다. 냉동하면 색상이 보라색으로 바뀌고 해동 후 짙은 빨간색으로 돌아갑니다(그림 3A). 도 3B 는 베어 AuNP 및 DNA-코팅된 AuNP의 흡광도 스펙트럼을 나타낸다.
그 후, DONA 조립 단계에서 색상은 전체 공정에서 짙은 빨간색으로 유지됩니다. 아가로스 겔 정제 동안, 샘플에서 가장 빠르게 실행되는 밴드인 유리 AuNP 밴드 위에 이량체 밴드가 나타납니다. 이 이량체 밴드는 DONA에 해당하며 이후에 잘라내고 압착하여 샘플을 추출합니다(그림 4).
마지막으로, colocalization 측정을 위해 DONA를 찾기 위해 샘플의 AFM 이미징이 수행됩니다(그림 5). 그런 다음 단일 DONA의 라만 스펙트럼을 수집하고 비교하여 얻은 스펙트럼이 TAMRA 분자에서 나온 것인지 확인합니다(그림 6).

그림 1: DNA 종이접기 포크와 완전히 조립된 DONA의 개략도. (A) 다리 길이가 90 뉴클레오티드인 DNA 종이접기 포크의 치수. (B) 두 개의 AuNP와 DNA 종이접기 포크가 사이에 있는 조립된 DONA의 개략적인 측면도. (C) 교량 중앙에 SM의 배치 위치를 보여주는 조립된 DONA의 개략도 평면도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
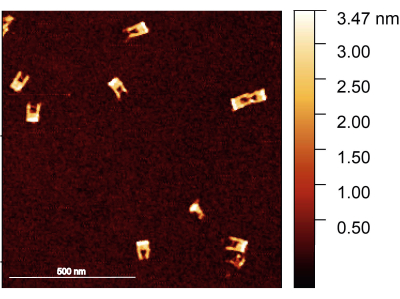
그림 2: 조립 후 DNA 종이접기 포크의 AFM 이미지. 포크는 잘 형성되어 있으며 일부 포크에서 다리가 보입니다. 포크의 높이는 1.5-2nm입니다. 스케일 바 = 500 nm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
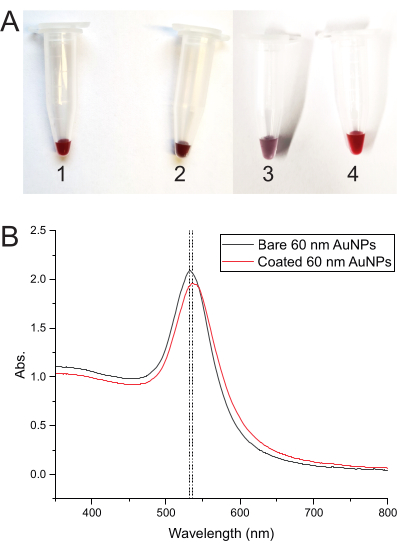
그림 3: AuNPs의 발색 및 흡광도 스펙트럼 . (A) AuNP 용액의 색상을 여러 단계로 보여주는 튜브. (1) 노출된 AuNP 용액의 짙은 붉은색. (2) AuNPs에 코팅 DNA를 첨가한 후 짙은 자줏빛을 띤 적색. (3) DNA-AuNP 혼합물을 동결 코팅한 후 보라색을 띤다. (4) 혼합물이 해동된 후 색이 짙은 빨간색으로 돌아갑니다. (B) 노출된 AuNP(튜브 1)에서 DNA 코팅된 AuNP(튜브 4)로의 흡광도 피크 이동을 보여주는 60nm AuNP의 흡광도 스펙트럼. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
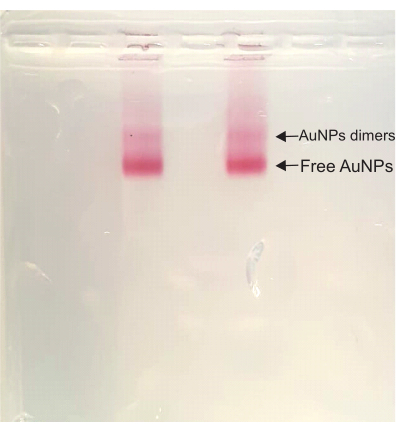
그림 4: DONA 용액의 아가로스 겔. 두 레인 모두 동일한 샘플을 가지며 이량체 밴드(DONA)와 자유 AuNP 밴드가 모두 명확하게 보입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: DONA의 AFM 이미지. (A) 이미지는 여러 DONA 구조를 보여줍니다. 이 AFM 이미지는 colocalization 측정에 사용됩니다. (B) 원으로 표시된 DONA의 확대 이미지와 DONA의 수직 단면. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
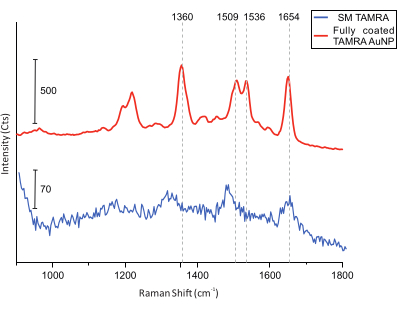
그림 6: 완전히 코팅된 TAMRA AuNP와 단일 TAMRA 분자가 장착된 DONA의 SERS 스펙트럼. 수직 눈금선은 주요 TAMRA 피크를 나타냅니다. 주요 TAMRA 피크는 완전히 코팅된 TAMRA AuNP에서 볼 수 있습니다. SM TAMRA 스펙트럼에 대한 신호 대 잡음비는 더 낮지만, 주요 피크는 식별 가능하다: 1,360 cm-1: C-C 스트레칭; 1,509 cm-1: C=C 스트레칭; 1,536 cm-1: C=C 스트레칭; 1,654 cm-1: C=O 스트레칭. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: DNA 종이접기 포크 스테이플 목록. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: 변형된 DNA 가닥 목록. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
SM SERS는 연구자들이 시료1 내에서 개별 분자의 거동과 상호작용을 연구할 수 있는 강력한 도구이다. 이러한 기술을 사용하면 전례 없는 수준의 감도로 시스템을 분석할 수 있으며, 단일 분자의 기본 거동과 분자 앙상블에 대한 화학적 또는 물리적 특성의 분포에 대한 새로운 통찰력을 제공하고 화학 공정에서 관련 중간체를 식별하는 데 도움이 됩니다. 그러나 핫 스폿에 단일 분자를 배치하는 동시에 핫 스폿의 표면 강화가 충분한지 확인하는 것은 상당히 어려울 수 있습니다27. 이 프로토콜에 설명 된 DONA는 두 개의 금 나노 입자 사이의 핫스팟에 단일 분자를 정확하게 배치하면서 1011 배 표면 향상에 도달 할 수 있습니다.
나노 입자 사이의 간격은 DONA 어셈블리가 SM SERS 연구에 필요한 표면 향상에 도달하는 데 중요합니다. DONA는 60nm에서 80nm 사이의 구형 나노 입자에 최적화되어 있습니다. 또한, 나노 입자의 품질은 나노 입자와 DNA 종이 접기 포크의 혼성화에 상당한 영향을 미칠 수 있습니다. 코팅 단계에서 사용되는 나노 입자가 6 개월 이상 오래되면 혼성화 효율이 감소하기 시작합니다.
프로토콜의 또 다른 중요한 측면은 구성 요소 간의 정확한 비율이 필요한 단계를 정확하게 따라야 하며 그렇지 않으면 DONA가 올바르게 형성되지 않는다는 것입니다. DNA 종이접기 포크는 온도 상승 프로토콜에 매우 민감하며, 변화가 구조의 무결성에 영향을 미치거나 포크가 형성되는 것을 방지합니다.
비정질 탄소 생성은 피크가 일반적으로 많은 분자의 지문 영역(1,200-1,700cm-1)과 동일한 범위에 있기 때문에 SERS 측정 중에 중요한 문제입니다. 형성은 아직 완전히 이해되지 않았지만, 일반적으로 높은 레이저 출력 또는 긴 통합 시간28과 관련이 있습니다. 예방 조치로 가장 낮은 레이저 출력과 가능한 가장 짧은 통합 시간을 사용해야 합니다. 그러나 원하는 SERS 신호를 얻는 것과 비정질 탄소의 생성을 피하는 것 사이에서 균형을 이루어야하기 때문에 쉽게 달성 할 수 없습니다.
DONA는 은색 구체, 금색 꽃 또는 별과 같이 사용할 수 있는 다양한 유형과 모양의 나노 입자와 관련하여 SM 시스템으로서 매우 다재다능합니다. 또한 조사 중인 분자는 절차를 변경하지 않고 다리 중간에 있는 DNA 가닥만 변경하여 쉽게 대체할 수 있습니다. 시토크롬 C와 같은 단백질로의 전환은 다리에 피리딘 변형 DNA 포획 가닥을 가짐으로써 수행 될 수 있으며, 이는 시토크롬 C에 결합하고 SM SERS 측정22의 핫스팟에 있는지 확인합니다. 이것은 또한 방사선 조사를 위해 레이저를 유연하게 선택하는 것으로 해석되며, 잠재적으로 최대한의 향상을 제공하는 레이저를 사용합니다.
요약하면, 이 방법은 DONA 구조를 조립하고 단일 분자 표면 강화 라만 분광법 측정에 사용하는 데 신뢰할 수 있습니다.
공개
저자는 경쟁적인 재정적 이해 관계나 기타 이해 상충이 없습니다.
감사의 말
이 연구는 유럽 연구위원회 (ERC, 통합 보조금 번호 772752)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 100 kDa MWCO Amicon filters, 0.5 mL | Merck | UFC5100BK | |
| 10x TAE buffer (0.4 M Tris, 0.2 M acetic acid, 0.01 M EDTA) | SIGMA Aldrich | T9650 | |
| 60 nm goldspheres, bare (citrate) | NanoComposix | AUCN60 | |
| ACCESS-NC-A AFM probes | SCHAEFER-TEC | ||
| Agarose powder | SIGMA Aldrich | 9012-36-6 | |
| AuNP DNA coating strands | IDT | ||
| AuNP DNA coating strands (TAMRA) | SIGMA Aldrich | ||
| Glycerol | SIGMA Aldrich | 56-81-5 | |
| Heraeus Fresco 17 centrifuge | Thermo Fisher Scientific | ||
| HORIBA OmegaScope with a LabRAM HR evolution | HORIBA | ||
| Magnesium chloride | SIGMA Aldrich | 7786-30-3 | |
| Nanofork DNA bridge strand (TAMRA) | Metabion | ||
| Nanofork DNA staple strands | SIGMA Aldrich | ||
| ParafilmM | Carl Roth | CNP8.1 | |
| Primus 25 Thermocycler | Peqlab/VWR | ||
| Silicon wafer | Siegert wafer | BW14076 | |
| Single-stranded scaffold DNA, type p7249 (M13mp18) | Tilibit nanosystems | ||
| TCEP solution | SIGMA Aldrich | 51805-45-9 |
참고문헌
- Heck, C., Kanehira, Y., Kneipp, J., Bald, I. Placement of single proteins within the SERS hot spots of self-assembled silver nanolenses. Angewandte Chemie. 57 (25), 7444-7447 (2018).
- Dey, S., et al. DNA origami. Nature Reviews Methods Primers. 1 (1), 13(2021).
- Tasciotti, E. Smart cancer therapy with DNA origami. Nature Biotechnology. 36 (3), 234-235 (2018).
- Ijäs, H., et al. Unraveling the interaction between doxorubicin and DNA origami nanostructures for customizable chemotherapeutic drug release. Nucleic Acids Research. 49 (6), 3048-3062 (2021).
- Wang, S., et al. DNA origami-enabled biosensors. Sensors. 20 (23), 6899(2020).
- Kabusure, K. M., et al. Optical characterization of DNA origami-shaped silver nanoparticles created through biotemplated lithography. Nanoscale. 14 (27), 9648-9654 (2022).
- Kershner, R. J., et al. Placement and orientation of individual DNA shapes on lithographically patterned surfaces. Nature Nanotechnology. 4 (9), 557-561 (2009).
- Dutta, A., et al. Molecular states and spin crossover of hemin studied by DNA origami enabled single-molecule surface-enhanced Raman scattering. Nanoscale. 14 (44), 16467-16478 (2022).
- Langer, J., et al. Present and future of surface-enhanced Raman scattering. ACS Nano. 14 (1), 28-117 (2020).
- Jones, R. R., Hooper, D. C., Zhang, L., Wolverson, D., Valev, V. K. Raman techniques: fundamentals and frontiers. Nanoscale Research Letters. 14 (1), 231(2019).
- Blackie, E. J., Le Ru, E. C., Etchegoin, P. G. Single-molecule surface-enhanced Raman spectroscopy of nonresonant molecules. Journal of the American Chemical Society. 131 (40), 14466-14472 (2009).
- Sepúlveda, B., Angelomé, P. C., Lechuga, L. M., Liz-Marzán, L. M. LSPR-based nanobiosensors. Nano Today. 4 (3), 244-251 (2009).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The optical properties of metal nanoparticles: The influence of size, shape, and dielectric environment. The Journal of Physical Chemistry B. 107 (3), 668-677 (2003).
- Funston, A. M., Novo, C., Davis, T. J., Mulvaney, P. Plasmon coupling of gold nanorods at short distances and in different geometries. Nano Letters. 9 (4), 1651-1658 (2009).
- Niu, R., et al. DNA origami-based nanoprinting for the assembly of plasmonic nanostructures with single-molecule surface-enhanced Raman scattering. Angewandte Chemie. 60 (21), 11695-11701 (2021).
- Fang, W., et al. Quantizing single-molecule surface-enhanced Raman scattering with DNA origami metamolecules. Science Advances. 5 (9), (2019).
- Zhan, P., et al. DNA origami directed assembly of gold bowtie nanoantennas for single-molecule surface-enhanced Raman scattering. Angewandte Chemie. 57 (11), 2846-2850 (2018).
- Choi, H. K., et al. Single-molecule surface-enhanced Raman scattering as a probe of single-molecule surface reactions: promises and current challenges. Accounts of Chemical Research. 52 (11), 3008-3017 (2019).
- Liu, N., Liedl, T. DNA-assembled advanced plasmonic architectures. Chemical Reviews. 118 (6), 3032-3053 (2018).
- Acuna, G. P., et al. Fluorescence enhancement at docking sites of DNA-directed self-assembled nanoantennas. Science. 338 (6106), 506-510 (2012).
- Shen, B., Kostiainen, M. A., Linko, V. DNA origami nanophotonics and plasmonics at interfaces. Langmuir. 34 (49), 14911-14920 (2018).
- Tapio, K., et al. A versatile DNA origami-based plasmonic nanoantenna for label-free single-molecule surface-enhanced Raman spectroscopy. ACS Nano. 15 (4), 7065-7077 (2021).
- Liu, B., Liu, J. Freezing-driven DNA adsorption on gold nanoparticles: tolerating extremely low salt concentration but requiring high DNA concentration. Langmuir. 35 (19), 6476-6482 (2019).
- Aliano, A., et al. AFM, tapping mode. Encyclopedia of Nanotechnology. , 99(2012).
- Recording Raman spectral images and profiles. Horiba Scientific. , Available from: https://www.horiba.com/int/scientific/technologies/raman-imaging-and-spcetroscopy/recording-spectral-images-and=profiles/ (2023).
- Raman Images Explained. Renishaw. , Available from: https://www.renishaw.com/en/raman-images-explained-25810 (2023).
- Kogikoski, S., Tapio, K., von Zander, R. E., Saalfrank, P., Bald, I. Raman enhancement of nanoparticle dimers self-assembled using DNA origami nanotriangles. Molecules. 26 (6), 1684(2021).
- Heck, C., Kanehira, Y., Kneipp, J., Bald, I. Amorphous carbon generation as a photocatalytic reaction on DNA-assembled gold and silver nanostructures. Molecules. 24 (12), 2324(2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유