Method Article
Plazmonik DNA Origami Nanoantenleri Tarafından Sağlanan Tek Moleküllü Yüzey Geliştirilmiş Raman Saçılma Ölçümleri
Bu Makalede
Özet
Bu protokol, kolokalize atomik kuvvet mikroskobu (AFM) ve Raman ölçümleri ile birleştirilmiş bir DNA origami nanoanteni (DONA) kullanarak tek moleküllü yüzey geliştirilmiş Raman saçılımı (SERS) ölçümlerini göstermektedir.
Özet
Yüzeyle geliştirilmiş Raman saçılması (SERS), yüksek alan geliştirmesinin gerekli olduğu tek molekülleri tespit etme yeteneğine sahiptir. Tek moleküllü (SM) SER, bireysel moleküller hakkında moleküle özgü spektroskopik bilgi sağlayabilir ve bu nedenle diğer SM tespit tekniklerinden daha ayrıntılı kimyasal bilgi verir. Aynı zamanda, dökme malzemenin Raman ölçümlerinde gizli kalan SM ölçümlerinden elde edilen bilgileri çözme potansiyeli vardır. Bu protokol, atomik kuvvet mikroskobu (AFM) ve Raman spektroskopisi ile birlikte bir DNA origami nanoanteni (DONA) kullanarak SM SERS ölçümlerini özetlemektedir. Bir DNA origami çatal yapısı ve iki altın nanopartikül, aralarında 1.2-2.0 nm'lik bir boşluk bulunan DONA'ları oluşturmak için birleştirilir. Bu, 10 adede kadar11 kat SERS sinyal iyileştirmesine izin vererek tek moleküllerin ölçülmesini sağlar. Protokol ayrıca, tek bir analit molekülünün bir SERS sıcak noktasına yerleştirilmesini, AFM görüntüleme işlemini ve ardından tek bir DONA'daki bir analiti ölçmek için Raman görüntülemenin üst üste binmesini göstermektedir.
Giriş
DNA origami, DNA iplikçiklerini belirli şekillere ve desenlere katlamayı içeren bir nanoteknoloji tekniğidir. Nano ölçekte hassas kontrole sahip yapılar oluşturma yeteneği, DNA origami1'in en önemli avantajlarından biridir. Maddeyi bu kadar küçük bir ölçekte manipüle etme yeteneği, tıp, elektronik ve malzeme bilimi2 dahil olmak üzere çok çeşitli alanlarda devrim yaratma potansiyeline sahiptir. Örneğin, DNA origami yapıları, ilaçları doğrudan kanser hücrelerine iletmek için kullanılmıştır3,4, hastalıkları tespit etmek için nano ölçekli sensörler oluşturmak 5,6 ve malzemelerin yüzeylerinde karmaşık desenler oluşturmak 6,7. Ayrıca, karmaşık nano ölçekli yapılar oluşturmak için DNA origami kullanma yeteneği,nano ölçekte 8'de temel biyolojik süreçleri incelemek için yeni fırsatlar yaratmıştır.
Yüzey geliştirilmiş Raman saçılması (SERS), molekülleri son derece düşük konsantrasyonlarda tespit eden ve tanımlayan sağlam bir analitik tekniktir9. Dağınık ışığın dalga boyundaki bir değişiklik olan Raman etkisine dayanır10. SERS, üzerine adsorbe edilen moleküllerin Raman sinyalini arttırmak için bir plazmonik metal substrat gerektirir. Bu geliştirme, geleneksel Raman spektroskopisi ile ölçülen aynı molekülden elde edilen sinyalden 1011 kat daha büyük olabilir, bu da SRERS'i eser miktarda maddeyi analiz etmek için oldukça hassas bir yöntem haline getirir11.
Nanopartiküllerin Raman sinyali arttırılması, çoğunlukla lokalize yüzey plazmon rezonansının (LSPR) uyarılmasına dayanan elektromanyetik geliştirmeden kaynaklanmaktadır12. Bu fenomende, metal nanopartikül içindeki elektronlar, ışık insidansı sırasında metal nanopartikülün yüzeyi etrafında toplu olarak salınır. Bu, gelen ışıkla rezonansa girebilen bir yüzey plazmonu olarak bilinen durağan bir elektron dalgasının yaratılmasıyla sonuçlanır. LSPR, parçacığın yüzeyine yakın elektrik alanını büyük ölçüde arttırır ve parçacığın optik emilimi, plazmon rezonans frekansında maksimumdur. Yüzey plazmonunun enerjisi, metal nanopartikülün şekline ve boyutuna ve ayrıca çevredeki ortamın özelliklerine bağlıdır13. Daha yüksek bir gelişme, iki nanopartikülün çap uzunluğunun yaklaşık 2.5 katı veya14'ten daha az bir mesafede birbirine yakın olması gibi plazmonik kaplinlerle daha da elde edilebilir. Yakınlık, her iki nanopartikülün LSPR'sinin birbirleriyle etkileşime girmesine neden olur ve parçacıklar arasındaki boşluktaki elektrik alanını, tek bir nanopartikül15,16,17'nin geliştirilmesini çok aşan birkaç büyüklük sırasına göre arttırır. Geliştirmenin büyüklüğü, nanopartiküller arasındaki mesafe ile ters orantılıdır; mesafe azaldıkça, geliştirmenin tek molekülleri (SM'ler) tespit etmek için yeterli olduğu kritik bir nokta ortaya çıkar18.
DNA origami, plazmonik kuplajdan yararlanmak ve optimize etmek için plazmonik nanopartikülleri verimli bir şekilde düzenleyebilen anahtar bir teknolojiyi temsil eder19. Aynı zamanda, ilgilenilen moleküller optik algılamanın en verimli olduğu yere tam olarak yerleştirilebilir. Bu, floresan tespiti için DNA origami bazlı plazmonik nanoantenlerle gösterilmiştir20. Floresan etiketlerin algılanmasının aksine, SERS bir molekülün doğrudan kimyasal parmak izini tespit etme imkanı sunarak, tek moleküllü SERS'i kimyasal reaksiyonları ve mekanik çalışmaları izlemenin yanı sıra algılama için çok çekici hale getirir. DNA origami, iyi tanımlanmış şekillere sahip plazmonik nanoyapıları üretmek için bir maske olarak da kullanılabilir21, ancak hedef molekülleri tam olarak sıcak noktaya yerleştirme olasılığı daha sonra kaybolur.
Kolokalize atomik kuvvet mikroskobu (AFM) ve Raman ölçümlerini kullanarak, Raman spektrumlarını tek bir DNA origami nanoanteninden (DONA) ve en yüksek sinyal geliştirme konumuna yerleştirilirse potansiyel olarak tek bir molekülden elde edebiliriz. DONA, bir DNA origami çatalı ve DNA origamiye bağlı genişletilmiş temel iplikçiklere tamamlayıcı DNA ile tamamen kaplanmış, hassas bir şekilde yerleştirilmiş iki nanopartikülden oluşur. DNA hibridizasyonu üzerine, nanopartiküller, nanopartikül yüzeyleri22 arasında 1.2-2.0 nm'lik bir boşluk ile DNA origami çatalına bağlanır. Bu tür bir montaj, sonlu fark zaman alanı (FDTD) simülasyonları22'den hesaplandığı gibi, 1011 kata kadar sinyal artışı ile nanopartiküller arasında bir sıcak nokta oluşturur ve böylece SM SERS ölçümlerine izin verir. Bununla birlikte, en yüksek geliştirmenin hacmi küçüktür (1-10 nm3 aralığında) ve sonuç olarak hedef moleküllerin tam olarak bu sıcak noktaya yerleştirilmesi gerekir. DNA origami çatalı, bir DNA çatal köprüsü ve uygun bağlantı kimyası kullanarak iki nanopartikül arasında tek bir molekülün konumlandırılmasına izin verir. Bununla birlikte, bu tür SM'leri Raman spektrumlarında gözlemlemek çok zordur22. Alternatif olarak, nanopartiküller, daha yüksek bir SERS yoğunluğu21 ile tek DONA ölçümlerine izin vermek için bir TAMRA boyası gibi hedef molekülle tamamen kaplanabilir. Bu durumda, TAMRA kovalent olarak DNA kaplama ipliğine bağlanır (Şekil 1).
Protokol
1. DNA origami çatal montajı
- DNA origami yapısını tek bir kapta kendi kendine birleştirin. İlk olarak, 15 mM MgCl 2 tamponu ile desteklenmiş 1x TAE'de (tris [hidroksimetil] aminometan [tris], asetik asit, etilendiamin asetik asit [EDTA]) içine2.5 nM dairesel iskele ipliği M13mp18 (7.249 nükleotit, bakınız Malzeme Tablosuna bakınız) ve 100 nM 201 kısa oligonükleotid (Tablo 1) ekleyin. Ardından, ultra saf su kullanarak toplam ses seviyesini 100 μL'ye ayarlayın.
- Çözeltiyi daha sonra bir termosikletçideki bir sıcaklık gradyanı ile tavlayın, önce hızlı bir şekilde 80 ° C'ye ısıtın, daha sonra 1 ° C / 12 dakikada 80 ° C'den 20 ° C'ye soğutularak, daha sonra 1 ° C / 6 dakikada 20 ° C'den 16 ° C'ye soğutun, ardından 16 ° C'den 8 ° C'ye hızla soğutun.
- Karışımı fazla zımbalardan arındırmak için 100 kDa moleküler ağırlık kesme (MWCO) Amicon filtreleri kullanın ( Malzeme Tablosuna bakınız).
- Amicon filtrelerine 100 μL DNA origami çözeltisinin yanı sıra 400 μL ultra saf su ekleyin, ardından oda sıcaklığında (RT) 8 dakika boyunca 6.000 x g'de santrifüj yapın.
- Filtreyi çıkararak ve lavabodaki yıkamayı gidermek için tüpü çevirerek filtreyi atın, ardından filtreye 400 μL ultra saf su ekleyin ve tekrar santrifüj yapın. Bu adımı bir kez daha yineleyin.
- Saflaştırılmış nanoyapı çözeltisini toplamak için, üreticinin talimatlarını izleyerek filtreyi yeni bir tüp ve santrifüjde (1.000 x g, 2 dakika, RT) baş aşağı çevirin (bkz. Bu çözelti buzdolabında 8 ° C'de 2 haftaya kadar saklanabilir.
NOT: Amicon filtre arıtma adımı için ultra saf su yerine 1x TAE tamponu veya 15 mM MgCl2 tamponu ile desteklenmiş 1x TAE kullanın, çünkü su stabiliteyi azaltır ve elde edilen DNA origami çatallarının konsantrasyonunu düşürür. Tek bir boya molekülü ölçümü için, DNA elyaf ipliği karışımı, 5' ucunda bir TAMRA boyası içeren modifiye edilmiş bir iplik karışımı ile değiştirilir. Bu modifiye iplikçik, nanofork köprüsünün ortasındadır (Tablo 2).
2. Altın nanopartikül (AuNP) kaplama
NOT: AuNP'leri kaplamak için Liu ve ark.23 protokolünün değiştirilmiş bir versiyonu kullanıldı ve kaplama işlemi AuNP-DNA çözeltisinin dondurulmasını içeriyordu.
- Santrifüj (3.500 x g, 5 dak, RT) 400 μL 60 nm çapında AuNP çözeltisi (ticari olarak elde edilir; bkz. Ardından, peleti 25 μL ultra saf suda çözündürün. AuNP'lerin son konsantrasyonu ~ 0.3 nM'dir.
- 4 μL tiol modifiye DNA'ya (üretici tarafından sağlanan 100 μM; Malzeme Tablosuna bakınız) 1 μL 100 mM tris (2-karboksiyetil) fosfin (TCEP) çözeltisi ekleyin ve RT'de 10 dakika boyunca inkübe edin.
- İnkübasyondan sonra, 5 μL karışımını konsantre AuNP çözeltisine (adım 2.1), 5 s vortekse ekleyin ve -20 ° C'de en az 2 saat dondurun.
- RT'de çözüldükten sonra, aşırı eklenen kaplama DNA'sını çıkarmak için karışımı santrifüj (3.500 x g, 5 dakika, RT) santrifüjleyin. Bir pipet kullanarak, süpernatanı çıkarın ve peleti 10 μL su içinde çözünürleştirin.
NOT: Nanofork üzerindeki AuNP'lerin her biri için iki kaplama ipliği vardır (Tablo 2). Adımlar, DNA kaplama ipliğinin dizisi dışında aynıdır. Parçacıklar kaplandıktan sonra, çok kararlıdırlar; buzdolabında aylarca olduğu gibi kalabilir ve hatta dondurulabilirler. Tamamen kaplanmış boya AuNP'ler için, kaplama DNA iplikçikleri dahili bir TAMRA boyasına sahiptir.
3. DONA meclisi
- Kaplanmış AuNP çözeltisini, 1.5: 1 konsantrasyon molar oranına sahip nanofork çözeltisine ekleyin.
- 50 mM MgCl 2 stok çözeltisi kullanarak 4 mM'lik son konsantrasyona MgCl2 ekleyin. Son ses seviyesini ultra saf su kullanarak 20 μL'ye ayarlayın.
- DONA'ları bir termosiklusta bir sıcaklık gradyanı kullanarak hibritleştirin. İlk olarak, hızlı bir şekilde 40 ° C'ye ısıtın, daha sonra 1 ° C / 10 dakikada 40 ° C'den 20 ° C'ye soğutun ve ardından 20 ° C'den 8 ° C'ye hızla soğutun.
4. Jel elektroforezi
NOT: DONA çözeltisindeki bağlanmamış nanopartiküller agaroz jel elektroforezi ile uzaklaştırılır.
- % 1 agaroz jeli hazırlayın. Bunun için, 5 mMMgCl 2 ile desteklenmiş 80 mL 1x TAE içinde 0.8 g agarozu çözün.
- Adım 3.2'de 4 mM'den 5 mM MgCl 2'lik nihai konsantrasyona ulaşmak için 18 μL DONA çözeltisine 2,25 μL yükleme tamponu (% 30 gliserol, 13 mM MgCl2; bkz. Yükleme tamponu ayrıca numunenin jelin cebinde kalmasını sağlar.
- Jeli buzlu su banyosunda 70 V'ta 60 dakika boyunca çalıştırın. Çalışan tampon, 5 mM MgCl 2 ile desteklenmiş 1x TAE'dir.
- İlgilendiğiniz bandı kesin ve parafin plastik film sarılı mikroskopi slaydına yerleştirin ve ardından ikinci bir parafin plastik film sarılı mikroskopi slaydı kullanarak çözeltiyi sıkın. Bir pipet kullanarak, sıkılmış sıvıyı 500 μL'lik bir tüpe toplayın.
5. AFM ve Raman ölçümlerinin kolokalizasyonu
- Plazma, bir silikon çipi (Malzeme Tablosuna bakınız) 10 dakika boyunca işlemden geçirir, daha sonra 10 μL saflaştırılmış DONA çözeltisini artı 10 μL 100 mM MgCl2'yi çip üzerinde 3 saat boyunca inkübe eder. Ardından, çipi iki kez 1:1 etanol ve su karışımı (hacme göre) ile yıkayın ve basınçlı hava ile fön ile kurutun. Ardından, çipi manyetik bir diske bantlayın ve görüntüleme için cihaza yerleştirin.
NOT: Ölçümlere başlamadan önce, Raman uyarma lazerinin konumu AFM prob ucunun üstünde olacak şekilde ayarlanır. Bu çalışmada bir HORIBA LabRAM HR Evolution Raman mikroskobu ile HORIBA Omegaskop AFM birleştirilmiştir. Cihaz, LabSpec ve AST yazılımı kullanılarak kontrol edilir. - AFM ölçümü için, ACCESS-NC-A (rezonans frekansı: 300 kHz; yay sabiti: 45 N/m) uçları24 ile kılavuz çekme modunu (AC modu) kullanın. AC modu, 1 Hz'e ayarlanan tarama hızı dışındaki tüm parametreleri otomatik olarak kontrol eder.
NOT: AFM görüntülemeyi takiben, AFM ucu Raman lazerin yolunda olmayacak şekilde çekilir. Bu, sistemde programlanmış bir makro işlevi olan "Prob uzakta" kullanılarak yapılır. Bu şekilde, AFM görüntüsünde seçilen herhangi bir nokta için, lazer AFM'ye kıyasla ofset olmadan aynı konumda olacaktır. - Raman ölçümleri için istenen lazer dalga boyunu, gücünü ve birikim süresini seçin, çünkü tüm bu parametreler ölçülen numuneye bağlıdır.
- Tam kaplamalı bir TAMRA AuNP ölçümü için belirtilen parametreleri kullanın: 633 nm lazer, 100 μW güç ve 1 s entegrasyon süresi.
- Tek bir TAMRA ölçümü için belirtilen parametreleri kullanın: 633 nm lazer, 400 μW güç ve 4 s entegrasyon süresi.
- Parametreleri ayarladıktan sonra, imleci AFM görüntüsünde istenen DONA'nın üzerine getirin; Yazılımdaki "imleci hareket ettir" işlevi bunu yapar. Ardından, Raman ölçümünü başlatın.
NOT: Spektrumları elde etmek için farklı modlar vardır: tek nokta ölçümü-tek boyutlu zaman haritalaması-burada tek bir noktanın zaman içinde ölçüldüğü25; ve bir XY ızgarası26'daki bir dizi noktadan spektrum elde etmek için motorlu bir aşamanın lazer altında hareket ettirildiği iki boyutlu XY alan haritalaması.
Sonuçlar
Protokolü takiben, DNA origami çatalının doğru şekilde monte edildiğinden emin olunmalıdır; çatalların yapısını incelemek için tercih edilen yöntem AFM görüntülemedir. Çoğu çatalın sağlam olması ve kollarının kırılmaması beklenir. Öte yandan, kollar arasındaki köprünün küçük çapı ve yüksek esnekliği nedeniyle görüntülenmesi zordur; aynı zamanda çok keskin bir AFM ucu gerektirir (Şekil 2).
AuNP kaplama işleminin her adımındaki çözelti rengi değişimi, her şeyin doğru çalıştığını gösterir. Renk sadece AuNP'lerle koyu kırmızı başlar, ancak DNA eklenir eklenmez koyu morumsu kırmızıya dönüşür. Donma rengi mora çevirir ve çözüldükten sonra koyu kırmızıya döndürür (Şekil 3A). Şekil 3B , çıplak AuNP'lerin ve DNA kaplı AuNP'lerin absorbans spektrumlarını göstermektedir.
Bundan sonra, DONA montaj adımlarında, renk tüm süreç boyunca koyu kırmızı kalır. Agaroz jel saflaştırması sırasında, numunedeki en hızlı çalışan bant olan serbest AuNP bandının üzerinde bir dimer bant belirir. Bu dimer bant DONA'lara karşılık gelir ve daha sonra numuneyi çıkarmak için kesilir ve sıkılır (Şekil 4).
Son olarak, kolokalizasyon ölçümleri için, DONA'ların aranması için numunenin AFM görüntülemesi yapılır (Şekil 5). Bunu takiben, tek DONA'lardan Raman spektrumları toplanır ve elde edilen spektrumların TAMRA moleküllerinden olduğundan emin olmak için karşılaştırılır (Şekil 6).

Resim 1: DNA origami çatalının ve tamamen monte edilmiş DONA'nın şematik gösterimi. (A) 90 nükleotid uzunluğunda bir köprü ile DNA origami çatalının boyutları. (B) İki AuNP ve aralarında DNA origami çatalı bulunan monte edilmiş bir DONA'nın şematik yan görünümü. (C) Köprünün ortasındaki SM'nin yerleştirme konumunu gösteren monte edilmiş DONA'nın şematik üstten görünümü. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
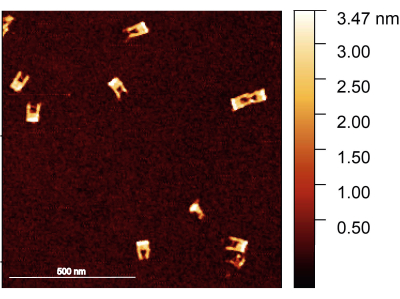
Resim 2: Montajdan sonra DNA origami çatallarının AFM görüntüsü. Çatallar iyi biçimlendirilmiştir, köprü bazı çatallarda görülebilir. Çatallar 1.5-2 nm arasında bir yüksekliğe sahiptir. Ölçek çubuğu = 500 nm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
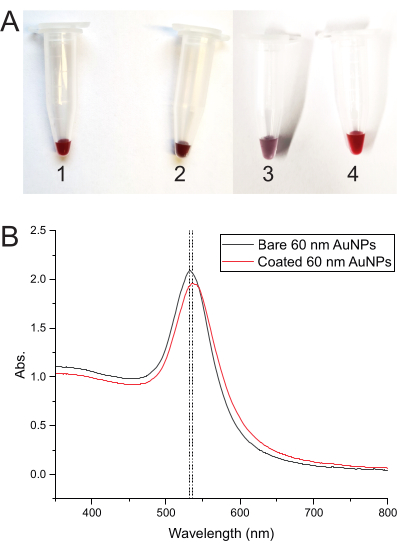
Şekil 3: AuNP'lerin renk gelişimi ve absorbans spektrumları . (A) AuNP çözeltisinin rengini farklı adımlarda gösteren tüpler. (1) Çıplak AuNP çözeltisinin koyu kırmızı rengi. (2) Kaplama DNA'sının AuNP'lere eklenmesinden sonra koyu-morumsu kırmızı. (3) Kaplama DNA-AuNP karışımı dondurulduktan sonra mor renk. (4) Karışım çözüldükten sonra renk koyu kırmızıya döner. (B) 60 nm AuNP'lerin absorbans spektrumları, absorbans zirvesindeki çıplak AuNP'lerden (tüp 1) DNA kaplı AuNP'lere (tüp 4) kaymayı gösterir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
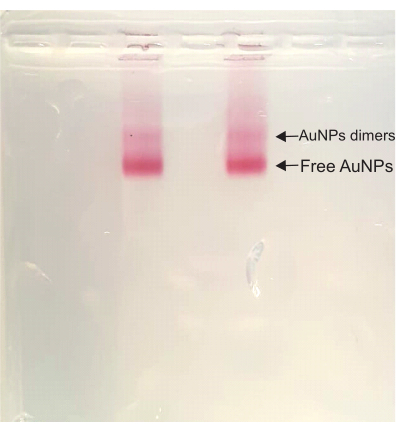
Şekil 4: DONA çözeltisinin agaroz jeli. Her iki şerit de aynı örneğe sahiptir ve hem dimer bant (DONA) hem de serbest AuNP bandı açıkça görülebilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 5: DONA'ların AFM görüntüsü. (A) Resimde birden fazla DONA yapısı gösterilmektedir; Bu AFM görüntüsü kolokalizasyon ölçümleri için kullanılır. (B) Dairesel DONA'nın yakınlaştırılmış görüntüsü ve DONA'nın dikey kesiti. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
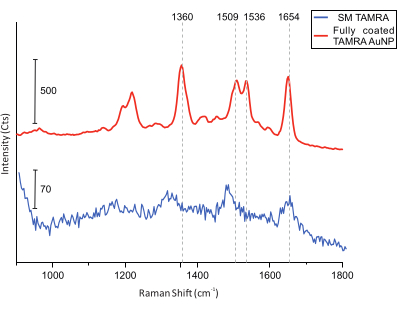
Şekil 6: Tam kaplamalı TAMRA AuNP'ler ve tek bir TAMRA molekülü ile donatılmış DONA'ların SERS spektrumları. Dikey kılavuz çizgileri ana TAMRA zirvelerini gösterir. Ana TAMRA zirveleri, tamamen kaplanmış TAMRA AuNP'de görülebilir. SM TAMRA spektrumları için sinyal-gürültü oranı daha düşük olmasına rağmen, ana pikler tanımlanabilir: 1.360 cm-1: C-C germe; 1.509 cm-1: C=C germe; 1.536 cm-1: C=C germe; 1.654 cm-1: C=O germe. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tablo 1: DNA origami çatal zımbalarının listesi. Bu Tabloyu indirmek için lütfen tıklayınız.
Tablo 2: Modifiye DNA iplikçiklerinin listesi. Bu Tabloyu indirmek için lütfen tıklayınız.
Tartışmalar
SM SERS, araştırmacıların bir örnek1 içindeki bireysel moleküllerin davranışlarını ve etkileşimlerini incelemelerini sağlayan güçlü bir araçtır. Böyle bir teknik, sistemlerin benzeri görülmemiş bir hassasiyet seviyesinde analiz edilmesine izin verir, tek moleküllerin temel davranışlarına ve kimyasal veya fiziksel özelliklerin bir molekül topluluğu üzerindeki dağılımına yeni bakış açıları sağlar ve kimyasal işlemlerde ilgili ara ürünlerin tanımlanmasına yardımcı olur. Bununla birlikte, sıcak noktaya tek bir molekül yerleştirirken, aynı zamanda sıcak noktanın yeterli yüzey iyileştirmesine sahip olduğundan emin olmak oldukça zor olabilir27. Bu protokolde açıklanan DONA'lar, 10adet 11 kat yüzey iyileştirmesine ulaşılmasını sağlarken, iki altın nanopartikül arasındaki sıcak noktaya tek bir molekülü hassas bir şekilde yerleştirebilir.
Nanopartiküller arasındaki boşluk, DONA düzeneğinin SM SERS çalışmaları için gerekli yüzey iyileştirmesine ulaşması için kritik öneme sahiptir. DONA'lar, 60 ila 80 nm arasındaki boyutlara sahip küresel nanopartiküller için optimize edilmiştir. Ayrıca, nanopartiküllerin kalitesi, nanopartiküllerin DNA origami çatalları ile hibridizasyonunu önemli ölçüde etkileyebilir; Kaplama adımında kullanılan nanopartiküller 6 aydan daha eski olduğunda, hibridizasyonun verimliliği düşmeye başlar.
Protokolün bir diğer kritik yönü, bileşenler arasında kesin bir oran gerektiren adımların tam olarak izlenmesi gerektiğidir, aksi takdirde DONA'lar doğru şekilde oluşturulmaz. DNA origami çatalı, yapının bütünlüğünü etkileyen veya çatalların oluşmasını önleyen değişikliklerle sıcaklık artırma protokolüne karşı son derece hassastır.
Amorf karbon üretimi, SERS ölçümleri sırasında önemli bir konudur, çünkü zirveleri tipik olarak birçok molekül için parmak izi alanıyla aynı aralıktadır (1.200-1.700 cm-1). Oluşum henüz tam olarak anlaşılmamış olsa da, genellikle yüksek lazer gücü veya uzun entegrasyon süreleriile ilişkilidir 28. Önlem olarak, mümkün olan en düşük lazer gücü ve mümkün olan en kısa entegrasyon süresi kullanılmalıdır. Bununla birlikte, bu kolayca başarılamaz, çünkü istenen SERS sinyalini elde etmek ve amorf karbon oluşumunu önlemek arasında bir denge sağlanmalıdır.
DONA'lar, gümüş küreler, altın çiçekler veya yıldızlar gibi kullanılabilecek farklı nanopartikül türleri ve şekilleri ile ilgili bir SM sistemi olarak çok yönlüdür. Ek olarak, incelenen molekül, prosedürde herhangi bir değişiklik yapılmadan, sadece köprünün ortasındaki DNA ipliğini değiştirerek kolayca değiştirilebilir. Sitokrom C gibi proteinlere geçiş, köprüde piridin modifiye edilmiş bir DNA yakalama ipliğine sahip olarak yapılabilir, bu da sitokrom C'yi bağlayacak ve SM SERS ölçümleri için sıcak noktada olmasını sağlayacaktır22. Bu aynı zamanda lazeri ışınlama için esnek bir şekilde seçmek, potansiyel olarak maksimum iyileştirme sağlayan bir lazer kullanmak anlamına gelir.
Özetle, bu yöntem DONA yapılarını monte etmek ve bunları tek moleküllü yüzey geliştirilmiş Raman spektroskopisi ölçümleri için kullanmak için güvenilirdir.
Açıklamalar
Yazarların birbiriyle çelişen finansal çıkarları veya diğer çıkar çatışmaları yoktur.
Teşekkürler
Bu araştırma Avrupa Araştırma Konseyi (ERC; consolidator Grant No. 772752) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 100 kDa MWCO Amicon filters, 0.5 mL | Merck | UFC5100BK | |
| 10x TAE buffer (0.4 M Tris, 0.2 M acetic acid, 0.01 M EDTA) | SIGMA Aldrich | T9650 | |
| 60 nm goldspheres, bare (citrate) | NanoComposix | AUCN60 | |
| ACCESS-NC-A AFM probes | SCHAEFER-TEC | ||
| Agarose powder | SIGMA Aldrich | 9012-36-6 | |
| AuNP DNA coating strands | IDT | ||
| AuNP DNA coating strands (TAMRA) | SIGMA Aldrich | ||
| Glycerol | SIGMA Aldrich | 56-81-5 | |
| Heraeus Fresco 17 centrifuge | Thermo Fisher Scientific | ||
| HORIBA OmegaScope with a LabRAM HR evolution | HORIBA | ||
| Magnesium chloride | SIGMA Aldrich | 7786-30-3 | |
| Nanofork DNA bridge strand (TAMRA) | Metabion | ||
| Nanofork DNA staple strands | SIGMA Aldrich | ||
| ParafilmM | Carl Roth | CNP8.1 | |
| Primus 25 Thermocycler | Peqlab/VWR | ||
| Silicon wafer | Siegert wafer | BW14076 | |
| Single-stranded scaffold DNA, type p7249 (M13mp18) | Tilibit nanosystems | ||
| TCEP solution | SIGMA Aldrich | 51805-45-9 |
Referanslar
- Heck, C., Kanehira, Y., Kneipp, J., Bald, I. Placement of single proteins within the SERS hot spots of self-assembled silver nanolenses. Angewandte Chemie. 57 (25), 7444-7447 (2018).
- Dey, S., et al. DNA origami. Nature Reviews Methods Primers. 1 (1), 13(2021).
- Tasciotti, E. Smart cancer therapy with DNA origami. Nature Biotechnology. 36 (3), 234-235 (2018).
- Ijäs, H., et al. Unraveling the interaction between doxorubicin and DNA origami nanostructures for customizable chemotherapeutic drug release. Nucleic Acids Research. 49 (6), 3048-3062 (2021).
- Wang, S., et al. DNA origami-enabled biosensors. Sensors. 20 (23), 6899(2020).
- Kabusure, K. M., et al. Optical characterization of DNA origami-shaped silver nanoparticles created through biotemplated lithography. Nanoscale. 14 (27), 9648-9654 (2022).
- Kershner, R. J., et al. Placement and orientation of individual DNA shapes on lithographically patterned surfaces. Nature Nanotechnology. 4 (9), 557-561 (2009).
- Dutta, A., et al. Molecular states and spin crossover of hemin studied by DNA origami enabled single-molecule surface-enhanced Raman scattering. Nanoscale. 14 (44), 16467-16478 (2022).
- Langer, J., et al. Present and future of surface-enhanced Raman scattering. ACS Nano. 14 (1), 28-117 (2020).
- Jones, R. R., Hooper, D. C., Zhang, L., Wolverson, D., Valev, V. K. Raman techniques: fundamentals and frontiers. Nanoscale Research Letters. 14 (1), 231(2019).
- Blackie, E. J., Le Ru, E. C., Etchegoin, P. G. Single-molecule surface-enhanced Raman spectroscopy of nonresonant molecules. Journal of the American Chemical Society. 131 (40), 14466-14472 (2009).
- Sepúlveda, B., Angelomé, P. C., Lechuga, L. M., Liz-Marzán, L. M. LSPR-based nanobiosensors. Nano Today. 4 (3), 244-251 (2009).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The optical properties of metal nanoparticles: The influence of size, shape, and dielectric environment. The Journal of Physical Chemistry B. 107 (3), 668-677 (2003).
- Funston, A. M., Novo, C., Davis, T. J., Mulvaney, P. Plasmon coupling of gold nanorods at short distances and in different geometries. Nano Letters. 9 (4), 1651-1658 (2009).
- Niu, R., et al. DNA origami-based nanoprinting for the assembly of plasmonic nanostructures with single-molecule surface-enhanced Raman scattering. Angewandte Chemie. 60 (21), 11695-11701 (2021).
- Fang, W., et al. Quantizing single-molecule surface-enhanced Raman scattering with DNA origami metamolecules. Science Advances. 5 (9), (2019).
- Zhan, P., et al. DNA origami directed assembly of gold bowtie nanoantennas for single-molecule surface-enhanced Raman scattering. Angewandte Chemie. 57 (11), 2846-2850 (2018).
- Choi, H. K., et al. Single-molecule surface-enhanced Raman scattering as a probe of single-molecule surface reactions: promises and current challenges. Accounts of Chemical Research. 52 (11), 3008-3017 (2019).
- Liu, N., Liedl, T. DNA-assembled advanced plasmonic architectures. Chemical Reviews. 118 (6), 3032-3053 (2018).
- Acuna, G. P., et al. Fluorescence enhancement at docking sites of DNA-directed self-assembled nanoantennas. Science. 338 (6106), 506-510 (2012).
- Shen, B., Kostiainen, M. A., Linko, V. DNA origami nanophotonics and plasmonics at interfaces. Langmuir. 34 (49), 14911-14920 (2018).
- Tapio, K., et al. A versatile DNA origami-based plasmonic nanoantenna for label-free single-molecule surface-enhanced Raman spectroscopy. ACS Nano. 15 (4), 7065-7077 (2021).
- Liu, B., Liu, J. Freezing-driven DNA adsorption on gold nanoparticles: tolerating extremely low salt concentration but requiring high DNA concentration. Langmuir. 35 (19), 6476-6482 (2019).
- Aliano, A., et al. AFM, tapping mode. Encyclopedia of Nanotechnology. , 99(2012).
- Recording Raman spectral images and profiles. Horiba Scientific. , Available from: https://www.horiba.com/int/scientific/technologies/raman-imaging-and-spcetroscopy/recording-spectral-images-and=profiles/ (2023).
- Raman Images Explained. Renishaw. , Available from: https://www.renishaw.com/en/raman-images-explained-25810 (2023).
- Kogikoski, S., Tapio, K., von Zander, R. E., Saalfrank, P., Bald, I. Raman enhancement of nanoparticle dimers self-assembled using DNA origami nanotriangles. Molecules. 26 (6), 1684(2021).
- Heck, C., Kanehira, Y., Kneipp, J., Bald, I. Amorphous carbon generation as a photocatalytic reaction on DNA-assembled gold and silver nanostructures. Molecules. 24 (12), 2324(2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır