A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الفحص المجهري للتمدد فوق الهيكلي في ثلاث مراحل من دورة حياة المثقبية الكروزية في المختبر
* These authors contributed equally
In This Article
Summary
تظهر هذه الدراسة بروتوكولا مفصلا لإجراء الفحص المجهري لتمدد البنية الفوقية في ثلاث مراحل في دورة حياة المثقبية الكروزية ، العامل الممرض المسؤول عن مرض شاغاس. نقوم بتضمين التقنية المحسنة لبروتينات الهيكل الخلوي ووضع العلامات على البروتينات.
Abstract
نصف هنا تطبيق الفحص المجهري لتمدد البنية الفوقية (U-ExM) في المثقبية الكروزية ، وهي تقنية تسمح بزيادة الدقة المكانية للخلية أو الأنسجة للتصوير المجهري. يتم تنفيذ ذلك عن طريق توسيع العينة فعليا بمواد كيميائية جاهزة ومعدات مختبرية شائعة.
مرض شاغاس هو مصدر قلق واسع النطاق وملح للصحة العامة يسببه المثقبية الكروزية. ينتشر المرض في أمريكا اللاتينية وأصبح مشكلة كبيرة في المناطق غير الموبوءة بسبب زيادة الهجرة. يحدث انتقال T. cruzi من خلال ناقلات الحشرات الدموية التي تنتمي إلى عائلات Reduviidae و Hemiptera. بعد الإصابة ، تتكاثر T. cruzi amastigotes داخل مضيف الثدييات وتتمايز إلى المثقبيات ، وهي شكل مجرى الدم غير التكاثري. في ناقل الحشرات ، تتحول المثقبيات إلى epimastigotes وتتكاثر من خلال الانشطار الثنائي. يتطلب التمايز بين مراحل دورة الحياة إعادة ترتيب واسعة النطاق للهيكل الخلوي ويمكن إعادة إنشائه في المختبر بالكامل باستخدام تقنيات زراعة الخلايا المختلفة.
نصف هنا بروتوكولا مفصلا لتطبيق U-ExM في ثلاث مراحل من دورة حياة المثقبية الكروزية في المختبر ، مع التركيز على تحسين التوطين المناعي لبروتينات الهيكل الخلوي. قمنا أيضا بتحسين استخدام إستر N-Hydroxysuccinimide (NHS) ، وهو ملصق عموم بروتين مكننا من تمييز الهياكل الطفيلية المختلفة.
Introduction
تم وصف الفحص المجهري التوسعي (ExM) لأول مرة في عام 2015 بواسطة Boyden et al.1. إنه بروتوكول تصوير يمكن للمجهر التقليدي من خلاله تحقيق دقة مكانية أقل من حد الحيود. يتم الحصول على هذه الدقة الأعلى بسبب التوسيع المادي للعينة. لتحقيق ذلك ، يتم ربط الجزيئات المصنفة بالفلورسنت مع هيدروجيل ، والذي يتم توسيعه لاحقا بشكل متناحي مع الماء. نتيجة لهذا التوسع ، يتم فصل الإشارات بشكل متناحي تقريبا في جميع الأبعاد الثلاثة. تستخدم هذه الطريقة مواد كيميائية منخفضة التكلفة وتتيح دقة مكانية تبلغ حوالي 65 نانومتر باستخدام المجاهر التقليدية (الكونفوكالية) ، وهو ما يقارب أربع مرات أفضل من الدقة القياسية للمجهر متحد البؤر (حوالي 250 نانومتر)1.
كان المعلم التالي ، الذي مكن من استخدام الفحص المجهري التوسعي في العديد من المجالات البيولوجية ، هو تكييف وضع العلامات المناعية مع الأجسام المضادة التقليدية2. تكيف آخر من بروتوكول ExM المنشور في البداية هو التحليل المكبر للبروتين (MAP)3. أدخلت هذه الطريقة استخدام تركيزات عالية من مادة الأكريلاميد وبارافورمالدهايد قبل غمر الهيدروجيل في العينة لمنع التشابك داخل البروتين وبين البروتينات ، مما أدى إلى الحفاظ بشكل أفضل على محتوى البروتين في العينات والهندسة الخلوية تحت الخلوية. تم تحسين هذا البروتوكول البديل للحصول على حفظ معزز للبنية التحتية الكلية للعضيات المعزولة من خلال استخدام تركيزات أقل من العوامل المثبتة (الفورمالديهايد / بارافورمالدهايد والأكريلاميد). أطلق على هذا النهج اسم الفحص المجهري لتوسيع البنية الفوقية (U-ExM)4.
للحصول على مزيد من الدقة ، تم الإبلاغ أيضا عن الجمع بين ExM وتقنيات الفحص المجهري فائق الاستبانة ، بما في ذلك الفحص المجهري المستنفد للانبعاثات المحفز أو الفحص المجهري لتحديد الموقع أحادي الجزيء ، من أجل الوصول إلى استبانات أقل من 20 نانومتر5.
تم الإبلاغ عن استخدام ExM على نطاق واسع في مجالات علم الأعصاب وأبحاث الهيكل الخلوي6 ، ولكن تم إجراء عدد قليل فقط من الدراسات على الطلائعيات الطفيلية. كان مختبرنا أول من أبلغ عن تطبيق U-ExM في T. cruzi7. يعتمد بروتوكول الأساس بشكل أساسي على تقارير U-ExM السابقة في Toxoplasma gondii و Plasmodium ssp. و Trypanosoma brucei8،9،10،11.
واحدة من أعظم مزايا ExM هي طبيعتها المعيارية ، والتي تتيح مرونة كبيرة للتكيف مع العينات البيولوجية المختلفة. يمكن تقسيم البروتوكول إلى خطوات (مثل التثبيت أو منع التشابك أو التبلور) يمكن للمستخدم تعديلها بسهولة لتلبية متطلباته التجريبية. بالإضافة إلى ذلك ، يمكن تعديل خط الأنابيب هذا لتعزيز التوافق مع الكائن الحي النموذجي أو لتحقيق دقة محددة. نتيجة لذلك ، توفر ExM إمكانات هائلة لكل من الأنظمة البصرية المتقدمة وغير المتقدمة ، مما يضمن تطبيقات أوسع في المستقبل.
مرض شاغاس ، المعروف أيضا باسم داء المثقبيات الأمريكي ، هو مرض مستوطن في أمريكا اللاتينية يسببه المثقبية الكروزية ، وهو طفيلي أولي. دورة حياة الطفيلي معقدة وتتضمن مرحلتين تنمويتين في الثدييات ومرحلتين في مضيف الحشرات (أعضاء عائلة Triatominidae) ، وهو الناقل البيولوجي لهذا المرض. ينتمي مرض شاغاس إلى مجموعة أمراض المناطق المدارية المهملة التي أدرجتها منظمة الصحة العالمية ويمثل مشكلة اقتصادية واجتماعية كبيرة في أمريكا اللاتينية. تقدر الدراسات الوبائية أن 8 ملايين شخص حول العالم يعيشون مع مرض شاغاس وأكثر من 10,000 حالة وفاة سنويا. تجسد هذه الأرقام أهمية مرض شاغاس كقضية صحية عامة في جميع أنحاء العالم. لقد تغير التوزيع الجغرافي لمرض شاغاس في العقود الأخيرة، حيث يقيم العديد من الأفراد المصابين الآن في مناطق حضرية كبيرة على مستوى العالم بسبب زيادة الهجرات، على عكس المناطق الريفية في المقام الأول في أمريكا اللاتينية حيث تم العثور عليهفي الأصل 12.
تختلف مراحل نمو T. cruzi طوال دورة حياتها ، والتي يمكن تكرارها بالكامل في المختبر. Epimastigotes هي أشكال تكاثرية في ناقل الحشرات ، ولها نواة كروية في المنطقة الوسطى من جسم الخلية وبلاست حركي على شكل شريط (هيكل يحتوي على الحمض النووي للميتوكوندريا فريد من نوعه للبلاستيد الحركي) في المنطقة الأمامية بالنسبة للنواة ، مع سوط حر. Trypomastigotes هي الشكل المعدي غير التكاثري ، ولها نواة ممدودة ، وبلاست حركي خلفي مستدير ، وسوط متصل بغشاء البلازما على طول الطفيل بالكامل. Amastigotes هي الشكل التكاثري داخل الخلايا. لديهم نواة في المنطقة الوسطى ، وبلاست حركي على شكل قضيب في الجزء الأمامي من جسم الخلية ، وسوط مخفض. إن قدرة الطفيلي على التكيف مع البيئات المختلفة هي انعكاس لهذه الاختلافات المورفولوجية. ومن الجدير بالذكر أيضا أن دورة الحياة هذه تنطوي على انقسام متماثل ومراحل نمو انتقاليةمختلفة 13. أثناء التمايز ، يلعب الهيكل الخلوي للمثقبيات دورا حاسما. يتكون هذا الهيكل من مشد من الأنابيب الدقيقة تحت الجريمية مرتبة في مجموعة مرتبة من الأنابيب الدقيقة المستقرة أسفل غشاء البلازما. أيضا ، يوجد قضيب شبه سوطي في هذه الكائنات الحية ، وهو هيكل يشبه الشبكة يعمل بالتوازي ومتصل بمحور السوط14. يتضمن التنظيم الدقيق للهيكل الخلوي والتغيرات الهيكلية النووية على طول مراحل دورة الخلية آليات فريدة لتنظيم الجينات الخاصة بالمثقبيات ، مما يجعلها نماذج مثيرة للاهتمام لدراسات بيولوجيا الخلية.
نظرا لصغر حجم T. cruzi والطفيليات الأولية الأخرى ، تقدم U-ExM أداة ممتازة لتحليل السمات الهيكلية لهذه مسببات الأمراض المهمة. كما ذكرنا سابقا ، تم التحقق من صحة تطبيق هذه التقنية على T. cruzi لأول مرة من قبل الدكتور ألونسو7. يوضح هذا التقرير بالتفصيل بروتوكول U-ExM الكامل ، مع التركيز على تحديد الموقع المناعي لبروتينات الهيكل الخلوي خلال مراحل دورة الحياة المختلفة ل T. cruzi. أيضا ، قمنا بتحسين استخدام إستر N-Hydroxysuccinimide (NHS) ، وهو ملصق عموم بروتيوم يمكننا من تمييز الهياكل الطفيلية المختلفة. بالإضافة إلى ذلك ، يتم وصف منهجية في المختبر للحصول على المراحل الثلاث للطفيلي.
Protocol
ملاحظة: يوضح الشكل 1 التصميم التجريبي الكامل.
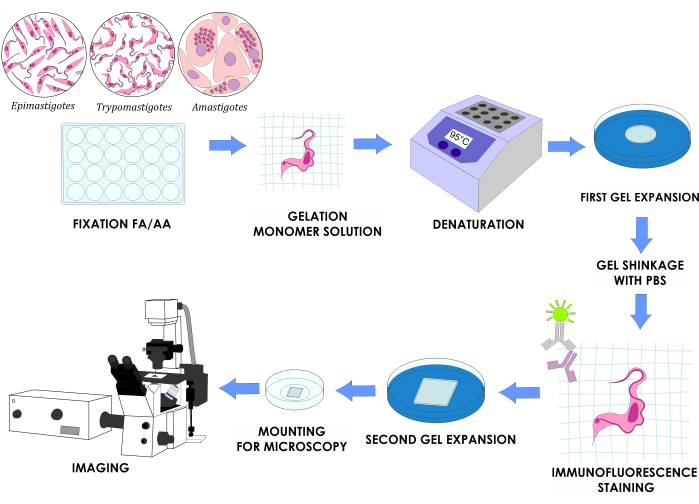
الشكل 1: سير عمل U-ExM لثلاث مراحل دورة حياة في المختبر من T. cruzi. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
1. تحضير أغطية المغلفة بولي دي ليسين
- ضع طبقة مانعة للتسرب مقاس 10 سم × 10 سم مربعة في طبق بتري. اغسل الأغطية عن طريق استحمامها بالإيثانول المطلق في طبق بتري زجاجي مقاس 35 مم.
- قم بإزالة الغطاء بالملاقط من حمام الإيثانول واستنزاف السائل الزائد بالمناديل الورقية. ضع الغطاء فوق فيلم الختم.
- امتصاص باقي الإيثانول بورق من الدرجة المجهرية. أضف محلول 0.1٪ v / v من poly-D-lysine في وسط الغطاء وانشره بالطرف لتغطية ما يقرب من 80٪ من سطحه. أغلق طبق بتري واحتضنه لمدة ساعة واحدة عند 37 درجة مئوية.
ملاحظة: بالنسبة للغطاء 22 مم2 ، استخدم 200 ميكرولتر من محلول بولي دي ليسين ؛ بالنسبة للأغطية المستديرة مقاس 12 مم ، استخدم 100 ميكرولتر من محلول بولي دي ليسين. - اغسل الأغطية بالماء فائق النقاء ثلاث مرات. استخدم الشفط مع مكنسة كهربائية لإزالة الماء بين كل غسلة. يحفظ في درجة حرارة 4 درجات مئوية لمدة تصل إلى أسبوع واحد.
2. تحضير الحل
- تحضير محاليل مخزون من 38٪ (وزن / وزن) أكريلات الصوديوم (SA).
- أضف ببطء 19 جم من SA إلى 31 مل من الماء الخالي من النوكلياز أثناء التحريك.
ملاحظة: هذا الحل لزج جدا. انتبه عند سحب العينات. - بمجرد إذابة SA تماما ، قم بتخزينه في وعاء معقم. احتفظ بها عند 4 درجات مئوية وقم بتغييرها كل 6 أشهر.
ملاحظة: تظهر SA أحيانا علامات التلوث ببولي أكريلات الصوديوم اعتمادا على العلامة التجارية ، وهو ما يمكن ملاحظته عند تحضير محلول المرق حيث يتحول إلى اللون الأصفر والغائم. استخدمه بحذر إذا كان هذا هو الحال.
- أضف ببطء 19 جم من SA إلى 31 مل من الماء الخالي من النوكلياز أثناء التحريك.
- قم بإعداد محلول مخزون بنسبة 40٪ (وزن / حجم) من مادة الأكريلاميد (AA) ومحلول مخزون بنسبة 2٪ (وزن / حجم) N ، N'-methylene bisacrylamide (BIS). قم بإذابة كل مركب في ماء فائق النقاء وقم بالتصفية باستخدام مرشح حقنة معقم 0.22 ميكرومتر. يحفظ في وعاء معقم عند 4 درجات مئوية.
تنبيه: AA و BIS من المواد شديدة السمية. اعمل تحت غطاء الدخان واستخدم عناصر الحماية المناسبة (القفازات والملابس الواقية والقناع ونظارات السلامة). - تحضير محلول منع التشابك البروتيني (CP) عن طريق خلط 38 ميكرولتر من محلول الفورمالديهايد 37٪ (FA) مع 50 ميكرولتر من محلول مخزون الأكريلاميد بنسبة 40٪ (الخطوة 2.2) في 912 ميكرولتر من محلول ملحي مخزن بالفوسفات (PBS; الجدول 1) للحصول على تركيز نهائي من 1.4٪ فورمالديهايد و 2٪ أكريلاميد.
ملاحظة: قم دائما بإعداد محلول CP حديثا وكن دقيقا للغاية عند سحب العينات. على سبيل المثال، استخدم ماصة P1000 لأخذ 900 ميكرولتر من PBS وماصة P20 لأخذ 12 ميكرولتر المتبقية من PBS. - تحضير الحل الأحادي
ملاحظة: لا تستخدم المحلول فور تحضيره ؛ يحفظ في درجة حرارة -20 درجة مئوية قبل 24 ساعة على الأقل من استخدامه.- امزج 500 ميكرولتر من محلول SA 38٪ (الخطوة 2.1) ، و 250 ميكرولتر من محلول AA بنسبة 40٪ ، و 50 ميكرولتر من محلول BIS (الخطوة 2.2) ، بالإضافة إلى 100 ميكرولتر من 10x PBS (الجدول 1).
- Aliquot هذا الحجم النهائي البالغ 900 ميكرولتر في أنابيب أجهزة الطرد المركزي الدقيقة 10x 1.5 مل مع 90 ميكرولتر من المحلول الأحادي لكل منها. يحفظ في درجة حرارة -20 درجة مئوية لمدة تصل إلى أسبوعين.
ملاحظة: قد يظل محلول SA على الطرف عند سحب العينة لأنه شديد اللزجة. كن حذرا واستغني عن كل شيء.
- تحضير محلول تغيير الطبيعة
- امزج 114.3 مل من محلول كبريتات دوديسيل الصوديوم (SDS) سعة 350 ملي مولار المحضر في ماء فائق النقاء مع 10 مل من محلول كلوريد الصوديوم 4 M المحضر في ماء فائق النقاء. أضف 12 جم من تريس مع التحريك في دورق سعة 250 مل.
تنبيه: SDS شديد السمية. استخدمه تحت غطاء الدخان مرتديا القفازات والملابس الواقية والقناع ونظارات السلامة. - اضبط الرقم الهيدروجيني إلى 9 بمحلول مركز من حمض الهيدروكلوريك. اصنع ما يصل إلى 200 مل بماء فائق النقاء واحفظه في قارورة معقمة عند 4 درجات مئوية.
- امزج 114.3 مل من محلول كبريتات دوديسيل الصوديوم (SDS) سعة 350 ملي مولار المحضر في ماء فائق النقاء مع 10 مل من محلول كلوريد الصوديوم 4 M المحضر في ماء فائق النقاء. أضف 12 جم من تريس مع التحريك في دورق سعة 250 مل.
- تحضير محلول بيرسلفات الأمونيوم بنسبة 10٪ (APS) ومحلول TEMED بنسبة 10٪.
- قم بإذابة 0.1 جم من APS في 1 مل من الماء عالي النقاء.
- تحضير 1 مل من محلول TEMED بنسبة 10٪ في ماء عالي النقاء.
- قم بإعداد 100 ميكرولتر من كلا المحاللين في أنابيب معقمة لأجهزة الطرد المركزي الدقيقة سعة 1.5 مل وتخزينها عند -20 درجة مئوية لمدة تصل إلى شهر واحد.
- تحضير محلول بارافورمالدهايد.
- قم بإذابة 2 جم من بارافورمالدهيد في 40 مل من PBS مع التقليب عند 60 درجة مئوية. أضف 1 M هيدروكسيد الصوديوم بالتنقيط حتى يتحول المحلول من الأبيض إلى عديم اللون.
تحذير: الفورمالديهايد شديد السمية. استخدمه تحت غطاء الدخان مرتديا القفازات والملابس الواقية والقناع ونظارات السلامة. - قم بتبريد المحلول في درجة حرارة الغرفة واضبط الرقم الهيدروجيني باستخدام هيدروكسيد الصوديوم إلى 7.2 في حجم نهائي قدره 50 مل. قم بالتصفية باستخدام فلتر حقنة معقمة 0.22 ميكرومتر وتخزينها في وعاء معقم.
- قم بإعداد حصصات من 1 مل في أنابيب الطرد المركزي الدقيقة المعقمة سعة 1.5 مل وتخزينها عند -20 درجة مئوية.
- قم بإذابة 2 جم من بارافورمالدهيد في 40 مل من PBS مع التقليب عند 60 درجة مئوية. أضف 1 M هيدروكسيد الصوديوم بالتنقيط حتى يتحول المحلول من الأبيض إلى عديم اللون.
- تحضير محلول بارافورمالدهايد / جلوتارالديهايد.
- أضف 0.2 جم من بارافورمالدهيد في 3.5 مل من الماء فائق النقاء و 50 ميكرولتر من محلول هيدروكسيد الصوديوم 16 م. سخني المحلول إلى 60 درجة مئوية لإذابة بارافورمالدهايد.
- تبرد وأضف 300 ميكرولتر من 70٪ جلوتارالديهايد. ارفع الحجم إلى 5 مل بالماء فائق النقاء وأخيرا إلى 10 مل باستخدام PBS.
تنبيه: بارافورمالدهيد والجلوتارالديهايد شديد السمية. استخدمها تحت غطاء الدخان مرتديا القفازات والملابس الواقية والقناع ونظارات السلامة. - قم بإعداد حصصات من 1 مل في أنابيب الطرد المركزي الدقيقة المعقمة سعة 1.5 مل وتخزينها عند -20 درجة مئوية.
3. تحضير الثقافات الطفيلية
- تنمو T. cruzi epimastigotes.
- استخدم مزرعة محورية في قارورة T-25 (منطقة نمو 25 سم2 ) وحافظ على المزارع في المرحلة اللوغاريتمية عن طريق الزراعة الفرعية كل 48-72 ساعة في وسط التربتوز بتسريب الكبد (LIT) مع مصل ربلة الساق الجنينية بنسبة 10٪ (FCS; الجدول 1).
- تأكد من إغلاق الغطاء بإحكام واحتفظ بقارورة الاستزراع عموديا عند 28 درجة مئوية للحضانة. راقب نمو الطفيليات عن طريق عد الخلايا في غرفة نيوباور خلال كل ثقافة فرعية.
ملاحظة: بالنسبة لسلالة Dm28c المستخدمة في هذه الدراسة ، يتراوح تركيز epimastigotes في مزارع الطور اللوغاريتمي بين 1-5 × 107 طفيليات / مل. - تحضير معلق 2 × 106 epimastigotes / مل من مزرعة طور لوغاريتم في وسط LIT مكمل بنسبة 10٪ FCS. جهاز الطرد المركزي للتعليق عند 5,000 × جم لمدة 10 دقائق في درجة حرارة الغرفة (RT). يغسل باستخدام PBS مرة أو مرتين ويعلق في 200 ميكرولتر من PBS.
- التمسك بالغطاء الدائري مقاس 12 مم المطلي مسبقا ب poly-D-lysine (القسم 1). احتضن في RT لمدة 15-20 دقيقة. تابع إلى خطوة منع التشابك (القسم 4).
ملاحظة: بدلا من ذلك ، قم بإصلاح epimastigotes بالميثانول البارد لمدة 7 دقائق أو محلول بارافورمالدهيد / جلوتارالديهايد (الخطوة 2.8) لمدة 10 دقائق في RT قبل التصاق الطفيليات بالغطاء. من الممكن تخزين الطفيليات الثابتة عند 4 درجات مئوية لمدة تصل إلى أسبوع واحد.
- الحصول على amastigotes من خلايا Vero المصابة.
- ضع غطاء دائري معقم مقاس 12 مم في الجزء السفلي من صفيحة زراعة الأنسجة المكونة من 24 بئرا. قم بإعداد معلق من 2 × 105 خلايا فيرو / مل في وسط النسر المعدل (DMEM) من Dulbecco مع مصل ربلة الساق الجنينية بنسبة 2٪ (FCS). بذور 500 ميكرولتر من المعلق لكل بئر.
ملاحظة: تستخدم هذه الدراسة DMEM مع 2٪ FCS للسماح للخلايا بالنمو بشكل أبطأ. - احتضان طوال الليل (تشغيل ؛ 12-16 ساعة) عند 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 لضمان التصاق الخلية.
- بعد الحضانة ، اغسل الخلايا مرتين باستخدام 500 ميكرولتر من PBS المعقم. أضف T. cruzi المثقبية إلى الخلايا عند تعدد العدوى (MOI) من 10 في 100 ميكرولتر من DMEM مع 2٪ FCS لكل بئر ، أي ما يعادل مليون المثقبيات لكل بئر. احتضان عند 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 لمدة 6 ساعات.
- بعد الحضانة ، اشطف الأطباق مرتين باستخدام PBS. أضف 500 ميكرولتر من DMEM مكملا بنسبة 2٪ FCS. عند هذه النقطة، تابع إلى خطوة منع التشابك (القسم 4).
ملاحظة: ستكون الماستيجوت داخل الهيولى مرئية من خلال مجهر بصري مقلوب بعد يومين من الإصابة (الشكل التكميلي 1). بدلا من ذلك ، قم بإصلاح المثقبيات بالميثانول البارد لمدة 7 دقائق عند -20 درجة مئوية ، أو بارافورمالديهايد / جلوتارالديهايد لمدة 10 دقائق عند RT ، قبل التصاق الطفيليات بالغطاء.
- ضع غطاء دائري معقم مقاس 12 مم في الجزء السفلي من صفيحة زراعة الأنسجة المكونة من 24 بئرا. قم بإعداد معلق من 2 × 105 خلايا فيرو / مل في وسط النسر المعدل (DMEM) من Dulbecco مع مصل ربلة الساق الجنينية بنسبة 2٪ (FCS). بذور 500 ميكرولتر من المعلق لكل بئر.
- الحصول على المثقبيات من خلايا فيرو المصابة.
- اجمع المادة الطافية لطبقة أحادية لخلية Vero (التقاء 30٪ -40٪) المصابة بالمثقبيات (MOI 1:10; في الحضانة) بعد 4 أيام من الإصابة.
ملاحظة: بالنسبة لقارورة T-25 ، فإن التركيز الأولي لخلايا Vero المستخدمة هو 800,000 خلية ، وبالنسبة لقارورة T-75 يبلغ مليوني خلية. - حدد تركيز المثقبيات باستخدام غرفة نيوباور لعد الخلايا. جهاز طرد مركزي 4 × 106 المثقبيات عند 7,000 × جم عند RT لمدة 10 دقائق.
- اشطفها باستخدام PBS مرتين ثم أعد تعليقها في 200 ميكرولتر من PBS. يوضع على غطاء دائري مقاس 12 مم مطلي ببولي دي ليسين (القسم 1). احتضن لمدة 10-15 دقيقة في RT. تابع خطوة منع التشابك (القسم 4).
ملاحظة: بدلا من ذلك ، قم بإصلاح المثقبيات بالميثانول البارد لمدة 7 دقائق عند -20 درجة مئوية أو بارافورمالديهايد / جلوتارالديهايد لمدة 10 دقائق عند RT قبل التصاق الطفيليات بالغطاء.
- اجمع المادة الطافية لطبقة أحادية لخلية Vero (التقاء 30٪ -40٪) المصابة بالمثقبيات (MOI 1:10; في الحضانة) بعد 4 أيام من الإصابة.
4. إجراء منع التشابك (اليوم 1)
- اغمر الغطاء 12 مم مع الطفيليات الملتصقة أو الخلايا المصابة (متجهة لأعلى) في صفيحة مكونة من 24 بئرا مع 0.5 مل من محلول CP (الخطوة 2.3) في كل بئر.
- املأ الآبار الفارغة بالماء لتقليل التبخر. أغلق اللوحة بغشاء مانع للتسرب. احتضان لمدة 5 ساعات عند 37 درجة مئوية. يمكن تمديد هذه الخطوة حتى حضانة ON عند 4 درجات مئوية.
ملاحظة: قم دائما بغمر الغطاء في المحلول ؛ لا تقم بسحب محلول التثبيت فوق الغطاء.
5. إجراء هلام العينة
- قم بتجميع غرفة رطبة في طبق بتري مع غشاء مانع للتسرب فوق المناديل الورقية (الشكل 2 أ). أضف الماء إلى المناديل الورقية واحتضنه عند -20 درجة مئوية لمدة 20 دقيقة حتى يبرد. قم بإذابة TEMED و APS aliquot على الجليد لمدة 20 دقيقة (الخطوة 2.6).
ملاحظة: لا تقم بتجميد وإذابة APS أكثر من ثلاث مرات. - ضع الغرفة الباردة والرطبة على الجليد (الشكل 2 أ). خذ الطبق المكون من 24 بئرا المحضر في القسم 4 من الحاضنة. قم بشفط محلول CP باستخدام ماصة باستور سعة 3 مل ، مع ترك بعض المحلول ، وإلا فسيكون من الصعب إزالة الغطاء.
- قم بإزالة الغطاء مقاس 12 مم من محلول التثبيت باستخدام ملاقط وضعها على المناديل الورقية بحيث تكون الطفيليات متجهة لأعلى.
ملاحظة: من المفيد استخدام إبرة معقمة لرفع الغطاء ثم إمساكه بالملاقط. - إلى حصة 90 ميكرولتر من المحلول الأحادي (الخطوة 2.4) ، أضف 5 ميكرولتر من TEMED و 5 ميكرولتر من APS المذابة مسبقا. تخلط مع خلاط دوامة لمدة لا تزيد عن 2-3 ثوان ؛ ليس من الضروري إغلاق الأنبوب بالغطاء.
ملاحظة: أضف دائما TEMED أولا و APS أخيرا. إن إضافة APS أولا و TEMED أخيرا إلى المحلول الأحادي يجعل عملية التبلور أسرع ، ولا يمنح أي وقت للتلاعب بها. - قم بعمل قطرة واحدة بسرعة من 35 ميكرولتر فوق فيلم مانع التسرب للغرفة الرطبة لكل غطاء غطاء. التقط الغطاء على الفور بالملاقط واستلق فوق القطرة (الشكل 2 ب) بحيث تكون الطفيليات متجهة لأسفل.
ملاحظة: قم بعمل غطاءين كحد أقصى في المرة الواحدة. من الأهمية بمكان عدم تأخير هذه الخطوة لأن المحلول يتبلمر بسرعة كبيرة. - احتضان الغرفة الرطبة لمدة 5 دقائق على الجليد ثم لمدة ساعة واحدة عند 37 درجة مئوية. قم بتشغيل كتلة التسخين عند 95 درجة مئوية لضمان درجة الحرارة الصحيحة للخطوة التالية.
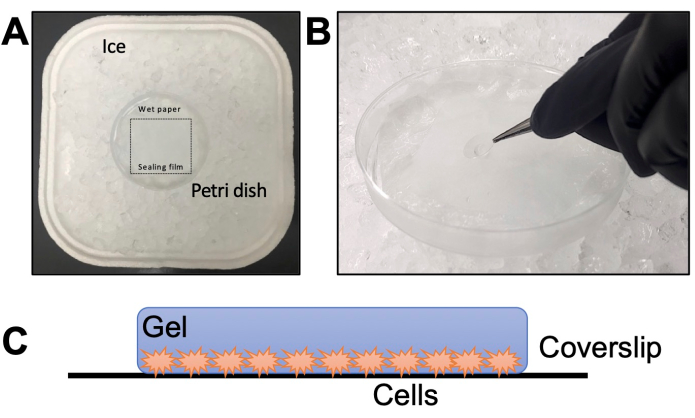
الشكل 2: تفاصيل خطوة التبلور. (أ) تجميع الغرفة الرطبة. (ب) إسقاط الغطاء على محلول المونومر باستخدام TEMED و APS للهلام. (ج) التمثيل التخطيطي للهلام الذي تم تجميعه للتصوير. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. تغيير طبيعة العينات المهلمة وإجراء التمدد التماثلي
- قم بإزالة محلول التمسخ (الخطوة 2.5) من 4 درجات مئوية. إذا ترسب ، ضعه في حمام ماء ساخن حتى يذوب تماما.
- أضف 2 مل من محلول تغيير الطبيعة إلى كل بئر من صفيحة 6 آبار. انقل الغطاء من الخطوة 5.3 إلى اللوحة باستخدام محلول التمسخ. احتضن لمدة 15 دقيقة في RT مع رج لطيف حتى ينفصل الجل عن الغطاء.
- انقل الجل بعناية (قم بإزالته من غطاء الغطاء 12 مم) باستخدام ملعقة معدنية إلى أنبوب طرد مركزي دقيق معقم سعة 1.5 مل مع 1 مل من محلول تغيير الطبيعة. استخدم أقفال الغطاء لتأمين الأنابيب. احتضن لمدة 1 ساعة و 30 دقيقة عند 95 درجة مئوية في كتلة تسخين.
ملاحظة: تبدأ المواد الهلامية في التوسع خلال هذه الخطوة ؛ كن لطيفا عند نقل الجل إلى أنبوب الطرد المركزي الدقيق سعة 1.5 مل.
تنبيه: بعد الحضانة ، يكون الأنبوب الذي يحتوي على الجل عند 95 درجة مئوية ، مما قد يكون خطيرا. استخدم القفازات الواقية واترك الأنابيب تبرد قبل التعامل معها لتجنب الحروق والإسقاطات. - إجراء الجولة الأولى من التوسع
- استنشق محلول تغيير الطبيعة من أنبوب الطرد المركزي الدقيق سعة 1.5 مل باستخدام الجل باستخدام ماصة P1000. انقل الجل من أنبوب الطرد المركزي الدقيق سعة 1.5 مل إلى طبق بتري مع 10 مل من الماء فائق النقاء لمدة 30 دقيقة باستخدام ملعقة صغيرة.
- قم بتغيير الماء فائق النقاء باستخدام ماصة باستور سعة 3 مل يمكن التخلص منها. احتضن ON في RT.
ملاحظة: كن لطيفا مع المواد الهلامية لأنها بعد أول 30 دقيقة من الحضانة ، أصبحت هشة. - قم بتغيير الماء فائق النقاء باستخدام ماصة باستور سعة 3 مل يمكن التخلص منها مرة أخرى.
ملاحظة: ثلاث حضانات مائية مدة كل منها 30 دقيقة كافية ، ولكن من أجل التطبيق العملي ، من الأفضل ترك الحضانة الثانية قيد التشغيل.
7. إجراء وضع العلامات الفلورية للبروتينات المستهدفة (اليوم 2)
- قم بإزالة الماء من طبق بتري باستخدام الجل باستخدام ماصة باستور سعة 3 مل يمكن التخلص منها. قم بقياس قطر الجل باستخدام الفرجار لحساب التمدد (بين أربع وخمس مرات).
- يغسل مرتين ب 10 مل من PBS لمدة 15 دقيقة. قطع الجل بشفرة حلاقة إلى مربعات حوالي 10 مم × 10 مم في وسط الجل الدائري. استخدم مربعا واحدا لكل شرط ليتم اختباره.
ملاحظة: يتقلص الجل بعد حضانات PBS. يمكن تخزين المواد الهلامية في PBS عند 4 درجات مئوية لمدة تصل إلى أسبوع واحد. - انقل كل مربع إلى صفيحة مكونة من 12 بئرا واحتضنه ب 500 ميكرولتر من الجسم المضاد الأولي المخفف في 2٪ ألبومين مصل PBS-bovine (BSA) لمدة ساعتين و 30 دقيقة عند 37 درجة مئوية مع الرج.
ملاحظة: يمكن إجراء حضانة الأجسام المضادة البديلة عند 4 درجات مئوية. الحد الأدنى لحجم الجسم المضاد الذي يمكن استخدامه هو 300 ميكرولتر في صفيحة 24 بئرا. كقاعدة عامة ، استخدم ضعف تركيز الأجسام المضادة المستخدمة في وضع العلامات المناعية التقليدية. - يغسل ثلاث مرات باستخدام 2 مل من PBS مع 0.1٪ بولي سوربات 20 لمدة 10 دقائق أثناء رجها في طبق من 6 آبار.
- انقل الجل إلى صفيحة مكونة من 12 بئرا واحتضنه ب 500 ميكرولتر من الجسم المضاد الثانوي في PBS مع DAPI و 10 ميكروغرام / مل NHS-ester مترافق مع الفلوروفور المطلوب لمدة ساعتين و 30 دقيقة عند 37 درجة مئوية مع اهتزاز لطيف.
ملاحظة: كقاعدة عامة ، استخدم ضعف تركيز الأجسام المضادة المستخدمة في وضع العلامات المناعية التقليدية. بدلا من ذلك ، يمكن إجراء هذه الحضانة عند 4 درجات مئوية. - يغسل ثلاث مرات باستخدام 2 مل من PBS مع 0.1٪ بولي سوربات 20 لمدة 10 دقائق أثناء رجها في طبق من 6 آبار.
- انقل الجل إلى طبق بتري بالماء عالي النقاء. احتضان لمدة 30 دقيقة. قم بتغيير الماء مرتين باستخدام ماصة باستور سعة 3 مل يمكن التخلص منها، كما هو الحال في الخطوة 6.4.
8. التصوير ومعالجة الصور (اليوم 3)
- قم بإزالة الماء من أطباق Petri باستخدام ماصة باستور يمكن التخلص منها 3 مل وقم بقياس قطر الجل باستخدام الفرجار لحساب عامل التمدد.
- اقطع قطعة صغيرة ~ 10 مم × 10 مم بشفرة حلاقة وضعها على طبق زجاجي قاع 35 مم.
ملاحظة: كبديل ، ضع الجل بين شريحة وغطاء (بدون بولي دي ليسين). يجب أن تحتوي الشريحة على قطعتين أصغر مقطوعة بسكين ماسي متصلة على الجانبين لتشكيل غرفة حول سمك الجل. - تحقق من الاتجاه عند التكبير 10x أو 20x. من أجل التركيز بشكل صحيح ، تأكد من أن الطفيليات تواجه الغطاء ؛ خلاف ذلك ، يتعين على المرء أن يدير الجل ويتحقق مرة أخرى (الشكل 2 ج).
- بمجرد العثور على الاتجاه الصحيح ، جفف الجل المتبقي بورق مجهري. قم بتغطية الجل بغطاء مطلي بالبولي دي ليسين.
- أضف قطرة صغيرة من الماء فائق النقاء إلى الجل لتصورها باستخدام مجهر متحد البؤر.
ملاحظة: لضمان التصوير المناسب ، من الضروري الحفاظ على اتجاه الجل طوال العملية بحيث يكون جانب الجل الذي يحتوي على خلايا بالقرب من سطحه مواجها للطبق ذي القاع الزجاجي في النهاية. عند استخدام أطباق مقاس 35 مم ، فإن إضافة بولي دي ليسين إلى الغطاء الموضوع في الجزء السفلي يقلل من تحول الجل أثناء الحصول على الصورة. - معلمات الحصول على الصور
- قم بتصوير العينات في مجهر متحد البؤر (جدول المواد) باستخدام هدف 63x الغمر بالزيت 1.4 فتحة العدسة العددية (NA).
- الحصول على مكدسات Z ، وعرض كل خطوة z ، ووقت التعرض لكل بكسل ، ليتم تحديدها تجريبيا اعتمادا على العينة وشدة الإشارة وتحسين أوقات الاستحواذ. استخدم تكبير/تصغير المسح الضوئي للتكبير الفعال إذا رغبت في ذلك.
- افتح مكدس Z باستخدام برنامج معالجة الصور (جدول المواد). لكل قناة، قم بتجميع الصور المكدسة باستخدام خيار مشروع المجموعة Z . حدد الإسقاط الأقصى للشدة.
- لدمج الصور، استخدم أداة Merge Channels وحدد لون كل قناة. أضف شريط مقياس باستخدام أداة Scale Bar في برنامج المعالجة.
ملاحظة: بدلا من ذلك ، يمكن للمرء تلوين كل قناة حسب الرغبة (انظر الأمثلة في النتائج التمثيلية).
النتائج
إذا تم تنفيذ البروتوكول بشكل صحيح (الشكل 1) ، فستكون العينات مرئية على شكل هلام مستو وشفاف يمكن توسيعه حتى معامل 4-4.5x في الماء (الشكل 3 أ). قدم هذا التوسع دقة فعالة تبلغ حوالي 70 نانومتر ، والتي قد تختلف اعتمادا على عامل التمدد النهائي ونظام ال?...
Discussion
الفحص المجهري للتمدد فوق البني هو تقنية تسمح بالحصول على صور عالية الدقة للعينات البيولوجية عن طريق توسيعها فعليا إلى عدة أضعاف حجمها الأصلي. يتضمن بروتوكول U-ExM العديد من الخطوات الحاسمة التي يجب تنفيذها بعناية لتحقيق أفضل النتائج4. أولا ، يجب تثبيت العينة ?...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
نشكر دولوريس كامبوس على مساعدتها في زراعة خلايا فيرو ورومينا مانارين للمساعدة في ثقافة T. cruzi . وحظي هذا العمل بدعم من الوكالة الوطنية للنهوض بالعلوم والتكنولوجيا ووزارة العلوم والابتكارات من الأرجنتين (PICT2019-0526)، والمجلس الوطني للبحوث العلمية والتقنية (PIBAA 1242)، ومجلس البحوث في المملكة المتحدة [MR/P027989/1].
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 micrometers sterile syringe filters PES | Membrane solutions | SFPES030022S | |
| 1 L beaker | Schott Duran | 10005227 | |
| 1.5-mL SPINWIN Micro Centrifuge Tube | Tarson | T38-500010 | |
| 10 mL disposable sterile serynge | NP | 66-32 | |
| 10 mL serological pipette sterile | Jet Biofil | GSP211010 | |
| 12-mm coverslips | Merienfeld GmbH | 01 115 20 | Round coverslips |
| 12-well plates | Jet Biofil | TCP011012 | |
| 22-mm coverslips | Corning | 2845-22 | Square coverslips |
| 24-well plates | Jet Biofil | TCP-011-024 | |
| 250 mL beaker | Schott Duran | C108.1 | |
| 3 mL Pasteur pipette | Deltalab | 200037 | |
| 35-mm glass bottom dishes | Matsunami glass ind | D11130H | |
| 4′,6-Diamidine-2′-phenylindole dihydrochloride | Sigma Aldrich | D9542 | DAPI |
| 5 ml serological pipette sterile | Jet Biofil | GSP010005 | |
| 6-well plates | Sarstedt | 83.3920 | |
| Acrilamide | BioRad | 1610101 | |
| Ammonium persulfate | Sigma Aldrich | A3678-25G | APS |
| ATTO 647 NHS ester | BOC Sciences | F10-0107 | For pan-proteome labelling |
| Biosafty Cabinet | Telstar | Bio II A/P | |
| Bovine Sodium Albumine | Sigma Aldrich | A7906 | BSA |
| CO2 Incubator | Sanyo | MCO-15A | |
| Confocal Microscope | Zeiss | LSM 880 | |
| Disposable Petridish | Tarsons | 460095 | 90 mm diameter |
| DMEM, High Glucose | Thermo Fisher Cientific | 12100046 | Powder |
| Electronic digital caliper | Radar | RADAR-SLIDE-CALIPER | |
| Ethanol Absolute | Supelco | 1,00,98,31,000 | |
| Fetal Calf Serum | Internegocios SA | FCS FRA 500 | Sterile and heat-inactivated |
| Fiji image processing package | ImageJ | doi:10.1038/nmeth.2019 | |
| Formaldehyde 37% | Sigma Aldrich | F8775 | FA |
| Glass Petridish | Marienfeld Superior | PM-3400300 | 60 mm diameter |
| Glucosa D(+) | Cicarelli | 716214 | |
| Glutaraldehyde 70% | Sigma Aldrich | G7776 | |
| Goat anti-Mouse IgG Secondary Antibody Alexa Fluor 555 | Invitrogen | A-21422 | |
| Goat anti-Rabbit IgG Secondary Antibody FICT | Jackson Immunoresearch | 115-095-003 | |
| Graduated cylinder | Nalgene | 3663-1000 | |
| Graduated glass flask | Glassco | GL-274.202.01 | 100 mL |
| Heating Block | IBR | Made in house | |
| Hemin | Frontier Scientific | H651-9 | |
| Hydrochloric acid 36.8-38.0% | Ciccarelli | 918110 | |
| Ice bucket | Corning | 1167U68 | |
| Incubator | Tecno Dalvo | TOC130 | |
| Liver Infusion | Difco | 226920 | |
| Magnetic stirrer and heater | Lab companion | HP-3000 | |
| Metal spatula | SALTTECH | 200MM | |
| Metal tweezers | Marienfeld Superior | PM-6633002 | |
| Methanol absolut | Cicarelli | 897110 | |
| Microcentrifuge tube 1.5 mL | Tarson | 500010-N | |
| Microscopy grade paper KimWipes | Kimtech Science | B0013HT2QW | |
| Milli-Q water sistem | Merk Millipore | IQ-7003 | |
| mouse anti- alpha tubulin clone DM1A | Sigma Aldrich | T9026 | |
| mouse anti-PFR | Purified antibodies | Donated by Dr. Ariel Silber (USP) | |
| N,N´-methylenbisacrilamide | ICN | 193997 | BIS |
| Na2HPO4 | Cicarelli | 834214 | |
| Neubauer chamber | Boeco | BOE 01 | |
| p1000 pipette | Gilson | PIPETMAN P1000 | |
| p1000 pipette tips | Tarson | TAR-521020B | |
| p20 pipette | Gilson | PIPETMAN P20 | |
| p20 pipette tips | Tarson | TAR-527108 | |
| p200 pipette | Gilson | PIPETMAN P200 | |
| p200 pipette tips | Tarson | TAR-521010Y | |
| Paraformaldehyde | Sigma Aldrich | P6148 | PFA |
| pH / ORP / °C meter | HANNA Instruments | HI 2211 | |
| Poly-D-Lysine 0.1% | Sigma Aldrich | P8920 | |
| Potassium Chloride | Cicarelli | 867212 | KCl |
| Razor blade | Printex | BS 2982:1992 | |
| Sealing FIlm "Parafilm M" | Bemis | PM996 | |
| Sodium Acrilate | Sigma Aldrich | 408220-25G | SA |
| Sodium Bicarbonate | Cicarelli | 929211 | NaHCO3 |
| Sodium Chloride | Cicarelli | 750214 | NaCl |
| Sodium Dodecyl Sulfate | BioRad | 1610302 | SDS |
| Sodium Hidroxide | Merk | 1-06498 | NaOH |
| Sorvall ST 16 Centrifuge | Thermo Fisher Scientific | 75004380 | |
| T-25 flasks | Corning | 430639 | |
| TEMED | Invitrogen | 15524-010 | |
| Tissue paper | Elite | ||
| Triptose | Merck | 1106760500 | |
| Tris | BioRad | 1610719 | |
| Tween-20 | Biopack | 2003-07 | Polysorbate 20 |
| Vaccum pump | Silfab | N33-A | |
| Vero cells | ATCC | CRL-1587 | |
| Vortex MIxer | Dragon Lab | MX-S |
References
- Chen, F., Tillberg, P. W., Boyden, E. S. Expansion microscopy. Science. 347 (6221), 543-548 (2015).
- Chozinski, T. J., et al. Expansion microscopy with conventional antibodies and fluorescent proteins. Nature Methods. 13 (6), 485-488 (2016).
- Ku, T., et al. Multiplexed and scalable super-resolution imaging of three-dimensional protein localization in size-adjustable tissues. Nature Biotechnology. 34 (9), 973-981 (2016).
- Gambarotto, D., et al. Imaging cellular ultrastructures using expansion microscopy (U-ExM). Nature Methods. 16 (1), 71-74 (2018).
- Tillberg, P. W., Chen, F. Expansion microscopy: Scalable and convenient super-resolution microscopy. Annual Review of Cell and Developmental Biology. 35, 683-701 (2019).
- Jurriens, D., van Batenburg, V., Katrukha, E. A., Kapitein, L. C. Mapping the neuronal cytoskeleton using expansion microscopy. Methods in Cell Biology. 161, 105-124 (2021).
- Alonso, V. L. Ultrastructure expansion microscopy (U-ExM) in Trypanosoma cruzi: localization of tubulin isoforms and isotypes. Parasitology Research. 121 (10), 3019-3024 (2022).
- Kalichava, A., Ochsenreiter, T. Ultrastructure expansion microscopy in Trypanosoma brucei. Open Biology. 11 (10), 210132 (2021).
- Amodeo, S., et al. Characterization of the novel mitochondrial genome segregation factor TAP110 in Trypanosoma brucei. Journal of Cell Science. 134 (5), (2021).
- Liffner, B., Absalon, S. Expansion microscopy reveals plasmodium falciparum blood-stage parasites undergo anaphase with a chromatin bridge in the absence of mini-chromosome maintenance complex binding protein. Microorganisms. 9 (11), 2306 (2021).
- Dos Santos Pacheco, N., Soldati-Favre, D. Coupling auxin-inducible degron system with ultrastructure expansion microscopy to accelerate the discovery of gene function in Toxoplasma gondii. Methods in Molecular Biology. 2369, 121-137 (2021).
- Lidani, K. C. F., et al. Chagas disease: From discovery to a worldwide health problem. Frontiers in Public Health. 7, 166 (2019).
- Carrea, A., Diambra, L. Systems biology approach to model the life cycle of Trypanosoma cruzi. PloS One. 11 (1), e0146947 (2016).
- Vidal, J. C., De Souza, W. . Morphological and Functional Aspects of Cytoskeleton of Trypanosomatids. Cytoskeleton - Structure, Dynamics, Function and Disease. , (2017).
- Kunz, T. C., Götz, R., Gao, S., Sauer, M., Kozjak-Pavlovic, V. Using expansion microscopy to visualize and characterize the morphology of mitochondrial cristae. Frontiers in Cell and Developmental Biology. 8, 617 (2020).
- Laporte, M. H., Klena, N., Hamel, V., Guichard, P. Visualizing the native cellular organization by coupling cryofixation with expansion microscopy (Cryo-ExM). Nature Methods. 19 (2), 216-222 (2022).
- Sahabandu, N., et al. Expansion microscopy for the analysis of centrioles and cilia. Journal of Microscopy. 276 (3), 145-159 (2019).
- Wen, G., Leen, V., Rohand, T., Sauer, M., Hofkens, J. Current progress in expansion microscopy: chemical strategies and applications. Chemical Reviews. 123 (6), 3299-3323 (2023).
- Trinks, N., et al. Subdiffraction-resolution fluorescence imaging of immunological synapse formation between NK cells and A. fumigatus by expansion microscopy. Communications Biology. 4 (1), 1151 (2021).
- White, B. M., Kumar, P., Conwell, A. N., Wu, K., Baskin, J. M. Lipid expansion microscopy. Journal of the American Chemical Society. 144 (40), 18212-18217 (2022).
- Steib, E., et al. TissUExM enables quantitative ultrastructural analysis in whole vertebrate embryos by expansion microscopy. Cell Reports Methods. 2 (10), 100311 (2022).
- Shaib, A. H., et al. Visualizing proteins by expansion microscopy. bioRxiv. , (2023).
- M'Saad, O., et al. All-optical visualization of specific molecules in the ultrastructural context of brain tissue. bioRxiv. , (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved