このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
Trypanosoma cruziの3つのIn Vitroライフサイクルステージにおける超微細構造拡大顕微鏡
* これらの著者は同等に貢献しました
要約
この研究は、シャーガス病の原因となる病原体であるTrypanosoma cruziの3つのin vitroライフサイクルステージで超微細構造拡大顕微鏡法を実施するための詳細なプロトコルを示しています。細胞骨格タンパク質と汎プロテオーム標識に最適化された技術が含まれています。
要約
ここでは、顕微鏡イメージングのために細胞または組織の空間分解能を向上させる技術である Trypanosoma cruziにおける超微細構造拡大顕微鏡(U-ExM)の応用について説明します。これは、既製の化学物質と一般的なラボ機器を使用してサンプルを物理的に膨張させることによって実行されます。
シャーガス病は、 T. cruziによって引き起こされる広範かつ差し迫った公衆衛生上の懸念事項です。この病気はラテンアメリカで蔓延しており、移住の増加により非流行地域で重大な問題となっています。 T. cruzi の伝染は、Reduviidae科とHemphoptera科に属する食性昆虫ベクターを介して起こります。感染後、 T. cruzi amastigotesは哺乳類の宿主内で増殖し、非複製的な血流形態であるトリポマスティゴテスに分化します。昆虫ベクターでは、トリポマスティゴテスがエピマスティゴテスに変化し、二元分裂を通じて増殖します。ライフサイクルステージ間の分化には、細胞骨格の広範な再配置が必要であり、さまざまな細胞培養技術を使用してラボで完全に再現できます。
ここでは、Trypanosoma cruziの3つのin vitroライフサイクルステージにおけるU-ExMの適用に関する詳細なプロトコールについて、細胞骨格タンパク質の免疫局在の最適化に焦点を当てています。また、汎プロテオーム標識であるN-ヒドロキシスクシンイミドエステル(NHS)の使用を最適化し、さまざまな寄生虫構造をマークすることを可能にしました。
概要
拡大顕微鏡(ExM)は、2015年にBoydenらによって初めて報告されました1。これは、従来の顕微鏡が回折限界を下回る空間分解能を達成できるイメージングプロトコルです。この高い分解能は、サンプルの物理的な拡大によって得られます。これを達成するために、蛍光標識された分子をハイドロゲルに架橋し、その後、ヒドロゲルを水で等方的に膨張させます。この拡張の結果として、信号は3次元すべてでほぼ等方的に分離されます。この方法は、低コストの薬品を使用し、従来の(共焦点)顕微鏡で約65nmの空間分解能を実現しており、これは共焦点顕微鏡の標準分解能(約250nm)の約4倍です1。
多くの生物学的分野で拡大顕微鏡の使用を可能にした次のマイルストーンは、従来の抗体2による免疫蛍光標識の適応でした。最初に公開されたExMプロトコルからの別の適応は、プロテオーム(MAP)3の拡大分析です。この方法では、サンプルハイドロゲルを浸す前に高濃度のアクリルアミドとパラホルムアルデヒドを使用して、タンパク質内およびタンパク質間の架橋を防ぎ、サンプルのタンパク質含有量と細胞内構造をよりよく保存することにつながりました。この代替プロトコルは、低濃度の固定剤(ホルムアルデヒド/パラホルムアルデヒドおよびアクリルアミド)を利用することにより、単離されたオルガネラの全体的な超微細構造の保存を強化するように最適化されました。このアプローチは、超微細構造拡大顕微鏡(U-ExM)4と呼ばれていました。
さらに分解能を高めるために、ExMと誘導放出枯渇顕微鏡法や単一分子局在顕微鏡などの超解像顕微鏡法との組み合わせも報告されており、20 nm5未満の分解能を達成しています。
ExMの使用は、神経科学や細胞骨格研究の分野で広く報告されていますが6、寄生原生生物に関する研究はごくわずかです。当研究室は、T. cruzi7におけるU-ExMの適用を最初に報告しました。この基礎プロトコルは、主にToxoplasma gondii、Plasmodium ssp.、およびTrypanosoma brucei 8,9,10,11の以前のU-ExM報告に基づいています。
ExMの最大の利点の1つは、そのモジュール性により、さまざまな生物学的サンプルに柔軟に適応できることです。プロトコールは、ユーザーが実験要件を満たすように簡単に調整できるステップ(固定、架橋防止、ゲル化など)に分けることができます。さらに、このパイプラインを変更して、モデル生物との互換性を強化したり、特定の解像度を達成したりできます。その結果、ExMは、高度な光学システムと非高度な光学システムの両方に大きな可能性を提供し、将来的にはより広範なアプリケーションを保証します。
シャーガス病は、アメリカトリパノソーマ症とも呼ばれ、原虫である トリパノソーマ・クルージによって引き起こされるラテンアメリカの風土病です。この寄生虫のライフサイクルは複雑で、哺乳類では2つの発生段階、この病気の生物学的ベクターである昆虫宿主(トリアトミナ科のメンバー)では2つの発生段階が関与しています。シャーガス病は、世界保健機関(WHO)がリストアップした顧みられない熱帯病のグループに属し、ラテンアメリカにおける重大な経済的・社会的問題となっています。疫学研究では、世界中で800万人がシャーガス病に罹患し、年間1万人以上が死亡していると推定されています。これらの数字は、シャーガス病が世界中の公衆衛生問題として重要であることを実証しています。シャーガス病の地理的分布はここ数十年で変化しており、当初発見されたラテンアメリカの主に農村部とは対照的に、移住の増加により、多くの感染者が世界の大都市部に居住するようになりました12。
T. cruziの発生段階は、そのライフサイクルを通じて異なり、これは完全にin vitroで再現できます。エピマスティゴテスは昆虫ベクターの複製型であり、細胞体の中央領域に球状の核を持ち、核に対して前部に棒状のキネトプラスト(キネトプラストに特有のミトコンドリアDNA含有構造)を持ち、遊離鞭毛を持っています。トリポマスチゴテは感染性で非複製性の形態であり、細長い核、丸みを帯びた後部運動細胞形成体、および寄生虫の全長に沿って原形質膜に付着した鞭毛を持っています。アマスチゴテスは細胞内複製型です。それらは、中央領域に核を持ち、細胞体の前部に棒状の運動細胞形成体を持ち、そして減少した鞭毛を有する。寄生虫のさまざまな環境への適応性は、これらの形態学的変化を反映しています。また、このライフサイクルには対称的な分割と異なる移行発達段階が含まれていることも言及する価値があります13。分化時には、トリパノソーマ科の細胞骨格が重要な役割を果たします。この構造は、原形質膜の下に安定な微小管が規則正しく配列された膜下微小管のコルセットによって形成されます。また、これらの生物には傍鞭毛桿体が存在し、これは平行に走る格子状の構造であり、べん毛軸索14に付着している。細胞周期段階に沿った正確な細胞骨格組織と核構造の変化には、トリパノソーマチドに固有の遺伝子制御メカニズムが関与しており、細胞生物学研究の興味深いモデルとなっています。
T. cruziやその他の原虫寄生虫のサイズが小さいことを考えると、U-ExMはこれらの重要な病原体の構造的特徴を分析するための優れたツールを提供します。前述のように、この技術のT.cruziへの適用性は、Alonso 7博士によって初めて検証されました。このレポートでは、T. cruziのさまざまなライフサイクル段階における細胞骨格タンパク質の免疫局在に重点を置いた、完全なU-ExMプロトコルについて詳しく説明します。また、さまざまな寄生虫構造をマークすることを可能にする汎プロテオーム標識であるN-ヒドロキシスクシンイミドエステル(NHS)の使用を最適化しました。さらに、寄生虫の3つの段階を取得するためのin vitro方法論が記載されている。
プロトコル
注: 図1 は、完全な実験計画を示しています。
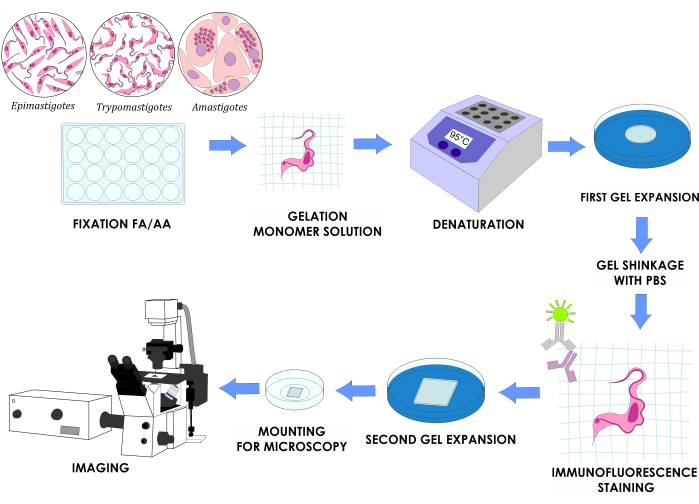
図1:T. cruziの3つのin vitroライフサイクルステージのU-ExMワークフロー この図の拡大版を表示するには、ここをクリックしてください。
1. ポリ-D-リジンコーティングされたカバースリップの調製
- 10 cm x 10 cm四方のシーリングフィルムをペトリ皿に入れます。カバースリップを無水エタノールに浸して、35mmのガラスシャーレで洗います。
- エタノールバスからピンセットでカバースリップを取り外し、余分な液体をティッシュペーパーで排出します。カバースリップをシーリングフィルムの上に置きます。
- 残りのエタノールを顕微鏡グレードの紙で吸収します。カバーガラスの中央にポリ-D-リジンの0.1% v/v溶液を加え、先端で広げて表面の約80%を覆います。ペトリ皿を閉じ、37°Cで1時間インキュベートします。
注:22 mm2 カバースリップの場合、200 μLのポリ-D-リジン溶液を使用してください。12 mmの丸型カバースリップには、100 μLのポリ-D-リジン溶液を使用します。 - カバーガラスを超純水で3回洗います。真空で吸引して、各洗浄の間に水分を取り除きます。4°Cで最大1週間保管します。
2. 溶液の調製
- 38%(w / w)のアクリル酸ナトリウム(SA)のストック溶液を調製します。
- 攪拌しながら、19 gのSAを31 mLのヌクレアーゼフリー水にゆっくりと加えます。
注:このソリューションは非常に粘性があります。ピペッティングの際はご注意ください。 - SAが完全に溶解したら、滅菌容器に保管します。4°Cに保ち、6か月ごとに交換してください。
注:SAは、ブランドによってはポリアクリル酸ナトリウムによる汚染の兆候を示すことがあり、これはストック溶液を調製するときに黄色がかった濁りに変わるときに目立ちます。その場合は慎重に使用してください。
- 攪拌しながら、19 gのSAを31 mLのヌクレアーゼフリー水にゆっくりと加えます。
- 40%(w / v)アクリルアミド(AA)の原液と2%(w / v)N、N'-メチレンビスアクリルアミド(BIS)の原液を準備します。各化合物を超純水に溶解し、0.22μmの滅菌シリンジフィルターでろ過します。滅菌容器に入れて4°Cで保存してください。
注意:AAとBISは非常に有毒な物質です。ドラフトの下で作業し、適切な保護要素(手袋、防護服、マスク、安全メガネ)を使用してください。 - 37%ホルムアルデヒド(FA)溶液38μLと40%アクリルアミドストック溶液50μL(ステップ2.2)を912μLのリン酸緩衝生理食塩水(PBS; 表1)1.4%ホルムアルデヒドと2%アクリルアミドの最終濃度を得るため。
注:CP溶液は常に新鮮に調製し、ピペッティングするときは非常に正確です。例えば、P1000ピペットを使用して900μLのPBSを採取し、P20ピペットを使用して残りの12μLのPBSを採取します。 - モノマー溶液を調製します
注意: 調製後すぐに溶液を使用しないでください。使用する前に少なくとも24時間-20°Cで保管してください。- 38% SA溶液500 μL(ステップ2.1)、40% AA溶液250 μL、BIS溶液50 μL(ステップ2.2)、10x PBS100 μLを混合します(表1)。
- この最終容量900 μLを1.5 mL microcentrifuge tubesに10x 1.5 mL入りで分注し、それぞれ90 μLのモノマー溶液を添加します。-20°Cで最大2週間保存してください。
注:SA溶液は粘性が高いため、ピペッティング時にチップに留まる場合があります。注意して、すべてを分配してください。
- 変性液を調製します
- 超純水で調製した350 mMドデシル硫酸ナトリウム(SDS)溶液114.3 mLと、超純水で調製した4 M塩化ナトリウム溶液10 mLを混合します。250mLのビーカーで攪拌しながらトリス12gを加えます。
注意:SDSは非常に有毒です。手袋、防護服、マスク、安全メガネを着用してドラフトの下で使用してください。 - 塩酸の濃縮溶液でpHを9に調整します。超純水で最大200mLを調製し、4°Cの滅菌フラスコで保存します。
- 超純水で調製した350 mMドデシル硫酸ナトリウム(SDS)溶液114.3 mLと、超純水で調製した4 M塩化ナトリウム溶液10 mLを混合します。250mLのビーカーで攪拌しながらトリス12gを加えます。
- 10%過硫酸アンモニウム(APS)溶液と10%TEMED溶液を調製します。
- 0.1gのAPSを1mLの超純水に溶解します。
- 10% TEMED溶液1 mLを超純水で調製します。
- 1.5 mLの微量遠心分離用滅菌チューブに両溶液のアリコート100 μLを調製し、-20°Cで最大1か月間保存します。
- パラホルムアルデヒド溶液を調製します。
- パラホルムアルデヒド2gをPBS40mLに溶解し、60°Cで撹拌します。 溶液が白色から無色に変わるまで、1 M NaOHを滴下します。
注意:ホルムアルデヒドは非常に有毒です。手袋、防護服、マスク、安全メガネを着用してドラフトの下で使用してください。 - 溶液を室温で冷却し、NaOHを含むpHを最終容量50mLで7.2に調整します。0.22 μm滅菌シリンジフィルターでろ過し、滅菌容器で保存します。
- 1.5 mLの滅菌微量遠心チューブに1 mLのアリコートを調製し、-20°Cで保存します。
- パラホルムアルデヒド2gをPBS40mLに溶解し、60°Cで撹拌します。 溶液が白色から無色に変わるまで、1 M NaOHを滴下します。
- パラホルムアルデヒド/グルタルアルデヒド溶液を調製します。
- 0.2 gのパラホルムアルデヒドを3.5 mLの超純水と50 μLの16 M NaOH溶液に加えます。溶液を60°Cに加熱して、パラホルムアルデヒドを溶解します。
- 冷まして、70%グルタルアルデヒドを300μL加えます。超純水で5mLまで、PBSで10mLまで容量を上げます。
注意:パラホルムアルデヒドとグルタルアルデヒドは非常に有毒です。手袋、防護服、マスク、安全メガネを着用してドラフトの下で使用してください。 - 1.5 mLの滅菌微量遠心チューブに1 mLのアリコートを調製し、-20°Cで保存します。
3.寄生虫培養物の調製
- T. cruzi epimastigotesを育てます。
- T-25フラスコ(成長領域25 cm2 )で無菌培養を使用し、10%の子牛胎児血清(FCS; 表 1)。
- キャップがしっかりと閉まっていることを確認し、培養フラスコを垂直に28°Cに保ち、インキュベーションします。各継代培養中にノイバウアーチャンバー内で細胞計数することにより、寄生虫の増殖をモニターします。
注:この研究で使用したDm28c株の場合、対数期培養物中のエピマスティゴテスの濃度は1〜5 x 107 寄生虫/ mLです。 - 10% FCSを添加したLIT培地中の対数期培養液から、2 x 106 エピマスティゴート/mLの懸濁液を調製します。懸濁液を5,000 x g で室温(RT)で10分間遠心分離します。PBSで1〜2回洗浄し、200μLのPBSに再懸濁します。
- ポリ-D-リジンで以前にコーティングされた丸い12mmカバーガラス(セクション1)に接着します。室温で15〜20分間インキュベートします。架橋防止手順(セクション4)に進みます。
注:あるいは、寄生虫をカバースリップに付着する前に、冷たいメタノールで7分間、またはパラホルムアルデヒド/グルタルアルデヒド溶液(ステップ2.8)でRTで10分間エピマスティゴテスを固定します。固定寄生虫は4°Cで最大1週間保存することができます。
- 感染したVero細胞からアマスチゴテスを取得します。
- 滅菌済みの12 mm丸型カバースリップを24ウェル組織培養プレートの底に置きます。2% ウシ胎児血清(FCS)を添加したダルベッコの改変イーグル培地(DMEM)に 2 x 105 Vero 細胞/mL の懸濁液を調製します。懸濁液500μLをウェルあたり播種します。
注:この研究では、細胞の成長を遅くするために、DMEMと2%FCSを使用しています。 - 37°Cおよび5%CO2 で一晩(ON; 12-16時間)インキュベートして、細胞の接着を確保します。
- インキュベーション後、500 μLの滅菌PBSを使用して細胞を2回洗浄します。100μLのDMEM中100μL、1ウェルあたり2%FCSで、ウェルあたり100万個のトリポポマスティゴテに相当する感染の多重度(MOI)でT . cruzi トリポマスチゴテを細胞に添加します。37°Cおよび5%CO2 で6時間インキュベートします。
- インキュベーション後、プレートをPBSで2回すすいでください。2% FCSを添加したDMEMを500 μL加えます。この時点で、架橋防止ステップ(セクション4)に進みます。
注:細胞質内異常症は、感染後2日で倒立光学顕微鏡で見ることができます(補足図1)。あるいは、寄生虫をカバーガラスに付着させる前に、トリポマスチゴテを冷メタノールで-20°Cで7分間、またはパラホルムアルデヒド/グルタルアルデヒドをRTで10分間固定します。
- 滅菌済みの12 mm丸型カバースリップを24ウェル組織培養プレートの底に置きます。2% ウシ胎児血清(FCS)を添加したダルベッコの改変イーグル培地(DMEM)に 2 x 105 Vero 細胞/mL の懸濁液を調製します。懸濁液500μLをウェルあたり播種します。
- 感染したベロ細胞からトリポマスチゴテを取得します。
- トリポマスティゴテスに感染したVero細胞単層(30%-40%のコンフルエンス)の上清を収集します(MOI 1:10;ONインキュベーション)感染後4日。
注:T-25フラスコの場合、使用されるVero細胞の初期濃度は800,000細胞であり、T-75フラスコの場合、200万細胞です。 - 細胞計数用のノイバウアーチャンバーを使用して、トリポマスティギガー濃度を測定します。4 x 106 トライポマスチゴテを 7,000 x g で RT で 10 分間遠心分離します。
- PBSで2回すすぎ、200μLのPBSに再懸濁します。ポリD-リジンでコーティングされた丸い12mmカバーガラス(セクション1)に適用します。室温で10-15分間インキュベートし、架橋防止ステップ(セクション4)に進みます。
注:あるいは、寄生虫がカバーガラスに付着する前に、トリポマスチゴットを冷メタノールで-20°Cで7分間、またはパラホルムアルデヒド/グルタルアルデヒドをRTで10分間固定します。
- トリポマスティゴテスに感染したVero細胞単層(30%-40%のコンフルエンス)の上清を収集します(MOI 1:10;ONインキュベーション)感染後4日。
4. 架橋防止の実施(1日目)
- 付着した寄生虫または感染細胞を上向きにして(上向きに)付着させた12 mmカバースリップを、各ウェルに0.5 mLのCP溶液(ステップ2.3)を入れた24ウェルプレートに浸します。
- 蒸発を減らすために、空の井戸に水を入れます。プレートをシーリングフィルムで密封します。37°Cで5時間インキュベートします。 このステップは、4°CでのONインキュベーションまで延長できます。
注意: 常にカバースリップを溶液に浸してください。固定液をカバーガラスの上にピペットで固定しないでください。.
5.サンプルのゲル化を行う
- ティッシュペーパーの上にシーリングフィルムを貼ったシャーレに湿ったチャンバーを組み立てます(図2A)。ティッシュペーパーに水を加え、-20°Cで20分間インキュベートして冷まします。TEMEDとAPSアリコートを氷の上で20分間解凍します(ステップ2.6)。
注意: APSを3回以上凍結融解しないでください。 - 冷たく湿ったチャンバーを氷の上に置きます(図2A)。セクション4で調製した24ウェルプレートをインキュベーターから取り出します。3mLのパスツールピペットでCP溶液を吸引し、溶液を残します。そうしないと、カバースリップが剥がれにくくなります。
- 固定液から12mmのカバースリップをピンセットで取り出し、寄生虫を上に向けてティッシュペーパーの上に置きます。
注意: 滅菌針を使用してカバースリップを持ち上げ、ピンセットで保持すると便利です。 - 90 μL の単量体溶液 (ステップ 2.4) に、5 μL の TEMED と 5 μL の APS を事前に解凍しておいていただきたいと思います。ボルテックスミキサーで2〜3秒以内に混合します。チューブを蓋で閉じる必要はありません。
注:常にTEMEDを最初に追加し、APSを最後に追加します。モノマー溶液に最初にAPSを、最後にTEMEDを添加すると、ゲル化プロセスが速くなり、操作する時間がなくなります。 - 各カバースリップについて、湿潤チャンバーのシーリングフィルム上に35μLをすばやく1滴滴下します。すぐにピンセットでカバーガラスを拾い上げ、寄生虫を下に向けてドロップの上に置きます(図2B)。
注意: 一度に最大 2 枚のカバースリップを作成します。溶液は非常に速く重合するため、このステップを遅らせないことが重要です。 - 湿潤チャンバーを氷上で5分間インキュベートし、次に37°Cで1時間インキュベートします。 95°Cで加熱ブロックをオンにして、次のステップのために正しい温度を確保します。
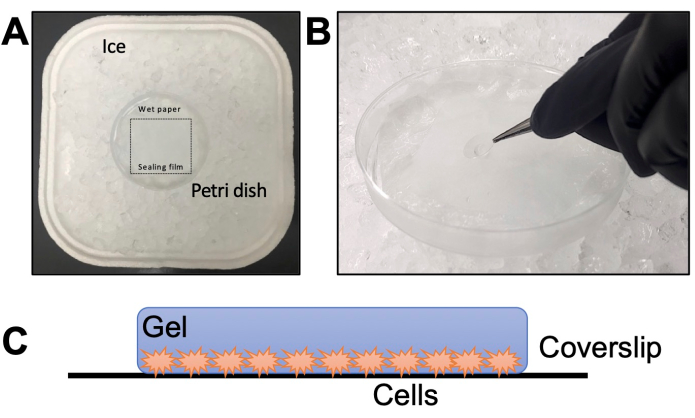
図2:ゲル化ステップの詳細 (A)湿潤チャンバーの組み立て。(B)カバースリップをTEMEDおよびAPSを含むモノマー溶液上に落下させてゲル化します。(C)イメージングのために組み立てられたゲルの概略図。 この図の拡大版を表示するには、ここをクリックしてください。
6. ゲル化したサンプルの変性および等方性の拡大を行う
- 変性溶液(ステップ2.5)を4°Cから取り出します。 沈殿した場合は、完全に溶けるまでお湯浴に入れてください。
- 2 mLの変性溶液を6ウェルプレートの各ウェルに加えます。ステップ5.3のカバースリップを変性溶液のあるプレートに移します。RTで15分間インキュベートし、穏やかに振とうして、ゲルがカバーガラスから剥がれるようにします。
- ゲルを金属製のヘラで慎重に移し(12 mmカバースリップから取り出します)、1 mLの変性溶液が入った1.5 mLの滅菌マイクロ遠心チューブに入れます。キャップロックを使用してチューブを固定します。加熱ブロック内で95°Cで1時間30分インキュベートします。
注:このステップ中にゲルが膨張し始めます。ゲルを1.5 mLの微量遠心チューブに移すときは、穏やかにしてください。
注意:インキュベーション後、ゲルの入ったチューブは95°Cにあり、危険な場合があります。火傷や突起を避けるために、保護手袋を使用し、チューブを冷ましてから取り扱ってください。 - 拡張の最初のラウンドを実行する
- 1.5 mLの微量遠心チューブから変性溶液をゲルで吸引し、P1000ピペットで加熱します。1.5 mLの微量遠心チューブから10 mLの超純水を入れたシャーレにゲルを移し、小さなスパチュラを使用して30分間移します。
- 超純水は、使い捨ての3mLパスツールピペットを使用して交換します。RTでONインキュベートします。
注:インキュベーションの最初の30分後、ゲルは壊れやすくなったため、ゲルには優しくしてください。 - 超純水は、使い捨ての3mLパスツールピペットでもう一度交換してください。
注:それぞれ30分の水インキュベーションを3回行うだけで十分ですが、実用性のために、2回目のインキュベーションをオンにしておくことをお勧めします。
7. 標的タンパク質の蛍光標識の実施(2日目)
- 使い捨ての3mLパスツールピペットでジェルでペトリ皿から水を取り除きます。キャリパーでゲルの直径を測定し、膨張を計算します(4〜5倍)。
- PBS10mLで15分間2回洗浄します。カミソリの刃でゲルを円形のゲルの中央で約10mm×10mmの正方形にカットします。テストする条件ごとに 1 つの正方形を使用します。
注:ゲルはPBSインキュベーション後に収縮します。ゲルは、4°CのPBSで最大1週間保存できます。 - 各正方形を12ウェルプレートに移し、2% PBS-ウシ血清アルブミン(BSA)で希釈した一次抗体500 μLと37°C、振とうしながら37°Cで2時間および30分間インキュベートします。
注:代替抗体インキュベーションは、4°CでONに行うことができます。 使用できる最小抗体容量は、24ウェルプレートで300μLです。原則として、従来の免疫標識に使用される抗体の2倍の濃度を使用してください。 - 6ウェルプレートで振とうしながら、2mLのPBSと0.1%ポリソルベート20を10分間3回洗浄します。
- ゲルを12ウェルプレートに移し、500 μLの二次抗体をPBSに添加し、DAPIおよび10 μg/mLのNHSエステルを目的の蛍光色素に結合させて、37°Cで2時間および30分間、穏やかに振とうしながらインキュベートします。
注:原則として、従来の免疫標識に使用される抗体の2倍の濃度を使用してください。あるいは、このインキュベーションを4°CでONに実行することもできます。 - 6ウェルプレートで振とうしながら、2mLのPBSと0.1%ポリソルベート20を10分間3回洗浄します。
- ゲルを超純水を入れたシャーレに移します。30分間インキュベートします。手順6.4で行ったように、使い捨ての3 mLパスツールピペットで水を2回交換します。
8. イメージングと画像処理(3日目)
- 使い捨ての3 mLパスツールピペットでペトリ皿から水を取り除き、キャリパーでゲルの直径を測定して膨張係数を計算します。
- カミソリの刃で~10mm×10mmの小片を切り取り、35mmのガラス底皿に置きます。
注:別の方法として、スライドとカバーガラス(ポリ-D-リジンなし)の間にゲルを置きます。スライドには、ゲルの厚さとほぼ同じチャンバーを形成するために、側面に取り付けられたダイヤモンドナイフでカットされた2つの小さなスライドピースが必要です。 - 10倍または20倍の倍率で向きを確認してください。適切に焦点を合わせるために、寄生虫がカバーガラスに面していることを確認してください。そうでない場合は、ゲルを裏返して再度確認する必要があります(図2C)。
- 適切な配向が見つかったら、残りのゲルを顕微鏡用紙で乾かします。ポリ-D-リジンコーティングされたカバースリップでゲルを覆います。
- ゲルに少量の超純水を加え、共焦点顕微鏡で可視化します。
注:適切なイメージングを確実にするためには、プロセス全体を通してゲルの配向を維持し、その表面近くの細胞を含むゲルの側が端でガラス底皿に面するようにすることが重要です。35 mmディッシュを使用する場合は、底面に配置したカバーガラスにポリ-D-リジンを追加すると、画像取得中のゲルシフトが減少します。 - 画像取得パラメータ
- 63倍油浸1.4開口数(NA)対物レンズを使用して、共焦点顕微鏡(Table of Materials)でサンプルを画像化します。
- Zスタック、各zステップの幅、およびピクセルあたりの露光時間は、サンプル、信号強度、および取得時間の最適化に応じて経験的に決定されます。必要に応じて、スキャンズームを使用して効果的な倍率にします。
- 画像処理ソフト(材料表)でZスタックを開きます。各チャンネルで、 グループZプロジェクト オプションを使用して、スタックされた画像をグループ化します。最大強度の投影を選択します。
- 画像を結合するには、 チャネルの結合 ツールを使用して、各チャネルの色を選択します。処理ソフトウェアの スケールバー ツールを使用してスケールバーを追加します。
注:または、必要に応じて各チャネルに色を付けることもできます(代表的な結果の例を参照)。
結果
プロトコールが適切に実施されている場合(図1)、サンプルは平面的で半透明のゲルとして表示され、水中で最大4〜4.5倍まで拡張できます(図3A)。この膨張により、約70nmの有効分解能が得られましたが、これは最終的な膨張係数と使用するイメージングシステムによって異なる場合があります。2回目の拡大プロセスと共焦?...
ディスカッション
超微細構造拡大顕微鏡は、生体試料を物理的に元のサイズの数倍に拡大することで、生体試料の高解像度画像を取得できる技術です。U-ExMプロトコルには、最適な結果を得るために慎重に実行しなければならないいくつかの重要なステップが含まれています4。まず、サンプルをCP剤で固定し、膨潤性ヒドロゲルマトリックスに包埋する必要がありま?...
開示事項
著者には、開示すべき利益相反はありません。
謝辞
Vero細胞培養を支援してくださったDolores Campos氏と、 T. cruzi 培養を支援してくださったRomina Manarin氏に感謝します。この研究は、Agencia Nacional de Promoción Científica y Tecnológica、アルゼンチンのMinisterio de Ciencia e Innovación Productiva (PICT2019-0526)、Consejo Nacional de Investigaciones Científicas y Técnicas (PIBAA 1242)、Research Council United Kingdom [MR/P027989/1] の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 0.22 micrometers sterile syringe filters PES | Membrane solutions | SFPES030022S | |
| 1 L beaker | Schott Duran | 10005227 | |
| 1.5-mL SPINWIN Micro Centrifuge Tube | Tarson | T38-500010 | |
| 10 mL disposable sterile serynge | NP | 66-32 | |
| 10 mL serological pipette sterile | Jet Biofil | GSP211010 | |
| 12-mm coverslips | Merienfeld GmbH | 01 115 20 | Round coverslips |
| 12-well plates | Jet Biofil | TCP011012 | |
| 22-mm coverslips | Corning | 2845-22 | Square coverslips |
| 24-well plates | Jet Biofil | TCP-011-024 | |
| 250 mL beaker | Schott Duran | C108.1 | |
| 3 mL Pasteur pipette | Deltalab | 200037 | |
| 35-mm glass bottom dishes | Matsunami glass ind | D11130H | |
| 4′,6-Diamidine-2′-phenylindole dihydrochloride | Sigma Aldrich | D9542 | DAPI |
| 5 ml serological pipette sterile | Jet Biofil | GSP010005 | |
| 6-well plates | Sarstedt | 83.3920 | |
| Acrilamide | BioRad | 1610101 | |
| Ammonium persulfate | Sigma Aldrich | A3678-25G | APS |
| ATTO 647 NHS ester | BOC Sciences | F10-0107 | For pan-proteome labelling |
| Biosafty Cabinet | Telstar | Bio II A/P | |
| Bovine Sodium Albumine | Sigma Aldrich | A7906 | BSA |
| CO2 Incubator | Sanyo | MCO-15A | |
| Confocal Microscope | Zeiss | LSM 880 | |
| Disposable Petridish | Tarsons | 460095 | 90 mm diameter |
| DMEM, High Glucose | Thermo Fisher Cientific | 12100046 | Powder |
| Electronic digital caliper | Radar | RADAR-SLIDE-CALIPER | |
| Ethanol Absolute | Supelco | 1,00,98,31,000 | |
| Fetal Calf Serum | Internegocios SA | FCS FRA 500 | Sterile and heat-inactivated |
| Fiji image processing package | ImageJ | doi:10.1038/nmeth.2019 | |
| Formaldehyde 37% | Sigma Aldrich | F8775 | FA |
| Glass Petridish | Marienfeld Superior | PM-3400300 | 60 mm diameter |
| Glucosa D(+) | Cicarelli | 716214 | |
| Glutaraldehyde 70% | Sigma Aldrich | G7776 | |
| Goat anti-Mouse IgG Secondary Antibody Alexa Fluor 555 | Invitrogen | A-21422 | |
| Goat anti-Rabbit IgG Secondary Antibody FICT | Jackson Immunoresearch | 115-095-003 | |
| Graduated cylinder | Nalgene | 3663-1000 | |
| Graduated glass flask | Glassco | GL-274.202.01 | 100 mL |
| Heating Block | IBR | Made in house | |
| Hemin | Frontier Scientific | H651-9 | |
| Hydrochloric acid 36.8-38.0% | Ciccarelli | 918110 | |
| Ice bucket | Corning | 1167U68 | |
| Incubator | Tecno Dalvo | TOC130 | |
| Liver Infusion | Difco | 226920 | |
| Magnetic stirrer and heater | Lab companion | HP-3000 | |
| Metal spatula | SALTTECH | 200MM | |
| Metal tweezers | Marienfeld Superior | PM-6633002 | |
| Methanol absolut | Cicarelli | 897110 | |
| Microcentrifuge tube 1.5 mL | Tarson | 500010-N | |
| Microscopy grade paper KimWipes | Kimtech Science | B0013HT2QW | |
| Milli-Q water sistem | Merk Millipore | IQ-7003 | |
| mouse anti- alpha tubulin clone DM1A | Sigma Aldrich | T9026 | |
| mouse anti-PFR | Purified antibodies | Donated by Dr. Ariel Silber (USP) | |
| N,N´-methylenbisacrilamide | ICN | 193997 | BIS |
| Na2HPO4 | Cicarelli | 834214 | |
| Neubauer chamber | Boeco | BOE 01 | |
| p1000 pipette | Gilson | PIPETMAN P1000 | |
| p1000 pipette tips | Tarson | TAR-521020B | |
| p20 pipette | Gilson | PIPETMAN P20 | |
| p20 pipette tips | Tarson | TAR-527108 | |
| p200 pipette | Gilson | PIPETMAN P200 | |
| p200 pipette tips | Tarson | TAR-521010Y | |
| Paraformaldehyde | Sigma Aldrich | P6148 | PFA |
| pH / ORP / °C meter | HANNA Instruments | HI 2211 | |
| Poly-D-Lysine 0.1% | Sigma Aldrich | P8920 | |
| Potassium Chloride | Cicarelli | 867212 | KCl |
| Razor blade | Printex | BS 2982:1992 | |
| Sealing FIlm "Parafilm M" | Bemis | PM996 | |
| Sodium Acrilate | Sigma Aldrich | 408220-25G | SA |
| Sodium Bicarbonate | Cicarelli | 929211 | NaHCO3 |
| Sodium Chloride | Cicarelli | 750214 | NaCl |
| Sodium Dodecyl Sulfate | BioRad | 1610302 | SDS |
| Sodium Hidroxide | Merk | 1-06498 | NaOH |
| Sorvall ST 16 Centrifuge | Thermo Fisher Scientific | 75004380 | |
| T-25 flasks | Corning | 430639 | |
| TEMED | Invitrogen | 15524-010 | |
| Tissue paper | Elite | ||
| Triptose | Merck | 1106760500 | |
| Tris | BioRad | 1610719 | |
| Tween-20 | Biopack | 2003-07 | Polysorbate 20 |
| Vaccum pump | Silfab | N33-A | |
| Vero cells | ATCC | CRL-1587 | |
| Vortex MIxer | Dragon Lab | MX-S |
参考文献
- Chen, F., Tillberg, P. W., Boyden, E. S. Expansion microscopy. Science. 347 (6221), 543-548 (2015).
- Chozinski, T. J., et al. Expansion microscopy with conventional antibodies and fluorescent proteins. Nature Methods. 13 (6), 485-488 (2016).
- Ku, T., et al. Multiplexed and scalable super-resolution imaging of three-dimensional protein localization in size-adjustable tissues. Nature Biotechnology. 34 (9), 973-981 (2016).
- Gambarotto, D., et al. Imaging cellular ultrastructures using expansion microscopy (U-ExM). Nature Methods. 16 (1), 71-74 (2018).
- Tillberg, P. W., Chen, F. Expansion microscopy: Scalable and convenient super-resolution microscopy. Annual Review of Cell and Developmental Biology. 35, 683-701 (2019).
- Jurriens, D., van Batenburg, V., Katrukha, E. A., Kapitein, L. C. Mapping the neuronal cytoskeleton using expansion microscopy. Methods in Cell Biology. 161, 105-124 (2021).
- Alonso, V. L. Ultrastructure expansion microscopy (U-ExM) in Trypanosoma cruzi: localization of tubulin isoforms and isotypes. Parasitology Research. 121 (10), 3019-3024 (2022).
- Kalichava, A., Ochsenreiter, T. Ultrastructure expansion microscopy in Trypanosoma brucei. Open Biology. 11 (10), 210132 (2021).
- Amodeo, S., et al. Characterization of the novel mitochondrial genome segregation factor TAP110 in Trypanosoma brucei. Journal of Cell Science. 134 (5), (2021).
- Liffner, B., Absalon, S. Expansion microscopy reveals plasmodium falciparum blood-stage parasites undergo anaphase with a chromatin bridge in the absence of mini-chromosome maintenance complex binding protein. Microorganisms. 9 (11), 2306 (2021).
- Dos Santos Pacheco, N., Soldati-Favre, D. Coupling auxin-inducible degron system with ultrastructure expansion microscopy to accelerate the discovery of gene function in Toxoplasma gondii. Methods in Molecular Biology. 2369, 121-137 (2021).
- Lidani, K. C. F., et al. Chagas disease: From discovery to a worldwide health problem. Frontiers in Public Health. 7, 166 (2019).
- Carrea, A., Diambra, L. Systems biology approach to model the life cycle of Trypanosoma cruzi. PloS One. 11 (1), e0146947 (2016).
- Vidal, J. C., De Souza, W. . Morphological and Functional Aspects of Cytoskeleton of Trypanosomatids. Cytoskeleton - Structure, Dynamics, Function and Disease. , (2017).
- Kunz, T. C., Götz, R., Gao, S., Sauer, M., Kozjak-Pavlovic, V. Using expansion microscopy to visualize and characterize the morphology of mitochondrial cristae. Frontiers in Cell and Developmental Biology. 8, 617 (2020).
- Laporte, M. H., Klena, N., Hamel, V., Guichard, P. Visualizing the native cellular organization by coupling cryofixation with expansion microscopy (Cryo-ExM). Nature Methods. 19 (2), 216-222 (2022).
- Sahabandu, N., et al. Expansion microscopy for the analysis of centrioles and cilia. Journal of Microscopy. 276 (3), 145-159 (2019).
- Wen, G., Leen, V., Rohand, T., Sauer, M., Hofkens, J. Current progress in expansion microscopy: chemical strategies and applications. Chemical Reviews. 123 (6), 3299-3323 (2023).
- Trinks, N., et al. Subdiffraction-resolution fluorescence imaging of immunological synapse formation between NK cells and A. fumigatus by expansion microscopy. Communications Biology. 4 (1), 1151 (2021).
- White, B. M., Kumar, P., Conwell, A. N., Wu, K., Baskin, J. M. Lipid expansion microscopy. Journal of the American Chemical Society. 144 (40), 18212-18217 (2022).
- Steib, E., et al. TissUExM enables quantitative ultrastructural analysis in whole vertebrate embryos by expansion microscopy. Cell Reports Methods. 2 (10), 100311 (2022).
- Shaib, A. H., et al. Visualizing proteins by expansion microscopy. bioRxiv. , (2023).
- M'Saad, O., et al. All-optical visualization of specific molecules in the ultrastructural context of brain tissue. bioRxiv. , (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved