Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Ультраструктурная экспансионная микроскопия на трех стадиях жизненного цикла in vitro Trypanosoma cruzi
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этом исследовании представлен подробный протокол проведения ультраструктурно-экспансионной микроскопии на трех стадиях жизненного цикла in vitro Trypanosoma cruzi, патогена, ответственного за болезнь Шагаса. Мы включили оптимизированную технику для цитоскелетных белков и пан-протеомного мечения.
Аннотация
Мы описываем применение ультраструктурно-экспансионной микроскопии (U-ExM) у Trypanosoma cruzi, метода, который позволяет увеличить пространственное разрешение клетки или ткани для микроскопической визуализации. Это выполняется путем физического расширения образца с помощью готовых химикатов и обычного лабораторного оборудования.
Болезнь Шагаса является широко распространенной и насущной проблемой общественного здравоохранения, вызываемой T. cruzi. Болезнь распространена в Латинской Америке и стала серьезной проблемой в неэндемичных регионах из-за увеличения миграции. Передача T. cruzi происходит через гематофагов-переносчиков, принадлежащих к семействам Reduviidae и Hemiptera. После заражения T. cruzi amastigotes размножаются в организме млекопитающих-хозяев и дифференцируются в трипомастиготы, нерепликативную форму кровотока. В насекомых-переносчиках трипомастиготы превращаются в эпимастиготы и размножаются путем бинарного деления. Дифференциация между стадиями жизненного цикла требует обширной перестройки цитоскелета и может быть полностью воссоздана в лаборатории с использованием различных методов культивирования клеток.
Мы описываем подробный протокол применения U-ExM на трех стадиях жизненного цикла in vitro Trypanosoma cruzi, уделяя особое внимание оптимизации иммунолокализации белков цитоскелета. Мы также оптимизировали использование N-гидроксисукцинимидного эфира (NHS), пан-протеомной метки, которая позволила нам маркировать различные структуры паразитов.
Введение
Экспансионная микроскопия (ExM) была впервые описана в 2015 году Boyden et al.1. Это протокол визуализации, с помощью которого обычный микроскоп может достичь пространственного разрешения ниже дифракционного предела. Такое более высокое разрешение достигается за счет физического увеличения образца. Для этого флуоресцентно меченые молекулы сшиваются с гидрогелем, который впоследствии изотропно расширяется водой. В результате этого расширения сигналы разделяются почти изотропно во всех трех измерениях. В этом методе используются недорогие химические вещества, и он обеспечивает пространственное разрешение около 65 нм при использовании обычных (конфокальных) микроскопов, что примерно в четыре раза лучше, чем стандартное разрешение конфокального микроскопа (примерно 250 нм)1.
Следующей вехой, позволившей использовать экспансионную микроскопию во многих биологических областях, стала адаптация иммунофлуоресцентного мечения обычными антителами2. Еще одной адаптацией первоначально опубликованного протокола ExM является увеличенный анализ протеома (MAP)3. Этот метод позволил использовать высокие концентрации акриламида и параформальдегида перед погружением образца в гидрогель для предотвращения внутри- и межбелкового сшивания клеток, что привело к лучшему сохранению содержания белка и субклеточной архитектуры образцов. Этот альтернативный протокол был оптимизирован для получения улучшенного сохранения общей ультраструктуры выделенных органелл за счет использования более низких концентраций фиксаторов (формальдегида/параформальдегида и акриламида); этот подход получил название ультраструктурно-экспансионной микроскопии (U-ExM)4.
Для достижения еще большего разрешения также сообщалось о сочетании ExM с методами микроскопии сверхвысокого разрешения, включая микроскопию со стимулированным истощением эмиссии или микроскопию локализации одиночных молекул, для достижения разрешения ниже 20 нм5.
Использование ExM широко освещалось в области нейробиологиии исследований цитоскелета6, но было проведено лишь несколько исследований паразитических протистов. Наша лаборатория первой сообщила о применении U-ExM у T. cruzi7. Протокол основания в основном основан на предыдущих отчетах U-ExM по Toxoplasma gondii, Plasmodium ssp. и Trypanosoma brucei 8,9,10,11.
Одним из самых больших преимуществ ExM является его модульная структура, которая обеспечивает большую гибкость для адаптации к различным биологическим образцам. Протокол может быть разделен на этапы (такие как фиксация, предотвращение сшивания или гелеобразование), которые могут быть легко скорректированы пользователем в соответствии с его экспериментальными требованиями. Кроме того, этот конвейер может быть изменен для повышения совместимости с модельным организмом или для достижения определенного разрешения. В результате, ExM предлагает огромный потенциал как для передовых, так и для непередовых оптических систем, обеспечивая более широкое применение в будущем.
Болезнь Шагаса, также называемая американским трипаносомозом, является эндемическим заболеванием в Латинской Америке, вызываемым простейшим паразитом Trypanosoma cruzi. Жизненный цикл паразита сложен и включает в себя две стадии развития у млекопитающих и две у насекомых-хозяев (членов семейства Triatominidae), которые являются биологическими переносчиками этого заболевания. Болезнь Шагаса относится к группе забытых тропических болезней, внесенных в список Всемирной организации здравоохранения, и представляет собой значительную экономическую и социальную проблему в Латинской Америке. По оценкам эпидемиологических исследований, 8 миллионов человек во всем мире живут с болезнью Шагаса и более 10 000 смертей в год. Эти цифры иллюстрируют важность болезни Шагаса как проблемы общественного здравоохранения во всем мире. Географическое распространение болезни Шагаса изменилось в последние десятилетия, и многие инфицированные люди в настоящее время проживают в крупных городских районах по всему миру из-за увеличения миграции, в отличие от преимущественно сельских районов Латинской Америки, где онабыла первоначально обнаружена.
Стадии развития T. cruzi различаются на протяжении всего его жизненного цикла, который может быть полностью воспроизведен in vitro. Эпимастиготы являются репликативными формами в векторе насекомых и имеют сферическое ядро в центральной области тела клетки и кинетопласт в форме стержня (структура, содержащая митохондриальную ДНК, уникальная для кинетопластид) в передней области относительно ядра, со свободным жгутиком. Трипомастиготы являются инфекционной, нерепликативной формой и имеют удлиненное ядро, закругленный задний кинетопласт и жгутик, прикрепленный к плазматической мембране по всей длине паразита. Амастиготы являются внутриклеточной репликативной формой; Они имеют ядро в центральной области, палочковидный кинетопласт в передней части тела клетки и редуцированный жгутик. Приспособляемость паразита к различным условиям окружающей среды является отражением этих морфологических вариаций. Стоит также упомянуть, что этот жизненный цикл включает в себя симметричное деление и различные переходные стадииразвития13. Во время дифференцировки цитоскелет трипаносоматид играет решающую роль. Эта структура образована корсетом субпелликулярных микротрубочек, расположенных в упорядоченном массиве стабильных микротрубочек ниже плазматической мембраны. Кроме того, у этих организмов присутствует парафлагеллярный стержень, который представляет собой решетчатую структуру, идущую параллельно и прикрепленную к жгутиковой аксонеме14. Точная организация цитоскелета и ядерные структурные изменения на этапах клеточного цикла включают уникальные механизмы регуляции генов, специфичные для трипаносоматид, что делает их интересными моделями для исследований клеточной биологии.
Учитывая небольшие размеры T. cruzi и других простейших паразитов, U-ExM представляет собой отличный инструмент для анализа структурных особенностей этих важных патогенов. Как упоминалось ранее, применимость этой методики к T. cruzi была впервые подтверждена доктором Алонсо7. В этом отчете подробно описан полный протокол U-ExM с акцентом на иммунолокализацию белков цитоскелета на различных стадиях жизненного цикла T. cruzi. Кроме того, мы оптимизировали использование N-гидроксисукцинимидного эфира (NHS), пан-протеомной метки, которая позволяет нам маркировать различные структуры паразитов. Кроме того, описана методика in vitro для получения трех стадий паразита.
протокол
ПРИМЕЧАНИЕ: На рисунке 1 показан полный план эксперимента.
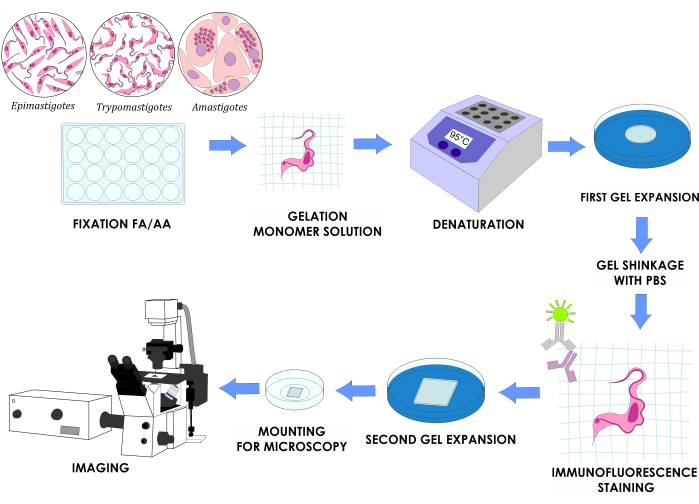
Рисунок 1: Рабочий процесс U-ExM для трех стадий жизненного цикла T. cruzi in vitro. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
1. Подготовка покровного стекла с поли-D-лизиновым покрытием
- Поместите квадрат пленки размером 10 см х 10 см в чашку Петри. Промойте покровные стекла, погрузив их в абсолютный этанол в стеклянную чашку Петри диаметром 35 мм.
- Снимите покровные стекла пинцетом с ванны с этанолом и слейте лишнюю жидкость с помощью папиросной бумаги. Поместите покровные стекла поверх герметизирующей пленки.
- Впитайте оставшуюся часть этанола с помощью бумаги для микроскопии. Добавьте 0,1% v/v раствор поли-D-лизина в центр покровного стекла и распределите его кончиком, чтобы покрыть примерно 80% его поверхности. Закройте чашку Петри и выдерживайте в течение 1 часа при температуре 37 °C.
ПРИМЕЧАНИЕ: Для2 покровных стекол диаметром 22 мм используйте 200 μл раствора поли-D-лизина; для круглых покровных крышек 12 мм используйте 100 мкл раствора поли-D-лизина. - Промойте покровные стекла ультрачистой водой три раза. Используйте аспирацию с пылесосом для удаления воды между каждой стиркой. Хранить при температуре 4 °C до 1 недели.
2. Приготовление раствора
- Приготовьте стоковые растворы из 38% (масс./мас.) акрилата натрия (СК).
- Медленно добавьте 19 г SA в 31 мл воды, не содержащей нуклеаз, помешивая.
ПРИМЕЧАНИЕ: Этот раствор очень вязкий; Будьте внимательны при пипетировании. - Как только СК полностью растворится, храните его в стерильном контейнере. Держите его при температуре 4 °C и меняйте каждые 6 месяцев.
ПРИМЕЧАНИЕ: SA иногда проявляет признаки загрязнения полиакрилатом натрия в зависимости от марки, что заметно при приготовлении исходного раствора, так как он становится желтоватым и мутным. В этом случае используйте его с осторожностью.
- Медленно добавьте 19 г SA в 31 мл воды, не содержащей нуклеаз, помешивая.
- Приготовьте исходный раствор из 40% (w/v) акриламида (AA) и исходный раствор из 2% (w/v) N'-метиленбисакриламида (BIS). Растворите каждое соединение в ультрачистой воде и отфильтруйте стерильным шприцевым фильтром 0,22 мкм. Хранить в стерильном контейнере при температуре 4 °C.
ВНИМАНИЕ: АА и БИС являются высокотоксичными веществами. Работайте под вытяжным шкафом и используйте надлежащие элементы защиты (перчатки, защитную одежду, маску и защитные очки). - Приготовьте раствор для предотвращения сшивки белков (ЦП), смешав 38 мкл 37% раствора формальдегида (ЖК) с 50 мкл 40% исходного раствора акриламида (стадия 2.2) в 912 мкл фосфатно-солевого буфера (PBS; Таблица 1) Получить конечную концентрацию 1,4% формальдегида и 2% акриламида.
ПРИМЕЧАНИЕ: Всегда готовьте раствор CP свежим и будьте предельно точны при пипетировании. Например, используйте пипетку P1000 для забора 900 μл PBS и пипетку P20 для забора оставшихся 12 μл PBS. - Приготовьте мономерный раствор
ПРИМЕЧАНИЕ: Не используйте раствор сразу после приготовления; хранить при температуре -20 °C не менее 24 часов перед использованием.- Смешайте 500 мкл 38% раствора SA (шаг 2.1), 250 μл 40% раствора AA и 50 μл раствора BIS (шаг 2.2), а также 100 μл 10x PBS (Таблица 1).
- Распределите этот конечный объем 900 мкл в 10 микроцентрифужных пробирках по 1,5 мл по 90 мкл мономерного раствора каждая. Хранить при температуре -20 °C до 2 недель.
ПРИМЕЧАНИЕ: Раствор SA может оставаться на кончике при пипетировании, потому что он очень вязкий; Будьте осторожны и выдавайте все.
- Приготовьте денатурирующий раствор
- Смешайте 114,3 мл 350 мМ раствора додецилсульфата натрия (SDS), приготовленного в ультрачистой воде, с 10 мл 4 М раствора натрия хлорида, приготовленного в сверхчистой воде. Добавьте 12 г триса, помешивая, в стакан объемом 250 мл.
ВНИМАНИЕ: SDS очень токсичен; Используйте его под вытяжным шкафом в перчатках, защитной одежде, маске и защитных очках. - Отрегулируйте pH до 9 с помощью концентрированного раствора соляной кислоты. Смешайте до 200 мл сверхчистой воды и храните в стерильной колбе при температуре 4 °C.
- Смешайте 114,3 мл 350 мМ раствора додецилсульфата натрия (SDS), приготовленного в ультрачистой воде, с 10 мл 4 М раствора натрия хлорида, приготовленного в сверхчистой воде. Добавьте 12 г триса, помешивая, в стакан объемом 250 мл.
- Приготовьте 10% раствор персульфата аммония (APS) и 10% раствор TEMED.
- Растворите 0,1 г APS в 1 мл сверхчистой воды.
- Приготовьте 1 мл 10% раствора TEMED в ультрачистой воде.
- Приготовьте по 100 мкл аликвот обоих растворов в микроцентрифужных стерильных пробирках объемом 1,5 мл и храните их при температуре -20 °C до 1 месяца.
- Приготовьте раствор параформальдегида.
- Растворите 2 г параформальдегида в 40 мл PBS при перемешивании при 60 °C. Добавляйте 1 М NaOH по каплям, пока раствор не превратится из белого в бесцветный.
ВНИМАНИЕ: Формальдегид очень токсичен; Используйте его под вытяжным шкафом в перчатках, защитной одежде, маске и защитных очках. - Охладите раствор до комнатной температуры и отрегулируйте pH с помощью NaOH до 7,2 в конечном объеме 50 мл. Отфильтровать стерильным шприцевым фильтром 0,22 мкм и хранить в стерильном контейнере.
- Приготовьте аликвоты по 1 мл в стерильных микроцентрифужных пробирках объемом 1,5 мл и храните при температуре -20 °С.
- Растворите 2 г параформальдегида в 40 мл PBS при перемешивании при 60 °C. Добавляйте 1 М NaOH по каплям, пока раствор не превратится из белого в бесцветный.
- Приготовьте раствор параформальдегида/глутаральдегида.
- Добавьте 0,2 г параформальдегида в 3,5 мл ультрачистой воды и 50 мкл 16 М раствора NaOH. Нагрейте раствор до 60 °C, чтобы растворить параформальдегид.
- Остудите и добавьте 300 мкл 70% глутаральдегида. Увеличьте объем до 5 мл с помощью ультрачистой воды и, наконец, до 10 мл с помощью PBS.
ВНИМАНИЕ: Параформальдегид и глутаральдегид обладают высокой токсичностью; Используйте их под вытяжным шкафом в перчатках, защитной одежде, маске и защитных очках. - Приготовьте аликвоты по 1 мл в стерильных микроцентрифужных пробирках объемом 1,5 мл и храните при температуре -20 °С.
3. Подготовка культур от паразитов
- Выращивайте T. cruzi epimastigotes.
- Используйте аксеническую культуру в колбе Т-25 (площадь роста 25см2 ) и поддерживайте культуры в логарифмической фазе путем субкультивирования каждые 48-72 ч в среде для инфузии печени триптозы (LIT) с 10% сывороткой плода телят (FCS; Таблица 1).
- Убедитесь, что крышка надежно закрыта, и держите колбу с культурой вертикально при температуре 28 °C для инкубации. Контролируйте рост паразитов путем подсчета клеток в камере Нейбауэра во время каждой субкультуры.
Примечание: Для штамма Dm28c, используемого в этом исследовании, концентрация эпимастигот в культурах логарифмической фазы составляет от 1 до 5 x 107 паразитов/мл. - Приготовьте суспензию 2 х10 6 эпимастигот/мл из логарифмической культуры в среде ЛИТ с добавлением 10% FCS. Центрифугируйте суспензию при давлении 5 000 x g в течение 10 минут при комнатной температуре (RT). Промойте PBS один или два раза и снова суспендируйте в 200 мкл PBS.
- Приклейте к круглому покровному стекло толщиной 12 мм, предварительно покрытому поли-D-лизином (секция 1). Инкубировать при RT в течение 15-20 мин. Перейдите к шагу по предотвращению сшивки (раздел 4).
ПРИМЕЧАНИЕ: В качестве альтернативы можно зафиксировать эпимастиготы холодным метанолом в течение 7 минут или раствором параформальдегида/глутаральдегида (шаг 2.8) в течение 10 минут при температуре RT до прилипания паразитов к покровному листу. Возможно хранение неподвижных паразитов при температуре 4 °C до 1 недели.
- Получите амастиготы из инфицированных клеток Vero.
- Положите стерильный круглый покровный лист диаметром 12 мм на дно 24-луночного планшета для культивирования тканей. Приготовьте суспензию 2 x 105 клеток Vero/мл в модифицированной среде Dulbecco Eagle (DMEM) с добавлением 2% эмбриональной телячьей сыворотки (FCS). Семян 500 мкл суспензии на лунку.
ПРИМЕЧАНИЕ: В этом исследовании используется DMEM с 2% FCS, чтобы позволить клеткам расти медленнее. - Инкубировать в течение ночи (ON; 12-16 ч) при 37 °C и 5%CO2 для обеспечения прикрепления клеток.
- После инкубации клетки дважды промыть, используя 500 мкл стерильного PBS. Добавляйте трипомастиготы T. cruzi в клетки при кратности инфекции (MOI) 10 на 100 мкл DMEM с 2% FCS на лунку, что соответствует одному миллиону трипомастигот на лунку. Инкубировать при 37 °C и 5%CO2 в течение 6 часов.
- После инкубации дважды промойте планшеты PBS. Добавьте 500 мкл DMEM с добавлением 2% FCS. На этом этапе перейдите к шагу предотвращения сшивки (раздел 4).
ПРИМЕЧАНИЕ: Интрацитоплазматические амастиготы будут видны через инвертированный оптический микроскоп через 2 дня после заражения (дополнительный рисунок 1). В качестве альтернативы трипомастиготы можно зафиксировать холодным метанолом в течение 7 мин при -20 °C или параформальдегидом/глутаральдегидом в течение 10 мин при RT, до прилипания паразитов к покровному стеклу.
- Положите стерильный круглый покровный лист диаметром 12 мм на дно 24-луночного планшета для культивирования тканей. Приготовьте суспензию 2 x 105 клеток Vero/мл в модифицированной среде Dulbecco Eagle (DMEM) с добавлением 2% эмбриональной телячьей сыворотки (FCS). Семян 500 мкл суспензии на лунку.
- Получение трипомастиготов из инфицированных клеток Vero.
- Соберите надосадочную жидкость монослоя клеток Vero (30%-40% слияние), зараженного трипомастиготами (MOI 1:10; На инкубации) через 4 дня после заражения.
ПРИМЕЧАНИЕ: Для колбы Т-25 используемая начальная концентрация клеток Vero составляет 800 000 клеток, а для колбы Т-75 - два миллиона клеток. - Определение концентрации трипомастиготы с помощью камеры Нейбауэра для подсчета клеток. Центрифуга 4 x 106 трипомастигот при 7 000 x g при RT в течение 10 мин.
- Дважды промойте PBS и повторно суспендируйте в 200 мкл PBS. Нанесите на круглый покровный лист толщиной 12 мм, покрытый поли-D-лизином (раздел 1). Инкубировать в течение 10-15 минут при RT. Приступайте к этапу профилактики сшивки (раздел 4).
ПРИМЕЧАНИЕ: В качестве альтернативы зафиксируйте трипомастиготы холодным метанолом в течение 7 минут при -20 °C или параформальдегидом/глутаральдегидом в течение 10 минут при RT до прилипания паразитов к покровному стеклу.
- Соберите надосадочную жидкость монослоя клеток Vero (30%-40% слияние), зараженного трипомастиготами (MOI 1:10; На инкубации) через 4 дня после заражения.
4. Выполнение профилактики сшивки (ДЕНЬ 1)
- Погрузите покровное стекло диаметром 12 мм с прилипшими паразитами или инфицированными клетками (лицевой стороной вверх) в 24-луночный планшет с 0,5 мл раствора CP (шаг 2,3) в каждую лунку.
- Заполните пустые лунки водой, чтобы уменьшить испарение. Заклейте пластину герметизирующей пленкой. Выдерживать в течение 5 ч при 37 °C. Этот этап может быть продлен до инкубации ON при 4 °C.
ПРИМЕЧАНИЕ: Всегда погружайте покровное стекло в раствор; Не наносите фиксирующий раствор пипеткой на покровные стекла.
5. Выполнение гелеобразования образца
- Соберите влажную камеру в чашке Петри с запечатывающей пленкой поверх папиросной бумаги (рисунок 2А). Добавьте воду в папиросную бумагу и выдерживайте при температуре -20 °C в течение 20 минут, чтобы остыть. Разморозьте аликвоту TEMED и APS на льду в течение 20 минут (шаг 2.6).
ПРИМЕЧАНИЕ: Не замораживайте-размораживая APS более трех раз. - Положите прохладную влажную камеру на лед (рисунок 2А). Выньте из инкубатора планшет на 24 лунки, приготовленный в секции 4. Отсадите раствор CP с помощью пипетки Пастера объемом 3 мл, оставляя немного раствора, иначе покровные стекла будет трудно удалить.
- Снимите пинцетом 12 мм покровные стекла с фиксирующего раствора и разложите их на папиросной бумаге паразитами вверх.
ПРИМЕЧАНИЕ: Полезно использовать стерильную иглу, чтобы поднять покровную крышку, а затем удерживать ее пинцетом. - К аликвоте 90 мкл мономерного раствора (шаг 2.4) добавить 5 мкл TEMED и 5 мкл ранее размороженного APS. Перемешивать вихревым миксером не более 2-3 с; Закрывать трубку крышкой не нужно.
ПРИМЕЧАНИЕ: Всегда добавляйте TEMED первым, а APS последним. Добавление сначала APS и TEMED в последний раз в мономерный раствор ускоряет процесс гелеобразования, не оставляя времени на манипуляции. - Быстро нанесите одну каплю объемом 35 мкл на уплотнительную пленку влажной камеры для каждого покровного стекла. Сразу же поднимите покровный лист пинцетом и положите на каплю (рисунок 2Б) паразитами вниз.
ПРИМЕЧАНИЕ: Сделайте не более двух конвертов за один раз; Очень важно не затягивать с этим шагом, потому что раствор очень быстро полимеризуется. - Инкубируйте влажную камеру в течение 5 минут на льду, а затем в течение 1 часа при температуре 37 °C. Включите нагревательный блок на 95 °C, чтобы обеспечить правильную температуру для следующего шага.
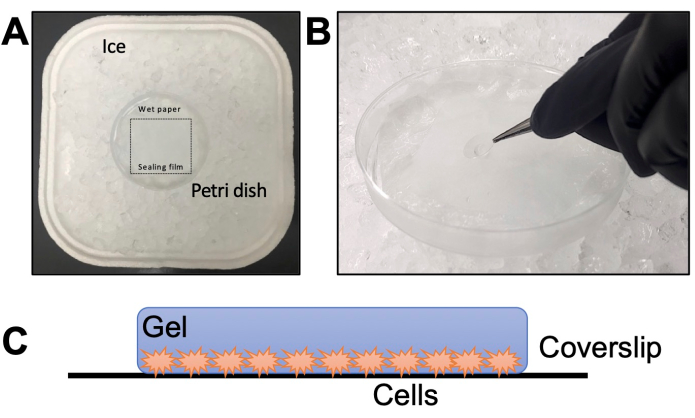
Рисунок 2: Детали этапа гелеобразования. (A) Сборка влажной камеры. (B) Опускание покровных стекол на раствор мономера с TEMED и APS для гелеобразования. (C) Схематическое изображение геля, собранного для визуализации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
6. Денатурация гелеобразных образцов и выполнение изотропного расширения
- Удалите раствор для денатурации (шаг 2,5) с температуры 4 °C. Если он выпал в осадок, поставьте его на водяную баню с горячей водой до полного растворения.
- Добавьте по 2 мл денатурирующего раствора в каждую лунку 6-луночного планшета. Перенесите покровные стекла с шага 5.3 на пластину с раствором для денатурации. Инкубировать в течение 15 минут при РТ с легким встряхиванием, чтобы гель отделился от покровного стекла.
- Осторожно переложите гель (сняв его с покровного стекла 12 мм) металлическим шпателем в стерильную микроцентрифужную пробирку объемом 1,5 мл с 1 мл денатурирующего раствора. Используйте колпачковые замки для фиксации пробирок. Выдерживать в течение 1 ч 30 мин при температуре 95 °C в нагревательном блоке.
ПРИМЕЧАНИЕ: На этом этапе гели начинают расширяться; Будьте осторожны при переносе геля в микроцентрифужную пробирку объемом 1,5 мл.
ВНИМАНИЕ: После инкубации температура в пробирке, содержащей гель, составляет 95 °C, что может быть опасно. Используйте защитные перчатки и дайте трубкам остыть, прежде чем брать их в руки, чтобы избежать ожогов и выступов. - Выполнение первого раунда расширения
- Отсадите денатурирующий раствор из микроцентрифужной пробирки объемом 1,5 мл с гелем с помощью пипетки P1000. Перенесите гель из микроцентрифужной пробирки объемом 1,5 мл в чашку Петри с 10 мл сверхчистой воды в течение 30 минут с помощью небольшого шпателя.
- Замените сверхчистую воду с помощью одноразовой пипетки Пастера объемом 3 мл. Incubate ON в RT.
ПРИМЕЧАНИЕ: Будьте осторожны с гелями, потому что после первых 30 минут инкубации они стали хрупкими. - Смените сверхчистую воду с помощью одноразовой пипетки Пастера объемом 3 мл еще раз.
ПРИМЕЧАНИЕ: Достаточно трех водных инкубаций по 30 минут каждая, но для практичности лучше оставить вторую инкубацию включенной.
7. Выполнение флуоресцентного мечения целевых белков (ДЕНЬ 2)
- Удалите воду из чашки Петри с помощью геля с помощью одноразовой пипетки Пастера объемом 3 мл. Измерьте диаметр геля с помощью штангенциркуля, чтобы рассчитать расширение (от четырех до пяти раз).
- Дважды умыться 10 мл PBS в течение 15 минут. Разрежьте гель лезвием бритвы на квадраты размером примерно 10 мм х 10 мм в центре круглого геля. Используйте один квадрат для каждого тестируемого условия.
ПРИМЕЧАНИЕ: Гель сжимается после инкубации PBS. Гели могут храниться в PBS при температуре 4 °C до 1 недели. - Переложите каждый квадрат в 12-луночный планшет и инкубируйте с 500 мкл первичного антитела, разведенного в 2% PBS-бычьем сывороточном альбумине (BSA) в течение 2 ч 30 мин при 37 °C с встряхиванием.
ПРИМЕЧАНИЕ: Инкубация альтернативных антител может быть выполнена при 4 °C. Минимальный объем антитела, который можно использовать, составляет 300 мкл в 24-луночном планшете. Как правило, используйте в два раза большую концентрацию антител, чем для обычного иммуномечения. - Трижды промыть 2 мл PBS с 0,1% полисорбатом 20 в течение 10 минут, встряхивая в 6-луночной тарелке.
- Переложите гель в 12-луночный планшет и инкубируйте с 500 мкл вторичного антитела в PBS с DAPI и 10 мкг/мл NHS-эфира, конъюгированного с нужным флуорофором, в течение 2 ч 30 мин при 37 °C с легким встряхиванием.
ПРИМЕЧАНИЕ: Как правило, используйте в два раза больше концентраций антител, чем для обычного иммуномечения. В качестве альтернативы эту инкубацию можно проводить при температуре 4 °C. - Трижды промыть 2 мл PBS с 0,1% полисорбатом 20 в течение 10 минут, встряхивая в 6-луночной тарелке.
- Переложите гель в чашку Петри со сверхчистой водой. Выдерживать в течение 30 минут. Дважды смените воду с помощью одноразовой пипетки Пастера объемом 3 мл, как это сделано в шаге 6.4.
8. Визуализация и обработка изображений (ДЕНЬ 3)
- Удалите воду из чашек Петри с помощью одноразовой пипетки Пастера объемом 3 мл и измерьте диаметр геля штангенциркулем для расчета коэффициента расширения.
- Отрежьте небольшой кусочек размером ~10 мм x 10 мм лезвием бритвы и положите его на блюдо со стеклянным дном 35 мм.
ПРИМЕЧАНИЕ: В качестве альтернативы поместите гель между предметным стеклом и покровным стеклом (без поли-D-лизина). Предметное стекло должно иметь две меньшие части предметного стекла, разрезанные алмазным ножом, прикрепленными по бокам, чтобы сформировать камеру толщиной примерно с гелем. - Проверьте ориентацию при 10-кратном или 20-кратном увеличении. Чтобы правильно сосредоточиться, убедитесь, что паразиты находятся лицом к покровному листу; в противном случае нужно перевернуть гель и снова проверить (Рисунок 2C).
- Как только будет найдена правильная ориентация, высушите оставшийся гель бумагой для микроскопии. Накройте гель покровным стеклом с покрытием из поли-D-лизина.
- Добавьте в гель небольшую каплю сверхчистой воды для визуализации с помощью конфокального микроскопа.
ПРИМЕЧАНИЕ: Для обеспечения правильной визуализации крайне важно поддерживать ориентацию геля на протяжении всего процесса, чтобы сторона геля, содержащего клетки рядом с его поверхностью, была обращена к чашке со стеклянным дном в конце. При использовании посуды диаметром 35 мм добавление поли-D-лизина в покровное стекло, расположенное на дне, уменьшает смещение геля во время получения изображения. - Параметры получения изображения
- Визуализируйте образцы в конфокальный микроскоп (Таблица материалов) с помощью объектива с 63-кратным погружением в масло с числовой апертурой 1,4.
- Получите стеки Z, ширину каждого шага z и время экспозиции на пиксель, которые будут определены опытным путем в зависимости от выборки, интенсивности сигнала и оптимизации времени сбора. При желании используйте скан-зум для эффективного увеличения.
- Откройте стек Z с помощью программного обеспечения для обработки изображений (Таблица материалов). Для каждого канала сгруппируйте сложенные изображения с помощью опции «Сгруппировать Z-проект ». Выберите проекцию максимальной интенсивности.
- Чтобы объединить изображения, используйте инструмент «Объединить каналы » и выберите цвет каждого канала. Добавьте масштабную линейку с помощью инструмента «Масштабная линейка » в программном обеспечении для обработки.
ПРИМЕЧАНИЕ: В качестве альтернативы можно раскрасить каждый канал по своему усмотрению (см. примеры в репрезентативных результатах).
Результаты
Если протокол был выполнен правильно (Рисунок 1), образцы будут видны в виде плоского и полупрозрачного геля, который может быть увеличен в воде до 4-4,5 раз (Рисунок 3A). Это расширение обеспечило эффективное разрешение около 70 нм, которое м...
Обсуждение
Ультраструктурная экспансионная микроскопия — это метод, который позволяет получать изображения биологических образцов с высоким разрешением путем их физического расширения в несколько раз по сравнению с первоначальным размером. Протокол U-ExM включает в себя неско...
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Мы благодарим Долорес Кампос за помощь в культивировании клеток Vero и Ромину Манарин за помощь в культивировании T. cruzi . Эта работа была поддержана Национальным агентством по продвижению науки и технологий (Agencia Nacional de Promoción Científica y Tecnológica), Ministerio de Ciencia e Innovación Productiva из Аргентины (PICT2019-0526), Consejo Nacional de Investigaciones Científicas y Técnicas (PIBAA 1242) и Исследовательским советом Соединенного Королевства [MR/P027989/1].
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 micrometers sterile syringe filters PES | Membrane solutions | SFPES030022S | |
| 1 L beaker | Schott Duran | 10005227 | |
| 1.5-mL SPINWIN Micro Centrifuge Tube | Tarson | T38-500010 | |
| 10 mL disposable sterile serynge | NP | 66-32 | |
| 10 mL serological pipette sterile | Jet Biofil | GSP211010 | |
| 12-mm coverslips | Merienfeld GmbH | 01 115 20 | Round coverslips |
| 12-well plates | Jet Biofil | TCP011012 | |
| 22-mm coverslips | Corning | 2845-22 | Square coverslips |
| 24-well plates | Jet Biofil | TCP-011-024 | |
| 250 mL beaker | Schott Duran | C108.1 | |
| 3 mL Pasteur pipette | Deltalab | 200037 | |
| 35-mm glass bottom dishes | Matsunami glass ind | D11130H | |
| 4′,6-Diamidine-2′-phenylindole dihydrochloride | Sigma Aldrich | D9542 | DAPI |
| 5 ml serological pipette sterile | Jet Biofil | GSP010005 | |
| 6-well plates | Sarstedt | 83.3920 | |
| Acrilamide | BioRad | 1610101 | |
| Ammonium persulfate | Sigma Aldrich | A3678-25G | APS |
| ATTO 647 NHS ester | BOC Sciences | F10-0107 | For pan-proteome labelling |
| Biosafty Cabinet | Telstar | Bio II A/P | |
| Bovine Sodium Albumine | Sigma Aldrich | A7906 | BSA |
| CO2 Incubator | Sanyo | MCO-15A | |
| Confocal Microscope | Zeiss | LSM 880 | |
| Disposable Petridish | Tarsons | 460095 | 90 mm diameter |
| DMEM, High Glucose | Thermo Fisher Cientific | 12100046 | Powder |
| Electronic digital caliper | Radar | RADAR-SLIDE-CALIPER | |
| Ethanol Absolute | Supelco | 1,00,98,31,000 | |
| Fetal Calf Serum | Internegocios SA | FCS FRA 500 | Sterile and heat-inactivated |
| Fiji image processing package | ImageJ | doi:10.1038/nmeth.2019 | |
| Formaldehyde 37% | Sigma Aldrich | F8775 | FA |
| Glass Petridish | Marienfeld Superior | PM-3400300 | 60 mm diameter |
| Glucosa D(+) | Cicarelli | 716214 | |
| Glutaraldehyde 70% | Sigma Aldrich | G7776 | |
| Goat anti-Mouse IgG Secondary Antibody Alexa Fluor 555 | Invitrogen | A-21422 | |
| Goat anti-Rabbit IgG Secondary Antibody FICT | Jackson Immunoresearch | 115-095-003 | |
| Graduated cylinder | Nalgene | 3663-1000 | |
| Graduated glass flask | Glassco | GL-274.202.01 | 100 mL |
| Heating Block | IBR | Made in house | |
| Hemin | Frontier Scientific | H651-9 | |
| Hydrochloric acid 36.8-38.0% | Ciccarelli | 918110 | |
| Ice bucket | Corning | 1167U68 | |
| Incubator | Tecno Dalvo | TOC130 | |
| Liver Infusion | Difco | 226920 | |
| Magnetic stirrer and heater | Lab companion | HP-3000 | |
| Metal spatula | SALTTECH | 200MM | |
| Metal tweezers | Marienfeld Superior | PM-6633002 | |
| Methanol absolut | Cicarelli | 897110 | |
| Microcentrifuge tube 1.5 mL | Tarson | 500010-N | |
| Microscopy grade paper KimWipes | Kimtech Science | B0013HT2QW | |
| Milli-Q water sistem | Merk Millipore | IQ-7003 | |
| mouse anti- alpha tubulin clone DM1A | Sigma Aldrich | T9026 | |
| mouse anti-PFR | Purified antibodies | Donated by Dr. Ariel Silber (USP) | |
| N,N´-methylenbisacrilamide | ICN | 193997 | BIS |
| Na2HPO4 | Cicarelli | 834214 | |
| Neubauer chamber | Boeco | BOE 01 | |
| p1000 pipette | Gilson | PIPETMAN P1000 | |
| p1000 pipette tips | Tarson | TAR-521020B | |
| p20 pipette | Gilson | PIPETMAN P20 | |
| p20 pipette tips | Tarson | TAR-527108 | |
| p200 pipette | Gilson | PIPETMAN P200 | |
| p200 pipette tips | Tarson | TAR-521010Y | |
| Paraformaldehyde | Sigma Aldrich | P6148 | PFA |
| pH / ORP / °C meter | HANNA Instruments | HI 2211 | |
| Poly-D-Lysine 0.1% | Sigma Aldrich | P8920 | |
| Potassium Chloride | Cicarelli | 867212 | KCl |
| Razor blade | Printex | BS 2982:1992 | |
| Sealing FIlm "Parafilm M" | Bemis | PM996 | |
| Sodium Acrilate | Sigma Aldrich | 408220-25G | SA |
| Sodium Bicarbonate | Cicarelli | 929211 | NaHCO3 |
| Sodium Chloride | Cicarelli | 750214 | NaCl |
| Sodium Dodecyl Sulfate | BioRad | 1610302 | SDS |
| Sodium Hidroxide | Merk | 1-06498 | NaOH |
| Sorvall ST 16 Centrifuge | Thermo Fisher Scientific | 75004380 | |
| T-25 flasks | Corning | 430639 | |
| TEMED | Invitrogen | 15524-010 | |
| Tissue paper | Elite | ||
| Triptose | Merck | 1106760500 | |
| Tris | BioRad | 1610719 | |
| Tween-20 | Biopack | 2003-07 | Polysorbate 20 |
| Vaccum pump | Silfab | N33-A | |
| Vero cells | ATCC | CRL-1587 | |
| Vortex MIxer | Dragon Lab | MX-S |
Ссылки
- Chen, F., Tillberg, P. W., Boyden, E. S. Expansion microscopy. Science. 347 (6221), 543-548 (2015).
- Chozinski, T. J., et al. Expansion microscopy with conventional antibodies and fluorescent proteins. Nature Methods. 13 (6), 485-488 (2016).
- Ku, T., et al. Multiplexed and scalable super-resolution imaging of three-dimensional protein localization in size-adjustable tissues. Nature Biotechnology. 34 (9), 973-981 (2016).
- Gambarotto, D., et al. Imaging cellular ultrastructures using expansion microscopy (U-ExM). Nature Methods. 16 (1), 71-74 (2018).
- Tillberg, P. W., Chen, F. Expansion microscopy: Scalable and convenient super-resolution microscopy. Annual Review of Cell and Developmental Biology. 35, 683-701 (2019).
- Jurriens, D., van Batenburg, V., Katrukha, E. A., Kapitein, L. C. Mapping the neuronal cytoskeleton using expansion microscopy. Methods in Cell Biology. 161, 105-124 (2021).
- Alonso, V. L. Ultrastructure expansion microscopy (U-ExM) in Trypanosoma cruzi: localization of tubulin isoforms and isotypes. Parasitology Research. 121 (10), 3019-3024 (2022).
- Kalichava, A., Ochsenreiter, T. Ultrastructure expansion microscopy in Trypanosoma brucei. Open Biology. 11 (10), 210132 (2021).
- Amodeo, S., et al. Characterization of the novel mitochondrial genome segregation factor TAP110 in Trypanosoma brucei. Journal of Cell Science. 134 (5), (2021).
- Liffner, B., Absalon, S. Expansion microscopy reveals plasmodium falciparum blood-stage parasites undergo anaphase with a chromatin bridge in the absence of mini-chromosome maintenance complex binding protein. Microorganisms. 9 (11), 2306 (2021).
- Dos Santos Pacheco, N., Soldati-Favre, D. Coupling auxin-inducible degron system with ultrastructure expansion microscopy to accelerate the discovery of gene function in Toxoplasma gondii. Methods in Molecular Biology. 2369, 121-137 (2021).
- Lidani, K. C. F., et al. Chagas disease: From discovery to a worldwide health problem. Frontiers in Public Health. 7, 166 (2019).
- Carrea, A., Diambra, L. Systems biology approach to model the life cycle of Trypanosoma cruzi. PloS One. 11 (1), e0146947 (2016).
- Vidal, J. C., De Souza, W. . Morphological and Functional Aspects of Cytoskeleton of Trypanosomatids. Cytoskeleton - Structure, Dynamics, Function and Disease. , (2017).
- Kunz, T. C., Götz, R., Gao, S., Sauer, M., Kozjak-Pavlovic, V. Using expansion microscopy to visualize and characterize the morphology of mitochondrial cristae. Frontiers in Cell and Developmental Biology. 8, 617 (2020).
- Laporte, M. H., Klena, N., Hamel, V., Guichard, P. Visualizing the native cellular organization by coupling cryofixation with expansion microscopy (Cryo-ExM). Nature Methods. 19 (2), 216-222 (2022).
- Sahabandu, N., et al. Expansion microscopy for the analysis of centrioles and cilia. Journal of Microscopy. 276 (3), 145-159 (2019).
- Wen, G., Leen, V., Rohand, T., Sauer, M., Hofkens, J. Current progress in expansion microscopy: chemical strategies and applications. Chemical Reviews. 123 (6), 3299-3323 (2023).
- Trinks, N., et al. Subdiffraction-resolution fluorescence imaging of immunological synapse formation between NK cells and A. fumigatus by expansion microscopy. Communications Biology. 4 (1), 1151 (2021).
- White, B. M., Kumar, P., Conwell, A. N., Wu, K., Baskin, J. M. Lipid expansion microscopy. Journal of the American Chemical Society. 144 (40), 18212-18217 (2022).
- Steib, E., et al. TissUExM enables quantitative ultrastructural analysis in whole vertebrate embryos by expansion microscopy. Cell Reports Methods. 2 (10), 100311 (2022).
- Shaib, A. H., et al. Visualizing proteins by expansion microscopy. bioRxiv. , (2023).
- M'Saad, O., et al. All-optical visualization of specific molecules in the ultrastructural context of brain tissue. bioRxiv. , (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены