需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
克氏锥虫体外生命周期三个阶段的超微结构扩展显微镜
* 这些作者具有相同的贡献
摘要
这项研究显示了在导致美洲锥虫病的病原体克氏锥虫的三个体外生命周期阶段进行超微结构扩增显微镜检查的详细方案。我们包括用于细胞骨架蛋白和泛蛋白质组标记的优化技术。
摘要
我们在这里描述了超微结构扩展显微镜 (U-ExM) 在 克氏锥虫中的应用,该技术可以提高细胞或组织的空间分辨率以进行显微镜成像。这是通过使用现成的化学品和常见的实验室设备对样品进行物理扩增来实现的。
美洲锥虫病是由 克氏锥虫引起的广泛而紧迫的公共卫生问题。该病在拉丁美洲很普遍,由于移民增加,该病已成为非流行地区的一个重大问题。 T. cruzi 的传播是通过属于 Reduviidae 和 Hemiptera 家族的噬血昆虫媒介发生的。感染后, T. cruzi 无毛体在哺乳动物宿主体内繁殖并分化为锥鞭毛体,即非复制性血流形式。在昆虫媒介中,锥鞭毛体转化为上鞭毛体并通过二元裂变增殖。生命周期阶段之间的分化需要对细胞骨架进行广泛的重排,并且可以在实验室中完全使用不同的细胞培养技术进行重建。
我们在这里描述了 U-ExM 在克氏锥虫的三个体外生命周期阶段中应用的详细方案,重点是优化细胞骨架蛋白的免疫定位。我们还优化了 N-羟基琥珀酰亚胺酯 (NHS) 的使用,这是一种泛蛋白质组标记,使我们能够标记不同的寄生虫结构。
引言
Boyden 等人于 2015 年首次描述了扩增显微镜 (ExM) 1。这是一种成像方案,传统显微镜可以通过该方案实现低于衍射极限的空间分辨率。由于样品的物理放大而获得这种更高的分辨率。为了实现这一点,荧光标记的分子与水凝胶交联,随后水凝胶与水凝胶各向同性膨胀。由于这种扩展,信号在所有三个维度上几乎各向同性地分离。该方法采用低成本化学品,使用传统(共聚焦)显微镜可实现约 65 nm 的空间分辨率,大约是共聚焦显微镜标准分辨率(约 250 nm)的四倍1。
使扩增显微镜在许多生物领域的使用成为可能的下一个里程碑是免疫荧光标记与常规抗体的适应2。最初发布的 ExM 方案的另一种改编是蛋白质组的放大分析 (MAP)3。该方法在样品水凝胶浸泡之前引入了高浓度丙烯酰胺和多聚甲醛的使用,以防止蛋白质内部和蛋白质间交联,从而更好地保存样品的蛋白质含量和亚细胞结构。该替代方案经过优化,以通过使用较低浓度的固定剂(甲醛/多聚甲醛和丙烯酰胺)来增强分离细胞器整体超微结构的保守性;这种方法被称为超微结构扩增显微镜 (U-ExM)4。
为了获得更高的分辨率,也有报道称 ExM 与超分辨率显微镜技术(包括受激发射耗竭显微镜或单分子定位显微镜)相结合,以达到低于 20 nm 的分辨率5。
ExM 的使用在神经科学和细胞骨架研究6 领域已得到广泛报道,但只有少数研究对寄生原生生物进行了研究。我们的实验室是第一个报道 U-ExM 在克氏锥虫 7 中的应用的实验室。基础方案主要基于弓形虫、疟原虫 ssp. 和布鲁氏锥虫 8,9,10,11 的先前 U-ExM 报告。
ExM 的最大优势之一是其模块化特性,这为适应不同的生物样品提供了极大的灵活性。该方案可分为多个步骤(如固定、防止交联或凝胶化),用户可以轻松调整以满足其实验要求。此外,可以修改此管道以增强与模式生物的兼容性或实现特定的分辨率。因此,ExM 为先进和非先进光学系统提供了巨大的潜力,确保未来有更广泛的应用。
美洲锥虫病,也称为美洲锥虫病,是由原生动物寄生虫克 氏锥虫引起的拉丁美洲地方病。这种寄生虫的生命周期很复杂,涉及哺乳动物的两个发育阶段和昆虫宿主(锥蝽科的成员)的两个发育阶段,这是这种疾病的生物载体。美洲锥虫病属于世界卫生组织列出的被忽视的热带病组,是拉丁美洲的一个重大经济和社会问题。流行病学研究估计,全世界有 800 万人患有美洲锥虫病,每年有 10,000 多人死亡。这些数字说明了美洲锥虫病作为全球公共卫生问题的重要性。近几十年来,美洲锥虫病的地理分布发生了变化,由于迁移的增加,许多感染者现在居住在全球的大城市地区,而最初发现的拉丁美洲主要是农村地区12。
克氏锥虫的发育阶段在其整个生命周期中都不同,可以完全在体外复制。上鞭毛体是昆虫媒介中的复制形式,它们在细胞体的中央区域有一个球形的细胞核,在相对于细胞核的前部区域有一个条形的动粒体(一种脱粒质体特有的含线粒体 DNA 的结构),具有游离的鞭毛。锥鞭毛体是感染性的、非复制性的形式,具有细长的细胞核、圆形的后部动质体和沿寄生虫的整个长度附着在质膜上的鞭毛。无鞘体是细胞内复制形式;它们在中央区域有一个细胞核,在细胞体的前部有一个杆状动粒体,鞭毛缩小。寄生虫对不同环境的适应性反映了这些形态变化。还值得一提的是,这个生命周期涉及对称划分和不同的过渡发展阶段13。在分化过程中,锥虫的细胞骨架起着关键作用。这种结构是由浆膜下方排列有序的稳定微管阵列的蝶结下微管紧身胸衣形成的。此外,这些生物体中存在鞭毛杆,这是一种平行并连接到鞭毛轴丝14 的晶格状结构。细胞周期阶段的精确细胞骨架组织和核结构变化涉及锥虫特有的独特基因调控机制,使其成为细胞生物学研究的有趣模型。
鉴于 克氏锥 虫和其他原生动物寄生虫的体积小,U-ExM 为分析这些重要病原体的结构特征提供了极好的工具。如前所述,该技术对 克氏锥虫 的适用性由 Alonso7 博士首次验证。本报告详细介绍了完整的 U-ExM 方案,重点是 T. cruzi 不同生命周期阶段细胞骨架蛋白的免疫定位。此外,我们还优化了 N-羟基琥珀酰亚胺酯 (NHS) 的使用,这是一种泛蛋白质组标记,使我们能够标记各种寄生虫结构。此外,还描述了一种获得寄生虫三个阶段的 体外 方法。
研究方案
注意: 图 1 说明了完整的实验设计。
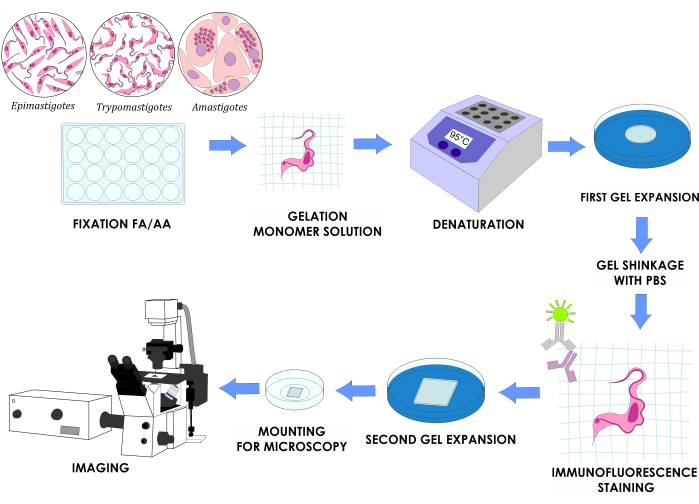
图 1:克氏锥虫三个体外生命周期阶段的 U-ExM 工作流程。请单击此处查看此图的较大版本。
1. 聚-D-赖氨酸包被的盖玻片的制备
- 将 10 cm x 10 cm 见方的密封膜放入培养皿中。通过在 35 mm 玻璃培养皿中用无水乙醇浸泡来清洗盖玻片。
- 用镊子从乙醇浴中取出盖玻片,然后用薄纸排干多余的液体。将盖玻片盖在密封膜上。
- 用显微镜级纸吸收剩余的乙醇。在盖玻片的中心加入 0.1% v/v 多聚-D-赖氨酸溶液,并用尖端涂抹以覆盖其表面的约 80%。关闭培养皿并在 37 °C 下孵育 1 小时。
注:对于 22 mm2 盖玻片,使用 200 μL 聚-D-赖氨酸溶液;对于 12 mm 圆形盖玻片,使用 100 μL 多聚-D-赖氨酸溶液。 - 用超纯水清洗盖玻片 3 次。使用真空抽吸功能去除每次洗涤之间的水分。在 4 °C 下保存长达 1 周。
2. 溶液制备
- 制备 38% (w/w) 丙烯酸钠 (SA) 的储备溶液。
- 一边搅拌,一边缓慢加入 19 g SA 到 31 mL 无核酸酶水中。
注意:该溶液非常粘稠;移液时要注意。 - 一旦 SA 完全溶解,请将其储存在无菌容器中。将其保持在 4 °C 并每 6 个月更换一次。
注:SA 有时会显示出聚丙烯酸钠污染的迹象,具体取决于品牌,这在制备储备液时很明显,因为它会变得淡黄色和混浊。如果是这种情况,请谨慎使用。
- 一边搅拌,一边缓慢加入 19 g SA 到 31 mL 无核酸酶水中。
- 制备 40% (w/v) 丙烯酰胺 (AA) 的储备溶液和 2% (w/v) N,N'-亚甲基双丙烯酰胺 (BIS) 的储备溶液。将每种化合物溶解在超纯水中,并用 0.22 μm 无菌注射器过滤器过滤。储存在 4 °C 的无菌容器中。
注意: AA 和 BIS 是剧毒物质。在通风橱下工作并使用适当的防护元件(手套、防护服、口罩和安全眼镜)。 - 通过将 38 μL 的 37% 甲醛 (FA) 溶液与 50 μL 的 40% 丙烯酰胺储备液(步骤 2.2)混合在 912 μL 磷酸盐缓冲盐水 (PBS; 表 1)获得 1.4% 甲醛和 2% 丙烯酰胺的最终浓度。
注意:始终新鲜制备 CP 溶液,并在移液时保持极其精确。例如,使用 P1000 移液器取 900 μL PBS,使用 P20 移液器取剩余的 12 μL PBS。 - 制备单体溶液
注意:配制后不要立即使用溶液;使用前至少在 -20 °C 下储存 24 小时。- 混合 500 μL 的 38% SA 溶液(步骤 2.1)、250 μL 的 40% AA 溶液和 50 μL 的 BIS 溶液(步骤 2.2),以及 100 μL 的 10x PBS(表 1)。
- 将最终体积的 900 μL 分装在 10x 1.5 mL 微量离心管中,每个管含 90 μL 单体溶液。在 -20 °C 下储存长达 2 周。
注意:移液时 SA 溶液可能会留在吸头上,因为它非常粘稠;小心并分配所有东西。
- 准备变性溶液
- 将 114.3 mL 用超纯水制备的 350 mM 十二烷基硫酸钠 (SDS) 溶液与 10 mL 用超纯水中制备的 4 M 氯化钠溶液混合。加入 12 g Tris,同时在 250 mL 烧杯中搅拌。
注意:SDS 具有剧毒;在通风橱下戴手套、防护服、口罩和安全眼镜使用。 - 用浓盐酸溶液将 pH 值调节至 9。用超纯水定型至 200 mL,并储存在 4 °C 的无菌培养瓶中。
- 将 114.3 mL 用超纯水制备的 350 mM 十二烷基硫酸钠 (SDS) 溶液与 10 mL 用超纯水中制备的 4 M 氯化钠溶液混合。加入 12 g Tris,同时在 250 mL 烧杯中搅拌。
- 制备 10% 过硫酸铵 (APS) 溶液和 10% TEMED 溶液。
- 将 0.1 g APS 溶于 1 mL 超纯水中。
- 在超纯水中制备 1 mL 的 10% TEMED 溶液。
- 在 1.5 mL 微量离心无菌管中制备 100 μL 两种溶液的等分试样,并在 -20 °C 下储存长达 1 个月。
- 制备多聚甲醛溶液。
- 在 60 °C 下搅拌,将 2 g 多聚甲醛溶解在 40 mL PBS 中。 滴加 1 M NaOH,直到溶液由白色变为无色。
注意:甲醛具有剧毒;在通风橱下戴手套、防护服、口罩和安全眼镜使用。 - 在室温下冷却溶液,并用 NaOH 将 pH 值调节至 7.2,最终体积为 50 mL。用 0.22 μm 无菌注射器过滤器过滤并储存在无菌容器中。
- 在 1.5 mL 无菌微量离心管中制备 1 mL 的等分试样,并在 -20 °C 下储存。
- 在 60 °C 下搅拌,将 2 g 多聚甲醛溶解在 40 mL PBS 中。 滴加 1 M NaOH,直到溶液由白色变为无色。
- 制备多聚甲醛/戊二醛溶液。
- 在 3.5 mL 超纯水和 50 μL 16 M NaOH 溶液中加入 0.2 g 多聚甲醛。将溶液加热至 60 °C 以溶解多聚甲醛。
- 冷却并加入 300 μL 的 70% 戊二醛。用超纯水将体积调至 5 mL,最后用 PBS 调至 10 mL。
注意:多聚甲醛和戊二醛具有剧毒;在通风橱下戴手套、防护服、口罩和安全眼镜使用它们。 - 在 1.5 mL 无菌微量离心管中制备 1 mL 的等分试样,并在 -20 °C 下储存。
3. 寄生虫培养物的制备
- 生长 T. cruzi 上鞭毛体。
- 在 T-25 培养瓶(25 cm2 生长区域)中使用轴系培养物,并通过在含有 10% 胎牛血清 (FCS; 表 1)。
- 确保盖子牢固关闭,并将培养瓶垂直保持在 28 °C 进行孵育。在每次传代培养期间,通过在 Neubauer 室中进行细胞计数来监测寄生虫生长。
注:对于本研究中使用的 Dm28c 菌株,对数期培养物中表皮鞭毛体的浓度在 1-5 x 107 个寄生虫/mL 之间。 - 在补充有 10% FCS 的 LIT 培养基中,从对数期培养物中制备 2 x 106 个表鞭毛体/mL 的悬浮液。在室温 (RT) 下以 5,000 x g 离心悬浮液 10 分钟。用 PBS 洗涤一次或两次,然后重悬于 200 μL PBS 中。
- 粘附在先前涂有聚-D-赖氨酸的圆形 12 mm 盖玻片上(第 1 部分)。在 RT 孵育 15-20 分钟。继续执行防交联步骤(第 4 部分)。
注:或者,在寄生虫粘附到盖玻片上之前,在 RT 下用冷甲醇固定上鞭毛体 7 分钟或多聚甲醛/戊二醛溶液(步骤 2.8)10 分钟。可以将固定的寄生虫在 4 °C 下储存长达 1 周。
- 从受感染的 Vero 细胞中获得无鞭毛体。
- 将无菌的 12 mm 圆形盖玻片放在 24 孔组织培养板的底部。在补充有 2% 胎牛血清 (FCS) 的 Dulbecco 改良 Eagle 培养基 (DMEM) 中制备 2 x 105 个 Vero 细胞/mL 的悬浮液。每孔接种 500 μL 悬浮液。
注意:本研究使用含 2% FCS 的 DMEM 来使细胞生长得更慢。 - 在 37 °C 和 5% CO2 下孵育过夜(ON;12-16 小时)以确保细胞附着。
- 孵育后,使用 500 μL 无菌 PBS 洗涤细胞两次。将克 氏锥 虫锥鞭体以 100 μL DMEM 中 10 的感染复数 (MOI) 添加到细胞中,每孔 2% FCS,相当于每孔 100 万个锥鞭毛体。在 37 °C 和 5% CO2 下孵育 6 小时。
- 孵育后,用 PBS 冲洗板两次。加入 500 μL 补充有 2% FCS 的 DMEM。此时,请继续进行防交联步骤(第 4 节)。
注意:感染后 2 天将通过倒置光学显微镜看到胞浆内无鞭毛体(补充图 1)。或者,在寄生虫粘附到盖玻片上之前,在 -20 °C 下用冷甲醇固定锥鞭毛体 7 分钟,或在室温下用多聚甲醛/戊二醛固定 10 分钟。
- 将无菌的 12 mm 圆形盖玻片放在 24 孔组织培养板的底部。在补充有 2% 胎牛血清 (FCS) 的 Dulbecco 改良 Eagle 培养基 (DMEM) 中制备 2 x 105 个 Vero 细胞/mL 的悬浮液。每孔接种 500 μL 悬浮液。
- 从感染的 Vero 细胞中获得锥鞭毛体。
- 收集感染锥鞭毛体的 Vero 细胞单层(30%-40% 汇合)的上清液 (MOI 1:10;ON 孵育期)感染后 4 天。
注:对于 T-25 培养瓶,使用的 Vero 细胞的初始浓度为 800,000 个细胞,而对于 T-75 培养瓶,使用的浓度为 200 万个细胞。 - 使用 Neubauer 室进行细胞计数测定锥鞭毛体浓度。在 RT 下以 7,000 x g 离心 4 x 106 个锥鞭毛体 10 分钟。
- 用 PBS 冲洗两次,然后重悬于 200 μL PBS 中。应用于涂有聚-D-赖氨酸的圆形 12 mm 盖玻片(第 1 部分)。在 RT 中孵育 10-15 分钟。继续进行交联预防步骤(第 4 节)。
注:或者,在寄生虫粘附到盖玻片上之前,在 -20 °C 下用冷甲醇固定锥鞭毛体 7 分钟或在室温下用多聚甲醛/戊二醛固定 10 分钟。
- 收集感染锥鞭毛体的 Vero 细胞单层(30%-40% 汇合)的上清液 (MOI 1:10;ON 孵育期)感染后 4 天。
4. 进行防交联(第 1 天)
- 将 12 mm 盖玻片与粘附的寄生虫或感染细胞(面朝上)浸入 24 孔板中,每个孔中含有 0.5 mL CP 溶液(步骤 2.3)。
- 将空井装满水以减少蒸发。用密封膜密封板。在 37 °C 下孵育 5 小时。 此步骤可延长至 4 °C 的 ON 孵育。
注意:始终将盖玻片浸入溶液中;不要将固定液移液到盖玻片上。
5. 对样品进行凝胶化
- 在培养皿中组装一个潮湿室,并在薄纸上贴上密封膜(图 2A)。向薄纸中加入水,并在 -20 °C 下孵育 20 分钟以冷却。在冰上解冻 TEMED 和 APS 等分试样 20 分钟(步骤 2.6)。
注意: 不要冻融 APS 超过三次。 - 将凉爽潮湿的腔室放在冰上(图 2A)。将第 4 部分中制备的 24 孔板从培养箱中取出。用 3 mL 巴斯德移液管吸出 CP 溶液,留下一些溶液,否则盖玻片将难以去除。
- 用镊子从固定液中取出 12 mm 盖玻片,然后将它们放在薄纸上,寄生虫朝上。
注意:使用无菌针头提起盖玻片,然后用镊子固定它是有帮助的。 - 向 90 μL 单体溶液的等分试样(步骤 2.4)中加入 5 μL TEMED 和 5 μL 先前解冻的 APS。与涡旋混合器混合不超过 2-3 秒;无需用盖子关闭管子。
注意:始终先添加 TEMED,最后添加 APS。在单体溶液中加入 APS first 和 TEMED last 可加快凝胶化过程,无需时间作。 - 为每个盖玻片在潮湿室的密封膜上快速滴一滴 35 μL。立即用镊子拿起盖玻片,放在液滴上(图 2B),寄生虫朝下。
注意:一次最多制作两个盖玻片;关键是不要延迟这一步,因为溶液聚合得非常快。 - 将潮湿室在冰上孵育 5 分钟,然后在 37 °C 下孵育 1 小时。 在 95 °C 下打开加热块,以确保下一步的温度正确。
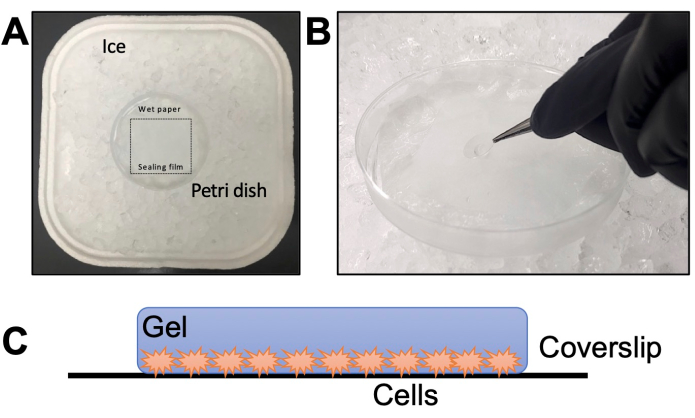
图 2:凝胶化步骤细节。 (A) 潮湿室的组装。(B) 将盖玻片滴到含有 TEMED 和 APS 的单体溶液上进行凝胶化。(C) 为成像而组装的凝胶的示意图。 请单击此处查看此图的较大版本。
6. 使凝胶化样品变性并进行各向同性膨胀
- 从 4 °C 中取出变性溶液(步骤 2.5)。 如果沉淀,请将其放入热水浴中,直至完全溶解。
- 向 6 孔板的每个孔中加入 2 mL 变性溶液。将步骤 5.3 中的盖玻片转移到带有变性溶液的板中。在 RT 下轻轻摇动孵育 15 分钟,使凝胶从盖玻片上分离。
- 用金属刮刀小心地将凝胶(从 12 mm 盖玻片中取出)转移到装有 1 mL 变性溶液的 1.5 mL 无菌微量离心管中。使用帽锁固定试管。在 95 °C 下在加热块中孵育 1 小时和 30 分钟。
注:在此步骤中,凝胶开始膨胀;将凝胶转移到 1.5 mL 微量离心管中时要轻柔。
注意:孵育后,含有凝胶的试管温度为 95 °C,这可能很危险。使用防护手套并在处理管子之前让管子冷却,以避免灼伤和突出。 - 执行第一轮扩展
- 用 P1000 移液器从含有凝胶的 1.5 mL 微量离心管中吸出变性溶液。使用小刮刀将凝胶从 1.5 mL 微量离心管转移到装有 10 mL 超纯水的培养皿中 30 分钟。
- 使用一次性 3 mL 巴斯德移液管更换超纯水。在 RT 上孵育。
注意:轻柔地处理凝胶,因为在孵育的前 30 分钟后,它们会变得脆弱。 - 使用一次性 3 mL 巴斯德移液器再次更换超纯水。
注意:三次水孵育,每次 30 分钟就足够了,但为了实用起见,最好让第二次孵育保持开启状态。
7. 对目标蛋白进行荧光标记(第 2 天)
- 用一次性 3 mL 巴斯德吸管从带有凝胶的培养皿中除去水。用卡尺测量凝胶的直径以计算膨胀率(四到五倍之间)。
- 用 10 mL PBS 洗涤两次,每次 15 分钟。用剃须刀片将凝胶在圆形凝胶的中心切成约 10 mm x 10 mm 的正方形。每个要测试的条件使用 1 个方块。
注:PBS 孵育后凝胶会收缩。凝胶可以在 4 °C 的 PBS 中储存长达 1 周。 - 将每个方块转移到 12 孔板中,并与 500 μL 用 2% PBS-牛血清白蛋白 (BSA) 稀释的一抗在 37 °C 下摇动孵育 2 小时和 30 分钟。
注:替代抗体孵育可在 4 °C 下进行。 24 孔板中可使用的最小抗体体积为 300 μL。作为一般规则,使用两倍于常规免疫标记的抗体浓度。 - 用 2 mL 含 0.1% 聚山梨酯 20 的 PBS 洗涤 3 次,每次 10 分钟,同时在 6 孔板中摇动。
- 将凝胶转移到 12 孔板中,与 500 μL 二抗在 PBS 中,含 DAPI 和 10 μg/mL NHS-酯与所需荧光团偶联物,在 37 °C 下孵育 2 小时和 30 分钟,同时轻轻摇动。
注:作为一般规则,使用两倍浓度的抗体用于常规免疫标记。或者,可以在 4 °C 下进行这种孵育。 - 用 2 mL 含 0.1% 聚山梨酯 20 的 PBS 洗涤 3 次,每次 10 分钟,同时在 6 孔板中摇动。
- 将凝胶转移到装有超纯水的培养皿中。孵育 30 分钟。用一次性 3 mL 巴斯德移液器换水两次,如步骤 6.4 所示。
8. 成像和图像处理(第 3 天)
- 用一次性 3 mL 巴斯德吸管从培养皿中除去水,并用卡尺测量凝胶直径以计算膨胀因子。
- 用剃须刀片切下一小块 ~10 mm x 10 mm,然后将其放在 35 mm 的玻璃底盘上。
注:作为替代方案,将凝胶放在载玻片和盖玻片之间(不含聚-D-赖氨酸)。载玻片应有两个较小的滑片,用连接在侧面的金刚石刀切割,以形成一个与凝胶厚度大致的腔室。 - 在 10 倍或 20 倍放大倍率下检查方向。为了正确聚焦,请确保寄生虫面向盖玻片;否则,必须将凝胶翻转并再次检查(图 2C)。
- 找到正确的方向后,用显微镜纸擦干剩余的凝胶。用聚-D-赖氨酸包被的盖玻片覆盖凝胶。
- 向凝胶中加入一小滴超纯水,以使用共聚焦显微镜进行观察。
注:为确保正确成像,在整个过程中保持凝胶方向至关重要,以便凝胶中靠近其表面的含有细胞的一侧在末端面向玻璃底培养皿。当使用 35 mm 培养皿时,将聚-D-赖氨酸添加到放置在底部的盖玻片中可减少图像采集过程中的凝胶移动。 - 图像采集参数
- 使用 63 倍油浸 1.4 数值孔径 (NA) 物镜在共聚焦显微镜(材料表)中对样品进行成像。
- 采集 Z 堆栈、每个 z 步长的宽度和每个像素的曝光时间,根据样本、信号强度和采集时间的优化根据经验确定。如果需要,使用扫描缩放进行有效放大。
- 使用图像处理软件(材料表)打开 Z 堆栈。对于每个通道,使用 Group Z 项目 选项对堆叠图像进行分组。选择最大强度投影。
- 要合并图像,请使用 合并通道 工具并选择每个通道的颜色。使用处理软件中的 比例尺 工具添加比例尺。
注意:或者,可以根据需要为每个通道着色(请参阅代表性结果中的示例)。
结果
如果协议已正确执行(图 1),样品将显示为平面和半透明凝胶,在水中可以膨胀至 4-4.5 倍(图 3A)。这种扩展提供了约 70 nm 的有效分辨率,该分辨率可能因最终膨胀因子和所采用的成像系统而异。在共聚焦显微镜中进行第二次膨胀过程和图像采集后,我们能够观察到大约 4.5 的膨胀因子。为了量化这种膨胀,我们测量了步骤...
讨论
超微结构膨胀显微镜是一种通过将生物样品物理膨胀到其原始尺寸的几倍来获得生物样品高分辨率图像的技术。U-ExM 协议涉及几个关键步骤,必须仔细执行这些步骤才能获得最佳结果4。首先,必须用 CP 试剂固定样品并包埋在可膨胀的水凝胶基质中。CP 溶液中存在的甲醛与丙烯酰胺的游离共价键相互作用,以防止与样品形成不需要的键。在该协议中,我?...
披露声明
作者没有需要披露的利益冲突。
致谢
我们感谢 Dolores Campos 协助 Vero 细胞培养和 Romina Manarin 协助克 氏锥虫 培养。这项工作得到了 Agencia Nacional de Promoción Científica y Tecnológica、阿根廷科学和创新生产部 (PICT2019-0526)、Consejo Nacional de Investigaciones Científicas y Técnicas (PIBAA 1242) 和英国研究委员会 [MR/P027989/1] 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.22 micrometers sterile syringe filters PES | Membrane solutions | SFPES030022S | |
| 1 L beaker | Schott Duran | 10005227 | |
| 1.5-mL SPINWIN Micro Centrifuge Tube | Tarson | T38-500010 | |
| 10 mL disposable sterile serynge | NP | 66-32 | |
| 10 mL serological pipette sterile | Jet Biofil | GSP211010 | |
| 12-mm coverslips | Merienfeld GmbH | 01 115 20 | Round coverslips |
| 12-well plates | Jet Biofil | TCP011012 | |
| 22-mm coverslips | Corning | 2845-22 | Square coverslips |
| 24-well plates | Jet Biofil | TCP-011-024 | |
| 250 mL beaker | Schott Duran | C108.1 | |
| 3 mL Pasteur pipette | Deltalab | 200037 | |
| 35-mm glass bottom dishes | Matsunami glass ind | D11130H | |
| 4′,6-Diamidine-2′-phenylindole dihydrochloride | Sigma Aldrich | D9542 | DAPI |
| 5 ml serological pipette sterile | Jet Biofil | GSP010005 | |
| 6-well plates | Sarstedt | 83.3920 | |
| Acrilamide | BioRad | 1610101 | |
| Ammonium persulfate | Sigma Aldrich | A3678-25G | APS |
| ATTO 647 NHS ester | BOC Sciences | F10-0107 | For pan-proteome labelling |
| Biosafty Cabinet | Telstar | Bio II A/P | |
| Bovine Sodium Albumine | Sigma Aldrich | A7906 | BSA |
| CO2 Incubator | Sanyo | MCO-15A | |
| Confocal Microscope | Zeiss | LSM 880 | |
| Disposable Petridish | Tarsons | 460095 | 90 mm diameter |
| DMEM, High Glucose | Thermo Fisher Cientific | 12100046 | Powder |
| Electronic digital caliper | Radar | RADAR-SLIDE-CALIPER | |
| Ethanol Absolute | Supelco | 1,00,98,31,000 | |
| Fetal Calf Serum | Internegocios SA | FCS FRA 500 | Sterile and heat-inactivated |
| Fiji image processing package | ImageJ | doi:10.1038/nmeth.2019 | |
| Formaldehyde 37% | Sigma Aldrich | F8775 | FA |
| Glass Petridish | Marienfeld Superior | PM-3400300 | 60 mm diameter |
| Glucosa D(+) | Cicarelli | 716214 | |
| Glutaraldehyde 70% | Sigma Aldrich | G7776 | |
| Goat anti-Mouse IgG Secondary Antibody Alexa Fluor 555 | Invitrogen | A-21422 | |
| Goat anti-Rabbit IgG Secondary Antibody FICT | Jackson Immunoresearch | 115-095-003 | |
| Graduated cylinder | Nalgene | 3663-1000 | |
| Graduated glass flask | Glassco | GL-274.202.01 | 100 mL |
| Heating Block | IBR | Made in house | |
| Hemin | Frontier Scientific | H651-9 | |
| Hydrochloric acid 36.8-38.0% | Ciccarelli | 918110 | |
| Ice bucket | Corning | 1167U68 | |
| Incubator | Tecno Dalvo | TOC130 | |
| Liver Infusion | Difco | 226920 | |
| Magnetic stirrer and heater | Lab companion | HP-3000 | |
| Metal spatula | SALTTECH | 200MM | |
| Metal tweezers | Marienfeld Superior | PM-6633002 | |
| Methanol absolut | Cicarelli | 897110 | |
| Microcentrifuge tube 1.5 mL | Tarson | 500010-N | |
| Microscopy grade paper KimWipes | Kimtech Science | B0013HT2QW | |
| Milli-Q water sistem | Merk Millipore | IQ-7003 | |
| mouse anti- alpha tubulin clone DM1A | Sigma Aldrich | T9026 | |
| mouse anti-PFR | Purified antibodies | Donated by Dr. Ariel Silber (USP) | |
| N,N´-methylenbisacrilamide | ICN | 193997 | BIS |
| Na2HPO4 | Cicarelli | 834214 | |
| Neubauer chamber | Boeco | BOE 01 | |
| p1000 pipette | Gilson | PIPETMAN P1000 | |
| p1000 pipette tips | Tarson | TAR-521020B | |
| p20 pipette | Gilson | PIPETMAN P20 | |
| p20 pipette tips | Tarson | TAR-527108 | |
| p200 pipette | Gilson | PIPETMAN P200 | |
| p200 pipette tips | Tarson | TAR-521010Y | |
| Paraformaldehyde | Sigma Aldrich | P6148 | PFA |
| pH / ORP / °C meter | HANNA Instruments | HI 2211 | |
| Poly-D-Lysine 0.1% | Sigma Aldrich | P8920 | |
| Potassium Chloride | Cicarelli | 867212 | KCl |
| Razor blade | Printex | BS 2982:1992 | |
| Sealing FIlm "Parafilm M" | Bemis | PM996 | |
| Sodium Acrilate | Sigma Aldrich | 408220-25G | SA |
| Sodium Bicarbonate | Cicarelli | 929211 | NaHCO3 |
| Sodium Chloride | Cicarelli | 750214 | NaCl |
| Sodium Dodecyl Sulfate | BioRad | 1610302 | SDS |
| Sodium Hidroxide | Merk | 1-06498 | NaOH |
| Sorvall ST 16 Centrifuge | Thermo Fisher Scientific | 75004380 | |
| T-25 flasks | Corning | 430639 | |
| TEMED | Invitrogen | 15524-010 | |
| Tissue paper | Elite | ||
| Triptose | Merck | 1106760500 | |
| Tris | BioRad | 1610719 | |
| Tween-20 | Biopack | 2003-07 | Polysorbate 20 |
| Vaccum pump | Silfab | N33-A | |
| Vero cells | ATCC | CRL-1587 | |
| Vortex MIxer | Dragon Lab | MX-S |
参考文献
- Chen, F., Tillberg, P. W., Boyden, E. S. Expansion microscopy. Science. 347 (6221), 543-548 (2015).
- Chozinski, T. J., et al. Expansion microscopy with conventional antibodies and fluorescent proteins. Nature Methods. 13 (6), 485-488 (2016).
- Ku, T., et al. Multiplexed and scalable super-resolution imaging of three-dimensional protein localization in size-adjustable tissues. Nature Biotechnology. 34 (9), 973-981 (2016).
- Gambarotto, D., et al. Imaging cellular ultrastructures using expansion microscopy (U-ExM). Nature Methods. 16 (1), 71-74 (2018).
- Tillberg, P. W., Chen, F. Expansion microscopy: Scalable and convenient super-resolution microscopy. Annual Review of Cell and Developmental Biology. 35, 683-701 (2019).
- Jurriens, D., van Batenburg, V., Katrukha, E. A., Kapitein, L. C. Mapping the neuronal cytoskeleton using expansion microscopy. Methods in Cell Biology. 161, 105-124 (2021).
- Alonso, V. L. Ultrastructure expansion microscopy (U-ExM) in Trypanosoma cruzi: localization of tubulin isoforms and isotypes. Parasitology Research. 121 (10), 3019-3024 (2022).
- Kalichava, A., Ochsenreiter, T. Ultrastructure expansion microscopy in Trypanosoma brucei. Open Biology. 11 (10), 210132 (2021).
- Amodeo, S., et al. Characterization of the novel mitochondrial genome segregation factor TAP110 in Trypanosoma brucei. Journal of Cell Science. 134 (5), (2021).
- Liffner, B., Absalon, S. Expansion microscopy reveals plasmodium falciparum blood-stage parasites undergo anaphase with a chromatin bridge in the absence of mini-chromosome maintenance complex binding protein. Microorganisms. 9 (11), 2306 (2021).
- Dos Santos Pacheco, N., Soldati-Favre, D. Coupling auxin-inducible degron system with ultrastructure expansion microscopy to accelerate the discovery of gene function in Toxoplasma gondii. Methods in Molecular Biology. 2369, 121-137 (2021).
- Lidani, K. C. F., et al. Chagas disease: From discovery to a worldwide health problem. Frontiers in Public Health. 7, 166 (2019).
- Carrea, A., Diambra, L. Systems biology approach to model the life cycle of Trypanosoma cruzi. PloS One. 11 (1), e0146947 (2016).
- Vidal, J. C., De Souza, W. . Morphological and Functional Aspects of Cytoskeleton of Trypanosomatids. Cytoskeleton - Structure, Dynamics, Function and Disease. , (2017).
- Kunz, T. C., Götz, R., Gao, S., Sauer, M., Kozjak-Pavlovic, V. Using expansion microscopy to visualize and characterize the morphology of mitochondrial cristae. Frontiers in Cell and Developmental Biology. 8, 617 (2020).
- Laporte, M. H., Klena, N., Hamel, V., Guichard, P. Visualizing the native cellular organization by coupling cryofixation with expansion microscopy (Cryo-ExM). Nature Methods. 19 (2), 216-222 (2022).
- Sahabandu, N., et al. Expansion microscopy for the analysis of centrioles and cilia. Journal of Microscopy. 276 (3), 145-159 (2019).
- Wen, G., Leen, V., Rohand, T., Sauer, M., Hofkens, J. Current progress in expansion microscopy: chemical strategies and applications. Chemical Reviews. 123 (6), 3299-3323 (2023).
- Trinks, N., et al. Subdiffraction-resolution fluorescence imaging of immunological synapse formation between NK cells and A. fumigatus by expansion microscopy. Communications Biology. 4 (1), 1151 (2021).
- White, B. M., Kumar, P., Conwell, A. N., Wu, K., Baskin, J. M. Lipid expansion microscopy. Journal of the American Chemical Society. 144 (40), 18212-18217 (2022).
- Steib, E., et al. TissUExM enables quantitative ultrastructural analysis in whole vertebrate embryos by expansion microscopy. Cell Reports Methods. 2 (10), 100311 (2022).
- Shaib, A. H., et al. Visualizing proteins by expansion microscopy. bioRxiv. , (2023).
- M'Saad, O., et al. All-optical visualization of specific molecules in the ultrastructural context of brain tissue. bioRxiv. , (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。