A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מיקרוסקופ הרחבה אולטרה-סטרוקטורלי בשלושה שלבי מחזור חיים חוץ גופי של טריפנוזומה קרוזי
* These authors contributed equally
In This Article
Summary
מחקר זה מראה פרוטוקול מפורט לביצוע מיקרוסקופ הרחבת אולטרה-מבנה בשלושה שלבי מחזור חיים במבחנה של טריפנוזומה קרוזי, הפתוגן האחראי למחלת צ'אגאס. אנו כוללים את הטכניקה האופטימלית עבור חלבונים ציטו-שלד ותיוג פאן-פרוטאום.
Abstract
אנו מתארים כאן את היישום של מיקרוסקופ הרחבת אולטרה-מבנה (U-ExM) ב Trypanosoma cruzi, טכניקה המאפשרת להגדיל את הרזולוציה המרחבית של תא או רקמה עבור הדמיה מיקרוסקופית. זה מתבצע על ידי הרחבה פיזית של דגימה עם כימיקלים מהמדף וציוד מעבדה נפוץ.
מחלת צ'אגאס היא דאגה נרחבת ודחופה לבריאות הציבור הנגרמת על ידי T. cruzi. המחלה נפוצה באמריקה הלטינית והפכה לבעיה משמעותית באזורים שאינם אנדמיים עקב הגירה מוגברת. העברת T. cruzi מתרחשת דרך וקטורי חרקים hematophagous השייכים למשפחות Reduviidae ו Hemiptera. לאחר ההדבקה, T. cruzi amastigotes מתרבים בתוך הפונדקאי של היונקים ומתמיינים לטריפומסטיגוטים, צורת זרם הדם שאינה משוכפלת. בווקטור החרקים, טריפומסטיגוטים הופכים לאפימסטיגוטים ומתרבים באמצעות ביקוע בינארי. ההתמיינות בין שלבי מחזור החיים דורשת סידור מחדש נרחב של שלד התא וניתן לשחזר אותה במעבדה לחלוטין תוך שימוש בטכניקות שונות של תרביות תאים.
אנו מתארים כאן פרוטוקול מפורט ליישום U-ExM בשלושה שלבי מחזור חיים חוץ גופיים של Trypanosoma cruzi, תוך התמקדות באופטימיזציה של אימונולוקליזציה של חלבונים ציטו-שלד. כמו כן, ביצענו אופטימיזציה של השימוש ב-N-Hydroxysuccinimide ester (NHS), תווית פאן-פרוטאום שאפשרה לנו לסמן מבנים שונים של טפילים.
Introduction
מיקרוסקופ הרחבה (ExM) תואר לראשונה בשנת 2015 על ידי Boyden et al.1. זהו פרוטוקול הדמיה שבעזרתו מיקרוסקופ קונבנציונלי יכול להשיג רזולוציה מרחבית מתחת לגבול העקיפה. רזולוציה גבוהה יותר זו מתקבלת בגלל הגדלה פיזית של המדגם. כדי להשיג זאת, מולקולות המסומנות באופן פלואורסצנטי מוצלבות להידרוג'ל, אשר לאחר מכן מורחב איזוטרופית עם מים. כתוצאה מהתפשטות זו, האותות מופרדים כמעט איזוטרופית בכל שלושת המימדים. שיטה זו עושה שימוש בכימיקלים זולים ומאפשרת רזולוציה מרחבית של כ-65 ננומטר באמצעות מיקרוסקופים קונפוקליים (קונפוקליים), שהיא בערך פי ארבעה יותר טובה מהרזולוציה הסטנדרטית של מיקרוסקופ קונפוקלי (כ-250 ננומטר)1.
אבן הדרך הבאה, שאפשרה שימוש במיקרוסקופ התפשטות בתחומים ביולוגיים רבים, הייתה התאמת הסימון האימונופלואורסצנטי לנוגדנים קונבנציונליים2. עיבוד נוסף מפרוטוקול ExM שפורסם לראשונה הוא ניתוח מוגדל של הפרוטאום (MAP)3. שיטה זו הציגה שימוש בריכוזים גבוהים של אקרילאמיד ופרפורמלדהיד לפני טבילת דגימה הידרוג'ל כדי למנוע קרוסלינקינג תוך ובין-חלבוני, מה שהוביל לשימור טוב יותר של תכולת החלבונים והארכיטקטורה התת-תאית של הדגימות. פרוטוקול חלופי זה הותאם להשגת שימור משופר של מבנה העל הכולל של אברונים מבודדים על ידי ניצול ריכוזים נמוכים יותר של חומרי הקיבוע (פורמלדהיד/פרפורמלדהיד ואקרילאמיד); גישה זו כונתה Ultrastructure expansion microscopy (U-ExM)4.
כדי להשיג רזולוציה רבה עוד יותר, דווח גם על שילוב של ExM עם טכניקות מיקרוסקופיה ברזולוציית על, כולל מיקרוסקופ דלדול פליטה מגורה או מיקרוסקופ לוקליזציה של מולקולה בודדת, על מנת להגיע לרזולוציות נמוכות מ-20 ננומטר5.
השימוש ב- ExM דווח בהרחבה בתחומי מדעי המוח ומחקר שלד ציטו-שלד6, אך רק מחקרים מעטים נערכו על פרוטיסטים טפיליים. המעבדה שלנו הייתה הראשונה לדווח על יישום U-ExM ב- T. cruzi7. פרוטוקול הבסיס מבוסס בעיקר על דוחות U-ExM קודמים ב- Toxoplasma gondii, Plasmodium ssp. ו- Trypanosoma brucei 8,9,10,11.
אחד היתרונות הגדולים ביותר של ExM הוא אופיו המודולרי, המאפשר גמישות רבה להסתגל לדגימות ביולוגיות שונות. ניתן לחלק את הפרוטוקול לשלבים (כגון קיבוע, מניעת crosslinking או gelation) שהמשתמש יכול להתאים בקלות כדי לעמוד בדרישות הניסוי שלהם. בנוסף, ניתן לשנות צינור זה כדי לשפר את התאימות עם אורגניזם המודל או כדי להשיג רזולוציה ספציפית. כתוצאה מכך, ExM מציעה פוטנציאל עצום עבור מערכות אופטיות מתקדמות ולא מתקדמות, מה שמבטיח יישומים רחבים יותר בעתיד.
מחלת צ'אגאס, הנקראת גם טריפנוסומיאזיס אמריקאית, היא מחלה אנדמית באמריקה הלטינית הנגרמת על ידי טריפנוזומה קרוזי, טפיל פרוטוזואי. מחזור החיים של הטפיל מורכב וכולל שני שלבי התפתחות ביונקים ושניים בפונדקאי החרק (בני משפחת הטריאטומיניים), שהוא הווקטור הביולוגי של מחלה זו. מחלת צ'אגאס שייכת לקבוצת המחלות הטרופיות המוזנחות המפורטות על ידי ארגון הבריאות העולמי ומייצגת בעיה כלכלית וחברתית משמעותית באמריקה הלטינית. מחקרים אפידמיולוגיים מעריכים כי 8 מיליון אנשים ברחבי העולם חיים עם מחלת צ'אגאס ויותר מ-10,000 מקרי מוות בשנה. מספרים אלה מדגימים את חשיבותה של מחלת צ'אגאס כבעיה של בריאות הציבור ברחבי העולם. התפוצה הגיאוגרפית של מחלת צ'אגאס השתנתה בעשורים האחרונים, כאשר אנשים נגועים רבים מתגוררים כיום באזורים עירוניים גדולים ברחבי העולם עקב הגירה מוגברת, בניגוד לאזורים הכפריים בעיקר של אמריקה הלטינית שם היא נמצאה במקור12.
שלבי ההתפתחות של T. cruzi שונים לאורך מחזור החיים שלו, אשר ניתן לשכפל לחלוטין במבחנה. אפימסטיגוטים הם צורות שכפולות בווקטור החרק, ויש להם גרעין כדורי באזור המרכזי של גוף התא וקינטופלסט בצורת בר (מבנה מיטוכונדריאלי המכיל DNA ייחודי לקינטופלסטידים) באזור הקדמי ביחס לגרעין, עם שוטון חופשי. טריפומסטיגוטים הם הצורה הזיהומית, הלא משוכפלת, ויש להם גרעין מוארך, קינטופלסט אחורי מעוגל, ושוטון המחובר לקרום הפלזמה לכל אורכו של הטפיל. אמסטיגוטים הם צורת השכפול התוך-תאית; יש להם גרעין באזור המרכז, קינטופלסט בצורת מוט בחלק הקדמי של גוף התא, ושוטון מופחת. יכולת ההסתגלות של הטפיל לסביבות שונות היא השתקפות של שינויים מורפולוגיים אלה. ראוי גם להזכיר כי מחזור חיים זה כרוך בחלוקה סימטרית ובשלבי התפתחות מעבר שונים13. במהלך ההתמיינות, השלד הציטוזומטי של הטריפנוזומטים ממלא תפקיד קריטי. מבנה זה נוצר על ידי מחוך של מיקרוטובולים תת-פליקולריים המסודרים במערך מסודר של מיקרוטובולים יציבים מתחת לקרום הפלזמה. כמו כן, מוט paraflagellar קיים באורגניזמים אלה, שהוא מבנה דמוי סריג העובר במקביל ומחובר לאקסונם flagellar14. הארגון הציטו-שלד המדויק והשינויים המבניים הגרעיניים לאורך שלבי מחזור התא כוללים מנגנוני ויסות גנים ייחודיים הספציפיים לטריפנוזומטים, מה שהופך אותם למודלים מעניינים למחקרים בביולוגיה של התא.
בהתחשב בגודל הקטן של T. cruzi וטפילים פרוטוזואן אחרים, U-ExM מציג כלי מצוין לניתוח התכונות המבניות של פתוגנים חשובים אלה. כאמור, תחולתה של טכניקה זו על T. cruzi אומתה לראשונה על ידי ד"ר אלונסו7. דו"ח זה מפרט פרוטוקול U-ExM מלא, עם דגש על אימונולוקליזציה של חלבוני שלד ציטו-שלד במהלך שלבי מחזור החיים השונים של T. cruzi. כמו כן, ביצענו אופטימיזציה של השימוש ב-N-Hydroxysuccinimide ester (NHS), תווית פאן-פרוטאום המאפשרת לנו לסמן מבנים שונים של טפילים. בנוסף, מתוארת מתודולוגיה במבחנה להשגת שלושת שלבי הטפיל.
Protocol
הערה: איור 1 ממחיש את התכנון הניסויי המלא.
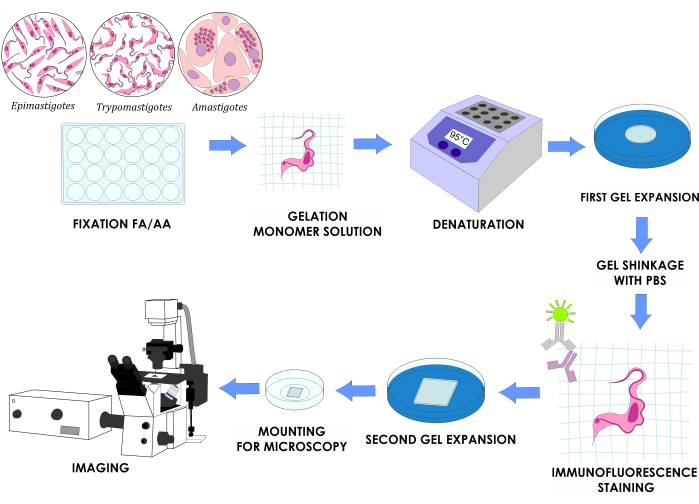
איור 1: זרימת עבודה של U-ExM עבור שלושה שלבי מחזור חיים חוץ גופיים של T. cruzi. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
1. הכנת כיסויים מצופים פולי-D-ליזין
- מניחים ריבוע של 10X10 ס"מ של סרט איטום בצלחת פטרי. שטפו את הכיסויים על ידי רחיצתם באתנול מוחלט בצלחת פטרי זכוכית 35 מ"מ.
- הסר את הכיסויים בפינצטה מאמבט האתנול ונקז את עודפי הנוזל עם נייר טישו. מניחים את הכיסויים מעל סרט האיטום.
- לספוג את שאר האתנול עם נייר ברמה מיקרוסקופית. הוסף תמיסת v/v 0.1% של פולי-D-ליזין במרכז הכיסוי ומרח אותה עם הקצה כדי לכסות כ-80% מפני השטח שלה. סגור את צלחת פטרי לדגור במשך 1 שעה ב 37 ° C.
הערה: עבור 22 מ"מ2 כיסויים, השתמש 200 μL של תמיסת פולי-D-ליזין; עבור כיסויים עגולים בקוטר 12 מ"מ, יש להשתמש ב-100 מיקרוליטר של תמיסת פולי-D-ליזין. - שטפו את הכיסויים במים טהורים במיוחד שלוש פעמים. השתמשו בשאיפה עם ואקום כדי להסיר את המים בין כל כביסה. יש לשמור על טמפרטורה של 4°C למשך עד שבוע.
2. הכנת פתרון
- הכינו תמיסות מלאי של 38% (w/w) נתרן אקרילט (SA).
- הוסיפו באיטיות 19 גרם חומצה סליצילית ל-31 מ"ל מים נטולי נוקלאז תוך כדי ערבוב.
הערה: פתרון זה צמיג מאוד; שימו לב כשאתם עושים פיפטינג. - לאחר המסת חומצה סליצילית לחלוטין, אחסנו אותה במיכל סטרילי. שמור אותו ב 4 ° C ולשנות אותו כל 6 חודשים.
הערה: SA מראה לפעמים סימנים של זיהום עם פוליאקרילט נתרן בהתאם למותג, אשר מורגש בעת הכנת פתרון המניות כפי שהוא הופך צהבהב ועכור. השתמש בו בזהירות אם זה המקרה.
- הוסיפו באיטיות 19 גרם חומצה סליצילית ל-31 מ"ל מים נטולי נוקלאז תוך כדי ערבוב.
- הכינו תמיסת מלאי של 40% (w/v) אקרילאמיד (AA) ותמיסת מלאי של 2% (w/v) N, N'-methylene bisacrylamide (BIS). ממיסים כל תרכובת במים טהורים במיוחד ומסננים עם מסנן מזרק סטרילי 0.22 מיקרומטר. יש לאחסן במיכל סטרילי בטמפרטורה של 4°C.
זהירות: AA ו-BIS הם חומרים רעילים ביותר. יש לעבוד מתחת למכסה מנוע מנדף ולהשתמש בגופי הגנה מתאימים (כפפות, ביגוד מגן, מסכה ומשקפי בטיחות). - הכן את תמיסת מניעת הצלבת חלבונים (CP) על ידי ערבוב 38 μL של תמיסת 37% פורמלדהיד (FA) עם 50 μL של תמיסת מלאי אקרילאמיד 40% (שלב 2.2) ב 912 μL של מלח חוצץ פוספט (PBS; טבלה 1) כדי לקבל ריכוז סופי של 1.4% פורמלדהיד ו 2% אקרילאמיד.
הערה: הכינו תמיד את תמיסת ה-CP טרייה והיו מדויקים ביותר בעת הפיפטה. לדוגמה, השתמש פיפטה P1000 לקחת 900 μL של PBS ופיפטה P20 לקחת את 12 μL הנותרים של PBS. - הכינו את הפתרון המונומרי
הערה: אין להשתמש בפתרון מיד לאחר ההכנה; יש לאחסן בטמפרטורה של -20°C לפחות 24 שעות לפני השימוש.- ערבבו 500 μL של תמיסת 38% SA (שלב 2.1), 250 μL של תמיסת 40% AA, ו-50 μL של תמיסת BIS (שלב 2.2), כמו גם 100 μL של 10x PBS (טבלה 1).
- Aliquot נפח סופי זה של 900 μL ב 10x 1.5 מ"ל צינורות microcentrifuge עם 90 μL של פתרון מונומרי כל אחד. יש לאחסן בטמפרטורה של -20°C למשך עד שבועיים.
הערה: תמיסת SA עשויה להישאר על הקצה בעת pipetting כי זה צמיג מאוד; היזהר וחלק על הכל.
- הכן את הפתרון denaturing
- ערבבו 114.3 מ"ל של תמיסת סודיום דודציל סולפט (SDS) בנפח 350 מ"מ שהוכנה במים טהורים במיוחד עם 10 מ"ל של תמיסת נתרן כלורי באורך 4 מ"מ שהוכנה במים טהורים במיוחד. מוסיפים 12 גרם של Tris תוך כדי ערבוב 250 מ"ל מכולת.
זהירות: SDS רעיל מאוד; השתמשו בו מתחת למכסה מנוע עם כפפות, ביגוד מגן, מסכה ומשקפי בטיחות. - התאם את ה- pH ל -9 עם תמיסה מרוכזת של חומצה הידרוכלורית. להכין עד 200 מ"ל עם מים טהורים במיוחד ולאחסן בקבוק סטרילי ב 4 °C (75 °F).
- ערבבו 114.3 מ"ל של תמיסת סודיום דודציל סולפט (SDS) בנפח 350 מ"מ שהוכנה במים טהורים במיוחד עם 10 מ"ל של תמיסת נתרן כלורי באורך 4 מ"מ שהוכנה במים טהורים במיוחד. מוסיפים 12 גרם של Tris תוך כדי ערבוב 250 מ"ל מכולת.
- הכינו תמיסת 10% אמוניום פרסולפט (APS) ותמיסת TEMED 10%.
- יש להמיס 0.1 גרם של APS ב-1 מ"ל של מים טהורים במיוחד.
- הכן 1 מ"ל של תמיסת TEMED 10% במים טהורים במיוחד.
- הכינו 100 μL aliquots של שתי התמיסות בצינורות סטריליים מיקרוצנטריפוגות 1.5 מ"ל ואחסנו אותם ב -20 °C למשך עד חודש אחד.
- הכן את הפתרון paraformaldehyde.
- יש להמיס 2 גרם של paraformaldehyde ב 40 מ"ל של PBS תוך ערבוב ב 60 ° C. מוסיפים 1 M NaOH בטיפה עד שהתמיסה הופכת מלבנה לחסרת צבע.
זהירות: פורמלדהיד רעיל מאוד; השתמשו בו מתחת למכסה מנוע עם כפפות, ביגוד מגן, מסכה ומשקפי בטיחות. - קררו את התמיסה בטמפרטורת החדר וכווננו את ה-pH עם NaOH ל-7.2 בנפח סופי של 50 מ"ל. מסננים עם מסנן מזרק סטרילי 0.22 מיקרומטר ומאחסנים במיכל סטרילי.
- להכין aliquots של 1 מ"ל ב 1.5 מ"ל צינורות מיקרוצנטריפוגה סטריליים ולאחסן ב -20 ° C.
- יש להמיס 2 גרם של paraformaldehyde ב 40 מ"ל של PBS תוך ערבוב ב 60 ° C. מוסיפים 1 M NaOH בטיפה עד שהתמיסה הופכת מלבנה לחסרת צבע.
- הכינו את תמיסת הפרפורמאלדהיד/גלוטראלדהיד.
- הוסף 0.2 גרם של paraformaldehyde ב 3.5 מ"ל של מים טהורים במיוחד ו 50 μL של 16 M תמיסת NaOH. מחממים את התמיסה ל-60°C כדי להמיס את הפרפורמלדהיד.
- מצננים ומוסיפים 300 μL של 70% גלוטראלדהיד. העלה את הנפח ל -5 מ"ל עם מים טהורים במיוחד ולבסוף ל -10 מ"ל עם PBS.
זהירות: Paraformaldehyde ו glutaraldehyde הם רעילים מאוד; השתמשו בהם מתחת למכסה מנוע עם כפפות, ביגוד מגן, מסכה ומשקפי מגן. - להכין aliquots של 1 מ"ל ב 1.5 מ"ל צינורות מיקרוצנטריפוגה סטריליים ולאחסן ב -20 ° C.
3. הכנת תרביות הטפילים
- לגדל T. cruzi epimastigotes.
- השתמש בתרבית אקסנית בבקבוק T-25 (25 ס"מ2 שטח גדילה) ושמור על התרביות בשלב הלוגריתמי על ידי תת-תרבית כל 48-72 שעות בתווך טריפטוז עירוי כבד (LIT) עם 10% נסיוב עגל עוברי (FCS; טבלה 1).
- ודא שהפקק סגור היטב ושמור את בקבוק התרבית במאונך על 28 מעלות צלזיוס לדגירה. עקוב אחר צמיחת הטפיל על ידי ספירת תאים בתא נויבאואר במהלך כל תת-תרבית.
הערה: עבור זן Dm28c ששימש במחקר זה, ריכוז epimastigotes בתרביות לוג פאזות הוא בין 1-5 x 107 טפילים / מ"ל. - הכינו השעיה של 2 x 106 epimastigotes/mL מתרבית שלב יומן במדיום LIT בתוספת 10% FCS. צנטריפוגה את המתלים במהירות של 5,000 x גרם למשך 10 דקות בטמפרטורת החדר (RT). יש לשטוף עם PBS פעם או פעמיים ולהשהות מחדש ב-200 מיקרוליטר של PBS.
- יש להיצמד לכיסוי העגול בקוטר 12 מ"מ שקודם לכן היה מצופה בפולי-D-ליזין (סעיף 1). יש לדגור ב-RT למשך 15-20 דקות. המשך לשלב מניעת crosslinking (סעיף 4).
הערה: לחלופין, תקן את האפימסטיגוטים עם מתנול קר למשך 7 דקות או תמיסת פרפורמלדהיד/גלוטראלדהיד (שלב 2.8) למשך 10 דקות ב- RT לפני היצמדות הטפילים לכיסוי. ניתן לאחסן את הטפילים הקבועים ב 4 °C (75 °F) עד שבוע אחד.
- להשיג amastigotes מתאי Vero נגועים.
- הניחו כיסוי עגול סטרילי בקוטר 12 מ"מ על תחתית צלחת תרבית רקמה בעלת 24 בארות. הכינו תרחיף של 2 x 105 תאי ורו / מ"ל במדיום הנשר המעובד של דולבקו (DMEM) בתוספת 2% נסיוב עגל עובר (FCS). זרע 500 μL של ההשעיה לכל באר.
הערה: מחקר זה משתמש DMEM עם 2% FCS כדי לאפשר לתאים לגדול לאט יותר. - יש לדגור למשך הלילה (ON; 12-16 שעות) בטמפרטורה של 37°C ו-5%CO2 כדי להבטיח חיבור לתאים.
- לאחר הדגירה, יש לשטוף את התאים פעמיים באמצעות 500 μL של PBS סטרילי. הוסף T . cruzi trypomastigotes לתוך התאים בריבוי של זיהום (MOI) של 10 ב 100 μL של DMEM עם 2% FCS לכל באר, המקביל מיליון trypomastigotes לכל באר. יש לדגור בטמפרטורה של 37°C ו-5%CO2 למשך 6 שעות.
- לאחר הדגירה, שטפו את הצלחות פעמיים עם PBS. הוסף 500 μL של DMEM בתוספת 2% FCS. בשלב זה, המשך לשלב מניעת ההצלבה (סעיף 4).
הערה: אמסטיגוטות תוך-ציטופלזמיות ייראו דרך מיקרוסקופ אופטי הפוך יומיים לאחר ההדבקה (איור משלים 1). לחלופין, לתקן את trypomastigotes עם מתנול קר במשך 7 דקות ב -20 ° C, או paraformaldehyde / glutaraldehyde במשך 10 דקות ב RT, לפני היצמדות של הטפילים לכיסוי.
- הניחו כיסוי עגול סטרילי בקוטר 12 מ"מ על תחתית צלחת תרבית רקמה בעלת 24 בארות. הכינו תרחיף של 2 x 105 תאי ורו / מ"ל במדיום הנשר המעובד של דולבקו (DMEM) בתוספת 2% נסיוב עגל עובר (FCS). זרע 500 μL של ההשעיה לכל באר.
- להשיג trypomastigotes מתאי Vero נגועים.
- אספו את הסופרנאטנט של חד-שכבה של תאי ורו (מפגש של 30%-40%) הנגועים בטריפומסטיגוטים (MOI 1:10; בדגירה) 4 ימים לאחר ההדבקה.
הערה: עבור בקבוק T-25, הריכוז ההתחלתי של תאי Vero בשימוש הוא 800,000 תאים, ועבור בקבוק T-75 הוא שני מיליון תאים. - לקבוע את ריכוז טריפומסטיגוט באמצעות תא נויבאואר לספירת תאים. צנטריפוגה 4 x 106 טריפומסטיגוטים ב 7,000 x גרם ב RT במשך 10 דקות.
- יש לשטוף עם PBS פעמיים ולהשהות מחדש ב-200 מיקרוליטר של PBS. יש למרוח על מכסה עגול בקוטר 12 מ"מ המצופה בפולי-די-ליזין (סעיף 1). יש לדגור במשך 10-15 דקות ב-RT. המשך בשלב מניעת ההצלבה (סעיף 4).
הערה: לחלופין, תקן את הטריפומסטיגוטים עם מתנול קר למשך 7 דקות ב -20 ° C או paraformaldehyde / glutaraldehyde במשך 10 דקות ב RT לפני היצמדות הטפילים לכיסוי.
- אספו את הסופרנאטנט של חד-שכבה של תאי ורו (מפגש של 30%-40%) הנגועים בטריפומסטיגוטים (MOI 1:10; בדגירה) 4 ימים לאחר ההדבקה.
4. ביצוע מניעת crosslinking (יום 1)
- השקיעו את הכיסוי בקוטר 12 מ"מ עם הטפילים המודבקים או התאים הנגועים (הפונים כלפי מעלה) בצלחת בת 24 בארות עם 0.5 מ"ל של תמיסת CP (שלב 2.3) בכל באר.
- מלאו את הבארות הריקות במים כדי להפחית את האידוי. אוטמים את הצלחת בסרט איטום. לדגור במשך 5 שעות ב 37 ° C. שלב זה יכול להיות מורחב עד דגירה ON ב 4 ° C.
הערה: תמיד לטבול את תלוש הכיסוי בתמיסה; אין לקלף את התמיסה המקבעת מעל הכיסויים.
5. ביצוע ג'לציה של המדגם
- הרכיבו תא לח בצלוחית פטרי עם סרט איטום על גבי נייר טישו (איור 2A). הוסיפו מים לנייר הטישו ודגרו בטמפרטורה של -20°C למשך 20 דקות כדי להתקרר. הפשירו TEMED ו-APS על קרח במשך 20 דקות (שלב 2.6).
הערה: אין להקפיא-להפשיר את ה-APS יותר משלוש פעמים. - הניחו את התא הקריר והלח על קרח (איור 2A). הוציאו את צלחת 24 הקידוחים שהוכנה בקטע 4 מתוך האינקובטור. שאפו את תמיסת CP עם פיפטה של 3 מ"ל פסטר, תוך השארת תמיסה כלשהי, אחרת יהיה קשה להסיר את הכיסויים.
- הסירו את כיסויי ה-12 מ"מ מהתמיסה המקובעת בפינצטה והניחו אותם על נייר טישו כשהטפילים פונים כלפי מעלה.
הערה: כדאי להשתמש במחט סטרילית כדי להרים את הכיסוי ולאחר מכן להחזיק אותו עם הפינצטה. - כדי aliquot של 90 μL של תמיסה מונומרית (שלב 2.4), להוסיף 5 μL של TEMED ו 5 μL של APS מופשר בעבר. מערבבים עם מערבל מערבולת לא יותר מ 2-3 שניות; אין צורך לסגור את הצינור עם המכסה.
הערה: הוסף תמיד TEMED ראשון ו-APS אחרון. התוספת של APS ראשון ו-TEMED אחרון לתמיסה המונומרית הופכת את תהליך הג'לציה למהיר יותר, ולא נותנת זמן לתפעל אותו. - יש לטפטף במהירות טיפה אחת של 35 μL מעל סרט האיטום של התא הלח עבור כל כיסוי. הרימו מיד את הכיסוי עם פינצטה ושכבו מעל הטיפה (איור 2B) כשהטפילים פונים כלפי מטה.
הערה: יש לבצע עד שני כיסויים בכל פעם; חשוב מאוד לא לעכב את השלב הזה כי התמיסה מתפלמרת מהר מאוד. - לדגור על החדר הלח במשך 5 דקות על קרח ולאחר מכן במשך 1 שעה ב 37 °C (77 °F). הפעל בלוק חימום ב 95 ° C כדי להבטיח את הטמפרטורה הנכונה לשלב הבא.
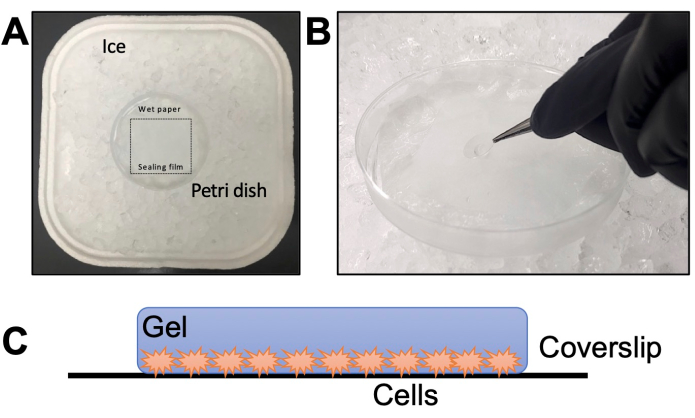
איור 2: פרטי שלב הגלציה. (A) הרכבה של החדר הלח. (B) הטלת החלקות הכיסוי על תמיסת המונומר עם TEMED ו-APS לג'לציה. (C) ייצוג סכמטי של הג'ל שהורכב להדמיה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
6. דנטורציה של דגימות הג'ל וביצוע ההתפשטות האיזוטרופית
- הסר את תמיסת הדנטורציה (שלב 2.5) מ- 4 מעלות צלזיוס. אם הוא זירז, לשים אותו באמבט מים חמים עד שהוא מתמוסס לחלוטין.
- הוסף 2 מ"ל של פתרון denaturing לכל באר של צלחת 6 באר. העבירו את החלקות הכיסויים משלב 5.3 לצלחת עם תמיסת הדנטורציה. יש לדגור במשך 15 דקות ב-RT עם ניעור עדין כדי שהג'ל יתנתק מהכיסוי.
- בזהירות להעביר את הג'ל (להסיר אותו מן כיסוי 12 מ"מ) עם מרית מתכת לתוך צינור microcentrifuge סטרילי 1.5 מ"ל עם 1 מ"ל של פתרון denaturing. השתמש במנעולי מכסה כדי לאבטח את הצינורות. יש לדגור במשך שעה ו-30 דקות בטמפרטורה של 95°C בבלוק חימום.
הערה: ג'לים מתחילים להתרחב במהלך שלב זה; להיות עדין בעת העברת הג'ל לצינור מיקרוצנטריפוגה 1.5 מ"ל.
אזהרה: לאחר הדגירה, הצינור המכיל את הג'ל נמצא בטמפרטורה של 95°C, מה שעלול להיות מסוכן. השתמש בכפפות מגן ותן לצינורות להתקרר לפני הטיפול בהם כדי למנוע כוויות והקרנות. - בצע את סבב ההרחבה הראשון
- לשאוף את הפתרון denaturing מן צינור microcentrifuge 1.5 מ"ל עם ג'ל עם פיפטה P1000. מעבירים את הג'ל מצינור מיקרוצנטריפוגה בנפח 1.5 מ"ל לצלחת פטרי עם 10 מ"ל מים אולטרה-טהורים למשך 30 דקות באמצעות מרית קטנה.
- החליפו את המים האולטרה-טהורים באמצעות פיפטה חד פעמית של 3 מ"ל פסטר. לדגור ON ב RT.
הערה: היו עדינים עם הג'לים מכיוון שלאחר 30 הדקות הראשונות של הדגירה, הם הפכו שבירים. - החליפו את המים האולטרה-טהורים באמצעות פיפטה חד פעמית של 3 מ"ל פסטר פעם נוספת.
הערה: שלוש דגירות מים של 30 דקות כל אחת מספיקות, אך לפרקטיות, עדיף להשאיר את הדגירה השנייה דולקת.
7. ביצוע תיוג פלואורסצנטי של חלבוני המטרה (יום 2)
- מוציאים את המים מצלחת הפטרי עם הג'ל עם פיפטה חד פעמית של 3 מ"ל. למדוד את הקוטר של ג'ל עם קליפר כדי לחשב את ההתפשטות (בין ארבע לחמש פעמים).
- יש לשטוף פעמיים עם 10 מ"ל PBS למשך 15 דקות. חותכים את הג'ל עם סכין גילוח לריבועים של כ 10 מ"מ x 10 מ"מ במרכז הג'ל העגול. השתמש בריבוע אחד לכל תנאי כדי להיבדק.
הערה: הג'ל מתכווץ לאחר דגירות PBS. ניתן לאחסן ג'לים ב-PBS בטמפרטורה של 4°C למשך עד שבוע. - מעבירים כל ריבוע לצלחת של 12 בארות ודגרים עם 500 μL של נוגדן ראשוני מדולל באלבומין סרום בקר 2% PBS (BSA) למשך שעתיים ו-30 דקות ב-37°C עם רעידות.
הערה: ניתן לבצע דגירה חלופית של נוגדנים ב-4°C. נפח הנוגדנים המינימלי שניתן להשתמש בו הוא 300 μL בצלחת 24 באר. ככלל, יש להשתמש בריכוז כפול של נוגדנים המשמשים לתיוג חיסוני קונבנציונלי. - יש לשטוף שלוש פעמים עם 2 מ"ל PBS עם 0.1% פוליסורבט 20 למשך 10 דקות תוך כדי ניעור צלחת של 6 בארות.
- מעבירים את הג'ל לצלחת של 12 בארות ודגרים עם 500 מיקרוליטר של נוגדן משני ב-PBS עם DAPI ו-10 מיקרוגרם/מ"ל NHS-ester מצומד לפלואורופור הרצוי למשך שעתיים ו-30 דקות ב-37°C עם טלטול עדין.
הערה: ככלל, יש להשתמש בריכוז כפול של נוגדנים המשמשים לתיוג חיסוני קונבנציונלי. לחלופין, דגירה זו יכולה להתבצע ON ב 4 ° C. - יש לשטוף שלוש פעמים עם 2 מ"ל PBS עם 0.1% פוליסורבט 20 למשך 10 דקות תוך כדי ניעור צלחת של 6 בארות.
- מעבירים את הג'ל לצלחת פטרי עם מים טהורים במיוחד. דוגרים במשך 30 דקות. החליפו את המים פעמיים עם פיפטה חד פעמית של 3 מ"ל פסטר, כפי שנעשה בשלב 6.4.
8. הדמיה ועיבוד תמונה (יום 3)
- מוציאים את המים מכלי הפטרי עם פיפטה חד פעמית של 3 מ"ל פסטר ומודדים את קוטר הג'ל עם קליפר כדי לחשב את גורם ההתפשטות.
- חותכים חתיכה קטנה של ~ 10 מ"מ x 10 מ"מ עם סכין גילוח ומניחים אותה על צלחת תחתית זכוכית 35 מ"מ.
הערה: כחלופה, הניחו את הג'ל בין מגלשה לכיסוי (ללא פולי-D-ליזין). המגלשה צריכה לכלול שתי חתיכות שקופיות קטנות יותר חתוכות עם סכין יהלום המחוברת בצדדים כדי ליצור תא בערך בעובי הג'ל. - בדוק את הכיוון בהגדלה של 10x או 20x. על מנת להתמקד כראוי, ודא כי הטפילים פונים אל הכיסוי; אחרת, צריך לסובב את הג'ל ולבדוק שוב (איור 2C).
- לאחר מציאת הכיוון הנכון, יבש את יתרת הג'ל בנייר מיקרוסקופי. מכסים את הג'ל בכיסוי מצופה פולי-D-ליזין.
- הוסף טיפה קטנה של מים טהורים במיוחד לג'ל כדי לדמיין עם מיקרוסקופ קונפוקלי.
הערה: כדי להבטיח הדמיה נכונה, חשוב לשמור על כיוון הג'ל לאורך כל התהליך, כך שהצד של הג'ל המכיל תאים קרוב לפני השטח שלו פונה לצלחת תחתית הזכוכית בקצה. בעת שימוש בצלחות 35 מ"מ, הוספת פולי-D-ליזין לכיסוי המונח בתחתית מפחיתה את תזוזת הג'ל במהלך רכישת התמונה. - פרמטרים של רכישת תמונה
- דמיינו את הדגימות במיקרוסקופ קונפוקלי (טבלת חומרים) באמצעות טבילת שמן 63x 1.4 צמצם נומרי (NA).
- קבל ערימות Z, הרוחב של כל צעד z וזמן חשיפה לפיקסל, שייקבעו אמפירית בהתאם לדגימה, עוצמת האות ומיטוב זמני הרכישה. השתמש בזום הסריקה להגדלה יעילה, אם תרצה בכך.
- פתח את ערימת Z באמצעות תוכנת עיבוד תמונה (רשימת חומרים). לכל ערוץ, קבץ את התמונות המוערמות באמצעות האפשרות Group Z-project . בחר את הקרנת העוצמה המרבית.
- למיזוג תמונות, השתמשו בכלי מיזוג ערוצים ובחרו בצבע של כל ערוץ. הוסף סרגל קנה מידה באמצעות הכלי סרגל קנה מידה בתוכנת העיבוד.
הערה: לחלופין, ניתן לצבוע כל ערוץ לפי הצורך (ראו דוגמאות בתוצאות המייצגות).
תוצאות
אם הפרוטוקול בוצע כראוי (איור 1), הדגימות ייראו כג'ל מישורי ושקוף שניתן להרחיב עד פי 4-4.5 במים (איור 3A). הרחבה זו סיפקה רזולוציה יעילה של כ -70 ננומטר, אשר עשויה להשתנות בהתאם לגורם ההתפשטות הסופי ומערכת ההדמיה בה נעשה שימוש. לאחר תהליך ההתפשטות...
Discussion
מיקרוסקופ הרחבה אולטרה-סטרוקטורלי הוא טכניקה המאפשרת קבלת תמונות ברזולוציה גבוהה של דגימות ביולוגיות על ידי הרחבתן פיזית עד פי כמה מגודלן המקורי. פרוטוקול U-ExM כולל מספר שלבים קריטיים שיש לבצע בזהירות כדי להשיג תוצאות אופטימליות4. ראשית, יש לתקן את המדגם עם ?...
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
אנו מודים לדולורס קמפוס על הסיוע בתרבית תאי ורו ורומינה מנרין על הסיוע בתרבית T. cruzi . עבודה זו נתמכה על ידי Agencia Nacional de Promoción Científica y Tecnológica, Ministerio de Ciencia e Innovación Productiva מארגנטינה (PICT2019-0526), Consejo Nacional de Investigaciones Científicas y Técnicas (PIBAA 1242) ומועצת המחקר של בריטניה [MR/P027989/1].
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 micrometers sterile syringe filters PES | Membrane solutions | SFPES030022S | |
| 1 L beaker | Schott Duran | 10005227 | |
| 1.5-mL SPINWIN Micro Centrifuge Tube | Tarson | T38-500010 | |
| 10 mL disposable sterile serynge | NP | 66-32 | |
| 10 mL serological pipette sterile | Jet Biofil | GSP211010 | |
| 12-mm coverslips | Merienfeld GmbH | 01 115 20 | Round coverslips |
| 12-well plates | Jet Biofil | TCP011012 | |
| 22-mm coverslips | Corning | 2845-22 | Square coverslips |
| 24-well plates | Jet Biofil | TCP-011-024 | |
| 250 mL beaker | Schott Duran | C108.1 | |
| 3 mL Pasteur pipette | Deltalab | 200037 | |
| 35-mm glass bottom dishes | Matsunami glass ind | D11130H | |
| 4′,6-Diamidine-2′-phenylindole dihydrochloride | Sigma Aldrich | D9542 | DAPI |
| 5 ml serological pipette sterile | Jet Biofil | GSP010005 | |
| 6-well plates | Sarstedt | 83.3920 | |
| Acrilamide | BioRad | 1610101 | |
| Ammonium persulfate | Sigma Aldrich | A3678-25G | APS |
| ATTO 647 NHS ester | BOC Sciences | F10-0107 | For pan-proteome labelling |
| Biosafty Cabinet | Telstar | Bio II A/P | |
| Bovine Sodium Albumine | Sigma Aldrich | A7906 | BSA |
| CO2 Incubator | Sanyo | MCO-15A | |
| Confocal Microscope | Zeiss | LSM 880 | |
| Disposable Petridish | Tarsons | 460095 | 90 mm diameter |
| DMEM, High Glucose | Thermo Fisher Cientific | 12100046 | Powder |
| Electronic digital caliper | Radar | RADAR-SLIDE-CALIPER | |
| Ethanol Absolute | Supelco | 1,00,98,31,000 | |
| Fetal Calf Serum | Internegocios SA | FCS FRA 500 | Sterile and heat-inactivated |
| Fiji image processing package | ImageJ | doi:10.1038/nmeth.2019 | |
| Formaldehyde 37% | Sigma Aldrich | F8775 | FA |
| Glass Petridish | Marienfeld Superior | PM-3400300 | 60 mm diameter |
| Glucosa D(+) | Cicarelli | 716214 | |
| Glutaraldehyde 70% | Sigma Aldrich | G7776 | |
| Goat anti-Mouse IgG Secondary Antibody Alexa Fluor 555 | Invitrogen | A-21422 | |
| Goat anti-Rabbit IgG Secondary Antibody FICT | Jackson Immunoresearch | 115-095-003 | |
| Graduated cylinder | Nalgene | 3663-1000 | |
| Graduated glass flask | Glassco | GL-274.202.01 | 100 mL |
| Heating Block | IBR | Made in house | |
| Hemin | Frontier Scientific | H651-9 | |
| Hydrochloric acid 36.8-38.0% | Ciccarelli | 918110 | |
| Ice bucket | Corning | 1167U68 | |
| Incubator | Tecno Dalvo | TOC130 | |
| Liver Infusion | Difco | 226920 | |
| Magnetic stirrer and heater | Lab companion | HP-3000 | |
| Metal spatula | SALTTECH | 200MM | |
| Metal tweezers | Marienfeld Superior | PM-6633002 | |
| Methanol absolut | Cicarelli | 897110 | |
| Microcentrifuge tube 1.5 mL | Tarson | 500010-N | |
| Microscopy grade paper KimWipes | Kimtech Science | B0013HT2QW | |
| Milli-Q water sistem | Merk Millipore | IQ-7003 | |
| mouse anti- alpha tubulin clone DM1A | Sigma Aldrich | T9026 | |
| mouse anti-PFR | Purified antibodies | Donated by Dr. Ariel Silber (USP) | |
| N,N´-methylenbisacrilamide | ICN | 193997 | BIS |
| Na2HPO4 | Cicarelli | 834214 | |
| Neubauer chamber | Boeco | BOE 01 | |
| p1000 pipette | Gilson | PIPETMAN P1000 | |
| p1000 pipette tips | Tarson | TAR-521020B | |
| p20 pipette | Gilson | PIPETMAN P20 | |
| p20 pipette tips | Tarson | TAR-527108 | |
| p200 pipette | Gilson | PIPETMAN P200 | |
| p200 pipette tips | Tarson | TAR-521010Y | |
| Paraformaldehyde | Sigma Aldrich | P6148 | PFA |
| pH / ORP / °C meter | HANNA Instruments | HI 2211 | |
| Poly-D-Lysine 0.1% | Sigma Aldrich | P8920 | |
| Potassium Chloride | Cicarelli | 867212 | KCl |
| Razor blade | Printex | BS 2982:1992 | |
| Sealing FIlm "Parafilm M" | Bemis | PM996 | |
| Sodium Acrilate | Sigma Aldrich | 408220-25G | SA |
| Sodium Bicarbonate | Cicarelli | 929211 | NaHCO3 |
| Sodium Chloride | Cicarelli | 750214 | NaCl |
| Sodium Dodecyl Sulfate | BioRad | 1610302 | SDS |
| Sodium Hidroxide | Merk | 1-06498 | NaOH |
| Sorvall ST 16 Centrifuge | Thermo Fisher Scientific | 75004380 | |
| T-25 flasks | Corning | 430639 | |
| TEMED | Invitrogen | 15524-010 | |
| Tissue paper | Elite | ||
| Triptose | Merck | 1106760500 | |
| Tris | BioRad | 1610719 | |
| Tween-20 | Biopack | 2003-07 | Polysorbate 20 |
| Vaccum pump | Silfab | N33-A | |
| Vero cells | ATCC | CRL-1587 | |
| Vortex MIxer | Dragon Lab | MX-S |
References
- Chen, F., Tillberg, P. W., Boyden, E. S. Expansion microscopy. Science. 347 (6221), 543-548 (2015).
- Chozinski, T. J., et al. Expansion microscopy with conventional antibodies and fluorescent proteins. Nature Methods. 13 (6), 485-488 (2016).
- Ku, T., et al. Multiplexed and scalable super-resolution imaging of three-dimensional protein localization in size-adjustable tissues. Nature Biotechnology. 34 (9), 973-981 (2016).
- Gambarotto, D., et al. Imaging cellular ultrastructures using expansion microscopy (U-ExM). Nature Methods. 16 (1), 71-74 (2018).
- Tillberg, P. W., Chen, F. Expansion microscopy: Scalable and convenient super-resolution microscopy. Annual Review of Cell and Developmental Biology. 35, 683-701 (2019).
- Jurriens, D., van Batenburg, V., Katrukha, E. A., Kapitein, L. C. Mapping the neuronal cytoskeleton using expansion microscopy. Methods in Cell Biology. 161, 105-124 (2021).
- Alonso, V. L. Ultrastructure expansion microscopy (U-ExM) in Trypanosoma cruzi: localization of tubulin isoforms and isotypes. Parasitology Research. 121 (10), 3019-3024 (2022).
- Kalichava, A., Ochsenreiter, T. Ultrastructure expansion microscopy in Trypanosoma brucei. Open Biology. 11 (10), 210132 (2021).
- Amodeo, S., et al. Characterization of the novel mitochondrial genome segregation factor TAP110 in Trypanosoma brucei. Journal of Cell Science. 134 (5), (2021).
- Liffner, B., Absalon, S. Expansion microscopy reveals plasmodium falciparum blood-stage parasites undergo anaphase with a chromatin bridge in the absence of mini-chromosome maintenance complex binding protein. Microorganisms. 9 (11), 2306 (2021).
- Dos Santos Pacheco, N., Soldati-Favre, D. Coupling auxin-inducible degron system with ultrastructure expansion microscopy to accelerate the discovery of gene function in Toxoplasma gondii. Methods in Molecular Biology. 2369, 121-137 (2021).
- Lidani, K. C. F., et al. Chagas disease: From discovery to a worldwide health problem. Frontiers in Public Health. 7, 166 (2019).
- Carrea, A., Diambra, L. Systems biology approach to model the life cycle of Trypanosoma cruzi. PloS One. 11 (1), e0146947 (2016).
- Vidal, J. C., De Souza, W. . Morphological and Functional Aspects of Cytoskeleton of Trypanosomatids. Cytoskeleton - Structure, Dynamics, Function and Disease. , (2017).
- Kunz, T. C., Götz, R., Gao, S., Sauer, M., Kozjak-Pavlovic, V. Using expansion microscopy to visualize and characterize the morphology of mitochondrial cristae. Frontiers in Cell and Developmental Biology. 8, 617 (2020).
- Laporte, M. H., Klena, N., Hamel, V., Guichard, P. Visualizing the native cellular organization by coupling cryofixation with expansion microscopy (Cryo-ExM). Nature Methods. 19 (2), 216-222 (2022).
- Sahabandu, N., et al. Expansion microscopy for the analysis of centrioles and cilia. Journal of Microscopy. 276 (3), 145-159 (2019).
- Wen, G., Leen, V., Rohand, T., Sauer, M., Hofkens, J. Current progress in expansion microscopy: chemical strategies and applications. Chemical Reviews. 123 (6), 3299-3323 (2023).
- Trinks, N., et al. Subdiffraction-resolution fluorescence imaging of immunological synapse formation between NK cells and A. fumigatus by expansion microscopy. Communications Biology. 4 (1), 1151 (2021).
- White, B. M., Kumar, P., Conwell, A. N., Wu, K., Baskin, J. M. Lipid expansion microscopy. Journal of the American Chemical Society. 144 (40), 18212-18217 (2022).
- Steib, E., et al. TissUExM enables quantitative ultrastructural analysis in whole vertebrate embryos by expansion microscopy. Cell Reports Methods. 2 (10), 100311 (2022).
- Shaib, A. H., et al. Visualizing proteins by expansion microscopy. bioRxiv. , (2023).
- M'Saad, O., et al. All-optical visualization of specific molecules in the ultrastructural context of brain tissue. bioRxiv. , (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved