A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
فعالية الوخز بالإبر تحت الجلد لفو على آلام العصب الوركي: التغيرات السلوكية والفيزيولوجية الكهربية في نموذج إصابة الفئران بإصابة الانقباض المزمن
* These authors contributed equally
In This Article
Summary
نقدم بروتوكولا لاستخدام الوخز بالإبر تحت الجلد لفو في نموذج إصابة انقباض مزمن للحث على ألم العصب الوركي في الفئران.
Abstract
يتم استخدام الوخز بالإبر تحت الجلد (FSN) ، وهي تقنية مبتكر للوخز بالإبر من الطب الصيني التقليدي ، في جميع أنحاء العالم لتخفيف الآلام. ومع ذلك ، لا تزال آليات العمل غير مفهومة تماما. أثناء علاج FSN ، يتم إدخال إبرة FSN والاحتفاظ بها في الأنسجة تحت الجلد لفترة طويلة مع حركة متمايلة. ومع ذلك ، تنشأ التحديات من الحفاظ على الموقف أثناء التلاعب ب FSN في النماذج الحيوانية (مثل الفئران) للباحثين. يمكن أن يؤدي العلاج غير المريح إلى الخوف ومقاومة إبر FSN ، مما يزيد من خطر الإصابة وقد يؤثر حتى على بيانات البحث. قد يؤثر التخدير أيضا على نتائج الدراسة أيضا. وبالتالي ، هناك حاجة إلى استراتيجيات في علاج FSN على التي تقلل من الإصابة أثناء التدخل. تستخدم هذه الدراسة نموذج إصابة انقباض مزمن في فئران Sprague-Dawley للحث على آلام الأعصاب. يكرر هذا النموذج الألم الناجم عن إصابة الأعصاب التي لوحظت في البشر من خلال الانقباض الجراحي للعصب المحيطي ، محاكيا الضغط أو الانحباس الذي يظهر في حالات مثل متلازمات ضغط الأعصاب واعتلالات الأعصاب الطرفية. نقدم معالجة مناسبة لإدخال إبرة FSN بسهولة في الطبقة تحت الجلد من جسم ، بما في ذلك إدخال الإبرة واتجاهها ، والاحتفاظ بالإبرة ، وحركة التأرجح. التقليل من انزعاج الفئران يمنع الفئران من التوتر ، مما يؤدي إلى تقلص العضلات وإعاقة دخول الإبرة وتحسين كفاءة الدراسة.
Introduction
يقدر أن ألم الأعصاب ، الذي يعرف بأنه الألم الناجم عن تلف الأعصاب ، يؤثر على 6.9٪ -10٪ من سكان العالم ، ومعدل الانتشار المبلغ عنه مدى الحياة هو 49٪ -70٪ 1,2. كما أنها تعتبر واحدة من أصعب متلازمات الألم لإدارتها. حقق استخدام العوامل الدوائية لإدارة آلام الأعصاب نجاحا محدودا حيث أظهرت أدوية الألم الموصوفة عادة مثل العقاقير غير الستيرويدية المضادة للالتهابات والمواد الأفيونية فعالية قليلة في تخفيف هذا النوع من الألم 3,4. لذلك هناك حاجة كبيرة لاستكشاف خيارات علاجية جديدة ، وخاصة العلاجات غير الدوائية. الوخز بالإبر ، كتدخل غير دوائي ، يحتمل أن يخفف من آلام الأعصاب عن طريق ممارسة تأثيرات مسكنة على الجهاز الحسي الجسدي. أشارت كل من الدراسات السريرية وما قبل السريرية إلى أن الوخز بالإبر فعال في تخفيف أعراض آلام الأعصاب دون آثار جانبية كبيرة5،6،7. ومع ذلك ، فإن الآلية المركزية لعلاج الوخز بالإبر لتخفيف الآلام في آلام الأعصاب لا تزال بحاجة إلى مزيد من التحقيق.
في السنوات الأخيرة ، اكتسبت الوخز بالإبر تحت الجلد (FSN) شعبية لعلاج الاضطرابات العصبية المرتبطة بالألم8. نشأت FSN من الوخز بالإبر الصينية التقليدية وتم وصفها لأول مرة من قبل الطبيب الصيني التقليدي Zhonghua Fu في عام 1996 9,10. في حين نشأت من الوخز بالإبر التقليدية ، تختلف FSN اختلافا كبيرا في تقنياتها ونظرياتها عن الوخز بالإبر القائم على خط الطول ، ومبادئ يين ويانغ ، ومفاهيم نقطة الوخز بالإبر. تركز FSN بشكل أكبر على الأساليب الفسيولوجية العصبية والتشريحية لمعالجة آلام اللفافة العضلية بشكل فعال11. يتم تطبيق علاج FSN في الممارسة السريرية لمعالجة مختلف الاضطرابات العضلية المؤلمة ، واستهداف الأنسجة الضامة المرتبطة ارتباطا وثيقا بالعضلات ، مع التركيز بشكل خاص على علاج العضلات المشدودة (TMs)12. كعلاج تكميلي لتخفيف الآلام ، هناك أيضا أدلة سريرية على أن FSN فعال في علاج إصابات الأنسجة الرخوة بالإضافة إلى توفير إدارة سريعة للألم وتحسين كبير في تشنجات الأنسجة الرخوة13,14. يتضمن العلاج FSN تقنيات محددة مصممة خصيصا لمعالجة نقاط الزناد الليفي العضلي الأساسية (MTrPs) المرتبطة بالحالة. يتم اختيار موضع إدخال إبرة FSN بعناية بناء على موقع نقاط الزناد هذه ، مما يسمح بالاستهداف الدقيق للمناطق المصابة. أثناء الإجراء ، يتم إدخال إبرة FSN في الطبقة تحت الجلد ، حيث يتم إيقافها عمدا لتحسين الآثار العلاجية. ثم يتم استخدام تقنية مميزة تعرف باسم حركة التمايل ، والتي تنطوي على حركة تذبذب لطيفة للإبرة لتحفيز الأنسجة وتعزيز الاستجابات العلاجية10. يرتبط تطوير MTrPs بنظرية أزمة الطاقة ، والتي توضح أن عوامل مثل الحمل الزائد للعضلات المزمن ، والتمرين المفرط ، والمواقف الجهدية غير السليمة ، وضمور العضلات ، والانحطاط يمكن أن تسهم في ظهور نقص تروية الأنسجة العضلية ونقص الأكسجة. يعتقد أن نقص الأكسجين والطاقة داخل الأنسجة العضلية يلعب دورا رئيسيا في تكوين MTrPs15,16. وقد وجدت الدراسات الحيوانية السابقة أن علاج FSN للألم المزمن في الفئران يحسن التركيب المورفولوجي ووظيفة الميتوكوندريا في TMs إلى حد ما ، مما يؤكد إمكانات علاج FSN لتعزيز استعادة الأعصاب والعضلات التالفة17.
تم تصنيف عرق النسا على أنه ألم الأعصاب18. يعتقد أن أصل ألم الأعصاب يكمن في أي مكان بين الصفيحة الطرفية الحركية والطبقة الليفية الخارجية للعضلة ، بما في ذلك نظام الأوعية الدموية الدقيقة والناقلات العصبية على المستوى الخلوي. يحدث فقدان تعصيب العضلات وموت الخلايا المبرمج للخلايا العصبية المعصبة عندما يحدث تلف الأعصاب19 ، مما يؤدي إلى مشية مرتبطة بالألم في الطرف المصاب. بالإضافة إلى ذلك ، يمكن أن يؤدي الضغط المزمن أو تهيج العصب إلى مجموعة متنوعة من التغييرات في طريقة وظائف الأعصاب ، والتي يمكن أن تزيد من تفاقم أعراض عرق النسا20. ومع ذلك ، فإن تعقيد الجهاز العصبي يجعل من الصعب تكراره في المختبر ، مما يستلزم استخدام النماذج الحيوانية لمثل هذه الدراسات. في التحقيق في اضطرابات آلام الأعصاب ، يتم استخدام الكائنات الحية النموذجية بشكل شائع ، والتي تنطوي على طرق مختلفة لإصابة الأعصاب الطرفية المباشرة ، مثل رباط العصب الوركي ، أو الاستئصال ، أو الضغط21,22. تم استخدام نموذج إصابة الانقباض المزمن (CCI) في فئران Sprague-Dawley للحث على آلام الأعصاب. يكرر هذا النموذج الألم الناجم عن إصابة الأعصاب التي لوحظت في البشر من خلال الانقباض الجراحي للعصب المحيطي ، محاكيا الضغط أو الانحباس الذي يظهر في حالات مثل متلازمات ضغط الأعصاب واعتلالات الأعصاب الطرفية.
في هذه الدراسة ، قمنا بتقييم الآثار المسكنة للعلاج FSN والعلاج الكهربائي منخفض التردد (محفز الأعصاب الكهربائي عبر الجلد ، TENS) في الفئران المصابة بإصابة انقباض مزمنة وآلام الأعصاب. نظرا لأن التخدير يبطئ أو يمنع النبضات العصبية ويؤثر على انتقال متشابك ووظيفة الخلايا العصبية23 ، لا يمكن تخدير في جميع إجراءات الوخز بالإبر وحركات التأرجح. لذلك ، هناك حاجة إلى تقنية إبرة مناسبة للحد من الانزعاج في الفئران. يتم وصف خطوات إنشاء نموذج CCI للفئران ، والطريقة التي عولجت بها الفئران بحركة تمايل مشتركة FSN دون تخدير ، واختبارات نمط سلوك الممكنة ، والتحقيقات الفيزيولوجية الكهربية بالتفصيل.
Protocol
تمت الموافقة على جميع الإجراءات التي تنطوي على مواضيع حيوانية من قبل اللجنة المؤسسية لرعاية واستخدام (IACUC) التابعة لمستشفى Chang Bing Show Chwan Memorial ، Changhua ، تايوان (111031) في أكتوبر 2022 (الشكل 1).
1. إعداد
- شراء 48 ذكرSprague-Dawley (SD) الفئران (العمر: 8-10 أسابيع ، الوزن: 250-300 غرام).
- فئران المنزل بشكل فردي في أقفاص جيدة التهوية عند 24 ± 2 درجة مئوية ودورة مظلمة وخفيفة لمدة 12 ساعة.
- تغذية الفئران نظام غذائي بيليه قياسي مع مياه الشرب المعقمة الجاهزة للاستخدام ، وتوفير الفراش لينة.
2. تجميع
- قسم عشوائيا 48 فأرا SD إلى ست مجموعات (n = 8 لكل مجموعة): المجموعة الوهمية ، مجموعة CCI ، مجموعة CCI + FSN ، مجموعة CCI + TENS ، مجموعة FSN وحدها ، ومجموعة TENS وحدها كما في الدراسة السابقة التي أجراها Chan et al.24.
ملاحظة: تفاصيل ست مجموعات: (1) مجموعة صورية: لا جراحة ولا علاج. (2) مجموعة CCI: مستعدة للجراحة بدون علاج ؛ (3) مجموعة علاج CCI + FSN: معالجة FSN بعد نمذجة CCI الناجحة ؛ (4) مجموعة علاج CCI + TENS: علاج TENS بعد نمذجة CCI الناجحة ؛ (5) مجموعة العلاج FSN وحدها: علاج FSN فقط بدون جراحة ؛ (6) مجموعة علاج TENS وحدها: علاج TENS فقط بدون جراحة.
3. إنشاء نموذج الفئران CCI
ملاحظة: تم تعديل نموذج جراحة CCI في الفئران وفقا لبينيت وشيه التي أجريت في 198825.
- تأكد من أن المشغل يرتدي قناعا جراحيا وغطاء تشغيل يمكن التخلص منه وقفازات معقمة.
- تطهير سطح الطاولة الجراحية مع 70 ٪ من الإيثانول. تعقيم الأدوات (على سبيل المثال ، المقص والملقط والمبعدات) والشاش والدبابيس ومسحات القطن عن طريق التعقيم.
ملاحظة: يتم استخدام تقنيات التعقيم طوال العملية الجراحية. - تخدير الفئران بنسبة 4٪ إيزوفلوران بعد تحضير الجلد القياسي (الحلاقة) والحفاظ عليها باستخدام 2٪ إيزوفلوران (الشكل 2 أ).
- تأكد من عمق التخدير المناسب من خلال ملاحظة عدم الاستجابة بعد قرص المخلب الخلفي ومراقبة الفئران المخدرة طوال العملية.
- ضع ما يكفي من مرهم العيون البيطري على العينين للحماية من التجفيف.
- ضع الفئران في وضعية الانبطاح على طاولة العمليات وحلق الشعر على جانب الساق الخلفية اليمنى ، ثم قم بتطهير الجلد بمحلول بوفيدون اليود و 75٪ إيثانول ثلاث مرات. توفير الدعم الحراري طوال العملية واستخدام الستائر المعقمة لتغطية موقع الجراحة.
- قم بعمل شق مواز في الجلد 3-4 مم تحت عظم الفخذ بحوالي 20-50 مم.
- إعطاء الأولوية لتحديد مواقف الألوية الكبرى والعضلة ذات الرأسين الفخذية. افصل الدهون تحت الجلد وطبقة اللفافة السطحية طبقة تلو الأخرى باستخدام مقص جراحي ، مع قطع النسيج الضام المحيط لكشف العضلات (الشكل 2 ب).
ملاحظة: لتمييز الدهون تحت الجلد وطبقات اللفافة السطحية ، راقب الملمس واللون. يجب أن تظهر طبقة الدهون تحت الجلد ناعمة ومرنة مع مظهر مصفر أو أبيض. اللفافة السطحية هي طبقة ليفية رقيقة تقع مباشرة تحت الدهون تحت الجلد. التفريق بين الطبقات عن طريق الجس بلطف أو التحقيق بأداة حادة ، مع ملاحظة أن الدهون تحت الجلد توفر مقاومة أكبر للضغط مقارنة باللفافة السطحية.
- باستخدام مقص حاد ، قم بقطع النسيج الضام بين الألوية السطحية وعضلات العضلة ذات الرأسين الفخذية.
- قم بتوسيع الفجوة بين هاتين العضلتين باستخدام مبعدة لكشف العصب الوركي (الشكل 2C).
ملاحظة: للتعرف بصريا على العصب الوركي في الفئران ، ركز على منطقة الفخذ. حدد نقطة منتصف منطقة الفخذ لتصور العصب الوركي. عادة ، يمتد العصب على طول الجانب الخلفي من الفخذ ، بدءا من منطقة الورك ويمتد نحو الركبة. - دون تغيير مورفولوجيا العصب ، اختر العصب الوركي بإبرة مجهرية من خلال مصدر ضوء جيد. اربط العصب الوركي مرتين باستخدام 3-0 أربطة أمعاء كرومية ، مع وضع نقاط الرباط على بعد حوالي 1 مم بين الغرزتين.
- بدءا من حلقة فضفاضة لكل رباط ، أمسك نهايات الرباط بالقرب من الحلقة وشدها حتى تصبح الحلقة دافئة ، مما يضمن عدم انزلاق الرباط على طول العصب. توقف عند ملاحظة ارتعاش طفيف للطرف أثناء الربط (الشكل 2 د).
- قم بتوسيع الفجوة بين هاتين العضلتين باستخدام مبعدة لكشف العصب الوركي (الشكل 2C).
- أغلق طبقة العضلات والجلد بطبقة باستخدام 4-0 خطوط خياطة. أخيرا ، قم بتطهير الجرح باليود (الشكل 2E).
- راقب عن كثب العلامات الحيوية للفئران أثناء التخدير وضعها في أقفاص التعافي الفردية حتى تستيقظ قبل وضعها مرة أخرى في أقفاصها. قم بتبطين الأقفاص بفراش ورقي مسطح لمنع الاختناق في الفاقدة للوعي. يشير ارتعاش قصير في الطرف بعد الجراحة إلى عملية ناجحة (الشكل 2F).
- قم بإجراء اختبار فرط الحساسية للألم عدة مرات قبل CCI (خط الأساس) وفي نقاط زمنية مختلفة بعد CCI.
- راقب الألم التلقائي والتغيرات السلوكية في الأيام 1 و 3 و 5 و 7 التالية لبناء النموذج.
ملاحظة: راقب مشية ووضعية الطرف الخلفي الأيمن ووجود لعق وعض على الطرف.- تحديد وجود ألم الأعصاب لتحديد الإنشاء الناجح للنموذج واستبعاد الفئران غير الناجحة.
ملاحظة: قم بتقييم نجاح النموذج من خلال ملاحظة علامات مثل الضعف في المشي في الأطراف السفلية ، وأصابع الطرف الأيمن متماسكة مع أروح خفيف ، والتدلي المتكرر ، والإحجام عن الهبوط. لاحظ أن الجرذ يقف مع الطرف الخلفي الأيسر الذي يدعم الوزن ، بينما يتم رفع الطرف الخلفي الأيمن وقريب من البطن.
- تحديد وجود ألم الأعصاب لتحديد الإنشاء الناجح للنموذج واستبعاد الفئران غير الناجحة.
4. إدارة التلاعب FSN
- ثبت فأر مجموعة العلاج FSN (بما في ذلك CCI + FSN ومجموعة FSN وحدها) في تقييد القوارض مع تعرض الطرف المصاب جانبيا. توفير الدعم الحراري طوال العملية. عولجت كلتا المجموعتين بإبر FSN التي تستخدم لمرة واحدة (الشكل 3 أ).
- بدون تخدير ، قم بتمديد الأطراف الخلفية للفأر تدريجيا وببطء حتى يتم شدها بإحكام (الشكل 3 ب).
ملاحظة: رأس الجرذ مغطى بستارة جراحية للحفاظ على هدوء واستقراره. لا تفرط في تمديد الساق لتسبب إصابة الفئران. راقب استجابة الفئران عن كثب بحثا عن أي علامات على الضيق أو الانزعاج. إذا أظهر الجرذ علامات الألم أو عدم الراحة ، فقم بإيقاف التمديد وتوفير استراحة قبل المحاولة مرة أخرى. - قم بإزالة الغلاف الواقي لإبرة FSN.
- أدخل طرف إبرة FSN باتجاه TMs (العضلات مع MTrPs) ، بالقرب من عضلة الألوية الكبرى تقريبا ، الموجودة في أسفل الظهر والخلف.
- ضع إبرة FSN بشكل مسطح وأدخل الجلد بزاوية 15 درجة تقريبا.
- ادفعه بعناية وبسرعة عبر الجلد وفي الفضاء تحت الجلد لمنع الإجهاد في الفئران حتى يتم إدخاله بالكامل. تأكد من إدخال الإبرة بشكل كاف لدفن الأنبوب الناعم بالكامل تحت الجلد.
- عند الدفع للأمام ، ارفع طرف الإبرة قليلا لمراقبة ما إذا كان انتفاخ الجلد يتحرك على طول طرف الإبرة (الشكل 3C).
- قم بإجراء حركة التمايل عن طريق تحريك طرف إبرة FSN بسلاسة ونعومة بالإبهام كنقطة ارتكاز مع الحفاظ على محاذاة السبابة والإصبع الأوسط والبنصر في خط مستقيم.
- أمسك إبرة FSN بين الإصبع الأوسط والإبهام في وضع وجها لوجه ، وقم بتبديل الحركة ذهابا وإيابا باستخدام السبابة والبنصر.
- اضبط التردد على 100 ضربة في الدقيقة وقم بإجراء العملية لمدة 1 دقيقة تقريبا (الشكل 3D).
- بعد الانتهاء من التلاعب ، اسحب إبرة FSN بسرعة.
ملاحظة: تم إجراء العملية كل يومين لما مجموعه أربع جلسات (الأيام 1 و 3 و 5 و 7 بعد إنشاء نموذج CCI). يجب استخدام إبر FSN التي يمكن التخلص منها مرة واحدة. الاستخدام المتكرر سوف يضعف الإبرة ويسبب زيادة الألم في الفئران.
5. إدارة التلاعب TENS
- ثبت فأر مجموعة علاج TENS (بما في ذلك CCI + TENS ومجموعة TENS وحدها) في تقييد القوارض مع تعرض الطرف المصاب بشكل جانبي. توفير الدعم الحراري طوال العملية. تأكد من حلق الفراء قبل معالجته.
ملاحظة: تم قطع الأقطاب الكهربائية إلى 45 مم (طول) × 5 مم (عرض) (الشكل 4 أ). - اختر نقطة Zusanli (ST36) ونقطة Sanyinjiao (SP6) كمواقع ل TENS. يعتمد هذا على نظرية علاج آلام الأعصاب26,27.
- حدد موقع نقطة Zusanli (ST36) على بعد حوالي 5 مم من الحديبة الأمامية للساق بين الظنبوب والشظية أسفل الركبةمباشرة 28.
- حدد موقع نقطة Sanyinjiao (SP6) عند الحد الخلفي للساق ، 3 مم بالقرب من malleolusالإنسي 28.
ملاحظة: تقع كل من نقطتي الوخز بالإبر هاتين عن طريق الفحص اليدوي كما هو موضح من قبل Stux و Pomeranz وفي أطلس الوخز بالإبر الحيوانية28،29 (الشكل 4B).
- قم بتوصيل تحفيز كهربائي منخفض التردد (موجة جيبية مستمرة 2 هرتز ، 3 مللي أمبير) لمدة 10 دقائق باستخدام جهاز TENS مع وضع القطب الكهربائي على الساق حول العصب. قم بتغطية رأس رأس الجرذ بستارة جراحية لإبقائه هادئا ومستقرا.
ملاحظة: يتم تنفيذ هذا الإجراء كل يومين لما مجموعه أربع جلسات (الأيام 1 و 3 و 5 و 7 بعد إنشاء نموذج CCI).
6. القياسات الفسيولوجية التي تؤدي اختبار سلوك
ملاحظة: مؤشر الوظيفة الوركية (SFI) 30 هو مؤشر يستخدم على نطاق واسع من قبل الباحثين الذين يدرسون علم الأمراض والعلاج المحتمل لإصابات الأعصاب ، ويتم تحديده من خلال مقارنة هندسة المخلب الخلفي المصاب في الفئران المصابة مع هندسة المخلب المقابل ومقارنته بالمخلب المعاكس.
- صمم ممرات الفئران بزجاج شبكي شفاف ومرايا مائلة لالتقاط آثار الأقدام واتجاه جسم الفئران أثناء المشي.
ملاحظة: الممشى عبارة عن منصة بطول 10 سم وعرض 50 سم وارتفاع 15 سم مع بطانة من الورق الأبيض في الأسفل (الشكل 5 أ). - ضع الفئران برفق وحرية في الصندوق واسمح لها بالتأقلم مع بيئتها الجديدة لمدة 5 دقائق على الأقل قبل التسجيل.
ملاحظة: يتم توخي الحذر بشكل خاص لتقليل الضغط غير الضروري على لتجنب تأثيره المحتمل على توتر العضلات الوضعي. - اغمس مخالب الفئران بالحبر الأحمر واسمح للفأر بالسير على طول شريط الممشى ، تاركا آثارا على ورق الدعم. سجل ما لا يقل عن 2 ثانية من المشي المستمر لكل اختبار. اجعل الجرذ يمشي 3 مرات على الأقل في اتجاه واحد (الشكل 5 ب).
ملاحظة: ضع حبرا أحمر سريع الجفاف وغير سام وقابل للذوبان في الماء على كلتا القدمين الخلفيتين لجعل آثار الأقدام الخلفية مرئية بوضوح. - في نهاية التجربة ، جفف شرائط الممشى لقياس المعلمات. قم بقياس آثار أقدامهم باستخدام المسطرة وقم بتقريبها إلى أقرب 0.5 مم.
ملاحظة: تم اختيار ثلاثة آثار أقدام واضحة من كل فأر من عدة آثار أقدام ، وتم قياس ثلاثة معلمات مختلفة. تشمل عوامل SFI طول الطباعة (PL) وانتشار إصبع القدم (TS) وانتشار إصبع القدم المتوسط (ITS).
يتم حساب قيم SFI باستخدام الصيغة التالية31: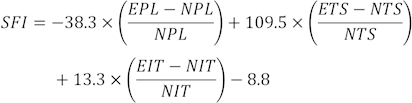
(EPL ، طول الطباعة التجريبية ؛ NPL ، طول الطباعة العادي ؛ ETS ، انتشار اصبع القدم التجريبية. NTS ، انتشار إصبع القدم الطبيعي ؛ EIT ، انتشار إصبع القدم الوسيط التجريبي ؛ NIT ، انتشار إصبع القدم المتوسط.)
SFI = 0 و - 100 يشير إلى خلل وظيفي طبيعي وكامل. تم تعيين الفئران التي سحبت أصابع قدميها بشكل تعسفي بقيمة -100. بالنسبة للوظيفة العصبية الطبيعية ، يتذبذب SFI حول 0 ، بينما يمثل حوالي -100 SFI خللا كاملا32.
7. التقييم الفسيولوجي العصبي عن طريق القياس الكهربي33
ملاحظة: تم استخدام تخطيط كهربية العضل لتسجيل النشاط الفيزيولوجي الكهربي في هذه الدراسة. تحدث إمكانات عمل العضلات المركبة (CMAP) بسبب تنشيط ألياف العضلات في العضلات المستهدفة التي يوفرها العصب. يتم التحقيق في سعة CMAP وزمن الوصول. يتم قياس سعة CMAP من خط الأساس إلى الذروة السالبة. يتم تحديد زمن انتقال CMAPs عن طريق قياس الوقت بين تطبيق التحفيز وبداية جهد الفعل المركب ، والذي يتأثر بالمسافة بين موقع التحفيز وموقع التسجيل. يوفر الفيزيولوجيا الكهربية تقييما موضوعيا لوظيفة الأعصاب الطرفية في الفئران.
- تطبيق زوليتيل 50 (40 ملغ/كغ، IP) لتخدير الفئران. تحضير الجلد وفقا للبروتوكولات القياسية (الحلاقة).
- ضع أقطاب سطح لاصقة يمكن التخلص منها (قطر خارجي 20 مم) على المناطق المخصصة. ثبت أقطاب التسجيل على الأسطح الجانبية والظهرية لعضلة الساق (الشكل 6 أ).
- تطبيق التحفيز الكهربائي (شدة 1.2 مللي أمبير) على جذع العصب الوركي القريب الأيمن. سجل جهد عمل العضلات المركبة (CMAP) على بطن عضلة الساق (الشكل 6 ب).
ملاحظة: كن حذرا عند إدخال الأقطاب الكهربائية لتجنب الأنسجة العضلية. - سجل تأثير ثلاثة قياسات متكررة لكل فأر.
ملاحظة: يتم التعبير عن CMAP كمتوسط ± SD لكل مجموعة. تم تضخيم الإشارة بواسطة مكبر للصوت ، تمت تصفيته (0.3-3 كيلو هرتز). بعد التكامل (ثابت الوقت = 0.05 ثانية) ، يتم إدخال كل من الإشارة الأصلية والإشارة المتكاملة. ثم يتم رقمنة الإشارة الأصلية والإشارة المدمجة في نظام PowerLab وتخزينها على القرص الصلب للكمبيوتر. - بعد الانتهاء من إجراءات الفيزيولوجيا الكهربية ، انقل الجرذ إلى قفص مختلف وراقبه حتى يستعيد وعيه الكافي للحفاظ على وضع راقد القص. بمجرد أن يتعافى الجرذ تماما من المخدر ، قم بنقله مرة أخرى إلى قفصه الأصلي.
8. الإحصاءات:
- تقييم الاختلافات في SFI و CMAPs بين المجموعات باستخدام تحليل التباين المتكرر (ANOVA).
- تحديد البيانات من قبل المساعدين الذين هم أعمى عن الظروف التجريبية. التعبير عن البيانات كمتوسط ± الانحراف المعياري.
- قارن البيانات ، عند الاقتضاء ، باستخدام اختبار t المزدوج وغير المزاوج للطالب. تحديد دلالة إحصائية ك p < 0.05.
النتائج
آثار أقدام SFI وتصميمها
درسنا تطور SFI في CCI وحده ، CCI + FSN ، ومجموعات CCI + TENS (الشكل 7). بعد 4 جلسات من علاجات FSN و TENS في اليوم 7 لجراحة CCI ، تحسنت SFI في مجموعات CCI + FSN (-15.85 ± 3.46) و CCI + TENS (-29.58 ± 9.19) بشكل ملحوظ مقارنة بمجموعة CCI وحدها (-87.40 ± 14.22). كان التحسن كبيرا في مجموعة CCI + FSN مقارن?...
Discussion
تلاحظ هذه الدراسة تأثير علاج FSN على آلام الأعصاب في نماذج CCI للفئران. تقدم هذه الدراسة بروتوكولا ل SFI واختبار الفيزيولوجيا الكهربية لتقييم الآثار العلاجية بعد علاج FSN أو TENS. بالإضافة إلى ذلك ، يوضح كيفية تقييم الانتعاش الوظيفي للعصب المصاب باستخدام الاختبارات السلوكية غير الباضعة والقياسا...
Disclosures
يعلن المؤلفون أنه لا يوجد تضارب في المصالح متنافس.
Acknowledgements
تم دعم هذه الدراسة بمنحة من مركز في مستشفى Chang Bing Show Chwan Memorial ، Changhua ، تايوان. يود المؤلفون أن يشكروا مستشفى Show Chwan Memorial Hospital IRCAD TAIWAN على دعمهم ومساعدتهم التي لا تقدر بثمن طوال هذا المشروع البحثي.
Materials
| Name | Company | Catalog Number | Comments |
| Forceps | World Precision Instruments | 14098 | |
| Fu’s subcutaneous needling | Nanjing Paifu Medical Science and Technology Co. | FSN needles are designed for single use. The FSN needle is made up of three parts: a solid steel needle core (bottom), a soft casing pipe (middle), and a protecting sheath (top). | |
| Medelec Synergy electromyography | Oxford Instrument Medical Ltd. | 034W003 | Electromyogram (EMG) are used to help in the diagnosis and management of disorders such as neuropathies. Contains a portable two-channel electromyography/nerve conduction velocity system. |
| Normal saline (0.9%) 20 mL | Taiwan Biotech Co.,Ltd. | 4711916010323 | Lot: 1TKB2022 |
| POLYSORB 4-0 VIOLET 30" CV-25 | UNITED STATES SURGICAL, A DIVISION OF TYCO HEALTHC | GL-181 | |
| Retractor | COOPERSURGICAL, INC.(USA) | 3311-8G | |
| Rompun | Elanco Animal Health Korea Co. Ltd. | 27668 | |
| SCISSORS CVD 90MM | BBRUAN | XG-LBB-BC101R | |
| Transcutaneous Electrical Nerve Stimulation | Well-Life Healthcare Co. | Model Number 2205A | Digital unit which offers TENS. Supplied complete with patient leads, self-adhesive electrodes, 3 AAA batteries and instructions in a soft carry bag. Interval ON time 1–30 s. Interval OFF time 1–30 s. |
| Zoletil | VIRRBAC | 8V8HA |
References
- van Hecke, O., Austin, S. K., Khan, R. A., Smith, B. H., Torrance, N. Neuropathic pain in the general population: a systematic review of epidemiological studies. Pain. 155 (4), 654-662 (2014).
- Younes, M., et al. Prevalence and risk factors of disk-related sciatica in an urban population in Tunisia. Joint Bone Spine. 73 (5), 538-542 (2006).
- Woolf, C. J., Mannion, R. J. Neuropathic pain: aetiology, symptoms, mechanisms, and management. Lancet. 353 (9168), 1959-1964 (1999).
- Baron, R., et al. Neuropathic low back pain in clinical practice. European Journal of Pain. 20 (6), 861-873 (2016).
- Ma, X., et al. Potential mechanisms of acupuncture for neuropathic pain based on somatosensory system. Frontiers in Neuroscience. 16, 940343 (2022).
- Jang, J. H., et al. Acupuncture alleviates chronic pain and comorbid conditions in a mouse model of neuropathic pain: the involvement of DNA methylation in the prefrontal cortex. Pain. 162 (2), 514-530 (2021).
- He, K., et al. Effects of acupuncture on neuropathic pain induced by spinal cord injury: A systematic review and meta-analysis. Evidence Based Complement and Alternative Medicine. 2022, 6297484 (2022).
- Fu, Z., Lu, D. Fu's Subcutaneous Needling: A Novel Therapeutic Proposal. Acupuncture - Resolving Old Controversies and Pointing New Pathways. IntechOpen. , (2019).
- Fu, Z. H. . The Foundation of Fu's Subcutaneous Needling. , (2016).
- Fu, Z. H., Chou, L. W. . Fu's Subcutaneous Needling, Trigger Point Dry Needling: An Evidence and Clinical-Based Approach. 2nd Edition. , 255-274 (2018).
- Fu, Z., Shepher, R. Fu's Subcutaneous Needling, a Modern Style of Ancient Acupuncture? Acupuncture in Modern Medicine. IntechOpen. , (2013).
- Chiu, P. E., et al. Efficacy of Fu's subcutaneous needling in treating soft tissue pain of knee osteoarthritis: A randomized clinical trial. Journal of Clinical Medicine. 11 (23), 7184 (2022).
- Huang, C. H., Lin, C. Y., Sun, M. F., Fu, Z., Chou, L. W. Efficacy of Fu's Subcutaneous Needling on Myofascial Trigger Points for Lateral Epicondylalgia: A randomized control trial. Evidence Based Complement and Alternative Medicine. 2022, 5951327 (2022).
- Huang, C. H. Rapid improvement in neck disability, mobility, and sleep quality with chronic neck pain treated by Fu's subcutaneous needling: A randomized control study. Pain Research and Management. 2022, 7592873 (2022).
- Chou, L. W., Hsieh, Y. L., Kuan, T. S., Hong, C. Z. Needling therapy for myofascial pain: recommended technique with multiple rapid needle insertion. Biomedicine (Taipei). 4 (2), 13 (2014).
- Ye, L., et al. Depression of mitochondrial function in the rat skeletal muscle model of myofascial pain syndrome is through down-regulation of the AMPK-PGC-1α-SIRT3 axis. Journal of Pain Research. 13, 1747-1756 (2020).
- Li, Y., et al. Effects of Fu's subcutaneous needling on mitochondrial structure and function in rats with sciatica. Molecular Pain. 18, 17448069221108717 (2022).
- Perreault, T., Fernández-de-Las-Peñas, C., Cummings, M., Gendron, B. C. Needling interventions for sciatica: Choosing methods based on neuropathic pain mechanisms-A scoping review. Journal of Clinical Medicine. 10 (10), 2189 (2021).
- Weller, J. L., Comeau, D., Otis, J. A. D. Myofascial pain. Seminars in Neurology. 38 (6), 640-643 (2018).
- Grøvle, L., et al. The bothersomeness of sciatica: patients' self-report of paresthesia, weakness and leg pain. European Spine Journal. 19 (2), 263-269 (2010).
- Jaggi, A. S., Jain, V., Singh, N. Animal models of neuropathic pain. Fundament Clinical Pharmacology. 25 (1), 1-28 (2011).
- Burma, N. E., Leduc-Pessah, H., Fan, C. Y., Trang, T. Animal models of chronic pain: Advances and challenges for clinical translation. Journal of Neuroscience Research. 95 (6), 1242-1256 (2017).
- McCann, M. E., Soriano, S. G. Does general anesthesia affect neurodevelopment in infants and children. British Medical Journal. 367, 6459 (2019).
- Chan, K. Y., et al. Ameliorative potential of hot compress on sciatic nerve pain in chronic constriction injury-induced rat model. Frontiers in Synaptic Neuroscience. 14, 859278 (2022).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. 33 (1), 87-107 (1988).
- Somers, D. L., Clemente, F. R. Transcutaneous electrical nerve stimulation for the management of neuropathic pain: The effects of frequency and electrode position on prevention of allodynia in a rat model of complex regional pain syndrome type II. Physical Therapy. 86 (5), 698-709 (2006).
- Xing, G., Liu, F., Wan, Y., Yao, L., Han, J. Electroacupuncture of 2 Hz induces long-term depression of synaptic transmission in the spinal dorsal horn in rats with neuropathic pain. Beijing Da Xue Xue Bao Yi Xue Ban. 35 (5), 453-457 (2003).
- Schone, A. M. . Veterinary Acupuncture: Ancient Art to Modern Medicine. , (1999).
- Stux, G., Pomeranz, B. . Acupuncture: Textbook and Atlas. , (1987).
- de Medinaceli, L., Freed, W. J., Wyatt, R. J. An index of the functional condition of rat sciatic nerve based on measurements made from walking tracks. Experimental Neurology. 77 (3), 634-643 (1982).
- Bain, J. R., Mackinnon, S. E., Hunter, D. A. Functional evaluation of complete sciatic, peroneal, and posterior tibial nerve lesions in the rat. Plastic and Reconstructive Surgery. 83 (1), 129-138 (1989).
- Kanaya, F., Firrell, J. C., Breidenbach, W. C. Sciatic function index, nerve conduction tests, muscle contraction, and axon morphometry as indicators of regeneration. Plastic and Reconstructive Surgery. 98 (7), 1264-1271 (1996).
- Wild, B. M., et al. In vivo electrophysiological measurement of the rat ulnar nerve with axonal excitability testing. Journal of Visualized Experiments: JoVE. (132), e56102 (2018).
- Wong, J. Y., Rapson, L. M. Acupuncture in the management of pain of musculoskeletal and neurologic origin. Physical Medicine and Rehabilitation Clinics of North America. 10 (3), 531-545 (1999).
- Qin, Z., Liu, X., Yao, Q., Zhai, Y., Liu, Z. Acupuncture for treating sciatica: A systematic review protocol. BMJ Open. 5 (4), 007498 (2015).
- Zhi, M. J., et al. Application of the chronic constriction injury of the partial sciatic nerve model to assess acupuncture analgesia. Journal of Pain Research. 10, 2271-2280 (2017).
- Fu, Z. H., Xu, J. G. A brief introduction to Fu's subcutaneous needling. Pain Clinic. 17, 343-348 (2005).
- Peng, J., et al. The effect of Fu's subcutaneous needling combined with reperfusion approach on surface electromyography signals in patients with cervical spondylosis and neck pain: A clinical trial protocol. Biomed Research International. 2022, 1761434 (2022).
- Fu, Z. H., Wang, J. H., Sun, J. H., Chen, X. Y., Xu, J. G. Fu's subcutaneous needling: possible clinical evidence of the subcutaneous connective tissue in acupuncture. Journal Alternative and Complementary Medicine. 13 (1), 47-51 (2007).
- Harrison, T. M., Churgin, S. M. Acupuncture and traditional Chinese veterinary medicine in zoological and exotic animal medicine: A review and introduction of methods. Veterinary Science. 9 (2), 74 (2022).
- Gollub, R. L., Hui, K. K., Stefano, G. B. Acupuncture: pain management coupled to immune stimulation. Zhongguo Yao Li Xue Bao. 20 (9), 769-777 (1999).
- Simons, D. G., Travell, J., Simons, L. E. . Myofascial Pain and Dysfunction: The Trigger Point Manual. 2nd ed. , (1999).
- Gerwin, R. D., Dommerholt, J., Shah, J. P. An expansion of Simons' integrated hypothesis of trigger point formation. Current Pain and Headache Reports. 8 (6), 468-475 (2004).
- Hong, C. Z., Simons, D. G. Pathophysiologic and electrophysiologic mechanisms of myofascial trigger points. Archives of Physical Medicine and Rehabilitation. 79 (7), 863-872 (1998).
- Fu, Z., et al. Remote subcutaneous needling to suppress the irritability of myofascial trigger spots: an experimental study in rabbits. Evidence Based Complement and Alternative Medicine. 2012, 353916 (2012).
- Hsieh, Y. L., Yang, C. C., Liu, S. Y., Chou, L. W., Hong, C. Z. Remote dose-dependent effects of dry needling at distant myofascial trigger spots of rabbit skeletal muscles on reduction of substance P levels of proximal muscle and spinal cords. Biomed Research International. 2014, 982121 (2014).
- Ma, K., et al. Peripheral nerve adjustment for postherpetic neuralgia: a randomized, controlled clinical study. Pain Medicine. 14 (12), 1944-1953 (2013).
- Gao, Y., Sun, J., Fu, Z., Chiu, P. E., Chou, L. W. Treatment of postsurgical trigeminal neuralgia with Fu's subcutaneous needling therapy resulted in prompt complete relief: Two case reports. Medicine. 102 (9), e33126 (2023).
- Lucas, L. R., Wang, C. J., McCall, T. J., McEwen, B. S. Effects of immobilization stress on neurochemical markers in the motivational system of the male rat. Brain Research. 1155, 108-115 (2007).
- Yang, C. H., et al. Effect of electroacupuncture on response to immobilization stress. Pharmacology, Biochemistry, and Behavior. 72 (4), 847-855 (2002).
- Adams, S., Pacharinsak, C. Mouse anesthesia and analgesia. Current Protocols in Mouse Biology. 5 (1), 51-63 (2015).
- Cantwell, S. L. Traditional Chinese veterinary medicine: the mechanism and management of acupuncture for chronic pain. Topics in Companion Animal Medicine. 25 (1), 53-58 (2010).
- Liebano, R. E., Rakel, B., Vance, C. G. T., Walsh, D. M., Sluka, K. A. An investigation of the development of analgesic tolerance to TENS in humans. Pain. 152 (2), 335-342 (2011).
- Khalil, Z., Merhi, M. Effects of aging on neurogenic vasodilator responses evoked by transcutaneous electrical nerve stimulation: relevance to wound healing. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 55 (6), B257-B263 (2000).
- Sato, K. L., Sanada, L. S., Silva, M. D. D., Okubo, R., Sluka, K. A. Transcutaneous electrical nerve stimulation, acupuncture, and spinal cord stimulation on neuropathic, inflammatory and, non-inflammatory pain in rat models. The Korean Journal of Pain. 33 (2), 121-130 (2020).
- Maeda, Y., Lisi, T. L., Vance, C. G., Sluka, K. A. Release of GABA and activation of GABA(A) in the spinal cord mediates the effects of TENS in rats. Brain Research. 1136 (1), 43-50 (2007).
- Degrugillier, L., et al. A new model of chronic peripheral nerve compression for basic research and pharmaceutical drug testing. Regenerative Medicine. 16 (10), 931-947 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved