Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Wirksamkeit von Fu's subkutanem Needling bei Ischiasnervenschmerzen: Verhaltens- und elektrophysiologische Veränderungen in einem Rattenmodell mit chronischer Verengungsverletzung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Wir stellen ein Protokoll für die Verwendung von Fu's subkutanem Needling in einem chronischen Verengungsverletzungsmodell vor, um Ischiasnervschmerzen bei Ratten zu induzieren.
Zusammenfassung
Fu's Subcutaneous Needling (FSN), eine erfundene Akupunkturtechnik aus der traditionellen chinesischen Medizin, wird weltweit zur Schmerzlinderung eingesetzt. Die Wirkmechanismen sind jedoch noch nicht vollständig verstanden. Während der FSN-Behandlung wird die FSN-Nadel eingeführt und mit einer schwankenden Bewegung über einen langen Zeitraum im Unterhautgewebe gehalten. Herausforderungen ergeben sich jedoch durch die Beibehaltung einer Haltung bei der Manipulation von FSN in Tiermodellen (z. B. Ratten) für Forscher. Eine unangenehme Behandlung kann zu Angst und Widerstand gegen FSN-Nadeln führen, das Verletzungsrisiko erhöhen und sogar Forschungsdaten beeinträchtigen. Auch die Anästhesie kann die Studienergebnisse beeinflussen. Daher besteht ein Bedarf an Strategien in der FSN-Therapie an Tieren, die Verletzungen während des Eingriffs minimieren. Diese Studie verwendet ein chronisches Verengungsverletzungsmodell bei Sprague-Dawley-Ratten, um neuropathische Schmerzen zu induzieren. Dieses Modell repliziert die Schmerzen, die durch Nervenverletzungen verursacht werden, die beim Menschen durch chirurgische Verengung eines peripheren Nervs beobachtet werden, und ahmt die Kompression oder Einklemmung nach, die bei Erkrankungen wie Nervenkompressionssyndromen und peripheren Neuropathien beobachtet wird. Wir führen eine geeignete Manipulation zum einfachen Einführen einer FSN-Nadel in die subkutane Schicht des Körpers des Tieres ein, einschließlich Nadeleinführung und -richtung, Nadelretention und Schwankbewegung. Die Minimierung des Unbehagens der Ratte verhindert, dass die Ratte angespannt ist, was dazu führt, dass sich der Muskel zusammenzieht und den Eintritt der Nadel behindert und die Studieneffizienz verbessert.
Einleitung
Neuropathische Schmerzen, definiert als Schmerzen, die durch Nervenschäden verursacht werden, betreffen schätzungsweise 6,9 % bis 10 % der Weltbevölkerung, und die gemeldete Lebenszeitprävalenz beträgt 49 % bis 70 %1,2. Es gilt auch als eines der am schwierigsten zu behandelnden Schmerzsyndrome. Die Verwendung pharmakologischer Wirkstoffe zur Behandlung neuropathischer Schmerzen hat nur begrenzten Erfolg gebracht, da häufig verschriebene Schmerzmittel wie nichtsteroidale entzündungshemmende Medikamente und Opioide bei der Linderung dieser Art von Schmerzen wenig wirksam waren 3,4. Es besteht daher ein großer Bedarf, neue Behandlungsmöglichkeiten zu erforschen, insbesondere nicht-pharmakologische Behandlungen. Akupunktur als nicht-pharmakologische Intervention lindert möglicherweise neuropathische Schmerzen, indem sie analgetische Wirkungen auf das somatosensorische System ausübt. Sowohl klinische als auch präklinische Studien haben gezeigt, dass Akupunktur bei der Linderung neuropathischer Schmerzsymptome ohne signifikante Nebenwirkungen wirksam ist 5,6,7. Der zentrale Mechanismus der Akupunkturbehandlung zur Schmerzlinderung bei neuropathischen Schmerzen muss jedoch noch weiter untersucht werden.
In den letzten Jahren hat Fus subkutanes Needling (FSN) bei der Behandlung schmerzbedingter neurologischer Störungen an Popularität gewonnen8. FSN stammt aus der traditionellen chinesischen Akupunktur und wurde erstmals 1996 von dem traditionellen chinesischen Arzt Zhonghua Fu beschrieben 9,10. Obwohl FSN aus der traditionellen Akupunktur stammt, unterscheidet es sich in seinen Techniken und Theorien erheblich von meridianbasierter Akupunktur, Yin- und Yang-Prinzipien und Akupunkturpunktkonzepten. FSN legt mehr Wert auf neurophysiologische und anatomische Ansätze, um myofasziale Schmerzen effektiv zu behandeln11. Die FSN-Therapie wird in der klinischen Praxis zur Behandlung verschiedener schmerzhafter Muskelerkrankungen eingesetzt, wobei das eng mit den Muskeln verbundene Bindegewebe angewandt wird, wobei der Schwerpunkt auf der Behandlung von verspannten Muskeln (TMs) liegt12. Als ergänzende Therapie zur Schmerzlinderung gibt es auch klinische Beweise dafür, dass FSN bei der Behandlung von Weichteilverletzungen wirksam ist und eine schnelle Schmerzbehandlung und eine signifikante Verbesserung von Weichteilkrämpfen bietet13,14. Die FSN-Therapie umfasst spezifische Techniken, die auf die zugrunde liegenden myofaszialen Triggerpunkte (MTrPs) zugeschnitten sind, die mit der Erkrankung verbunden sind. Die Position des FSN-Nadeleinstichs wird sorgfältig basierend auf der Position dieser Triggerpunkte ausgewählt, um eine präzise Ausrichtung auf betroffene Bereiche zu ermöglichen. Während des Eingriffs wird die FSN-Nadel in die Unterhautschicht eingeführt, wo sie absichtlich gestoppt wird, um die therapeutische Wirkung zu optimieren. Anschließend wird eine charakteristische Technik angewendet, die als Schwankbewegung bekannt ist und eine sanfte oszillierende Bewegung der Nadel beinhaltet, um das Gewebe zu stimulieren und die therapeutischen Reaktionen zu fördern10. Die Entwicklung von MTrPs ist mit der Energiekrisentheorie verbunden, die erklärt, dass Faktoren wie chronische Muskelüberlastung, übermäßige Bewegung, falsche Belastungshaltungen, Muskelatrophie und Degeneration zum Auftreten von Ischämie und Hypoxie des Muskelgewebes beitragen können. Es wird angenommen, dass dieser Sauerstoff- und Energiemangel im Muskelgewebe eine Schlüsselrolle bei der Bildung von MTrPsspielt 15,16. Frühere Tierstudien haben gezeigt, dass die FSN-Behandlung bei chronischen Schmerzen bei Ratten die morphologische Struktur und Funktion der Mitochondrien bei TMs bis zu einem gewissen Grad verbessert, was das Potenzial der FSN-Therapie zur Förderung der Erholung geschädigter Nerven und Muskeln bestätigt17.
Ischias wurde als neuropathischer Schmerzklassifiziert 18. Es wird angenommen, dass der Ursprung neuropathischer Schmerzen irgendwo zwischen der motorischen Endplatte und der äußeren fibrösen Schicht des Muskels liegt, an der das mikrovaskuläre System und Neurotransmitter auf zellulärer Ebene beteiligt sind. Der Verlust der Muskelinnervation und Apoptose von innervierten Nervenzellen tritt auf, wenn eine Nervenschädigungauftritt 19, die zu einem schmerzbedingten Gang in der betroffenen Extremität führt. Darüber hinaus kann eine chronische Kompression oder Reizung des Nervs zu einer Vielzahl von Veränderungen in der Art und Weise der Nervenfunktionen führen, die die Symptome von Ischias weiter verschlimmern können20. Die Komplexität des Nervensystems macht es jedoch schwierig, es in vitro zu replizieren, was die Verwendung von Tiermodellen für solche Studien erforderlich macht. Bei der Untersuchung neuropathischer Schmerzstörungen werden häufig Modellorganismen eingesetzt, die verschiedene Methoden der direkten peripheren Nervenverletzung beinhalten, wie z. B. Ischiasnervenligatur, Durchtrennung oder Kompression21,22. Das Modell der chronischen Verengungsverletzung (CCI) bei Sprague-Dawley-Ratten wurde verwendet, um neuropathische Schmerzen zu induzieren. Dieses Modell repliziert die Schmerzen, die durch Nervenverletzungen verursacht werden, die beim Menschen durch chirurgische Verengung eines peripheren Nervs beobachtet werden, und ahmt die Kompression oder Einklemmung nach, die bei Erkrankungen wie Nervenkompressionssyndromen und peripheren Neuropathien beobachtet wird.
In dieser Studie untersuchten wir die analgetische Wirkung der FSN-Therapie und der Niederfrequenz-Elektrotherapie (transkutaner elektrischer Nervenstimulator, TENS) bei Ratten mit chronischen Verengungsverletzungen und neuropathischen Schmerzen. Da die Anästhesie Nervenimpulse verlangsamt oder blockiert und die synaptische Übertragung und neuronale Funktion beeinflusst23, können Tiere nicht unter allen Nadelverfahren und Schwankbewegungen betäubt werden. Daher ist eine geeignete Nadeltechnik erforderlich, um die Beschwerden bei Ratten zu reduzieren. Die Schritte zur Erstellung eines Ratten-CCI-Modells, die Art und Weise, wie die Ratten mit FSN behandelt wurden, kombinierte Schwankbewegungen ohne Anästhesie, durchführbare Tierverhaltensmustertests und elektrophysiologische Untersuchungen werden detailliert beschrieben.
Protokoll
Alle Verfahren mit tierischen Probanden wurden im Oktober 2022 vom Institutional Animal Care and Use Committee (IACUC) des Chang Bing Show Chwan Memorial Hospital, Changhua, Taiwan (111031) genehmigt (Abbildung 1).
1. Vorbereitung der Tiere
- Kaufen Sie 48 männliche Sprague-Dawley (SD) Ratten (Alter: 8-10 Wochen, Gewicht: 250-300 g).
- Ratten einzeln in belüfteten Käfigen bei 24 ± 2 °C und einem 12-stündigen Dunkel- und Lichtzyklus unterbringen.
- Füttern Sie Ratten mit einer Standard-Pellet-Diät mit sterilem Trinkwasser und sorgen Sie für weiche Einstreu.
2. Gruppierung von Tieren
- Teilen Sie 48 SD-Ratten nach dem Zufallsprinzip in sechs Gruppen ein (n = 8 pro Gruppe): die Scheingruppe, die CCI-Gruppe, die CCI+FSN-Gruppe, die CCI+TENS-Gruppe, die FSN-Einzelgruppe und die TENS-Einzelgruppe wie in der vorherigen Studie von Chan et al.24.
HINWEIS: Die Details von sechs Gruppen: (1) Scheingruppe: keine Operation und keine Behandlung; (2) CCI-Gruppe: vorbereitet für eine Operation ohne Behandlung; (3) CCI+FSN-Behandlungsgruppe: FSN-Behandlung nach erfolgreicher CCI-Modellierung; (4) CCI+TENS-Behandlungsgruppe: TENS-Behandlung nach erfolgreicher CCI-Modellierung; (5) FSN-Behandlung allein Gruppe: nur FSN-Behandlung ohne Operation; (6) TENS-Behandlung allein Gruppe: nur TENS-Behandlung ohne Operation.
3. Etablierung eines CCI-Rattenmodells
HINWEIS: Das CCI-Operationsmodell bei Ratten wurde nach Bennett und Xie modifiziert, die 1988durchgeführt wurden 25.
- Stellen Sie sicher, dass der Bediener eine chirurgische Maske, eine Einweg-OP-Kappe und sterile Handschuhe trägt.
- Desinfizieren Sie die Oberfläche des Operationstisches mit 70% Ethanol. Sterilisieren Sie Instrumente (z. B. Scheren, Pinzetten und Retraktoren), Gaze, Heftklammern und Wattestäbchen durch Autoklavieren.
HINWEIS: Während des gesamten chirurgischen Eingriffs werden aseptische Techniken angewendet. - Betäuben Sie die Ratten nach der Standard-Hautvorbereitung (Rasur) mit 4% Isofluran und halten Sie sie mit 2% Isofluran aufrecht (Abbildung 2A).
- Bestätigen Sie die angemessene Anästhesietiefe, indem Sie das fehlende Ansprechen nach dem Einklemmen der Hinterpfote beobachten und die betäubten Ratten während des gesamten Eingriffs überwachen.
- Tragen Sie genügend veterinärmedizinische Augensalbe auf die Augen auf, um sie vor dem Austrocknen zu schützen.
- Legen Sie die Ratte in Bauchlage auf den Operationstisch und rasieren Sie die Haare an der Seite des rechten Hinterbeins, dann desinfizieren Sie die Haut dreimal mit Povidon-Jod-Lösung und 75% Ethanol. Bieten Sie während des gesamten Eingriffs thermische Unterstützung und verwenden Sie sterile Abdecktücher, um die Operationsstelle abzudecken.
- Machen Sie einen parallelen Schnitt in der Haut 3-4 mm unterhalb des Oberschenkelknochens von etwa 20-50 mm.
- Priorisieren Sie die Identifizierung der Positionen von Gluteus maximus und Bizeps femoris. Trennen Sie das Unterhautfett und die oberflächliche Faszie Schicht für Schicht mit einer chirurgischen Schere und schneiden Sie das umgebende Bindegewebe durch, um den Muskel freizulegen (Abbildung 2B).
HINWEIS: Um die subkutanen Fett- und oberflächlichen Faszienschichten zu unterscheiden, beobachten Sie die Textur und Farbe. Die subkutane Fettschicht sollte weich und biegsam erscheinen und gelblich oder weißlich aussehen. Die oberflächliche Faszie ist eine dünne Faserschicht, die sich direkt unter dem Unterhautfett befindet. Unterscheiden Sie zwischen den Schichten, indem Sie vorsichtig abtasten oder mit einem stumpfen Instrument sondieren, wobei Sie beachten müssen, dass das Unterhautfett im Vergleich zur oberflächlichen Faszie mehr Druckwiderstand bietet.
- Schneiden Sie mit einer stumpfen Schere das Bindegewebe zwischen dem oberflächlichen Gesäßmuskel und dem Bizeps femoris.
- Vergrößern Sie den Abstand zwischen diesen beiden Muskeln mit einem Retraktor, um den Ischiasnerv freizulegen (Abbildung 2C).
HINWEIS: Um den Ischiasnerv bei einer Ratte visuell zu identifizieren, konzentrieren Sie sich auf die Oberschenkelregion. Lokalisieren Sie den Mittelpunkt der Oberschenkelregion, um den Ischiasnerv sichtbar zu machen. Typischerweise verläuft der Nerv entlang der hinteren Seite des Oberschenkels, beginnend in der Hüftregion und bis zum Knie. - Ohne die Nervenmorphologie zu verändern, wählen Sie den Ischiasnerv mit einer Mikronadel durch eine gute Lichtquelle. Lilizieren Sie den Ischiasnerv zweimal mit 3-0 Chrom-Darmligaturen und positionieren Sie die Ligaturpunkte etwa 1 mm voneinander entfernt zwischen den beiden Nähten.
- Beginnen Sie mit einer losen Schlaufe für jede Ligatur, fassen Sie die Enden der Ligatur in der Nähe der Schlaufe und ziehen Sie sie fest, bis die Schlaufe gerade eng anliegt, um sicherzustellen, dass die Ligatur nicht am Nerv entlang rutscht. Stoppen Sie, wenn während der Ligatur ein leichtes Zucken der Extremität beobachtet wird (Abbildung 2D).
- Vergrößern Sie den Abstand zwischen diesen beiden Muskeln mit einem Retraktor, um den Ischiasnerv freizulegen (Abbildung 2C).
- Verschließen Sie den Muskel und die Haut Schicht für Schicht mit 4-0 Nahtlinien. Zum Schluss desinfizieren Sie die Wunde mit Jod (Abbildung 2E).
- Überwachen Sie die Vitalfunktionen der Ratten während der Anästhesie genau und setzen Sie sie in einzelne Aufwachkäfige, bis sie wach sind, bevor Sie sie wieder in ihre Käfige setzen. Legen Sie die Käfige mit flacher Papiereinstreu aus, um Erstickungsgefahr bei bewusstlosen Tieren zu vermeiden. Ein kurzes Zucken in der postoperativen Extremität zeigt eine erfolgreiche Operation an (Abbildung 2F).
- Führen Sie Schmerzüberempfindlichkeitstests mehrmals vor CCI (Baseline) und zu verschiedenen Zeitpunkten nach CCI durch.
- Achten Sie auf spontane Schmerzen und Verhaltensänderungen an den Tagen 1, 3, 5 und 7 nach der Modellkonstruktion.
HINWEIS: Beobachten Sie den Gang und die Haltung der rechten Hintergliedmaße und das Vorhandensein von Lecken und Beißen an der Extremität.- Identifizieren Sie das Vorhandensein neuropathischer Schmerzen, um die erfolgreiche Etablierung des Modells zu bestimmen und erfolglose Ratten auszuschließen.
HINWEIS: Beurteilen Sie den Erfolg des Modells, indem Sie Anzeichen wie Schwäche beim Gehen der unteren Extremitäten, zusammengehaltene Zehen der rechten Extremität mit leichtem Valgus, häufiges Schlenkern und Landungswiderwillen beobachten. Beobachten Sie, wie die Ratte mit der linken Hintergliedmaße steht, während die rechte Hintergliedmaße angehoben und nahe am Bauch liegt.
- Identifizieren Sie das Vorhandensein neuropathischer Schmerzen, um die erfolgreiche Etablierung des Modells zu bestimmen und erfolglose Ratten auszuschließen.
4. Verwaltung der FSN-Manipulation
- Fixieren Sie die Ratte der FSN-Behandlungsgruppe (einschließlich CCI+FSN und FSN allein Gruppe) in der Nagetierfessel, wobei die betroffene Extremität seitlich freiliegt. Bieten Sie während des gesamten Verfahrens thermische Unterstützung. Beide Gruppen wurden mit FSN-Einwegnadeln behandelt (Abbildung 3A).
- Strecken Sie die Hinterbeine der Ratte ohne Betäubung allmählich und langsam aus, bis sie straff gespannt waren (Abbildung 3B).
HINWEIS: Der Rattenkopf ist mit einem chirurgischen Tuch bedeckt, um das Tier ruhig und stabil zu halten. Überstrecken Sie das Bein nicht, um die Ratte zu verletzen. Beobachten Sie die Reaktion der Ratte genau auf Anzeichen von Stress oder Unbehagen. Wenn die Ratte Anzeichen von Schmerzen oder Beschwerden zeigt, stoppen Sie die Verlängerung und machen Sie eine Pause, bevor Sie es erneut versuchen. - Entfernen Sie die Schutzhülle der FSN-Nadel.
- Führen Sie die Spitze der FSN-Nadel in Richtung der TMs (Muskeln mit MTrPs) ein, ungefähr in der Nähe des Gesäßmuskels, der sich am unteren Rücken und am Rücken befindet.
- Legen Sie die FSN-Nadel flach und führen Sie sie in einem Winkel von ca. 15° in die Haut ein.
- Schieben Sie es vorsichtig und schnell durch die Haut und in den Unterhautraum, um Stress bei der Ratte zu vermeiden, bis es vollständig eingeführt ist. Stellen Sie sicher, dass die Nadel ausreichend eingeführt ist, um den weichen Schlauch vollständig unter der Haut zu vergraben.
- Heben Sie beim Vorwärtsdrücken die Nadelspitze leicht an, um zu beobachten, ob sich die Hautwölbung entlang der Nadelspitze bewegt (Abbildung 3C).
- Führen Sie die Schwankbewegung aus, indem Sie die FSN-Nadelspitze mit dem Daumen als Drehpunkt sanft und sanft fächern, während Zeigefinger, Mittelfinger und Ringfinger in einer geraden Linie ausgerichtet bleiben.
- Halten Sie die FSN-Nadel zwischen Mittelfinger und Daumen von Angesicht zu Angesicht und bewegen Sie sich abwechselnd mit Zeige- und Ringfinger hin und her.
- Stellen Sie die Frequenz auf 100 Hübe pro Minute ein und führen Sie den Vorgang ca. 1 Minute lang durch (Abbildung 3D).
- Ziehen Sie nach Abschluss der Manipulation schnell die FSN-Nadel heraus.
HINWEIS: Der Vorgang wurde alle 2 Tage für insgesamt vier Sitzungen durchgeführt (Tage 1, 3, 5 und 7 nach der Erstellung des CCI-Modells). Einweg-FSN-Nadeln müssen einmal verwendet werden. Wiederholter Gebrauch stumpft die Nadel ab und verursacht bei Ratten erhöhte Schmerzen.
5. Verabreichung von TENS-Manipulationen
- Fixieren Sie die Ratte der TENS-Behandlungsgruppe (einschließlich CCI+TENS und TENS allein Gruppe) in der Nagetierfessel, wobei die betroffene Extremität seitlich freiliegt. Bieten Sie während des gesamten Verfahrens thermische Unterstützung. Stellen Sie sicher, dass das Fell vor der Behandlung rasiert ist.
HINWEIS: Die Elektroden wurden auf 45 mm (Länge) x 5 mm (Breite) gekürzt (Abbildung 4A). - Wählen Sie Zusanli-Punkt (ST36) und Sanyinjiao-Punkt (SP6) als Positionen für TENS. Dies basiert auf der Theorie zur Behandlung neuropathischer Schmerzen26,27.
- Lokalisieren Sie den Zusanli-Punkt (ST36) etwa 5 mm lateral des vorderen Tuberkels der Tibia zwischen Tibia und Fibula direkt unter dem Knie28.
- Lokalisieren Sie den Sanyinjiao-Punkt (SP6) am hinteren Rand der Tibia, 3 mm proximal des medialen Knöchels28.
HINWEIS: Diese beiden Akupunkturpunkte werden durch manuelle Inspektion lokalisiert, wie von Stux und Pomeranz und im Tierakupunkturatlas28,29 beschrieben (Abbildung 4B).
- Führen Sie 10 Minuten lang eine niederfrequente elektrische Stimulation (2 Hz kontinuierliche Sinuswelle, 3 mA) mit dem TENS-Gerät durch, wobei die Elektrode am Bein um den Nerv herum angebracht wird. Decken Sie den Kopf des Rattenkopfes mit einem chirurgischen Abdecktuch ab, um ihn ruhig und stabil zu halten.
HINWEIS: Dieses Verfahren wird alle 2 Tage für insgesamt vier Sitzungen durchgeführt (Tage 1, 3, 5 und 7 nach der Erstellung des CCI-Modells).
6. Physiologische Messungen zur Durchführung des Tierverhaltenstests
HINWEIS: Der Ischiasfunktionsindex (SFI)30 ist ein weit verbreiteter Index von Forschern, die sich mit der Pathologie und der möglichen Behandlung von Nervenverletzungen befassen und durch den Vergleich der Geometrie der betroffenen Hinterpfote bei verletzten Ratten mit der der kontralateralen Pfote und mit der gegenüberliegenden Pfote bestimmt wird.
- Entwerfen Sie Rattenstege mit klarem Plexiglas und Kippspiegeln, um die Fußabdrücke und die Körperorientierung von Ratten während des Spaziergangs zu erfassen.
HINWEIS: Der Steg ist eine Plattform von 10 cm Länge, 50 cm Breite und 15 cm Höhe mit einem weißen Papierfutter an der Unterseite (Abbildung 5A). - Legen Sie die Ratten vorsichtig und frei in die Box und lassen Sie sie sich vor der Aufnahme mindestens 5 Minuten lang an ihre neue Umgebung gewöhnen.
HINWEIS: Besondere Sorgfalt wird darauf verwendet, unnötigen Stress für das Tier zu minimieren, um mögliche Auswirkungen auf die Haltungsmuskelspannung zu vermeiden. - Tauchen Sie die Pfoten der Ratte in rote Tinte und lassen Sie die Ratte über den Gehwegstreifen laufen, wobei Sie Spuren auf dem Trägerpapier hinterlassen. Zeichnen Sie für jeden Test mindestens 2 s ununterbrochenes Gehen auf. Lassen Sie die Ratte mindestens 3 Mal in eine Richtung laufen (Abbildung 5B).
HINWEIS: Tragen Sie schnell trocknende, ungiftige, wasserlösliche rote Tinte auf beide Hinterfüße auf, um die Hinterfußabdrücke deutlich sichtbar zu machen. - Trocknen Sie am Ende des Experiments die Laufstegstreifen, um die Parameter zu messen. Messen Sie ihre Fußabdrücke mit einem Lineal und runden Sie auf die nächsten 0,5 mm.
HINWEIS: Aus mehreren Fußabdrücken wurden drei klare Fußabdrücke von jeder Ratte ausgewählt und drei verschiedene Parameter gemessen. Zu den Faktoren für SFI gehören Drucklänge (PL), Zehenspreizung (TS) und Zwischenzehenspreizung (ITS).
SFI-Werte werden mit der folgenden Formelberechnet 31: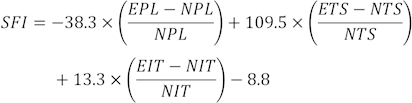
(EPL, experimentelle Drucklänge; NPL, normale Drucklänge; ETS, experimentelle Zehenspreizung; NTS, normale Zehenspreizung; EIT, experimentelle Zwischenzehenspreizung; NIT, Zwischenzehenspreiz.)
SFI = 0 und - 100 zeigt eine normale und vollständige Funktionsstörung an. Ratten, die ihre Zehen schleiften, wurde willkürlich ein Wert von -100 zugewiesen. Bei normaler neurologischer Funktion oszilliert der SFI um 0, während etwa -100 SFI eine vollständige Dysfunktiondarstellt 32.
7. Neurophysiologische Beurteilung durch elektrophysiologische Messung33
HINWEIS: Die Elektromyographie wurde verwendet, um die elektrophysiologische Aktivität in dieser Studie aufzuzeichnen. Das zusammengesetzte Muskelaktionspotential (CMAP) wird durch die Aktivierung von Muskelfasern im vom Nerv versorgten Zielmuskel verursacht. CMAP-Amplitude und -Latenz werden untersucht. Die CMAP-Amplitude wird von der Basislinie bis zum negativen Peak gemessen. Die Latenz von CMAPs wird durch Messung der Zeit zwischen der Anwendung des Stimulus und dem Einsetzen des zusammengesetzten Aktionspotentials bestimmt, die durch den Abstand zwischen der Stimulationsstelle und der Aufnahmestelle beeinflusst wird. Die Elektrophysiologie bietet eine objektive Beurteilung der peripheren Nervenfunktion bei Ratten.
- Verabreichen Sie Zoletil 50 (40 mg/kg, ip), um die Ratten zu betäuben. Bereiten Sie die Haut nach Standardprotokollen vor (Rasur).
- Platzieren Sie Einweg-Klebeflächenelektroden (20 mm Außendurchmesser) auf den dafür vorgesehenen Stellen. Befestigen Sie die Aufzeichnungselektroden an den lateralen und dorsalen Oberflächen des Musculus gastrocnemius (Abbildung 6A).
- Wenden Sie eine elektrische Stimulation (Intensität 1,2 mA) auf den rechten proximalen Ischiasnervenstamm an. Zeichnen Sie ein zusammengesetztes Muskelaktionspotential (CMAP) am Bauch des Gastrocnemius-Muskels auf (Abbildung 6B).
HINWEIS: Seien Sie vorsichtig beim Einführen der Elektroden, um das Muskelgewebe zu vermeiden. - Notieren Sie die Wirkung von drei wiederholten Messungen für jede Ratte.
HINWEIS: CMAP wird als Mittelwert ± SD jeder Gruppe ausgedrückt. Das Signal wurde durch einen Verstärker verstärkt, gefiltert (0,3-3 kHz). Nach der Integration (Zeitkonstante = 0,05 s) werden sowohl das Originalsignal als auch das integrierte Signal eingegeben. Das Originalsignal und das integrierte Signal werden dann im PowerLab-System digitalisiert und auf der Festplatte des Computers gespeichert. - Bringen Sie die Ratte nach Abschluss der elektrophysiologischen Verfahren in einen anderen Käfig und überwachen Sie sie, bis sie wieder genug Bewusstsein erlangt, um eine sternale liegende Position beizubehalten. Sobald sich die Ratte vollständig von der Narkose erholt hat, bringen Sie sie zurück in ihren ursprünglichen Käfig.
8. Statistik:
- Bewerten Sie Unterschiede in SFI und CMAPs zwischen Gruppen mithilfe der Varianzanalyse (ANOVA) mit wiederholten Messungen.
- Quantifizieren Sie die Daten durch Assistenten, die für die experimentellen Bedingungen blind sind. Drücken Sie die Daten als Mittelwert ± Standardabweichung aus.
- Vergleichen Sie die Daten gegebenenfalls mit dem zweiseitigen gepaarten und ungepaarten t-Test von Student. Stellen Sie die statistische Signifikanz als p < 0,05 fest.
Ergebnisse
Fußabdrücke und Bestimmung des SFI
Wir untersuchten die Entwicklung von SFI in den Gruppen CCI allein, CCI+FSN und CCI+TENS (Abbildung 7). Nach 4 Sitzungen mit FSN- und TENS-Behandlungen am Tag 7 für die CCI-Operation verbesserte sich der SFI in den Gruppen CCI+FSN (-15,85 ± 3,46) und CCI+TENS (-29,58 ± 9,19) signifikant im Vergleich zur CCI-Gruppe allein (-87,40 ± 14,22). Die Verbesserung war in der CCI+FSN-Gruppe im Vergleich zur CCI+TENS-Gruppe signifikant (
Diskussion
Diese Studie beobachtet die Wirkung der FSN-Behandlung auf neuropathische Schmerzen in Ratten-CCI-Modellen. Diese Studie stellt ein Protokoll für SFI und elektrophysiologische Tests vor, um die therapeutischen Effekte nach einer FSN- oder TENS-Behandlung zu bewerten. Darüber hinaus wird veranschaulicht, wie die funktionelle Wiederherstellung des verletzten Nervs mithilfe nichtinvasiver Verhaltenstests und physiologischer Messungen bewertet werden kann. Die Ergebnisse zeigten, dass die FSN-Behandlung nach CCI-induzierte...
Offenlegungen
Die Autoren erklären, dass keine konkurrierenden Interessenkonflikte bestehen.
Danksagungen
Diese Studie wurde durch einen Zuschuss des Tierzentrums des Chang Bing Show Chwan Memorial Hospital, Changhua, Taiwan, unterstützt. Die Autoren danken dem Show Chwan Memorial Hospital IRCAD TAIWAN für die unschätzbare Unterstützung und Hilfe während dieses Forschungsprojekts.
Materialien
| Name | Company | Catalog Number | Comments |
| Forceps | World Precision Instruments | 14098 | |
| Fu’s subcutaneous needling | Nanjing Paifu Medical Science and Technology Co. | FSN needles are designed for single use. The FSN needle is made up of three parts: a solid steel needle core (bottom), a soft casing pipe (middle), and a protecting sheath (top). | |
| Medelec Synergy electromyography | Oxford Instrument Medical Ltd. | 034W003 | Electromyogram (EMG) are used to help in the diagnosis and management of disorders such as neuropathies. Contains a portable two-channel electromyography/nerve conduction velocity system. |
| Normal saline (0.9%) 20 mL | Taiwan Biotech Co.,Ltd. | 4711916010323 | Lot: 1TKB2022 |
| POLYSORB 4-0 VIOLET 30" CV-25 | UNITED STATES SURGICAL, A DIVISION OF TYCO HEALTHC | GL-181 | |
| Retractor | COOPERSURGICAL, INC.(USA) | 3311-8G | |
| Rompun | Elanco Animal Health Korea Co. Ltd. | 27668 | |
| SCISSORS CVD 90MM | BBRUAN | XG-LBB-BC101R | |
| Transcutaneous Electrical Nerve Stimulation | Well-Life Healthcare Co. | Model Number 2205A | Digital unit which offers TENS. Supplied complete with patient leads, self-adhesive electrodes, 3 AAA batteries and instructions in a soft carry bag. Interval ON time 1–30 s. Interval OFF time 1–30 s. |
| Zoletil | VIRRBAC | 8V8HA |
Referenzen
- van Hecke, O., Austin, S. K., Khan, R. A., Smith, B. H., Torrance, N. Neuropathic pain in the general population: a systematic review of epidemiological studies. Pain. 155 (4), 654-662 (2014).
- Younes, M., et al. Prevalence and risk factors of disk-related sciatica in an urban population in Tunisia. Joint Bone Spine. 73 (5), 538-542 (2006).
- Woolf, C. J., Mannion, R. J. Neuropathic pain: aetiology, symptoms, mechanisms, and management. Lancet. 353 (9168), 1959-1964 (1999).
- Baron, R., et al. Neuropathic low back pain in clinical practice. European Journal of Pain. 20 (6), 861-873 (2016).
- Ma, X., et al. Potential mechanisms of acupuncture for neuropathic pain based on somatosensory system. Frontiers in Neuroscience. 16, 940343 (2022).
- Jang, J. H., et al. Acupuncture alleviates chronic pain and comorbid conditions in a mouse model of neuropathic pain: the involvement of DNA methylation in the prefrontal cortex. Pain. 162 (2), 514-530 (2021).
- He, K., et al. Effects of acupuncture on neuropathic pain induced by spinal cord injury: A systematic review and meta-analysis. Evidence Based Complement and Alternative Medicine. 2022, 6297484 (2022).
- Fu, Z., Lu, D. Fu's Subcutaneous Needling: A Novel Therapeutic Proposal. Acupuncture - Resolving Old Controversies and Pointing New Pathways. IntechOpen. , (2019).
- Fu, Z. H. . The Foundation of Fu's Subcutaneous Needling. , (2016).
- Fu, Z. H., Chou, L. W. . Fu's Subcutaneous Needling, Trigger Point Dry Needling: An Evidence and Clinical-Based Approach. 2nd Edition. , 255-274 (2018).
- Fu, Z., Shepher, R. Fu's Subcutaneous Needling, a Modern Style of Ancient Acupuncture? Acupuncture in Modern Medicine. IntechOpen. , (2013).
- Chiu, P. E., et al. Efficacy of Fu's subcutaneous needling in treating soft tissue pain of knee osteoarthritis: A randomized clinical trial. Journal of Clinical Medicine. 11 (23), 7184 (2022).
- Huang, C. H., Lin, C. Y., Sun, M. F., Fu, Z., Chou, L. W. Efficacy of Fu's Subcutaneous Needling on Myofascial Trigger Points for Lateral Epicondylalgia: A randomized control trial. Evidence Based Complement and Alternative Medicine. 2022, 5951327 (2022).
- Huang, C. H. Rapid improvement in neck disability, mobility, and sleep quality with chronic neck pain treated by Fu's subcutaneous needling: A randomized control study. Pain Research and Management. 2022, 7592873 (2022).
- Chou, L. W., Hsieh, Y. L., Kuan, T. S., Hong, C. Z. Needling therapy for myofascial pain: recommended technique with multiple rapid needle insertion. Biomedicine (Taipei). 4 (2), 13 (2014).
- Ye, L., et al. Depression of mitochondrial function in the rat skeletal muscle model of myofascial pain syndrome is through down-regulation of the AMPK-PGC-1α-SIRT3 axis. Journal of Pain Research. 13, 1747-1756 (2020).
- Li, Y., et al. Effects of Fu's subcutaneous needling on mitochondrial structure and function in rats with sciatica. Molecular Pain. 18, 17448069221108717 (2022).
- Perreault, T., Fernández-de-Las-Peñas, C., Cummings, M., Gendron, B. C. Needling interventions for sciatica: Choosing methods based on neuropathic pain mechanisms-A scoping review. Journal of Clinical Medicine. 10 (10), 2189 (2021).
- Weller, J. L., Comeau, D., Otis, J. A. D. Myofascial pain. Seminars in Neurology. 38 (6), 640-643 (2018).
- Grøvle, L., et al. The bothersomeness of sciatica: patients' self-report of paresthesia, weakness and leg pain. European Spine Journal. 19 (2), 263-269 (2010).
- Jaggi, A. S., Jain, V., Singh, N. Animal models of neuropathic pain. Fundament Clinical Pharmacology. 25 (1), 1-28 (2011).
- Burma, N. E., Leduc-Pessah, H., Fan, C. Y., Trang, T. Animal models of chronic pain: Advances and challenges for clinical translation. Journal of Neuroscience Research. 95 (6), 1242-1256 (2017).
- McCann, M. E., Soriano, S. G. Does general anesthesia affect neurodevelopment in infants and children. British Medical Journal. 367, 6459 (2019).
- Chan, K. Y., et al. Ameliorative potential of hot compress on sciatic nerve pain in chronic constriction injury-induced rat model. Frontiers in Synaptic Neuroscience. 14, 859278 (2022).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. 33 (1), 87-107 (1988).
- Somers, D. L., Clemente, F. R. Transcutaneous electrical nerve stimulation for the management of neuropathic pain: The effects of frequency and electrode position on prevention of allodynia in a rat model of complex regional pain syndrome type II. Physical Therapy. 86 (5), 698-709 (2006).
- Xing, G., Liu, F., Wan, Y., Yao, L., Han, J. Electroacupuncture of 2 Hz induces long-term depression of synaptic transmission in the spinal dorsal horn in rats with neuropathic pain. Beijing Da Xue Xue Bao Yi Xue Ban. 35 (5), 453-457 (2003).
- Schone, A. M. . Veterinary Acupuncture: Ancient Art to Modern Medicine. , (1999).
- Stux, G., Pomeranz, B. . Acupuncture: Textbook and Atlas. , (1987).
- de Medinaceli, L., Freed, W. J., Wyatt, R. J. An index of the functional condition of rat sciatic nerve based on measurements made from walking tracks. Experimental Neurology. 77 (3), 634-643 (1982).
- Bain, J. R., Mackinnon, S. E., Hunter, D. A. Functional evaluation of complete sciatic, peroneal, and posterior tibial nerve lesions in the rat. Plastic and Reconstructive Surgery. 83 (1), 129-138 (1989).
- Kanaya, F., Firrell, J. C., Breidenbach, W. C. Sciatic function index, nerve conduction tests, muscle contraction, and axon morphometry as indicators of regeneration. Plastic and Reconstructive Surgery. 98 (7), 1264-1271 (1996).
- Wild, B. M., et al. In vivo electrophysiological measurement of the rat ulnar nerve with axonal excitability testing. Journal of Visualized Experiments: JoVE. (132), e56102 (2018).
- Wong, J. Y., Rapson, L. M. Acupuncture in the management of pain of musculoskeletal and neurologic origin. Physical Medicine and Rehabilitation Clinics of North America. 10 (3), 531-545 (1999).
- Qin, Z., Liu, X., Yao, Q., Zhai, Y., Liu, Z. Acupuncture for treating sciatica: A systematic review protocol. BMJ Open. 5 (4), 007498 (2015).
- Zhi, M. J., et al. Application of the chronic constriction injury of the partial sciatic nerve model to assess acupuncture analgesia. Journal of Pain Research. 10, 2271-2280 (2017).
- Fu, Z. H., Xu, J. G. A brief introduction to Fu's subcutaneous needling. Pain Clinic. 17, 343-348 (2005).
- Peng, J., et al. The effect of Fu's subcutaneous needling combined with reperfusion approach on surface electromyography signals in patients with cervical spondylosis and neck pain: A clinical trial protocol. Biomed Research International. 2022, 1761434 (2022).
- Fu, Z. H., Wang, J. H., Sun, J. H., Chen, X. Y., Xu, J. G. Fu's subcutaneous needling: possible clinical evidence of the subcutaneous connective tissue in acupuncture. Journal Alternative and Complementary Medicine. 13 (1), 47-51 (2007).
- Harrison, T. M., Churgin, S. M. Acupuncture and traditional Chinese veterinary medicine in zoological and exotic animal medicine: A review and introduction of methods. Veterinary Science. 9 (2), 74 (2022).
- Gollub, R. L., Hui, K. K., Stefano, G. B. Acupuncture: pain management coupled to immune stimulation. Zhongguo Yao Li Xue Bao. 20 (9), 769-777 (1999).
- Simons, D. G., Travell, J., Simons, L. E. . Myofascial Pain and Dysfunction: The Trigger Point Manual. 2nd ed. , (1999).
- Gerwin, R. D., Dommerholt, J., Shah, J. P. An expansion of Simons' integrated hypothesis of trigger point formation. Current Pain and Headache Reports. 8 (6), 468-475 (2004).
- Hong, C. Z., Simons, D. G. Pathophysiologic and electrophysiologic mechanisms of myofascial trigger points. Archives of Physical Medicine and Rehabilitation. 79 (7), 863-872 (1998).
- Fu, Z., et al. Remote subcutaneous needling to suppress the irritability of myofascial trigger spots: an experimental study in rabbits. Evidence Based Complement and Alternative Medicine. 2012, 353916 (2012).
- Hsieh, Y. L., Yang, C. C., Liu, S. Y., Chou, L. W., Hong, C. Z. Remote dose-dependent effects of dry needling at distant myofascial trigger spots of rabbit skeletal muscles on reduction of substance P levels of proximal muscle and spinal cords. Biomed Research International. 2014, 982121 (2014).
- Ma, K., et al. Peripheral nerve adjustment for postherpetic neuralgia: a randomized, controlled clinical study. Pain Medicine. 14 (12), 1944-1953 (2013).
- Gao, Y., Sun, J., Fu, Z., Chiu, P. E., Chou, L. W. Treatment of postsurgical trigeminal neuralgia with Fu's subcutaneous needling therapy resulted in prompt complete relief: Two case reports. Medicine. 102 (9), e33126 (2023).
- Lucas, L. R., Wang, C. J., McCall, T. J., McEwen, B. S. Effects of immobilization stress on neurochemical markers in the motivational system of the male rat. Brain Research. 1155, 108-115 (2007).
- Yang, C. H., et al. Effect of electroacupuncture on response to immobilization stress. Pharmacology, Biochemistry, and Behavior. 72 (4), 847-855 (2002).
- Adams, S., Pacharinsak, C. Mouse anesthesia and analgesia. Current Protocols in Mouse Biology. 5 (1), 51-63 (2015).
- Cantwell, S. L. Traditional Chinese veterinary medicine: the mechanism and management of acupuncture for chronic pain. Topics in Companion Animal Medicine. 25 (1), 53-58 (2010).
- Liebano, R. E., Rakel, B., Vance, C. G. T., Walsh, D. M., Sluka, K. A. An investigation of the development of analgesic tolerance to TENS in humans. Pain. 152 (2), 335-342 (2011).
- Khalil, Z., Merhi, M. Effects of aging on neurogenic vasodilator responses evoked by transcutaneous electrical nerve stimulation: relevance to wound healing. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 55 (6), B257-B263 (2000).
- Sato, K. L., Sanada, L. S., Silva, M. D. D., Okubo, R., Sluka, K. A. Transcutaneous electrical nerve stimulation, acupuncture, and spinal cord stimulation on neuropathic, inflammatory and, non-inflammatory pain in rat models. The Korean Journal of Pain. 33 (2), 121-130 (2020).
- Maeda, Y., Lisi, T. L., Vance, C. G., Sluka, K. A. Release of GABA and activation of GABA(A) in the spinal cord mediates the effects of TENS in rats. Brain Research. 1136 (1), 43-50 (2007).
- Degrugillier, L., et al. A new model of chronic peripheral nerve compression for basic research and pharmaceutical drug testing. Regenerative Medicine. 16 (10), 931-947 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten