È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Efficacia dell'agugliatura sottocutanea di Fu sul dolore al nervo sciatico: cambiamenti comportamentali ed elettrofisiologici in un modello di ratto con lesione da costrizione cronica
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Presentiamo un protocollo per l'utilizzo dell'agugliatura sottocutanea di Fu in un modello di lesione da costrizione cronica per indurre dolore al nervo sciatico nei ratti.
Abstract
L'agugliatura sottocutanea di Fu (FSN), una tecnica di agopuntura inventata dalla medicina tradizionale cinese, è utilizzata in tutto il mondo per alleviare il dolore. Tuttavia, i meccanismi d'azione non sono ancora del tutto compresi. Durante il trattamento FSN, l'ago FSN viene inserito e trattenuto nei tessuti sottocutanei per una lunga durata con un movimento ondulatorio. Tuttavia, le sfide sorgono dal mantenimento di una postura durante la manipolazione dell'FSN in modelli animali (ad esempio, ratti) per i ricercatori. Un trattamento scomodo può portare alla paura e alla resistenza agli aghi FSN, aumentando il rischio di lesioni e può persino influenzare i dati della ricerca. Anche l'anestesia può influenzare i risultati dello studio. Quindi, c'è bisogno di strategie nella terapia FSN sugli animali che riducano al minimo il danno durante l'intervento. Questo studio impiega un modello di lesione da costrizione cronica nei ratti Sprague-Dawley per indurre dolore neuropatico. Questo modello replica il dolore indotto dalla lesione nervosa osservata negli esseri umani attraverso la costrizione chirurgica di un nervo periferico, imitando la compressione o l'intrappolamento osservato in condizioni come le sindromi da compressione nervosa e le neuropatie periferiche. Introduciamo una manipolazione appropriata per inserire facilmente un ago FSN nello strato sottocutaneo del corpo dell'animale, compreso l'inserimento e la direzione dell'ago, la ritenzione dell'ago e il movimento ondulatorio. Ridurre al minimo il disagio del ratto impedisce al ratto di essere teso, il che provoca la contrazione del muscolo e ostacola l'ingresso dell'ago e migliora l'efficienza dello studio.
Introduzione
Si stima che il dolore neuropatico, definito come dolore causato da danni ai nervi, colpisca il 6,9%-10% della popolazione mondiale e la prevalenza una tantum riportata è del 49%-70%1,2. È anche considerata una delle sindromi dolorose più difficili da gestire. L'uso di agenti farmacologici per gestire il dolore neuropatico ha prodotto un successo limitato poiché i farmaci antidolorifici comunemente prescritti come i farmaci antinfiammatori non steroidei e gli oppioidi hanno mostrato scarsa efficacia nell'alleviare questo tipo di dolore 3,4. C'è quindi un grande bisogno di esplorare nuove opzioni terapeutiche, in particolare i trattamenti non farmacologici. L'agopuntura, come intervento non farmacologico, allevia potenzialmente il dolore neuropatico esercitando effetti analgesici sul sistema somatosensoriale. Sia gli studi clinici che quelli preclinici hanno indicato che l'agopuntura è efficace nell'alleviare i sintomi del dolore neuropatico senza effetti collaterali significativi 5,6,7. Tuttavia, il meccanismo centrale del trattamento con agopuntura per alleviare il dolore nel dolore neuropatico deve ancora essere ulteriormente studiato.
Negli ultimi anni, il needling sottocutaneo di Fu (FSN) ha guadagnato popolarità per il trattamento dei disturbi neurologici legati al dolore8. La FSN ha avuto origine dall'agopuntura tradizionale cinese ed è stata descritta per la prima volta dal medico tradizionale cinese Zhonghua Fu nel 1996 9,10. Pur avendo origine dall'agopuntura tradizionale, la FSN differisce in modo significativo nelle sue tecniche e teorie dall'agopuntura basata sui meridiani, dai principi yin e yang e dai concetti di punti di agopuntura. FSN pone maggiore enfasi sugli approcci neurofisiologici e anatomici per affrontare efficacemente il dolore miofasciale11. La terapia FSN viene applicata nella pratica clinica per affrontare vari disturbi muscolari dolorosi, mirando ai tessuti connettivi strettamente associati ai muscoli, concentrandosi in particolare sul trattamento dei muscoli tesi (TM)12. Come terapia complementare per alleviare il dolore, ci sono anche prove cliniche che la FSN è efficace nel trattamento delle lesioni dei tessuti molli, oltre a fornire una rapida gestione del dolore e un miglioramento significativo degli spasmi dei tessuti molli13,14. La terapia FSN prevede tecniche specifiche su misura per affrontare i punti trigger miofasciali sottostanti (MTrP) associati alla condizione. La posizione di inserimento dell'ago FSN viene scelta con cura in base alla posizione di questi punti trigger, consentendo un targeting preciso delle aree interessate. Durante la procedura, l'ago FSN viene inserito nello strato sottocutaneo, dove viene intenzionalmente fermato per ottimizzare gli effetti terapeutici. Viene quindi impiegata una tecnica distintiva nota come movimento ondeggiante, che prevede un delicato movimento oscillatorio dell'ago per stimolare i tessuti e promuovere le risposte terapeutiche10. Lo sviluppo di MTrP è associato alla teoria della crisi energetica, che spiega che fattori come il sovraccarico muscolare cronico, l'esercizio fisico eccessivo, le posture di sforzo scorrette, l'atrofia muscolare e la degenerazione possono contribuire all'insorgenza di ischemia e ipossia del tessuto muscolare. Si ritiene che questa carenza di ossigeno ed energia all'interno del tessuto muscolare svolga un ruolo chiave nella formazione di MTrPs15,16. Precedenti studi sugli animali hanno scoperto che il trattamento con FSN per il dolore cronico nei ratti migliora in una certa misura la struttura morfologica e la funzione dei mitocondri nelle MT, convalidando il potenziale della terapia FSN per promuovere il recupero dei nervi e dei muscoli danneggiati17.
La sciatica è stata classificata come dolore neuropatico18. Si ritiene che l'origine del dolore neuropatico si trovi ovunque tra la placca terminale motoria e lo strato fibroso esterno del muscolo, coinvolgendo il sistema microvascolare e i neurotrasmettitori a livello cellulare. La perdita dell'innervazione muscolare e l'apoptosi delle cellule nervose innervate si verificano quando si verifica un danno ai nervi19, che porta all'andatura correlata al dolore nell'arto interessato. Inoltre, la compressione cronica o l'irritazione del nervo possono portare a una serie di cambiamenti nel modo in cui funzionano i nervi, che possono esacerbare ulteriormente i sintomi della sciatica20. Tuttavia, la complessità del sistema nervoso rende difficile replicarlo in vitro, rendendo quindi necessario l'uso di modelli animali per tali studi. Nell'indagine sui disturbi del dolore neuropatico, gli organismi modello sono comunemente impiegati, che coinvolgono vari metodi di lesione diretta del nervo periferico, come la legatura del nervo sciatico, la transezione o la compressione21,22. Il modello di lesione da costrizione cronica (CCI) nei ratti Sprague-Dawley è stato utilizzato per indurre dolore neuropatico. Questo modello replica il dolore indotto dalla lesione nervosa osservata negli esseri umani attraverso la costrizione chirurgica di un nervo periferico, imitando la compressione o l'intrappolamento osservato in condizioni come le sindromi da compressione nervosa e le neuropatie periferiche.
In questo studio, abbiamo valutato gli effetti analgesici della terapia FSN e dell'elettroterapia a bassa frequenza (stimolatore nervoso elettrico transcutaneo, TENS) in ratti con lesione da costrizione cronica e dolore neuropatico. Poiché l'anestesia rallenta o blocca gli impulsi nervosi e influisce sulla trasmissione sinaptica e sulla funzione neuronale23, gli animali non possono essere anestetizzati in tutte le procedure di needling e nei movimenti ondeggianti. Pertanto, è necessaria una tecnica di ago appropriata per ridurre il disagio nei ratti. I passaggi per stabilire un modello CCI di ratto, il modo in cui i ratti sono stati trattati con il movimento ondeggiante combinato FSN senza anestesia, i test del modello comportamentale animale fattibile e le indagini elettrofisiologiche sono descritti in dettaglio.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutte le procedure che coinvolgono soggetti animali sono state approvate dall'Institutional Animal Care and Use Committee (IACUC) del Chang Bing Show Chwan Memorial Hospital, Changhua, Taiwan (111031) nell'ottobre 2022 (Figura 1).
1. Preparazione degli animali
- Acquista 48 ratti maschi Sprague-Dawley (SD) (età: 8-10 settimane, peso: 250-300 g).
- Ratti domestici singolarmente in gabbie ventilate a 24 ± 2 °C e un ciclo di 12 ore di buio e luce.
- Nutrire i ratti con una dieta standard a base di pellet con acqua potabile sterile pronta all'uso e fornire una lettiera morbida.
2. Raggruppamento degli animali
- Dividi in modo casuale 48 ratti SD in sei gruppi (n = 8 per gruppo): il gruppo sham, il gruppo CCI, il gruppo CCI+FSN, il gruppo CCI+TENS, il gruppo FSN da solo e il gruppo TENS da solo come nel precedente studio condotto da Chan et al.24.
NOTA: I dettagli di sei gruppi: (1) Gruppo fittizio: nessun intervento chirurgico e nessun trattamento; (2) gruppo CCI: preparato per l'intervento chirurgico senza trattamento; (3) Gruppo di trattamento CCI+FSN: trattamento FSN dopo la modellazione CCI di successo; (4) Gruppo di trattamento CCI+TENS: trattamento TENS dopo la modellazione CCI di successo; (5) Trattamento FSN da solo gruppo: solo trattamento FSN senza chirurgia; (6) Trattamento TENS da solo gruppo: solo trattamento TENS senza chirurgia.
3. Istituzione di un modello di ratto CCI
NOTA: Il modello di chirurgia CCI nei ratti è stato modificato secondo Bennett e Xie condotto nel 198825.
- Assicurarsi che l'operatore indossi una mascherina chirurgica, un cappuccio operatorio monouso e guanti sterili.
- Disinfettare la superficie del tavolo operatorio con etanolo al 70%. Sterilizzare gli strumenti (ad es. forbici, pinze e divaricatori), garze, graffette e cotton fioc in autoclave.
NOTA: Le tecniche asettiche vengono utilizzate durante tutta la procedura chirurgica. - Anestetizzare i ratti con isoflurano al 4% dopo la preparazione standard della pelle (rasatura) e mantenere con isoflurano al 2% (Figura 2A).
- Confermare la profondità appropriata dell'anestesia osservando la mancanza di risposta dopo aver pizzicato la zampa posteriore e monitorando i ratti anestetizzati durante la procedura.
- Applicare una quantità sufficiente di unguento oftalmico veterinario sugli occhi per proteggersi dalla secchezza.
- Posizionare il ratto in posizione prona sul tavolo operatorio e radere i peli sul lato della zampa posteriore destra, quindi disinfettare la pelle con una soluzione di iodio povidone ed etanolo al 75% tre volte. Fornire supporto termico durante tutta la procedura e utilizzare teli sterili per coprire il sito chirurgico.
- Praticare un'incisione parallela nella pelle 3-4 mm sotto il femore di circa 20-50 mm.
- Dare priorità all'identificazione delle posizioni del grande gluteo e del bicipite femorale. Separare il grasso sottocutaneo e la fascia superficiale strato per strato utilizzando le forbici chirurgiche, tagliando il tessuto connettivo circostante per esporre il muscolo (Figura 2B).
NOTA: Per distinguere il grasso sottocutaneo e gli strati superficiali della fascia, osservare la consistenza e il colore. Lo strato di grasso sottocutaneo dovrebbe apparire morbido e flessibile con un aspetto giallastro o biancastro. La fascia superficiale è un sottile strato fibroso situato direttamente sotto il grasso sottocutaneo. Differenziare tra gli strati palpando delicatamente o sondando con uno strumento smussato, notando che il grasso sottocutaneo offre una maggiore resistenza alla pressione rispetto alla fascia superficiale.
- Usando delle forbici smussate, taglia il tessuto connettivo tra i glutei superficiali e i muscoli bicipite femorale.
- Allargare lo spazio tra questi due muscoli utilizzando un divaricatore per esporre il nervo sciatico (Figura 2C).
NOTA: Per identificare visivamente il nervo sciatico in un ratto, concentrarsi sulla regione della coscia. Individua il punto medio della regione della coscia per visualizzare il nervo sciatico. Tipicamente, il nervo corre lungo la parte posteriore della coscia, partendo dalla regione dell'anca ed estendendosi verso il ginocchio. - Senza alterare la morfologia del nervo, prelevare il nervo sciatico con un microago attraverso una buona fonte di luce. Legare il nervo sciatico due volte utilizzando legature intestinali cromiche 3-0, posizionando i punti di legatura a circa 1 mm di distanza tra le due suture.
- Iniziando con un anello allentato per ogni legatura, afferrare le estremità della legatura vicino all'ansa e stringere fino a quando l'ansa non è appena aderente, assicurandosi che la legatura non scivoli lungo il nervo. Fermarsi quando si osservano lievi contrazioni dell'arto durante la legatura (Figura 2D).
- Allargare lo spazio tra questi due muscoli utilizzando un divaricatore per esporre il nervo sciatico (Figura 2C).
- Chiudi il muscolo e la pelle strato per strato con linee di sutura 4-0. Infine, disinfettare la ferita con iodio (Figura 2E).
- Monitorare attentamente i segni vitali dei ratti durante l'anestesia e metterli in gabbie di recupero individuali fino a quando non sono svegli prima di rimetterli nelle loro gabbie. Rivestire le gabbie con lettiera di carta piatta per prevenire l'asfissia negli animali incoscienti. Una breve contrazione nell'arto post-operatorio indica che l'operazione è riuscita (Figura 2F).
- Eseguire il test di ipersensibilità al dolore più volte prima della CCI (basale) e in diversi momenti dopo la CCI.
- Osservare il dolore spontaneo e i cambiamenti comportamentali nei giorni 1, 3, 5 e 7 dopo la costruzione del modello.
NOTA: Osservare l'andatura e la postura dell'arto posteriore destro e la presenza di leccate e morsi sull'arto.- Identificare la presenza di dolore neuropatico per determinare il successo dell'instaurazione del modello ed escludere i ratti che non hanno avuto successo.
NOTA: Valutare il successo del modello osservando segni come debolezza nella deambulazione degli arti inferiori, dita dell'arto destro tenute insieme con valgismo lieve, frequenti penzoloni e riluttanza ad atterrare. Osserva il ratto in piedi con l'arto posteriore sinistro che sostiene il peso, mentre l'arto posteriore destro è sollevato e vicino all'addome.
- Identificare la presenza di dolore neuropatico per determinare il successo dell'instaurazione del modello ed escludere i ratti che non hanno avuto successo.
4. Somministrazione della manipolazione FSN
- Fissare il ratto del gruppo di trattamento FSN (incluso CCI+FSN e FSN da solo) nel sistema di ritenuta per roditori con l'arto interessato esposto lateralmente. Fornire supporto termico durante tutta la procedura. Entrambi i gruppi sono stati trattati con aghi monouso FSN (Figura 3A).
- Senza anestesia, estendere gradualmente e lentamente gli arti posteriori del ratto fino a quando non sono stati allungati (Figura 3B).
NOTA: La testa del ratto è coperta da un telo chirurgico per mantenere l'animale calmo e stabile. Non estendere eccessivamente la gamba per causare lesioni al ratto. Osserva attentamente la risposta del ratto per eventuali segni di angoscia o disagio. Se il ratto mostra segni di dolore o disagio, interrompi l'estensione e fai una pausa prima di riprovare. - Rimuovere la guaina protettiva dell'ago FSN.
- Inserire la punta dell'ago FSN verso i TM (muscoli con MTrP), approssimativamente vicino al muscolo grande gluteo, situato nella parte bassa della schiena e nella parte posteriore.
- Posizionare l'ago FSN in piano ed entrare nella pelle con un angolo di circa 15°.
- Spingerlo con cautela e rapidamente attraverso la pelle e nello spazio sottocutaneo per prevenire lo stress nel ratto fino a quando non è completamente inserito. Assicurarsi che l'ago sia inserito a sufficienza per seppellire completamente il tubo morbido sotto la pelle.
- Quando si spinge in avanti, sollevare leggermente la punta dell'ago per osservare se il rigonfiamento cutaneo si muove lungo la punta dell'ago (Figura 3C).
- Eseguire il movimento ondeggiante sventolando dolcemente e dolcemente la punta dell'ago FSN con il pollice come fulcro mantenendo l'indice, il medio e l'anulare allineati in linea retta.
- Tenere l'ago FSN tra il dito medio e il pollice in posizione faccia a faccia e alternare il movimento avanti e indietro usando l'indice e l'anulare.
- Impostare la frequenza su 100 colpi al minuto ed eseguire l'operazione per circa 1 minuto (Figura 3D).
- Dopo aver completato la manipolazione, estrarre rapidamente l'ago FSN.
NOTA: L'operazione è stata eseguita ogni 2 giorni per un totale di quattro sessioni (giorni 1, 3, 5 e 7 dopo la creazione del modello CCI). Gli aghi FSN monouso devono essere utilizzati una sola volta. L'uso ripetuto smusserà l'ago e causerà un aumento del dolore nei ratti.
5. Somministrazione della manipolazione TENS
- Fissare il ratto del gruppo di trattamento TENS (incluso il gruppo CCI+TENS e il gruppo TENS da solo) nel sistema di ritenuta per roditori con l'arto interessato esposto lateralmente. Fornire supporto termico durante tutta la procedura. Assicurarsi che la pelliccia sia rasata prima di essere trattata.
NOTA: Gli elettrodi sono stati tagliati a 45 mm (lunghezza) per 5 mm (larghezza) (Figura 4A). - Scegliete il punto Zusanli (ST36) e il punto Sanyinjiao (SP6) come posizioni per TENS. Questo si basa sulla teoria per il trattamento del dolore neuropatico26,27.
- Localizzare il punto di Zusanli (ST36) a circa 5 mm lateralmente rispetto al tubercolo anteriore della tibia tra la tibia e il perone appena sotto il ginocchio28.
- Localizzare il punto Sanyinjiao (SP6) sul bordo posteriore della tibia, 3 mm prossimale al malleolo mediale28.
NOTA: Entrambi questi due punti di agopuntura sono localizzati mediante ispezione manuale come descritto da Stux e Pomeranz e nell'atlante di agopuntura animale 28,29 (Figura 4B).
- Fornire una stimolazione elettrica a bassa frequenza (onda sinusoidale continua a 2 Hz, 3 mA) per 10 minuti utilizzando il dispositivo TENS con l'elettrodo applicato sulla gamba intorno al nervo. Copri la testa della testa del topo con un telo chirurgico per mantenerla calma e stabile.
NOTA: Questa procedura viene eseguita ogni 2 giorni per un totale di quattro sessioni (giorni 1, 3, 5 e 7 dopo la creazione del modello CCI).
6. Misurazioni fisiologiche durante l'esecuzione del test comportamentale sugli animali
NOTA: L'indice di funzione sciatica (SFI)30 è un indice ampiamente utilizzato dai ricercatori che studiano la patologia e il potenziale trattamento delle lesioni nervose, determinato confrontando la geometria della zampa posteriore colpita nei ratti feriti con quella della zampa controlaterale e confrontandola con la zampa opposta.
- Progetta passerelle per ratti con plexiglass trasparente e specchi inclinabili per catturare le impronte e l'orientamento del corpo dei ratti durante la passeggiata.
NOTA: La passerella è una piattaforma lunga 10 cm, larga 50 cm e alta 15 cm con un rivestimento di carta bianca nella parte inferiore (Figura 5A). - Posiziona delicatamente e liberamente i ratti nella scatola e lascia che si acclimatino al loro nuovo ambiente per almeno 5 minuti prima di registrare.
NOTA: Particolare attenzione viene prestata per ridurre al minimo lo stress inutile sull'animale per evitare il suo possibile effetto sulla tensione muscolare posturale. - Immergi le zampe del topo nell'inchiostro rosso e lascia che il topo cammini lungo la striscia della passerella, lasciando tracce sulla carta di supporto. Registrare almeno 2 s di camminata continua per ogni test. Fate camminare il ratto almeno 3 volte in una direzione (Figura 5B).
NOTA: Applicare inchiostro rosso ad asciugatura rapida, non tossico e solubile in acqua su entrambe le zampe posteriori per rendere chiaramente visibili le impronte posteriori. - Al termine dell'esperimento, asciugare le strisce di passerella per misurare i parametri. Misura le loro impronte con un righello e arrotonda a 0,5 mm più vicino.
NOTA: Tre impronte chiare di ciascun ratto sono state selezionate da diverse impronte e sono stati misurati tre diversi parametri. I fattori per SFI includono la lunghezza di stampa (PL), la diffusione della punta (TS) e la diffusione intermedia della punta (ITS).
I valori SFI sono calcolati utilizzando la seguente formula31: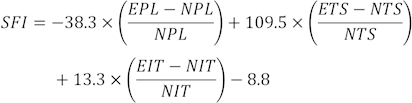
(EPL, lunghezza di stampa sperimentale; NPL, lunghezza di stampa normale; ETS, diffusione sperimentale delle dita dei piedi; NTS, normale diffusione delle dita dei piedi; EIT, tela intermedia sperimentale; NIT, diffusione intermedia della punta.)
SFI = 0 e - 100 indica una disfunzione normale e completa. Ai ratti che trascinavano le dita dei piedi veniva arbitrariamente assegnato un valore di -100. Per la normale funzione neurologica, l'SFI oscilla intorno a 0, mentre intorno a -100 SFI rappresenta la disfunzione completa32.
7. Valutazione neurofisiologica mediante misurazione elettrofisiologica33
NOTA: L'elettromiografia è stata utilizzata per registrare l'attività elettrofisiologica in questo studio. Il potenziale d'azione muscolare composto (CMAP) è causato dall'attivazione delle fibre muscolari nel muscolo bersaglio fornito dal nervo. Vengono studiate l'ampiezza e la latenza di CMAP. L'ampiezza CMAP viene misurata dal basale al picco negativo. La latenza dei CMAP è determinata misurando il tempo che intercorre tra l'applicazione dello stimolo e l'insorgenza del potenziale d'azione composto, che è influenzato dalla distanza tra il sito di stimolazione e il sito di registrazione. L'elettrofisiologia fornisce una valutazione obiettiva della funzione dei nervi periferici nei ratti.
- Somministrare Zoletil 50 (40 mg/kg, ip) per anestetizzare i ratti. Preparare la pelle secondo i protocolli standard (rasatura).
- Posizionare elettrodi adesivi monouso per superfici (diametro esterno 20 mm) sulle aree designate. Fissare gli elettrodi di registrazione alle superfici laterali e dorsali del muscolo gastrocnemio (Figura 6A).
- Applicare una stimolazione elettrica (intensità 1,2 mA) allo stelo del nervo sciatico prossimale destro. Registrare un potenziale d'azione muscolare composto (CMAP) sulla pancia del muscolo gastrocnemio (Figura 6B).
NOTA: Fare attenzione quando si inseriscono gli elettrodi per evitare il tessuto muscolare. - Registrare l'effetto di tre misurazioni ripetute per ogni ratto.
NOTA: CMAP è espresso come media ± DS di ciascun gruppo. Il segnale è stato amplificato da un amplificatore, filtrato (0,3-3 kHz). Dopo l'integrazione (costante di tempo = 0,05 s), vengono immessi sia il segnale originale che il segnale integrato. Il segnale originale e il segnale integrato vengono quindi digitalizzati nel sistema PowerLab e memorizzati sul disco rigido del computer. - Dopo aver completato le procedure elettrofisiologiche, spostare il ratto in un'altra gabbia e monitorarlo fino a quando non riprende abbastanza coscienza per mantenere una posizione sdraiata sternale. Una volta che il ratto si è completamente ripreso dall'anestetico, trasferiscilo di nuovo nella sua gabbia originale.
8. Statistiche:
- Valutare le differenze in SFI e CMAP tra i gruppi utilizzando l'analisi della varianza a misure ripetute (ANOVA).
- Quantificare i dati da parte di assistenti che sono ciechi alle condizioni sperimentali. Esprimere i dati come media ± deviazione standard.
- Confrontare i dati, quando appropriato, utilizzando il test t a due code accoppiato e non accoppiato di Student. Stabilire la significatività statistica come p < 0,05.
Access restricted. Please log in or start a trial to view this content.
Risultati
Impronte e determinazione dello SFI
Abbiamo esaminato lo sviluppo di SFI nei soli gruppi CCI, CCI+FSN e CCI+TENS (Figura 7). Dopo 4 sessioni di trattamenti FSN e TENS il giorno 7 per la chirurgia CCI, l'SFI nei gruppi CCI+FSN (-15,85 ± 3,46) e CCI+TENS (-29,58 ± 9,19) è migliorato significativamente rispetto al gruppo CCI da solo (-87,40 ± 14,22). Il miglioramento è stato significativo nel gruppo CCI+FSN rispetto al gruppo CCI+TENS (Figura 7A
Access restricted. Please log in or start a trial to view this content.
Discussione
Questo studio osserva l'effetto del trattamento FSN sul dolore neuropatico in modelli CCI di ratto. Questo studio presenta un protocollo per SFI e test elettrofisiologici per valutare gli effetti terapeutici dopo il trattamento con FSN o TENS. Inoltre, illustra come valutare il recupero funzionale del nervo lesionato utilizzando test comportamentali non invasivi e misurazioni fisiologiche. I risultati hanno mostrato che il trattamento FSN dopo dolore al nervo sciatico indotto da CCI ha mostrato un miglioramento significa...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori dichiarano che non esistono conflitti di interesse concorrenti.
Riconoscimenti
Questo studio è stato sostenuto da una sovvenzione del centro per animali del Chang Bing Show Chwan Memorial Hospital, Changhua, Taiwan. Gli autori desiderano ringraziare lo Show Chwan Memorial Hospital IRCAD TAIWAN per il loro inestimabile supporto e assistenza durante questo progetto di ricerca.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Forceps | World Precision Instruments | 14098 | |
| Fu’s subcutaneous needling | Nanjing Paifu Medical Science and Technology Co. | FSN needles are designed for single use. The FSN needle is made up of three parts: a solid steel needle core (bottom), a soft casing pipe (middle), and a protecting sheath (top). | |
| Medelec Synergy electromyography | Oxford Instrument Medical Ltd. | 034W003 | Electromyogram (EMG) are used to help in the diagnosis and management of disorders such as neuropathies. Contains a portable two-channel electromyography/nerve conduction velocity system. |
| Normal saline (0.9%) 20 mL | Taiwan Biotech Co.,Ltd. | 4711916010323 | Lot: 1TKB2022 |
| POLYSORB 4-0 VIOLET 30" CV-25 | UNITED STATES SURGICAL, A DIVISION OF TYCO HEALTHC | GL-181 | |
| Retractor | COOPERSURGICAL, INC.(USA) | 3311-8G | |
| Rompun | Elanco Animal Health Korea Co. Ltd. | 27668 | |
| SCISSORS CVD 90MM | BBRUAN | XG-LBB-BC101R | |
| Transcutaneous Electrical Nerve Stimulation | Well-Life Healthcare Co. | Model Number 2205A | Digital unit which offers TENS. Supplied complete with patient leads, self-adhesive electrodes, 3 AAA batteries and instructions in a soft carry bag. Interval ON time 1–30 s. Interval OFF time 1–30 s. |
| Zoletil | VIRRBAC | 8V8HA |
Riferimenti
- van Hecke, O., Austin, S. K., Khan, R. A., Smith, B. H., Torrance, N. Neuropathic pain in the general population: a systematic review of epidemiological studies. Pain. 155 (4), 654-662 (2014).
- Younes, M., et al. Prevalence and risk factors of disk-related sciatica in an urban population in Tunisia. Joint Bone Spine. 73 (5), 538-542 (2006).
- Woolf, C. J., Mannion, R. J. Neuropathic pain: aetiology, symptoms, mechanisms, and management. Lancet. 353 (9168), 1959-1964 (1999).
- Baron, R., et al. Neuropathic low back pain in clinical practice. European Journal of Pain. 20 (6), 861-873 (2016).
- Ma, X., et al. Potential mechanisms of acupuncture for neuropathic pain based on somatosensory system. Frontiers in Neuroscience. 16, 940343(2022).
- Jang, J. H., et al. Acupuncture alleviates chronic pain and comorbid conditions in a mouse model of neuropathic pain: the involvement of DNA methylation in the prefrontal cortex. Pain. 162 (2), 514-530 (2021).
- He, K., et al. Effects of acupuncture on neuropathic pain induced by spinal cord injury: A systematic review and meta-analysis. Evidence Based Complement and Alternative Medicine. 2022, 6297484(2022).
- Fu, Z., Lu, D. Fu's Subcutaneous Needling: A Novel Therapeutic Proposal. Acupuncture - Resolving Old Controversies and Pointing New Pathways. IntechOpen. , (2019).
- Fu, Z. H. The Foundation of Fu's Subcutaneous Needling. , People's Medical Publishing House, Co, Ltd. China. (2016).
- Fu, Z. H., Chou, L. W. Fu's Subcutaneous Needling, Trigger Point Dry Needling: An Evidence and Clinical-Based Approach. 2nd Edition. , Elsevier Health Sciences. Chapter 16 255-274 (2018).
- Fu, Z., Shepher, R. Fu's Subcutaneous Needling, a Modern Style of Ancient Acupuncture? Acupuncture in Modern Medicine. IntechOpen. , (2013).
- Chiu, P. E., et al. Efficacy of Fu's subcutaneous needling in treating soft tissue pain of knee osteoarthritis: A randomized clinical trial. Journal of Clinical Medicine. 11 (23), 7184(2022).
- Huang, C. H., Lin, C. Y., Sun, M. F., Fu, Z., Chou, L. W. Efficacy of Fu's Subcutaneous Needling on Myofascial Trigger Points for Lateral Epicondylalgia: A randomized control trial. Evidence Based Complement and Alternative Medicine. 2022, 5951327(2022).
- Huang, C. H. Rapid improvement in neck disability, mobility, and sleep quality with chronic neck pain treated by Fu's subcutaneous needling: A randomized control study. Pain Research and Management. 2022, 7592873(2022).
- Chou, L. W., Hsieh, Y. L., Kuan, T. S., Hong, C. Z. Needling therapy for myofascial pain: recommended technique with multiple rapid needle insertion. Biomedicine (Taipei). 4 (2), 13(2014).
- Ye, L., et al. Depression of mitochondrial function in the rat skeletal muscle model of myofascial pain syndrome is through down-regulation of the AMPK-PGC-1α-SIRT3 axis. Journal of Pain Research. 13, 1747-1756 (2020).
- Li, Y., et al. Effects of Fu's subcutaneous needling on mitochondrial structure and function in rats with sciatica. Molecular Pain. 18, 17448069221108717(2022).
- Perreault, T., Fernández-de-Las-Peñas, C., Cummings, M., Gendron, B. C. Needling interventions for sciatica: Choosing methods based on neuropathic pain mechanisms-A scoping review. Journal of Clinical Medicine. 10 (10), 2189(2021).
- Weller, J. L., Comeau, D., Otis, J. A. D. Myofascial pain. Seminars in Neurology. 38 (6), 640-643 (2018).
- Grøvle, L., et al. The bothersomeness of sciatica: patients' self-report of paresthesia, weakness and leg pain. European Spine Journal. 19 (2), 263-269 (2010).
- Jaggi, A. S., Jain, V., Singh, N. Animal models of neuropathic pain. Fundament Clinical Pharmacology. 25 (1), 1-28 (2011).
- Burma, N. E., Leduc-Pessah, H., Fan, C. Y., Trang, T. Animal models of chronic pain: Advances and challenges for clinical translation. Journal of Neuroscience Research. 95 (6), 1242-1256 (2017).
- McCann, M. E., Soriano, S. G. Does general anesthesia affect neurodevelopment in infants and children. British Medical Journal. 367, 6459(2019).
- Chan, K. Y., et al. Ameliorative potential of hot compress on sciatic nerve pain in chronic constriction injury-induced rat model. Frontiers in Synaptic Neuroscience. 14, 859278(2022).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. 33 (1), 87-107 (1988).
- Somers, D. L., Clemente, F. R. Transcutaneous electrical nerve stimulation for the management of neuropathic pain: The effects of frequency and electrode position on prevention of allodynia in a rat model of complex regional pain syndrome type II. Physical Therapy. 86 (5), 698-709 (2006).
- Xing, G., Liu, F., Wan, Y., Yao, L., Han, J. Electroacupuncture of 2 Hz induces long-term depression of synaptic transmission in the spinal dorsal horn in rats with neuropathic pain. Beijing Da Xue Xue Bao Yi Xue Ban. 35 (5), 453-457 (2003).
- Schone, A. M. Veterinary Acupuncture: Ancient Art to Modern Medicine. , American Veterinary Publication. (1999).
- Stux, G., Pomeranz, B. Acupuncture: Textbook and Atlas. , Springer-Verlag. Berlin. (1987).
- de Medinaceli, L., Freed, W. J., Wyatt, R. J. An index of the functional condition of rat sciatic nerve based on measurements made from walking tracks. Experimental Neurology. 77 (3), 634-643 (1982).
- Bain, J. R., Mackinnon, S. E., Hunter, D. A. Functional evaluation of complete sciatic, peroneal, and posterior tibial nerve lesions in the rat. Plastic and Reconstructive Surgery. 83 (1), 129-138 (1989).
- Kanaya, F., Firrell, J. C., Breidenbach, W. C. Sciatic function index, nerve conduction tests, muscle contraction, and axon morphometry as indicators of regeneration. Plastic and Reconstructive Surgery. 98 (7), 1264-1271 (1996).
- Wild, B. M., et al. In vivo electrophysiological measurement of the rat ulnar nerve with axonal excitability testing. Journal of Visualized Experiments: JoVE. (132), e56102(2018).
- Wong, J. Y., Rapson, L. M. Acupuncture in the management of pain of musculoskeletal and neurologic origin. Physical Medicine and Rehabilitation Clinics of North America. 10 (3), 531-545 (1999).
- Qin, Z., Liu, X., Yao, Q., Zhai, Y., Liu, Z. Acupuncture for treating sciatica: A systematic review protocol. BMJ Open. 5 (4), 007498(2015).
- Zhi, M. J., et al. Application of the chronic constriction injury of the partial sciatic nerve model to assess acupuncture analgesia. Journal of Pain Research. 10, 2271-2280 (2017).
- Fu, Z. H., Xu, J. G. A brief introduction to Fu's subcutaneous needling. Pain Clinic. 17, 343-348 (2005).
- Peng, J., et al. The effect of Fu's subcutaneous needling combined with reperfusion approach on surface electromyography signals in patients with cervical spondylosis and neck pain: A clinical trial protocol. Biomed Research International. 2022, 1761434(2022).
- Fu, Z. H., Wang, J. H., Sun, J. H., Chen, X. Y., Xu, J. G. Fu's subcutaneous needling: possible clinical evidence of the subcutaneous connective tissue in acupuncture. Journal Alternative and Complementary Medicine. 13 (1), 47-51 (2007).
- Harrison, T. M., Churgin, S. M. Acupuncture and traditional Chinese veterinary medicine in zoological and exotic animal medicine: A review and introduction of methods. Veterinary Science. 9 (2), 74(2022).
- Gollub, R. L., Hui, K. K., Stefano, G. B. Acupuncture: pain management coupled to immune stimulation. Zhongguo Yao Li Xue Bao. 20 (9), 769-777 (1999).
- Simons, D. G., Travell, J., Simons, L. E. Myofascial Pain and Dysfunction: The Trigger Point Manual. 2nd ed. , Williams and Wilkins. Baltimore, MD. (1999).
- Gerwin, R. D., Dommerholt, J., Shah, J. P. An expansion of Simons' integrated hypothesis of trigger point formation. Current Pain and Headache Reports. 8 (6), 468-475 (2004).
- Hong, C. Z., Simons, D. G. Pathophysiologic and electrophysiologic mechanisms of myofascial trigger points. Archives of Physical Medicine and Rehabilitation. 79 (7), 863-872 (1998).
- Fu, Z., et al. Remote subcutaneous needling to suppress the irritability of myofascial trigger spots: an experimental study in rabbits. Evidence Based Complement and Alternative Medicine. 2012, 353916(2012).
- Hsieh, Y. L., Yang, C. C., Liu, S. Y., Chou, L. W., Hong, C. Z. Remote dose-dependent effects of dry needling at distant myofascial trigger spots of rabbit skeletal muscles on reduction of substance P levels of proximal muscle and spinal cords. Biomed Research International. 2014, 982121(2014).
- Ma, K., et al. Peripheral nerve adjustment for postherpetic neuralgia: a randomized, controlled clinical study. Pain Medicine. 14 (12), 1944-1953 (2013).
- Gao, Y., Sun, J., Fu, Z., Chiu, P. E., Chou, L. W. Treatment of postsurgical trigeminal neuralgia with Fu's subcutaneous needling therapy resulted in prompt complete relief: Two case reports. Medicine. 102 (9), e33126(2023).
- Lucas, L. R., Wang, C. J., McCall, T. J., McEwen, B. S. Effects of immobilization stress on neurochemical markers in the motivational system of the male rat. Brain Research. 1155, 108-115 (2007).
- Yang, C. H., et al. Effect of electroacupuncture on response to immobilization stress. Pharmacology, Biochemistry, and Behavior. 72 (4), 847-855 (2002).
- Adams, S., Pacharinsak, C. Mouse anesthesia and analgesia. Current Protocols in Mouse Biology. 5 (1), 51-63 (2015).
- Cantwell, S. L. Traditional Chinese veterinary medicine: the mechanism and management of acupuncture for chronic pain. Topics in Companion Animal Medicine. 25 (1), 53-58 (2010).
- Liebano, R. E., Rakel, B., Vance, C. G. T., Walsh, D. M., Sluka, K. A. An investigation of the development of analgesic tolerance to TENS in humans. Pain. 152 (2), 335-342 (2011).
- Khalil, Z., Merhi, M. Effects of aging on neurogenic vasodilator responses evoked by transcutaneous electrical nerve stimulation: relevance to wound healing. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 55 (6), B257-B263 (2000).
- Sato, K. L., Sanada, L. S., Silva, M. D. D., Okubo, R., Sluka, K. A. Transcutaneous electrical nerve stimulation, acupuncture, and spinal cord stimulation on neuropathic, inflammatory and, non-inflammatory pain in rat models. The Korean Journal of Pain. 33 (2), 121-130 (2020).
- Maeda, Y., Lisi, T. L., Vance, C. G., Sluka, K. A. Release of GABA and activation of GABA(A) in the spinal cord mediates the effects of TENS in rats. Brain Research. 1136 (1), 43-50 (2007).
- Degrugillier, L., et al. A new model of chronic peripheral nerve compression for basic research and pharmaceutical drug testing. Regenerative Medicine. 16 (10), 931-947 (2021).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon