需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
傅氏皮下针刺治疗坐骨神经疼痛的疗效:慢性缩窄损伤大鼠模型中的行为和电生理变化
* 这些作者具有相同的贡献
摘要
我们提出了一种在慢性收缩损伤模型中使用 Fu 皮下针刺诱导大鼠坐骨神经疼痛的方案。
摘要
傅氏皮下针灸(FSN)是一种从中医发明的针灸技术,在世界范围内用于缓解疼痛。然而,作用机制仍未完全了解。在FSN治疗期间,FSN针头入并长时间保留在皮下组织中,并具有摇摆的运动。然而,对于研究人员来说,在动物模型(例如大鼠)中操作 FSN 时保持姿势会带来挑战。不舒服的治疗会导致对FSN针头的恐惧和抵抗,增加受伤的风险,甚至可能影响研究数据。麻醉也可能影响研究结果。因此,需要对动物进行FSN治疗的策略,以尽量减少干预期间的伤害。本研究在 Sprague-Dawley 大鼠中采用慢性收缩损伤模型来诱发神经性疼痛。该模型通过手术收缩周围神经来复制人类观察到的神经损伤引起的疼痛,模仿神经压迫综合征和周围神经病变等情况下的压迫或卡压。我们介绍了一种适当的操作,以便轻松地将FSN针头插入动物身体的皮下层,包括针头的插入和方向,针头的保持和摇摆运动。尽量减少大鼠的不适感,防止大鼠紧张,导致肌肉收缩,阻碍针头进入,提高研究效率。
引言
神经性疼痛,定义为由神经损伤引起的疼痛,估计影响世界人口的 6.9%-10%,报告的终生患病率为 49%-70%1,2。它也被认为是最难控制的疼痛综合征之一。使用药物治疗神经性疼痛的成功有限,因为常用的止痛药(如非甾体抗炎药和阿片类药物)在缓解此类疼痛方面几乎没有疗效 3,4。因此,非常需要探索新的治疗方案,尤其是非药物治疗。针灸作为一种非药物干预,通过对体感系统施加镇痛作用,可能减轻神经性疼痛。临床和临床前研究表明,针灸可有效缓解神经性疼痛症状,无明显副作用5,6,7。然而,针灸治疗缓解神经性疼痛的核心机制仍有待进一步研究。
近年来,傅氏皮下针(FSN)在治疗疼痛相关神经系统疾病方面越来越受欢迎8。FSN起源于中国传统针灸,由中医师傅忠华于1996年首次描述9,10。FSN虽然起源于传统针灸,但其技术和理论与经络针灸、阴阳原理和穴位概念有很大不同。FSN 更加重视神经生理学和解剖学方法,以有效解决肌筋膜疼痛11.FSN 疗法在临床实践中用于治疗各种疼痛性肌肉疾病,针对与肌肉密切相关的结缔组织,特别专注于肌肉紧绷 (TM) 的治疗12。作为缓解疼痛的补充疗法,还有临床证据表明,FSN 除了提供快速疼痛管理和显着改善软组织痉挛外,还可有效治疗软组织损伤13,14。FSN 治疗涉及为解决与该病症相关的潜在肌筋膜触发点 (MTrP) 而量身定制的特定技术。FSN针头的插入位置是根据这些触发点的位置精心选择的,可以精确定位受影响的区域。在手术过程中,将FSN针插入皮下层,在那里它被故意停止以优化治疗效果。然后采用一种称为摇摆运动的独特技术,包括针头的轻柔摆动运动以刺激组织并促进治疗反应10。MTrPs的发展与能量危机理论有关,该理论解释说,慢性肌肉超负荷、过度运动、不适当的劳累姿势、肌肉萎缩和退化等因素都会导致肌肉组织缺血和缺氧的发生。肌肉组织内的这种氧气和能量缺乏被认为在 MTrPs 的形成中起着关键作用15,16。先前的动物研究发现,FSN治疗大鼠慢性疼痛在一定程度上改善了TM中线粒体的形态结构和功能,验证了FSN疗法促进受损神经和肌肉恢复的潜力17。
坐骨神经痛被归类为神经性疼痛18。神经性疼痛的起源被认为位于运动终板和肌肉外纤维层之间的任何地方,涉及细胞水平的微血管系统和神经递质。当神经损伤发生时,肌肉神经支配丧失和神经支配神经细胞凋亡发生19,导致患肢出现与疼痛相关的步态。此外,神经的慢性压迫或刺激会导致神经功能方式的各种变化,从而进一步加剧坐骨神经痛的症状20。然而,神经系统的复杂性使其难以在体外复制,因此需要使用动物模型进行此类研究。在神经性疼痛障碍的研究中,通常采用模式生物,涉及各种直接周围神经损伤的方法,例如坐骨神经结扎、横断或压迫21,22。Sprague-Dawley大鼠的慢性收缩损伤(CCI)模型已被用于诱导神经性疼痛。该模型通过手术收缩周围神经来复制人类观察到的神经损伤引起的疼痛,模仿神经压迫综合征和周围神经病变等情况下的压迫或卡压。
在这项研究中,我们评估了FSN疗法和低频电疗法(经皮神经电刺激器,TENS)对慢性收缩损伤和神经性疼痛大鼠的镇痛效果。由于麻醉会减慢或阻断神经冲动并影响突触传递和神经元功能23,因此动物不能在所有针刺程序和摇摆运动下被麻醉。因此,需要适当的针头技术来减少大鼠的不适。详细描述了建立大鼠CCI模型的步骤,用FSN联合无麻醉摇摆运动治疗大鼠的方式,可行的动物行为模式测试和电生理学检查。
研究方案
2022 年 10 月,台湾彰化市 Chang Bing Show Chwan 纪念医院 (111031) 的机构动物护理和使用委员会 (IACUC) 批准了所有涉及动物受试者的程序(图 1)。
1.动物的准备
- 购买48只雄性Sprague-Dawley(SD)大鼠(年龄:8-10周,体重:250-300g)。
- 在24±2°C和12小时的黑暗和光照循环的通风笼中单独饲养大鼠。
- 用无菌饮用水喂养大鼠标准颗粒饮食,并提供柔软的垫料。
2. 动物分组
- 将 48 只 SD 大鼠随机分为 6 组(每组 n = 8 只):假手术组、CCI 组、CCI+FSN 组、FSN 单独组和 TENS 单独组,如 Chan 等人之前进行的研究24。
注:六组详情:(1)假组:无手术,无治疗;(2)CCI组:准备手术,无需治疗;(3)CCI+FSN处理组:CCI建模成功后的FSN处理;(4)CCI+TENS治疗组:CCI建模成功后的TENS治疗;(5)FSN单药治疗组:仅FSN治疗不手术;(6)单单TENS治疗组:仅TENS治疗,无需手术。
3. CCI大鼠模型的建立
注:根据 Bennett 和 Xie 于 1988年进行的 CCI 手术模型进行了修改 25.
- 确保操作人员佩戴外科口罩、一次性手术帽和无菌手套。
- 用70%乙醇对手术台表面进行消毒。通过高压灭菌对器械(例如剪刀、镊子和牵开器)、纱布、订书钉和棉签进行消毒。
注意:整个手术过程都使用无菌技术。 - 在标准皮肤准备(剃须)后用4%异氟醚麻醉大鼠,并用2%异氟醚维持(图2A)。
- 通过观察捏后爪后缺乏反应并在整个过程中监测麻醉大鼠来确认适当的麻醉深度。
- 在眼睛上涂抹足够的兽用眼药膏,以防止干燥。
- 将大鼠俯卧位放在手术台上,剃掉右后腿一侧的毛发,然后用聚维酮碘溶液和75%乙醇对皮肤进行消毒三次。在整个手术过程中提供热支持,并使用无菌窗帘覆盖手术部位。
- 在股骨下方3-4毫米处做一个平行切口,约20-50毫米。
- 优先确定臀大肌和股二头肌的位置。使用手术剪刀逐层分离皮下脂肪和浅筋膜,切开周围的结缔组织以暴露肌肉(图2B)。
注意:要区分皮下脂肪和浅筋膜层,请观察质地和颜色。皮下脂肪层应显得柔软柔韧,外观呈淡黄色或白色。浅筋膜是位于皮下脂肪正下方的薄纤维层。通过轻轻触诊或用钝器探查来区分各层,注意与浅筋膜相比,皮下脂肪具有更大的抗压能力。
- 使用钝剪刀,剪断臀浅肌和股二头肌之间的结缔组织。
- 使用牵开器扩大这两块肌肉之间的间隙,以暴露坐骨神经(图2C)。
注意:要从视觉上识别大鼠的坐骨神经,请关注大腿区域。找到大腿区域的中点以可视化坐骨神经。通常,神经沿着大腿的后部延伸,从臀部区域开始,向膝盖延伸。 - 在不改变神经形态的情况下,用微针通过良好的光源挑出坐骨神经。使用 3-0 染色肠结扎两次坐骨神经,将结扎点在两条缝合线之间相距约 1 毫米。
- 从每个结扎的松散环开始,抓住靠近环的结扎线末端并收紧,直到环刚好紧贴,确保结扎不会沿着神经滑动。在结扎过程中观察到肢体轻微抽搐时停止(图2D)。
- 使用牵开器扩大这两块肌肉之间的间隙,以暴露坐骨神经(图2C)。
- 用 4-0 缝合线逐层闭合肌肉和皮肤。最后,用碘对伤口进行消毒(图2E)。
- 在麻醉期间密切监测大鼠的生命体征,并将它们放入单独的恢复笼中,直到它们醒来,然后再将它们放回笼子中。在笼子里铺上扁平的纸垫,以防止失去知觉的动物窒息。术后肢体的短暂抽搐表明手术成功(图2F)。
- 在 CCI(基线)之前和 CCI 后的不同时间点进行多次疼痛超敏反应测试。
- 观察模型构建后第 1、3、5 和 7 天的自发性疼痛和行为变化。
注意:观察右后肢的步态和姿势以及肢体上是否存在舔和咬。- 识别神经性疼痛的存在,以确定模型的成功建立并排除不成功的大鼠。
注意:通过观察下肢行走无力、右肢脚趾并拢轻度外翻、频繁晃动和不愿着地等迹象来评估模型的成功。观察大鼠站立,左后肢支撑重物,而右后肢抬起并靠近腹部。
- 识别神经性疼痛的存在,以确定模型的成功建立并排除不成功的大鼠。
4. FSN操纵的管理
- 将FSN治疗组(包括CCI+FSN和FSN单独组)的大鼠固定在啮齿动物约束装置中,患肢侧向暴露。在整个过程中提供热支持。两组均用FSN一次性针头治疗(图3A)。
- 在没有麻醉的情况下,逐渐缓慢地伸展大鼠的后肢,直到它们被拉伸紧(图3B)。
注意:老鼠头上覆盖着手术布,以保持动物的平静和稳定。不要过度伸展腿部以伤害老鼠。密切观察大鼠的反应是否有任何痛苦或不适的迹象。如果大鼠出现疼痛或不适的迹象,请停止伸展并在再次尝试之前休息一下。 - 取下FSN针头的保护护套。
- 将FSN针头的尖端插入TM(具有MTrP的肌肉),大约靠近位于下背部和后部的臀大肌。
- 将 FSN 针头平放并以大约 15° 的角度进入皮肤。
- 小心而快速地将其推过皮肤并进入皮下空间,以防止大鼠受到压力,直到完全插入。确保针头插入充分,将软管完全埋在皮肤下。
- 向前推动时,稍微抬起针尖,观察皮肤隆起是否沿着针尖移动(图3C)。
- 以拇指为支点,平稳轻柔地扇动FSN针尖,同时保持食指、中指和无名指对齐成一条直线,进行摇摆运动。
- 将 FSN 针以面对面的位置握在中指和拇指之间,并使用食指和无名指来回交替移动。
- 将频率设置为每分钟 100 次并执行操作约 1 分钟(图 3D)。
- 完成操作后,迅速拔出FSN针头。
注意:该操作每 2 天执行一次,总共 4 个会话(创建 CCI 模型后的第 1、3、5 和 7 天)。一次性FSN针头必须使用一次。重复使用会使针头变钝并导致大鼠疼痛增加。
5. TENS操作的管理
- 将TENS治疗组(包括CCI+TENS和单独TENS组)的大鼠固定在啮齿动物约束装置中,患肢侧向暴露。在整个过程中提供热支持。确保在处理前剃掉毛皮。
注意:电极被切割成45mm(长度)x 5mm(宽度)(图4A)。 - 选择祖三里点(ST36)和三银角点(SP6)作为TENS的位置。这是基于治疗神经性疼痛的理论26,27。
- 将胫骨和腓骨之间的胫骨前结节外侧约 5 mm 处的 Zusanli 点 (ST36) 定位在膝盖下方 28 处。
- 将三阴娇穴 (SP6) 定位在胫骨后缘,内踝近端 3 mm 28。
注意:这两个穴位都是通过手动检查找到的,如Stux和Pomeranz以及动物针灸图集28,29(图4B)所述。
- 使用 TENS 设备将电极施加在神经周围的腿上,提供低频电刺激(2 Hz 连续正弦波,3 mA)10 分钟。用手术布盖住老鼠头的头部,以保持其平静和稳定。
注意:此过程每 2 天执行一次,总共执行 4 个会话(创建 CCI 模型后的第 1、3、5 和 7 天)。
6. 进行动物行为测试的生理测量
注意:坐骨神经功能指数 (SFI)30 是研究神经损伤病理学和潜在治疗的研究人员广泛使用的指数,通过比较受伤大鼠受影响后爪的几何形状和对侧爪的几何形状并将其与对面爪进行比较来确定。
- 设计带有透明有机玻璃和倾斜镜的老鼠走道,以捕捉老鼠在行走过程中的脚印和身体方向。
注意:人行道是一个长 10 厘米、宽 50 厘米、高 15 厘米的平台,底部有白纸衬里(图 5A)。 - 轻柔自由地将大鼠放入盒子中,让它们在记录前适应新环境至少5分钟。
注意:要特别注意尽量减少对动物的不必要压力,以避免其对姿势肌肉紧张的可能影响。 - 将老鼠的爪子浸入红色墨水中,让老鼠沿着人行道行走,在衬纸上留下痕迹。每次测试记录至少 2 秒的连续步行。让大鼠朝一个方向走至少3次(图5B)。
注意: 在双脚上涂抹速干、无毒、水溶性红色墨水,使后脚印清晰可见。 - 在实验结束时,干燥人行道条以测量参数。用尺子测量它们的足迹,四舍五入到最接近的 0.5 毫米。
注意:从几个脚印中选择每只大鼠的三个清晰脚印,并测量三个不同的参数。SFI 的因素包括打印长度 (PL)、脚趾展 (TS) 和中间脚趾展 (ITS)。
SFI 值使用以下公式31 计算: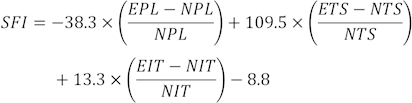
(EPL,实验打印长度;NPL,正常打印长度;ETS,实验性脚趾展开;NTS,正常脚趾张开;EIT,实验性中间趾展;NIT,中间脚趾张开。
SFI = 0 和 - 100 表示正常和完全功能障碍。拖着脚趾的大鼠被任意分配了 -100 的值。对于正常的神经功能,SFI 在 0 左右振荡,而 -100 左右的 SFI 代表完全功能障碍32。
7. 通过电生理测量进行神经生理学评估33
注意:肌电图用于记录本研究中的电生理活动。复合肌肉动作电位 (CMAP) 是由神经供应的靶肌肉中的肌纤维激活引起的。研究了CMAP幅度和延迟。CMAP振幅是从基线到负峰测量的。CMAP的潜伏期是通过测量刺激的施加和复合动作电位开始之间的时间来确定的,该时间受刺激部位和记录部位之间的距离影响。电生理学提供了大鼠周围神经功能的客观评估。
- 施用Zoletil 50(40mg / kg,ip)麻醉大鼠。根据标准方案(剃须)准备皮肤。
- 将一次性粘性表面电极(外径 20 毫米)放在指定区域。将记录电极固定在腓肠肌的外侧和背面(图6A)。
- 对右近端坐骨神经干施加电刺激(强度 1.2 mA)。记录腓肠肌腹部的复合肌肉动作电位(CMAP)(图6B)。
注意: 插入电极时要小心,以免触及肌肉组织。 - 记录每只大鼠三次重复测量的效果。
注意:CMAP表示为每组的平均值±SD。信号由滤波(0.3-3 kHz)的放大器放大。积分后(时间常数 = 0.05 s),原始信号和积分信号均输入。然后,原始信号和集成信号在PowerLab系统中进行数字化,并存储在计算机硬盘上。 - 完成电生理学程序后,将大鼠移至不同的笼子并对其进行监测,直到它恢复足够的意识以保持胸骨卧位。一旦大鼠从麻醉剂中完全恢复过来,将其转移回原来的笼子。
8. 统计:
- 使用重复测量方差分析 (ANOVA) 评估组间 SFI 和 CMAP 的差异。
- 由对实验条件视而不见的助手量化数据。将数据表示为平均值±标准差。
- 在适当的情况下,使用 Student 的双尾配对和不配对 t 检验比较数据。将统计显著性确定为 p < 0.05。
结果
SFI的足迹和确定
我们研究了 CCI、CCI+FSN 和 CCI+TENS 组中 SFI 的发展(图 7)。在第 7 天进行 4 次 FSN 和 TENS 治疗后,CCI+FSN 组 (-15.85 ± 3.46) 和 CCI+TENS (-29.58 ± 9.19) 组的 SFI 与单独 CCI 组 (-87.40 ± 14.22) 相比显着改善。与CCI+TENS组相比,CCI+FSN组的改善是显着的(图7A)。
我们还研究了假(0.02 ± 0.52)、单独 FSN(0.06 ?...
讨论
本研究观察了FSN治疗对大鼠CCI模型神经性疼痛的影响。本研究提出了一种 SFI 和电生理测试方案,以评估 FSN 或 TENS 治疗后的治疗效果。此外,它还说明了如何使用非侵入性行为测试和生理测量来评估受伤神经的功能恢复。结果显示,CCI诱导的坐骨神经疼痛后FSN治疗在所有预后指标上均明显优于TENS治疗。这项研究在未来以FSN疗法为重点的动物研究中具有巨大的应用潜力,以弥合基础研究和临床应?...
披露声明
作者声明不存在相互竞争的利益冲突。
致谢
这项研究得到了台湾彰化市Chang Bing Show Chwan纪念医院动物中心的资助。作者要感谢台湾IRCAD展春纪念医院在整个研究项目中的宝贵支持和帮助。
材料
| Name | Company | Catalog Number | Comments |
| Forceps | World Precision Instruments | 14098 | |
| Fu’s subcutaneous needling | Nanjing Paifu Medical Science and Technology Co. | FSN needles are designed for single use. The FSN needle is made up of three parts: a solid steel needle core (bottom), a soft casing pipe (middle), and a protecting sheath (top). | |
| Medelec Synergy electromyography | Oxford Instrument Medical Ltd. | 034W003 | Electromyogram (EMG) are used to help in the diagnosis and management of disorders such as neuropathies. Contains a portable two-channel electromyography/nerve conduction velocity system. |
| Normal saline (0.9%) 20 mL | Taiwan Biotech Co.,Ltd. | 4711916010323 | Lot: 1TKB2022 |
| POLYSORB 4-0 VIOLET 30" CV-25 | UNITED STATES SURGICAL, A DIVISION OF TYCO HEALTHC | GL-181 | |
| Retractor | COOPERSURGICAL, INC.(USA) | 3311-8G | |
| Rompun | Elanco Animal Health Korea Co. Ltd. | 27668 | |
| SCISSORS CVD 90MM | BBRUAN | XG-LBB-BC101R | |
| Transcutaneous Electrical Nerve Stimulation | Well-Life Healthcare Co. | Model Number 2205A | Digital unit which offers TENS. Supplied complete with patient leads, self-adhesive electrodes, 3 AAA batteries and instructions in a soft carry bag. Interval ON time 1–30 s. Interval OFF time 1–30 s. |
| Zoletil | VIRRBAC | 8V8HA |
参考文献
- van Hecke, O., Austin, S. K., Khan, R. A., Smith, B. H., Torrance, N. Neuropathic pain in the general population: a systematic review of epidemiological studies. Pain. 155 (4), 654-662 (2014).
- Younes, M., et al. Prevalence and risk factors of disk-related sciatica in an urban population in Tunisia. Joint Bone Spine. 73 (5), 538-542 (2006).
- Woolf, C. J., Mannion, R. J. Neuropathic pain: aetiology, symptoms, mechanisms, and management. Lancet. 353 (9168), 1959-1964 (1999).
- Baron, R., et al. Neuropathic low back pain in clinical practice. European Journal of Pain. 20 (6), 861-873 (2016).
- Ma, X., et al. Potential mechanisms of acupuncture for neuropathic pain based on somatosensory system. Frontiers in Neuroscience. 16, 940343 (2022).
- Jang, J. H., et al. Acupuncture alleviates chronic pain and comorbid conditions in a mouse model of neuropathic pain: the involvement of DNA methylation in the prefrontal cortex. Pain. 162 (2), 514-530 (2021).
- He, K., et al. Effects of acupuncture on neuropathic pain induced by spinal cord injury: A systematic review and meta-analysis. Evidence Based Complement and Alternative Medicine. 2022, 6297484 (2022).
- Fu, Z., Lu, D. Fu's Subcutaneous Needling: A Novel Therapeutic Proposal. Acupuncture - Resolving Old Controversies and Pointing New Pathways. IntechOpen. , (2019).
- Fu, Z. H. . The Foundation of Fu's Subcutaneous Needling. , (2016).
- Fu, Z. H., Chou, L. W. . Fu's Subcutaneous Needling, Trigger Point Dry Needling: An Evidence and Clinical-Based Approach. 2nd Edition. , 255-274 (2018).
- Fu, Z., Shepher, R. Fu's Subcutaneous Needling, a Modern Style of Ancient Acupuncture? Acupuncture in Modern Medicine. IntechOpen. , (2013).
- Chiu, P. E., et al. Efficacy of Fu's subcutaneous needling in treating soft tissue pain of knee osteoarthritis: A randomized clinical trial. Journal of Clinical Medicine. 11 (23), 7184 (2022).
- Huang, C. H., Lin, C. Y., Sun, M. F., Fu, Z., Chou, L. W. Efficacy of Fu's Subcutaneous Needling on Myofascial Trigger Points for Lateral Epicondylalgia: A randomized control trial. Evidence Based Complement and Alternative Medicine. 2022, 5951327 (2022).
- Huang, C. H. Rapid improvement in neck disability, mobility, and sleep quality with chronic neck pain treated by Fu's subcutaneous needling: A randomized control study. Pain Research and Management. 2022, 7592873 (2022).
- Chou, L. W., Hsieh, Y. L., Kuan, T. S., Hong, C. Z. Needling therapy for myofascial pain: recommended technique with multiple rapid needle insertion. Biomedicine (Taipei). 4 (2), 13 (2014).
- Ye, L., et al. Depression of mitochondrial function in the rat skeletal muscle model of myofascial pain syndrome is through down-regulation of the AMPK-PGC-1α-SIRT3 axis. Journal of Pain Research. 13, 1747-1756 (2020).
- Li, Y., et al. Effects of Fu's subcutaneous needling on mitochondrial structure and function in rats with sciatica. Molecular Pain. 18, 17448069221108717 (2022).
- Perreault, T., Fernández-de-Las-Peñas, C., Cummings, M., Gendron, B. C. Needling interventions for sciatica: Choosing methods based on neuropathic pain mechanisms-A scoping review. Journal of Clinical Medicine. 10 (10), 2189 (2021).
- Weller, J. L., Comeau, D., Otis, J. A. D. Myofascial pain. Seminars in Neurology. 38 (6), 640-643 (2018).
- Grøvle, L., et al. The bothersomeness of sciatica: patients' self-report of paresthesia, weakness and leg pain. European Spine Journal. 19 (2), 263-269 (2010).
- Jaggi, A. S., Jain, V., Singh, N. Animal models of neuropathic pain. Fundament Clinical Pharmacology. 25 (1), 1-28 (2011).
- Burma, N. E., Leduc-Pessah, H., Fan, C. Y., Trang, T. Animal models of chronic pain: Advances and challenges for clinical translation. Journal of Neuroscience Research. 95 (6), 1242-1256 (2017).
- McCann, M. E., Soriano, S. G. Does general anesthesia affect neurodevelopment in infants and children. British Medical Journal. 367, 6459 (2019).
- Chan, K. Y., et al. Ameliorative potential of hot compress on sciatic nerve pain in chronic constriction injury-induced rat model. Frontiers in Synaptic Neuroscience. 14, 859278 (2022).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. 33 (1), 87-107 (1988).
- Somers, D. L., Clemente, F. R. Transcutaneous electrical nerve stimulation for the management of neuropathic pain: The effects of frequency and electrode position on prevention of allodynia in a rat model of complex regional pain syndrome type II. Physical Therapy. 86 (5), 698-709 (2006).
- Xing, G., Liu, F., Wan, Y., Yao, L., Han, J. Electroacupuncture of 2 Hz induces long-term depression of synaptic transmission in the spinal dorsal horn in rats with neuropathic pain. Beijing Da Xue Xue Bao Yi Xue Ban. 35 (5), 453-457 (2003).
- Schone, A. M. . Veterinary Acupuncture: Ancient Art to Modern Medicine. , (1999).
- Stux, G., Pomeranz, B. . Acupuncture: Textbook and Atlas. , (1987).
- de Medinaceli, L., Freed, W. J., Wyatt, R. J. An index of the functional condition of rat sciatic nerve based on measurements made from walking tracks. Experimental Neurology. 77 (3), 634-643 (1982).
- Bain, J. R., Mackinnon, S. E., Hunter, D. A. Functional evaluation of complete sciatic, peroneal, and posterior tibial nerve lesions in the rat. Plastic and Reconstructive Surgery. 83 (1), 129-138 (1989).
- Kanaya, F., Firrell, J. C., Breidenbach, W. C. Sciatic function index, nerve conduction tests, muscle contraction, and axon morphometry as indicators of regeneration. Plastic and Reconstructive Surgery. 98 (7), 1264-1271 (1996).
- Wild, B. M., et al. In vivo electrophysiological measurement of the rat ulnar nerve with axonal excitability testing. Journal of Visualized Experiments: JoVE. (132), e56102 (2018).
- Wong, J. Y., Rapson, L. M. Acupuncture in the management of pain of musculoskeletal and neurologic origin. Physical Medicine and Rehabilitation Clinics of North America. 10 (3), 531-545 (1999).
- Qin, Z., Liu, X., Yao, Q., Zhai, Y., Liu, Z. Acupuncture for treating sciatica: A systematic review protocol. BMJ Open. 5 (4), 007498 (2015).
- Zhi, M. J., et al. Application of the chronic constriction injury of the partial sciatic nerve model to assess acupuncture analgesia. Journal of Pain Research. 10, 2271-2280 (2017).
- Fu, Z. H., Xu, J. G. A brief introduction to Fu's subcutaneous needling. Pain Clinic. 17, 343-348 (2005).
- Peng, J., et al. The effect of Fu's subcutaneous needling combined with reperfusion approach on surface electromyography signals in patients with cervical spondylosis and neck pain: A clinical trial protocol. Biomed Research International. 2022, 1761434 (2022).
- Fu, Z. H., Wang, J. H., Sun, J. H., Chen, X. Y., Xu, J. G. Fu's subcutaneous needling: possible clinical evidence of the subcutaneous connective tissue in acupuncture. Journal Alternative and Complementary Medicine. 13 (1), 47-51 (2007).
- Harrison, T. M., Churgin, S. M. Acupuncture and traditional Chinese veterinary medicine in zoological and exotic animal medicine: A review and introduction of methods. Veterinary Science. 9 (2), 74 (2022).
- Gollub, R. L., Hui, K. K., Stefano, G. B. Acupuncture: pain management coupled to immune stimulation. Zhongguo Yao Li Xue Bao. 20 (9), 769-777 (1999).
- Simons, D. G., Travell, J., Simons, L. E. . Myofascial Pain and Dysfunction: The Trigger Point Manual. 2nd ed. , (1999).
- Gerwin, R. D., Dommerholt, J., Shah, J. P. An expansion of Simons' integrated hypothesis of trigger point formation. Current Pain and Headache Reports. 8 (6), 468-475 (2004).
- Hong, C. Z., Simons, D. G. Pathophysiologic and electrophysiologic mechanisms of myofascial trigger points. Archives of Physical Medicine and Rehabilitation. 79 (7), 863-872 (1998).
- Fu, Z., et al. Remote subcutaneous needling to suppress the irritability of myofascial trigger spots: an experimental study in rabbits. Evidence Based Complement and Alternative Medicine. 2012, 353916 (2012).
- Hsieh, Y. L., Yang, C. C., Liu, S. Y., Chou, L. W., Hong, C. Z. Remote dose-dependent effects of dry needling at distant myofascial trigger spots of rabbit skeletal muscles on reduction of substance P levels of proximal muscle and spinal cords. Biomed Research International. 2014, 982121 (2014).
- Ma, K., et al. Peripheral nerve adjustment for postherpetic neuralgia: a randomized, controlled clinical study. Pain Medicine. 14 (12), 1944-1953 (2013).
- Gao, Y., Sun, J., Fu, Z., Chiu, P. E., Chou, L. W. Treatment of postsurgical trigeminal neuralgia with Fu's subcutaneous needling therapy resulted in prompt complete relief: Two case reports. Medicine. 102 (9), e33126 (2023).
- Lucas, L. R., Wang, C. J., McCall, T. J., McEwen, B. S. Effects of immobilization stress on neurochemical markers in the motivational system of the male rat. Brain Research. 1155, 108-115 (2007).
- Yang, C. H., et al. Effect of electroacupuncture on response to immobilization stress. Pharmacology, Biochemistry, and Behavior. 72 (4), 847-855 (2002).
- Adams, S., Pacharinsak, C. Mouse anesthesia and analgesia. Current Protocols in Mouse Biology. 5 (1), 51-63 (2015).
- Cantwell, S. L. Traditional Chinese veterinary medicine: the mechanism and management of acupuncture for chronic pain. Topics in Companion Animal Medicine. 25 (1), 53-58 (2010).
- Liebano, R. E., Rakel, B., Vance, C. G. T., Walsh, D. M., Sluka, K. A. An investigation of the development of analgesic tolerance to TENS in humans. Pain. 152 (2), 335-342 (2011).
- Khalil, Z., Merhi, M. Effects of aging on neurogenic vasodilator responses evoked by transcutaneous electrical nerve stimulation: relevance to wound healing. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 55 (6), B257-B263 (2000).
- Sato, K. L., Sanada, L. S., Silva, M. D. D., Okubo, R., Sluka, K. A. Transcutaneous electrical nerve stimulation, acupuncture, and spinal cord stimulation on neuropathic, inflammatory and, non-inflammatory pain in rat models. The Korean Journal of Pain. 33 (2), 121-130 (2020).
- Maeda, Y., Lisi, T. L., Vance, C. G., Sluka, K. A. Release of GABA and activation of GABA(A) in the spinal cord mediates the effects of TENS in rats. Brain Research. 1136 (1), 43-50 (2007).
- Degrugillier, L., et al. A new model of chronic peripheral nerve compression for basic research and pharmaceutical drug testing. Regenerative Medicine. 16 (10), 931-947 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。