Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Efficacité de l’aiguilletage sous-cutané de Fu sur la douleur du nerf sciatique : changements comportementaux et électrophysiologiques dans un modèle de rat de constriction chronique
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous présentons un protocole d’utilisation de l’aiguilletage sous-cutané de Fu dans un modèle de lésion de constriction chronique pour induire une douleur du nerf sciatique chez le rat.
Résumé
L’aiguilletage sous-cutané de Fu (FSN), une technique d’acupuncture inventée de la médecine traditionnelle chinoise, est utilisée dans le monde entier pour soulager la douleur. Cependant, les mécanismes d’action ne sont pas encore entièrement compris. Pendant le traitement par FSN, l’aiguille FSN est insérée et retenue dans les tissus sous-cutanés pendant une longue durée avec un mouvement de balancement. Cependant, le maintien d’une posture lors de la manipulation de la FSN dans des modèles animaux (par exemple, des rats) pour les chercheurs pose des défis. Un traitement inconfortable peut entraîner de la peur et de la résistance aux aiguilles FSN, augmentant le risque de blessure et pouvant même affecter les données de recherche. L’anesthésie peut également affecter les résultats de l’étude. Par conséquent, il est nécessaire de mettre en place des stratégies de thérapie FSN sur les animaux qui minimisent les blessures pendant l’intervention. Cette étude utilise un modèle de lésion de constriction chronique chez des rats Sprague-Dawley pour induire une douleur neuropathique. Ce modèle reproduit la douleur induite par une lésion nerveuse observée chez l’homme lors de la constriction chirurgicale d’un nerf périphérique, imitant la compression ou le piégeage observé dans des conditions telles que les syndromes de compression nerveuse et les neuropathies périphériques. Nous introduisons une manipulation appropriée pour insérer facilement une aiguille FSN dans la couche sous-cutanée du corps de l’animal, y compris l’insertion et la direction de l’aiguille, la rétention de l’aiguille et le mouvement de balancement. Minimiser l’inconfort du rat empêche le rat d’être tendu, ce qui provoque la contraction du muscle et entrave l’entrée de l’aiguille et améliore l’efficacité de l’étude.
Introduction
On estime que la douleur neuropathique, définie comme une douleur causée par des lésions nerveuses, touche 6,9 % à 10 % de la population mondiale, et la prévalence au cours de la vie est de 49 % à 70 %1,2. Il est également considéré comme l’un des syndromes douloureux les plus difficiles à gérer. L’utilisation d’agents pharmacologiques pour gérer la douleur neuropathique a donné un succès limité, car les analgésiques couramment prescrits comme les anti-inflammatoires non stéroïdiens et les opioïdes ont montré peu d’efficacité pour soulager ce type de douleur 3,4. Il est donc grand besoin d’explorer de nouvelles options de traitement, en particulier les traitements non pharmacologiques. L’acupuncture, en tant qu’intervention non pharmacologique, soulage potentiellement la douleur neuropathique en exerçant des effets analgésiques sur le système somatosensoriel. Des études cliniques et précliniques ont indiqué que l’acupuncture est efficace pour soulager les symptômes de la douleur neuropathique sans effets secondaires significatifs 5,6,7. Cependant, le mécanisme central du traitement par acupuncture pour soulager la douleur neuropathique reste à étudier.
Ces dernières années, l’aiguilletage sous-cutané de Fu (FSN) a gagné en popularité pour le traitement des troubles neurologiques liés à la douleur8. La FSN est issue de l’acupuncture traditionnelle chinoise et a été décrite pour la première fois par le médecin traditionnel chinois Zhonghua Fu en 1996 9,10. Bien qu’elle soit issue de l’acupuncture traditionnelle, la FSN diffère considérablement dans ses techniques et ses théories de l’acupuncture basée sur les méridiens, des principes du yin et du yang et des concepts ponctuels d’acupuncture. FSN met davantage l’accent sur les approches neurophysiologiques et anatomiques pour traiter efficacement la douleur myofasciale11. La thérapie FSN est appliquée en pratique clinique pour traiter divers troubles musculaires douloureux, ciblant les tissus conjonctifs étroitement associés aux muscles, en se concentrant particulièrement sur le traitement des muscles tendus (TM)12. En tant que thérapie complémentaire pour soulager la douleur, il existe également des preuves cliniques que la FSN est efficace dans le traitement des lésions des tissus mous en plus de fournir une gestion rapide de la douleur et une amélioration significative des spasmes des tissus mous13,14. Le traitement par FSN implique des techniques spécifiques adaptées pour traiter les points de déclenchement myofasciaux sous-jacents (MTrP) associés à la maladie. La position d’insertion de l’aiguille FSN est soigneusement choisie en fonction de l’emplacement de ces points de déclenchement, ce qui permet un ciblage précis des zones touchées. Au cours de la procédure, l’aiguille FSN est insérée dans la couche sous-cutanée, où elle est intentionnellement arrêtée pour optimiser les effets thérapeutiques. Une technique distinctive connue sous le nom de mouvement de balancement est alors utilisée, impliquant un léger mouvement d’oscillation de l’aiguille pour stimuler les tissus et favoriser les réponses thérapeutiques10. Le développement des MTrP est associé à la théorie de la crise énergétique, qui explique que des facteurs tels que la surcharge musculaire chronique, l’exercice excessif, les postures d’effort inappropriées, l’atrophie musculaire et la dégénérescence peuvent contribuer à l’apparition de l’ischémie et de l’hypoxie des tissus musculaires. On pense que cette carence en oxygène et en énergie dans le tissu musculaire joue un rôle clé dans la formation des MTrPs15,16. Des études animales antérieures ont montré que le traitement par FSN pour la douleur chronique chez le rat améliore dans une certaine mesure la structure morphologique et la fonction des mitochondries dans les MT, validant le potentiel de la thérapie FSN pour favoriser la récupération des nerfs et des muscles endommagés17.
La sciatique a été classée comme douleur neuropathique18. On pense que l’origine de la douleur neuropathique se situe n’importe où entre la plaque motrice et la couche fibreuse externe du muscle, impliquant le système microvasculaire et les neurotransmetteurs au niveau cellulaire. La perte d’innervation musculaire et l’apoptose des cellules nerveuses innervées se produisent lorsque des lésions nerveuses se produisent19, entraînant une démarche liée à la douleur dans le membre affecté. De plus, la compression ou l’irritation chronique du nerf peut entraîner divers changements dans le fonctionnement des nerfs, ce qui peut exacerber les symptômes de la sciatique20. Cependant, la complexité du système nerveux rend difficile sa reproduction in vitro, ce qui nécessite l’utilisation de modèles animaux pour de telles études. Dans l’étude des troubles de la douleur neuropathique, des organismes modèles sont couramment utilisés, impliquant diverses méthodes de lésions nerveuses périphériques directes, telles que la ligature, la transection ou la compression du nerf sciatique21,22. Le modèle de lésion de constriction chronique (CCI) chez les rats Sprague-Dawley a été utilisé pour induire des douleurs neuropathiques. Ce modèle reproduit la douleur induite par une lésion nerveuse observée chez l’homme lors de la constriction chirurgicale d’un nerf périphérique, imitant la compression ou le piégeage observé dans des conditions telles que les syndromes de compression nerveuse et les neuropathies périphériques.
Dans cette étude, nous avons évalué les effets antalgiques de la thérapie FSN et de l’électrothérapie à basse fréquence (stimulateur nerveux électrique transcutané, TENS) chez des rats présentant des lésions de constriction chronique et des douleurs neuropathiques. Comme l’anesthésie ralentit ou bloque l’influx nerveux et affecte la transmission synaptique et la fonction neuronale23, les animaux ne peuvent pas être anesthésiés sous toutes les procédures d’aiguilletage et les mouvements de balancement. Par conséquent, une technique d’aiguille appropriée est nécessaire pour réduire l’inconfort chez les rats. Les étapes de l’établissement d’un modèle CCI de rat, la façon dont les rats ont été traités avec le mouvement de balancement combiné FSN sans anesthésie, les tests de comportement animal réalisables et les investigations électrophysiologiques sont décrites en détail.
Access restricted. Please log in or start a trial to view this content.
Protocole
Toutes les procédures impliquant des sujets animaux ont été approuvées par le Comité institutionnel de soin et d’utilisation des animaux (IACUC) du Chang Bing Show Chwan Memorial Hospital, Changhua, Taïwan (111031) en octobre 2022 (Figure 1).
1. Préparation des animaux
- Acheter 48 rats mâles Sprague-Dawley (SD) (âge : 8-10 semaines, poids : 250-300 g).
- Hébergez les rats individuellement dans des cages ventilées à 24 ± 2 °C et un cycle sombre et lumineux de 12 heures.
- Nourrissez les rats avec une alimentation en granulés standard avec de l’eau potable stérile prête à l’emploi et fournissez-leur une litière douce.
2. Regroupement des animaux
- Divisez au hasard 48 rats SD en six groupes (n = 8 par groupe) : le groupe fictif, le groupe CCI, le groupe CCI+FSN, le groupe CCI+TENS, le groupe FSN seul et le groupe TENS seul, comme dans l’étude précédente menée par Chan et al.24.
REMARQUE : Les détails de six groupes : (1) Groupe fictif : pas de chirurgie ni de traitement ; (2) Groupe CCI : préparé à la chirurgie sans traitement ; (3) Groupe de traitement CCI+FSN : traitement FSN après modélisation CCI réussie ; (4) Groupe de traitement CCI+TENS : traitement TENS après modélisation CCI réussie ; (5) Groupe de traitement FSN seul : traitement FSN uniquement sans chirurgie ; (6) Groupe de traitement TENS seul : traitement TENS uniquement sans chirurgie.
3. Mise en place d’un modèle de rat CCI
NOTE : Le modèle de chirurgie CCI chez le rat a été modifié selon Bennett et Xie mené en 198825.
- Assurez-vous que l’opérateur porte un masque chirurgical, un capuchon d’opération jetable et des gants stériles.
- Désinfectez la surface de la table d’opération avec de l’éthanol à 70 %. Stérilisez les instruments (par exemple, les ciseaux, les pinces et les écarteurs), la gaze, les agrafes et les cotons-tiges par autoclavage.
REMARQUE : Des techniques aseptiques sont utilisées tout au long de l’intervention chirurgicale. - Anesthésier les rats avec de l’isoflurane à 4 % après la préparation standard de la peau (rasage) et maintenir avec de l’isoflurane à 2 % (figure 2A).
- Confirmez la profondeur appropriée de l’anesthésie en observant l’absence de réponse après avoir pincé la patte arrière et en surveillant les rats anesthésiés tout au long de la procédure.
- Appliquez suffisamment de pommade ophtalmique vétérinaire sur les yeux pour les protéger contre le dessèchement.
- Placez le rat en position couchée sur la table d’opération et rasez les poils sur le côté de la patte arrière droite, puis désinfectez la peau avec une solution de povidone iodée et de l’éthanol à 75% trois fois. Fournir un soutien thermique tout au long de la procédure et utiliser des champs stériles pour couvrir le site chirurgical.
- Faites une incision parallèle dans la peau à 3-4 mm sous le fémur d’environ 20-50 mm.
- Prioriser l’identification des positions du grand fessier et du biceps fémoral. Séparez la graisse sous-cutanée et le fascia superficiel couche par couche à l’aide de ciseaux chirurgicaux, en coupant le tissu conjonctif environnant pour exposer le muscle (Figure 2B).
REMARQUE : Pour distinguer la graisse sous-cutanée et les couches de fascia superficielles, observez la texture et la couleur. La couche de graisse sous-cutanée doit apparaître molle et souple avec un aspect jaunâtre ou blanchâtre. Le fascia superficiel est une fine couche fibreuse située directement sous la graisse sous-cutanée. Différenciez les couches en palpant ou en sondant doucement avec un instrument contondant, en notant que la graisse sous-cutanée offre plus de résistance à la pression que le fascia superficiel.
- À l’aide de ciseaux émoussés, coupez le tissu conjonctif entre les muscles fessier superficiel et le biceps fémoral.
- Élargir l’espace entre ces deux muscles à l’aide d’un écarteur pour exposer le nerf sciatique (Figure 2C).
REMARQUE : Pour identifier visuellement le nerf sciatique chez un rat, concentrez-vous sur la région de la cuisse. Localisez le point médian de la région de la cuisse pour visualiser le nerf sciatique. En règle générale, le nerf longe la face postérieure de la cuisse, partant de la région de la hanche et s’étendant vers le genou. - Sans altérer la morphologie du nerf, prélevez le nerf sciatique avec une micro-aiguille à travers une bonne source de lumière. Lister le nerf sciatique deux fois à l’aide de ligatures intestinales chromiques 3-0, en positionnant les points de ligature à environ 1 mm l’un de l’autre entre les deux sutures.
- En commençant par une boucle lâche pour chaque ligature, saisissez les extrémités de la ligature près de la boucle et serrez jusqu’à ce que la boucle soit juste serrée, en veillant à ce que la ligature ne glisse pas le long du nerf. Arrêt lorsqu’une légère contraction du membre est observée pendant la ligature (Figure 2D).
- Élargir l’espace entre ces deux muscles à l’aide d’un écarteur pour exposer le nerf sciatique (Figure 2C).
- Fermez le muscle et la peau couche par couche avec des lignes de suture 4-0. Enfin, désinfectez la plaie avec de l’iode (Figure 2E).
- Surveillez de près les signes vitaux des rats pendant l’anesthésie et placez-les dans des cages de récupération individuelles jusqu’à ce qu’ils soient réveillés avant de les remettre dans leurs cages. Tapisser les cages d’une litière en papier plat pour éviter l’asphyxie chez les animaux inconscients. Une brève contraction dans le membre postopératoire indique une opération réussie (Figure 2F).
- Effectuer des tests d’hypersensibilité à la douleur plusieurs fois avant l’ICC (ligne de base) et à différents moments après l’ICC.
- Observez la douleur spontanée et les changements de comportement les jours 1, 3, 5 et 7 après la construction du modèle.
REMARQUE : Observez la démarche et la posture du membre postérieur droit et la présence de léchage et de morsure sur le membre.- Identifier la présence de douleur neuropathique pour déterminer la réussite de l’établissement du modèle et exclure les rats qui n’ont pas réussi.
REMARQUE : Évaluez le succès du modèle en observant des signes tels qu’une faiblesse dans la marche des membres inférieurs, des orteils du membre droit maintenus ensemble avec un léger valgus, des pendaisons fréquentes et une réticence à atterrir. Observez le rat debout avec le membre postérieur gauche supportant le poids, tandis que le membre postérieur droit est surélevé et près de l’abdomen.
- Identifier la présence de douleur neuropathique pour déterminer la réussite de l’établissement du modèle et exclure les rats qui n’ont pas réussi.
4. Administration de la manipulation du FSN
- Fixez le rat du groupe de traitement FSN (y compris CCI+FSN et groupe FSN seul) dans la contention des rongeurs avec le membre affecté exposé latéralement. Fournir un soutien thermique tout au long de la procédure. Les deux groupes ont été traités avec des aiguilles jetables FSN (Figure 3A).
- Sans anesthésie, étendez les membres postérieurs du rat progressivement et lentement jusqu’à ce qu’ils soient tendus (Figure 3B).
REMARQUE : La tête du rat est recouverte d’un drap chirurgical pour garder l’animal calme et stable. Ne pas trop étendre la patte pour blesser le rat. Observez attentivement la réaction du rat pour détecter tout signe de détresse ou d’inconfort. Si le rat montre des signes de douleur ou d’inconfort, arrêtez l’extension et offrez-lui une pause avant de réessayer. - Retirez la gaine de protection de l’aiguille FSN.
- Insérez la pointe de l’aiguille FSN vers les TM (muscles avec MTrPs), à peu près près du muscle grand fessier, situés dans le bas du dos et à l’arrière.
- Placez l’aiguille FSN à plat et pénétrez dans la peau à un angle d’environ 15°.
- Poussez-le soigneusement et rapidement à travers la peau et dans l’espace sous-cutané pour éviter le stress chez le rat jusqu’à ce qu’il soit complètement inséré. Assurez-vous que l’aiguille est insérée suffisamment pour enterrer complètement le tube souple sous la peau.
- Lorsque vous poussez vers l’avant, soulevez légèrement la pointe de l’aiguille pour observer si le renflement cutané se déplace le long de la pointe de l’aiguille (Figure 3C).
- Effectuez le mouvement de balancement en éventant doucement et doucement la pointe de l’aiguille FSN avec le pouce comme point d’appui tout en gardant l’index, le majeur et l’annulaire alignés en ligne droite.
- Tenez l’aiguille FSN entre le majeur et le pouce en position face à face, et alternez le mouvement de va-et-vient à l’aide de l’index et de l’annulaire.
- Réglez la fréquence sur 100 coups par minute et effectuez l’opération pendant environ 1 min (Figure 3D).
- Une fois la manipulation terminée, retirez rapidement l’aiguille FSN.
REMARQUE : L’opération a été effectuée tous les 2 jours pour un total de quatre sessions (jours 1, 3, 5 et 7 après la création du modèle CCI). Les aiguilles FSN jetables doivent être utilisées une fois. Une utilisation répétée émoussera l’aiguille et causera une douleur accrue chez les rats.
5. Administration de la manipulation de la TENS
- Fixez le rat du groupe de traitement TENS (y compris CCI+TENS et groupe TENS seul) dans la contention des rongeurs avec le membre affecté exposé latéralement. Fournir un soutien thermique tout au long de la procédure. Assurez-vous que la fourrure est rasée avant d’être traitée.
REMARQUE : Les électrodes ont été coupées à 45 mm (longueur) par 5 mm (largeur) (Figure 4A). - Choisissez le point Zusanli (ST36) et le point Sanyinjiao (SP6) comme emplacements pour TENS. Ceci est basé sur la théorie du traitement de la douleur neuropathique26,27.
- Localiser le point de Zusanli (ST36) à environ 5 mm latéralement au tubercule antérieur du tibia entre le tibia et le péroné juste en dessous du genou28.
- Localisez le point de Sanyinjiao (SP6) au bord postérieur du tibia, à 3 mm de la malléole médiale28.
REMARQUE : Ces deux points d’acupuncture sont localisés par inspection manuelle comme décrit par Stux et Pomeranz et dans l’atlas d’acupuncture animale28,29 (Figure 4B).
- Délivrer une stimulation électrique à basse fréquence (onde sinusoïdale continue 2 Hz, 3 mA) pendant 10 min à l’aide de l’appareil TENS avec l’électrode appliquée sur la jambe autour du nerf. Couvrez la tête de la tête du rat avec un drap chirurgical pour la garder calme et stable.
REMARQUE : Cette procédure est effectuée tous les 2 jours pour un total de quatre sessions (jours 1, 3, 5 et 7 après la création du modèle CCI).
6. Mesures physiologiques pour effectuer le test comportemental sur l’animal
REMARQUE : L’indice de la fonction sciatique (SFI)30 est un indice largement utilisé par les chercheurs qui étudient la pathologie et le traitement potentiel des lésions nerveuses, déterminé en comparant la géométrie de la patte arrière affectée chez les rats blessés avec celle de la patte controlatérale et en la comparant à la patte opposée.
- Concevez des allées pour rats avec du plexiglas transparent et des miroirs inclinables pour capturer les empreintes de pas et l’orientation du corps des rats pendant la promenade.
REMARQUE : La passerelle est une plate-forme de 10 cm de long, 50 cm de large et 15 cm de haut avec une doublure en papier blanc au bas (figure 5A). - Placez doucement et librement les rats dans la boîte et laissez-les s’acclimater à leur nouvel environnement pendant au moins 5 minutes avant d’enregistrer.
REMARQUE : Un soin particulier est pris pour minimiser le stress inutile sur l’animal afin d’éviter son effet possible sur la tension musculaire posturale. - Trempez les pattes du rat dans de l’encre rouge et laissez-le marcher le long de la bande de l’allée, en laissant des traces sur le papier support. Enregistrez au moins 2 s de marche continue pour chaque test. Faites marcher le rat au moins 3 fois dans une direction (Figure 5B).
REMARQUE : Appliquez de l’encre rouge à séchage rapide, non toxique et soluble dans l’eau sur les deux pattes arrière pour rendre les empreintes de pas arrière clairement visibles. - À la fin de l’expérience, séchez les bandes de la passerelle pour mesurer les paramètres. Mesurez leurs empreintes avec une règle et arrondissez à 0,5 mm près.
REMARQUE : Trois empreintes claires de chaque rat ont été sélectionnées parmi plusieurs empreintes, et trois paramètres différents ont été mesurés. Les facteurs pour SFI comprennent la longueur d’impression (PL), l’écartement des orteils (TS) et l’écartement intermédiaire des orteils (ITS).
Les valeurs SFI sont calculées à l’aide de la formulesuivante 31 :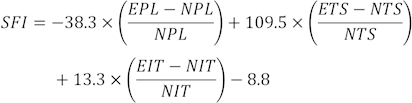
(EPL, longueur d’impression expérimentale ; NPL, longueur d’impression normale ; ETS, écartement expérimental des orteils ; NTS, écartement normal des orteils ; EIT, écartement intermédiaire expérimental des orteils ; NIT, écartement intermédiaire des orteils.)
SFI = 0 et - 100 indique un dysfonctionnement normal et complet. Les rats qui traînaient leurs orteils se voyaient attribuer arbitrairement une valeur de -100. Pour une fonction neurologique normale, le SFI oscille autour de 0, tandis qu’environ -100 SFI représente un dysfonctionnement complet32.
7. Évaluation neurophysiologique par mesure électrophysiologique33
NOTE : L’électromyographie a été utilisée pour enregistrer l’activité électrophysiologique dans cette étude. Le potentiel d’action musculaire composé (CMAP) est causé par l’activation des fibres musculaires dans le muscle cible alimenté par le nerf. L’amplitude et la latence du CMAP sont étudiées. L’amplitude CMAP est mesurée de la ligne de base au pic négatif. La latence des CMAP est déterminée en mesurant le temps entre l’application du stimulus et l’apparition du potentiel d’action du composé, qui est influencé par la distance entre le site de stimulation et le site d’enregistrement. L’électrophysiologie fournit une évaluation objective de la fonction nerveuse périphérique chez le rat.
- Administrer du Zoletil 50 (40 mg/kg, ip) pour anesthésier les rats. Préparez la peau selon les protocoles standards (rasage).
- Placez des électrodes de surface adhésives jetables (diamètre extérieur de 20 mm) sur les zones désignées. Fixez les électrodes d’enregistrement sur les surfaces latérales et dorsales du muscle gastrocnémien (Figure 6A).
- Appliquez une stimulation électrique (intensité 1,2 mA) sur le tronc du nerf sciatique proximal droit. Enregistrer un potentiel d’action musculaire composé (CMAP) sur le ventre du muscle gastrocnémien (Figure 6B).
REMARQUE : Soyez prudent lors de l’insertion des électrodes pour éviter le tissu musculaire. - Noter l’effet de trois mesures répétées pour chaque rat.
NOTE : Le CMAP est exprimé comme la moyenne ± l’écart-type de chaque groupe. Le signal était amplifié par un amplificateur, filtré (0,3-3 kHz). Après intégration (constante de temps = 0,05 s), le signal d’origine et le signal intégré sont saisis. Le signal d’origine et le signal intégré sont ensuite numérisés dans le système PowerLab et stockés sur le disque dur de l’ordinateur. - Après avoir terminé les procédures d’électrophysiologie, déplacez le rat dans une autre cage et surveillez-le jusqu’à ce qu’il retrouve suffisamment de conscience pour maintenir une position couchée sternale. Une fois que le rat s’est complètement remis de l’anesthésie, transférez-le dans sa cage d’origine.
8. Statistiques :
- Évaluer les différences entre les groupes en matière d’ISF et de PAD à l’aide de l’analyse de variance à mesures répétées (ANOVA).
- Quantifier les données par des assistants aveugles aux conditions expérimentales. Exprimez les données sous forme de moyenne ± d’écart-type.
- Comparez les données, le cas échéant, à l’aide du test t bilatéral apparié et non apparié de Student. Établir la signification statistique comme p < 0,05.
Access restricted. Please log in or start a trial to view this content.
Résultats
Empreintes et détermination du SFI
Nous avons examiné le développement de la SFI dans les groupes CCI seul, CCI+FSN et CCI+TENS (Figure 7). Après 4 séances de traitements FSN et TENS le jour 7 pour la chirurgie CCI, le SFI dans les groupes CCI+FSN (-15,85 ± 3,46) et CCI+TENS (-29,58 ± 9,19) s’est amélioré de manière significative par rapport au groupe CCI seul (-87,40 ± 14,22). L’amélioration a été significative dans le groupe CCI+FSN par rapport au grou...
Access restricted. Please log in or start a trial to view this content.
Discussion
Cette étude observe l’effet du traitement par FSN sur la douleur neuropathique dans des modèles CCI de rats. Cette étude présente un protocole de SFI et de tests électrophysiologiques pour évaluer les effets thérapeutiques après un traitement FSN ou TENS. De plus, il illustre comment évaluer la récupération fonctionnelle du nerf lésé à l’aide de tests comportementaux non invasifs et de mesures physiologiques. Les résultats ont montré que le traitement par FSN après une douleur du nerf sciatique indui...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs déclarent qu’il n’existe aucun conflit d’intérêts concurrent.
Remerciements
Cette étude a été financée par une subvention du centre animalier du Chang Bing Show Chwan Memorial Hospital, Changhua, Taïwan. Les auteurs tiennent à remercier le Show Chwan Memorial Hospital IRCAD TAIWAN pour leur soutien et leur assistance inestimables tout au long de ce projet de recherche.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Forceps | World Precision Instruments | 14098 | |
| Fu’s subcutaneous needling | Nanjing Paifu Medical Science and Technology Co. | FSN needles are designed for single use. The FSN needle is made up of three parts: a solid steel needle core (bottom), a soft casing pipe (middle), and a protecting sheath (top). | |
| Medelec Synergy electromyography | Oxford Instrument Medical Ltd. | 034W003 | Electromyogram (EMG) are used to help in the diagnosis and management of disorders such as neuropathies. Contains a portable two-channel electromyography/nerve conduction velocity system. |
| Normal saline (0.9%) 20 mL | Taiwan Biotech Co.,Ltd. | 4711916010323 | Lot: 1TKB2022 |
| POLYSORB 4-0 VIOLET 30" CV-25 | UNITED STATES SURGICAL, A DIVISION OF TYCO HEALTHC | GL-181 | |
| Retractor | COOPERSURGICAL, INC.(USA) | 3311-8G | |
| Rompun | Elanco Animal Health Korea Co. Ltd. | 27668 | |
| SCISSORS CVD 90MM | BBRUAN | XG-LBB-BC101R | |
| Transcutaneous Electrical Nerve Stimulation | Well-Life Healthcare Co. | Model Number 2205A | Digital unit which offers TENS. Supplied complete with patient leads, self-adhesive electrodes, 3 AAA batteries and instructions in a soft carry bag. Interval ON time 1–30 s. Interval OFF time 1–30 s. |
| Zoletil | VIRRBAC | 8V8HA |
Références
- van Hecke, O., Austin, S. K., Khan, R. A., Smith, B. H., Torrance, N. Neuropathic pain in the general population: a systematic review of epidemiological studies. Pain. 155 (4), 654-662 (2014).
- Younes, M., et al. Prevalence and risk factors of disk-related sciatica in an urban population in Tunisia. Joint Bone Spine. 73 (5), 538-542 (2006).
- Woolf, C. J., Mannion, R. J. Neuropathic pain: aetiology, symptoms, mechanisms, and management. Lancet. 353 (9168), 1959-1964 (1999).
- Baron, R., et al. Neuropathic low back pain in clinical practice. European Journal of Pain. 20 (6), 861-873 (2016).
- Ma, X., et al. Potential mechanisms of acupuncture for neuropathic pain based on somatosensory system. Frontiers in Neuroscience. 16, 940343(2022).
- Jang, J. H., et al. Acupuncture alleviates chronic pain and comorbid conditions in a mouse model of neuropathic pain: the involvement of DNA methylation in the prefrontal cortex. Pain. 162 (2), 514-530 (2021).
- He, K., et al. Effects of acupuncture on neuropathic pain induced by spinal cord injury: A systematic review and meta-analysis. Evidence Based Complement and Alternative Medicine. 2022, 6297484(2022).
- Fu, Z., Lu, D. Fu's Subcutaneous Needling: A Novel Therapeutic Proposal. Acupuncture - Resolving Old Controversies and Pointing New Pathways. IntechOpen. , (2019).
- Fu, Z. H. The Foundation of Fu's Subcutaneous Needling. , People's Medical Publishing House, Co, Ltd. China. (2016).
- Fu, Z. H., Chou, L. W. Fu's Subcutaneous Needling, Trigger Point Dry Needling: An Evidence and Clinical-Based Approach. 2nd Edition. , Elsevier Health Sciences. Chapter 16 255-274 (2018).
- Fu, Z., Shepher, R. Fu's Subcutaneous Needling, a Modern Style of Ancient Acupuncture? Acupuncture in Modern Medicine. IntechOpen. , (2013).
- Chiu, P. E., et al. Efficacy of Fu's subcutaneous needling in treating soft tissue pain of knee osteoarthritis: A randomized clinical trial. Journal of Clinical Medicine. 11 (23), 7184(2022).
- Huang, C. H., Lin, C. Y., Sun, M. F., Fu, Z., Chou, L. W. Efficacy of Fu's Subcutaneous Needling on Myofascial Trigger Points for Lateral Epicondylalgia: A randomized control trial. Evidence Based Complement and Alternative Medicine. 2022, 5951327(2022).
- Huang, C. H. Rapid improvement in neck disability, mobility, and sleep quality with chronic neck pain treated by Fu's subcutaneous needling: A randomized control study. Pain Research and Management. 2022, 7592873(2022).
- Chou, L. W., Hsieh, Y. L., Kuan, T. S., Hong, C. Z. Needling therapy for myofascial pain: recommended technique with multiple rapid needle insertion. Biomedicine (Taipei). 4 (2), 13(2014).
- Ye, L., et al. Depression of mitochondrial function in the rat skeletal muscle model of myofascial pain syndrome is through down-regulation of the AMPK-PGC-1α-SIRT3 axis. Journal of Pain Research. 13, 1747-1756 (2020).
- Li, Y., et al. Effects of Fu's subcutaneous needling on mitochondrial structure and function in rats with sciatica. Molecular Pain. 18, 17448069221108717(2022).
- Perreault, T., Fernández-de-Las-Peñas, C., Cummings, M., Gendron, B. C. Needling interventions for sciatica: Choosing methods based on neuropathic pain mechanisms-A scoping review. Journal of Clinical Medicine. 10 (10), 2189(2021).
- Weller, J. L., Comeau, D., Otis, J. A. D. Myofascial pain. Seminars in Neurology. 38 (6), 640-643 (2018).
- Grøvle, L., et al. The bothersomeness of sciatica: patients' self-report of paresthesia, weakness and leg pain. European Spine Journal. 19 (2), 263-269 (2010).
- Jaggi, A. S., Jain, V., Singh, N. Animal models of neuropathic pain. Fundament Clinical Pharmacology. 25 (1), 1-28 (2011).
- Burma, N. E., Leduc-Pessah, H., Fan, C. Y., Trang, T. Animal models of chronic pain: Advances and challenges for clinical translation. Journal of Neuroscience Research. 95 (6), 1242-1256 (2017).
- McCann, M. E., Soriano, S. G. Does general anesthesia affect neurodevelopment in infants and children. British Medical Journal. 367, 6459(2019).
- Chan, K. Y., et al. Ameliorative potential of hot compress on sciatic nerve pain in chronic constriction injury-induced rat model. Frontiers in Synaptic Neuroscience. 14, 859278(2022).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. 33 (1), 87-107 (1988).
- Somers, D. L., Clemente, F. R. Transcutaneous electrical nerve stimulation for the management of neuropathic pain: The effects of frequency and electrode position on prevention of allodynia in a rat model of complex regional pain syndrome type II. Physical Therapy. 86 (5), 698-709 (2006).
- Xing, G., Liu, F., Wan, Y., Yao, L., Han, J. Electroacupuncture of 2 Hz induces long-term depression of synaptic transmission in the spinal dorsal horn in rats with neuropathic pain. Beijing Da Xue Xue Bao Yi Xue Ban. 35 (5), 453-457 (2003).
- Schone, A. M. Veterinary Acupuncture: Ancient Art to Modern Medicine. , American Veterinary Publication. (1999).
- Stux, G., Pomeranz, B. Acupuncture: Textbook and Atlas. , Springer-Verlag. Berlin. (1987).
- de Medinaceli, L., Freed, W. J., Wyatt, R. J. An index of the functional condition of rat sciatic nerve based on measurements made from walking tracks. Experimental Neurology. 77 (3), 634-643 (1982).
- Bain, J. R., Mackinnon, S. E., Hunter, D. A. Functional evaluation of complete sciatic, peroneal, and posterior tibial nerve lesions in the rat. Plastic and Reconstructive Surgery. 83 (1), 129-138 (1989).
- Kanaya, F., Firrell, J. C., Breidenbach, W. C. Sciatic function index, nerve conduction tests, muscle contraction, and axon morphometry as indicators of regeneration. Plastic and Reconstructive Surgery. 98 (7), 1264-1271 (1996).
- Wild, B. M., et al. In vivo electrophysiological measurement of the rat ulnar nerve with axonal excitability testing. Journal of Visualized Experiments: JoVE. (132), e56102(2018).
- Wong, J. Y., Rapson, L. M. Acupuncture in the management of pain of musculoskeletal and neurologic origin. Physical Medicine and Rehabilitation Clinics of North America. 10 (3), 531-545 (1999).
- Qin, Z., Liu, X., Yao, Q., Zhai, Y., Liu, Z. Acupuncture for treating sciatica: A systematic review protocol. BMJ Open. 5 (4), 007498(2015).
- Zhi, M. J., et al. Application of the chronic constriction injury of the partial sciatic nerve model to assess acupuncture analgesia. Journal of Pain Research. 10, 2271-2280 (2017).
- Fu, Z. H., Xu, J. G. A brief introduction to Fu's subcutaneous needling. Pain Clinic. 17, 343-348 (2005).
- Peng, J., et al. The effect of Fu's subcutaneous needling combined with reperfusion approach on surface electromyography signals in patients with cervical spondylosis and neck pain: A clinical trial protocol. Biomed Research International. 2022, 1761434(2022).
- Fu, Z. H., Wang, J. H., Sun, J. H., Chen, X. Y., Xu, J. G. Fu's subcutaneous needling: possible clinical evidence of the subcutaneous connective tissue in acupuncture. Journal Alternative and Complementary Medicine. 13 (1), 47-51 (2007).
- Harrison, T. M., Churgin, S. M. Acupuncture and traditional Chinese veterinary medicine in zoological and exotic animal medicine: A review and introduction of methods. Veterinary Science. 9 (2), 74(2022).
- Gollub, R. L., Hui, K. K., Stefano, G. B. Acupuncture: pain management coupled to immune stimulation. Zhongguo Yao Li Xue Bao. 20 (9), 769-777 (1999).
- Simons, D. G., Travell, J., Simons, L. E. Myofascial Pain and Dysfunction: The Trigger Point Manual. 2nd ed. , Williams and Wilkins. Baltimore, MD. (1999).
- Gerwin, R. D., Dommerholt, J., Shah, J. P. An expansion of Simons' integrated hypothesis of trigger point formation. Current Pain and Headache Reports. 8 (6), 468-475 (2004).
- Hong, C. Z., Simons, D. G. Pathophysiologic and electrophysiologic mechanisms of myofascial trigger points. Archives of Physical Medicine and Rehabilitation. 79 (7), 863-872 (1998).
- Fu, Z., et al. Remote subcutaneous needling to suppress the irritability of myofascial trigger spots: an experimental study in rabbits. Evidence Based Complement and Alternative Medicine. 2012, 353916(2012).
- Hsieh, Y. L., Yang, C. C., Liu, S. Y., Chou, L. W., Hong, C. Z. Remote dose-dependent effects of dry needling at distant myofascial trigger spots of rabbit skeletal muscles on reduction of substance P levels of proximal muscle and spinal cords. Biomed Research International. 2014, 982121(2014).
- Ma, K., et al. Peripheral nerve adjustment for postherpetic neuralgia: a randomized, controlled clinical study. Pain Medicine. 14 (12), 1944-1953 (2013).
- Gao, Y., Sun, J., Fu, Z., Chiu, P. E., Chou, L. W. Treatment of postsurgical trigeminal neuralgia with Fu's subcutaneous needling therapy resulted in prompt complete relief: Two case reports. Medicine. 102 (9), e33126(2023).
- Lucas, L. R., Wang, C. J., McCall, T. J., McEwen, B. S. Effects of immobilization stress on neurochemical markers in the motivational system of the male rat. Brain Research. 1155, 108-115 (2007).
- Yang, C. H., et al. Effect of electroacupuncture on response to immobilization stress. Pharmacology, Biochemistry, and Behavior. 72 (4), 847-855 (2002).
- Adams, S., Pacharinsak, C. Mouse anesthesia and analgesia. Current Protocols in Mouse Biology. 5 (1), 51-63 (2015).
- Cantwell, S. L. Traditional Chinese veterinary medicine: the mechanism and management of acupuncture for chronic pain. Topics in Companion Animal Medicine. 25 (1), 53-58 (2010).
- Liebano, R. E., Rakel, B., Vance, C. G. T., Walsh, D. M., Sluka, K. A. An investigation of the development of analgesic tolerance to TENS in humans. Pain. 152 (2), 335-342 (2011).
- Khalil, Z., Merhi, M. Effects of aging on neurogenic vasodilator responses evoked by transcutaneous electrical nerve stimulation: relevance to wound healing. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 55 (6), B257-B263 (2000).
- Sato, K. L., Sanada, L. S., Silva, M. D. D., Okubo, R., Sluka, K. A. Transcutaneous electrical nerve stimulation, acupuncture, and spinal cord stimulation on neuropathic, inflammatory and, non-inflammatory pain in rat models. The Korean Journal of Pain. 33 (2), 121-130 (2020).
- Maeda, Y., Lisi, T. L., Vance, C. G., Sluka, K. A. Release of GABA and activation of GABA(A) in the spinal cord mediates the effects of TENS in rats. Brain Research. 1136 (1), 43-50 (2007).
- Degrugillier, L., et al. A new model of chronic peripheral nerve compression for basic research and pharmaceutical drug testing. Regenerative Medicine. 16 (10), 931-947 (2021).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon