A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
יעילות המחט התת עורית של פו על כאב עצבי סיאטי: שינויים התנהגותיים ואלקטרופיזיולוגיים במודל חולדה של פגיעת התכווצות כרונית
* These authors contributed equally
In This Article
Summary
אנו מציגים פרוטוקול לשימוש במחט התת עורית של פו במודל של פגיעה כרונית בהיצרות כדי לגרום לכאב עצבי סיאטי בחולדות.
Abstract
המחט התת עורית של פו (FSN), טכניקת דיקור שהומצאה מהרפואה הסינית המסורתית, משמשת ברחבי העולם לשיכוך כאבים. עם זאת, מנגנוני הפעולה עדיין אינם מובנים במלואם. במהלך הטיפול ב- FSN, מחט FSN מוחדרת ונשמרת ברקמות התת עוריות למשך זמן רב עם תנועה מתנודדת. עם זאת, אתגרים נובעים משמירה על יציבה תוך מניפולציה של FSN במודלים של בעלי חיים (למשל, חולדות) עבור חוקרים. טיפול לא נוח עלול להוביל לפחד והתנגדות למחטי FSN, להגדיל את הסיכון לפציעה ואף להשפיע על נתוני המחקר. הרדמה עשויה להשפיע גם על תוצאות המחקר. לפיכך, יש צורך באסטרטגיות בטיפול FSN על בעלי חיים למזער את הפגיעה במהלך ההתערבות. מחקר זה משתמש במודל של פגיעה כרונית בהיצרות בחולדות Sprague-Dawley כדי לגרום לכאב נוירופתי. מודל זה משכפל את הכאב הנגרם על ידי פגיעה עצבית שנצפתה בבני אדם באמצעות כיווץ כירורגי של עצב היקפי, המחקה את הדחיסה או המלכודת הנראית בתנאים כגון תסמונות דחיסת עצבים ונוירופתיות היקפיות. אנו מציגים מניפולציה מתאימה להחדרה קלה של מחט FSN לשכבה התת עורית של גוף החיה, כולל החדרת מחט וכיוון, שימור מחטים ותנועה מתנודדת. מזעור אי הנוחות של החולדה מונע מהחולדה להיות מתוחה, מה שגורם לשריר להתכווץ ולעכב את כניסת המחט ומשפר את יעילות המחקר.
Introduction
כאב נוירופתי, המוגדר ככאב הנגרם על ידי נזק עצבי, מוערך כמשפיע על 6.9%-10% מאוכלוסיית העולם, והשכיחות המדווחת לכל החיים היא 49%-70%1,2. היא נחשבת גם לאחת מתסמונות הכאב הקשות ביותר לניהול. השימוש בסוכנים פרמקולוגיים לניהול כאב נוירופתי הניב הצלחה מוגבלת מכיוון שתרופות כאב נפוצות כמו תרופות נוגדות דלקת לא סטרואידיות ואופיואידים הראו יעילות מועטה בהקלה על סוג זה של כאב 3,4. לכן יש צורך גדול לבחון אפשרויות טיפול חדשות, במיוחד טיפולים לא תרופתיים. דיקור סיני, כהתערבות לא תרופתית, עשוי להקל על כאב נוירופתי על ידי הפעלת השפעות משככות כאבים על המערכת הסומטוסנסורית. מחקרים קליניים ופרה-קליניים כאחד הצביעו על כך שדיקור סיני יעיל בהקלה על תסמיני כאב נוירופתי ללא תופעות לוואי משמעותיות 5,6,7. עם זאת, המנגנון המרכזי של טיפול בדיקור סיני להקלה על כאבים בכאב נוירופתי עדיין לא נחקר.
בשנים האחרונות, המחט התת עורית של פו (FSN) צברה פופולריות לטיפול בהפרעות נוירולוגיות הקשורות לכאב8. FSN מקורו בדיקור סיני מסורתי ותואר לראשונה על ידי הרופא הסיני המסורתי Zhonghua Fu בשנת 1996 9,10. בעוד שמקורו בדיקור המסורתי, FSN שונה באופן משמעותי בטכניקות ובתיאוריות שלו מדיקור מבוסס מרידיאן, עקרונות יין ויאנג, ומושגים של נקודות דיקור. FSN שם דגש רב יותר על גישות נוירופיזיולוגיות ואנטומיות לטיפול יעיל בכאב מיופציאלי11. טיפול FSN מיושם בפרקטיקה קלינית לטיפול בהפרעות שרירים כואבות שונות, תוך התמקדות ברקמות החיבור הקשורות קשר הדוק לשרירים, במיוחד התמקדות בטיפול בשרירים מכווצים (TMs)12. כטיפול משלים לשיכוך כאבים, קיימות גם עדויות קליניות לכך ש- FSN יעיל בטיפול בפציעות ברקמות רכות בנוסף למתן טיפול מהיר בכאב ושיפור משמעותי בעוויתות רקמות רכות13,14. טיפול FSN כולל טכניקות ספציפיות המותאמות לטיפול בנקודות הטריגר המיופציאליות הבסיסיות (MTrPs) הקשורות למצב. מיקום החדרת מחט FSN נבחר בקפידה בהתבסס על המיקום של נקודות טריגר אלה, ומאפשר מיקוד מדויק של האזורים הפגועים. במהלך ההליך, מחט FSN מוכנס לתוך השכבה תת עורית, שם הוא נעצר בכוונה כדי לייעל את ההשפעות הטיפוליות. לאחר מכן נעשה שימוש בטכניקה ייחודית הידועה בשם תנועת התנודה, הכוללת תנועה מתנודדת עדינה של המחט כדי לעורר את הרקמות ולקדם את התגובות הטיפוליות10. התפתחות MTrPs קשורה לתיאוריית משבר האנרגיה, המסבירה כי גורמים כגון עומס שרירים כרוני, פעילות גופנית מוגזמת, תנוחות מאמץ לא נכונות, ניוון שרירים וניוון יכולים לתרום להופעת איסכמיה של רקמת שריר והיפוקסיה. מאמינים כי מחסור זה בחמצן ובאנרגיה ברקמת השריר ממלא תפקיד מפתח בהיווצרות MTrPs15,16. מחקרים קודמים בבעלי חיים מצאו כי טיפול FSN בכאב כרוני בחולדות משפר במידה מסוימת את המבנה המורפולוגי והתפקוד של מיטוכונדריה במדיטציה טרנסנדנטלית, ומאמת במידה מסוימת את הפוטנציאל של טיפול ב-FSN לקדם החלמה של עצבים ושרירים פגועים17.
סיאטיקה סווגה ככאב נוירופתי18. מקורו של הכאב הנוירופתי נמצא ככל הנראה בכל מקום בין לוחית הקצה המוטורית לבין השכבה הסיבית החיצונית של השריר, המערבת את מערכת כלי הדם והמוליכים העצביים ברמה התאית. אובדן עצבוב שרירים ואפופטוזיס של תאי עצב עצביים מתרחש כאשר נזק עצבי מתרחש19, מה שמוביל להליכה הקשורה לכאב באיבר הפגוע. בנוסף, דחיסה כרונית או גירוי של העצב יכול להוביל למגוון שינויים בדרך של תפקודים עצביים, אשר יכול להחמיר עוד יותר את הסימפטומים של sciatica20. עם זאת, מורכבותה של מערכת העצבים מקשה על שכפול שלה במבחנה, ולכן מחייבת שימוש במודלים של בעלי חיים למחקרים כאלה. בחקר הפרעות כאב נוירופתיות, אורגניזמים מודל משמשים בדרך כלל, הכוללים שיטות שונות של פגיעה עצבית היקפית ישירה, כגון ליגטורה עצבית סיאטית, טרנסקציה, או דחיסה21,22. מודל פציעת ההתכווצות הכרונית (CCI) בחולדות Sprague-Dawley שימש לגרימת כאב נוירופתי. מודל זה משכפל את הכאב הנגרם על ידי פגיעה עצבית שנצפתה בבני אדם באמצעות כיווץ כירורגי של עצב היקפי, המחקה את הדחיסה או המלכודת הנראית בתנאים כגון תסמונות דחיסת עצבים ונוירופתיות היקפיות.
במחקר זה, הערכנו את ההשפעות משככות הכאבים של טיפול FSN ואלקטרותרפיה בתדר נמוך (מגרה עצבית חשמלית טרנסעורית, TENS) בחולדות עם פגיעת התכווצות כרונית וכאב נוירופתי. מכיוון שההרדמה מאטה או חוסמת דחפים עצביים ומשפיעה על ההולכה הסינפטית ועל התפקוד העצבי23 , לא ניתן להרדים בעלי חיים בכל הליכי המחטים והתנועות המתנדנדות. לכן, נדרשת טכניקת מחט מתאימה כדי להפחית את אי הנוחות בחולדות. השלבים לביסוס מודל CCI של חולדות, האופן שבו טופלו החולדות באמצעות FSN בשילוב תנועה מתנודדת ללא הרדמה, בדיקות אפשריות של דפוסי התנהגות של בעלי חיים וחקירות אלקטרופיזיולוגיות מתוארים בפירוט.
Protocol
כל הנהלים המערבים נבדקים בבעלי חיים אושרו על-ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) של בית החולים Chang Bing Show Chwan Memorial Hospital, Changhua, Taiwan (111031) באוקטובר 2022 (איור 1).
1. הכנת בעלי חיים
- רכשו 48 חולדות זכרSprague-Dawley (SD) (גיל: 8-10 שבועות, משקל: 250-300 גרם).
- חולדות בית בנפרד בכלובים מאווררים ב 24 ± 2 מעלות צלזיוס ומחזור חושך ואור של 12 שעות.
- האכילו את החולדות בתזונת כדוריות סטנדרטית במי שתייה סטריליים מוכנים לשימוש, וספקו מצעים רכים.
2. קיבוץ בעלי חיים
- חלקו באופן אקראי 48 חולדות SD לשש קבוצות (n = 8 לכל קבוצה): קבוצת דמה, קבוצת CCI, קבוצת CCI+FSN, קבוצת CCI+TENS, קבוצת FSN בלבד וקבוצת TENS בלבד כמו במחקר הקודם שנערך על ידי Chan et al.24.
הערה: פירוט שש קבוצות: (1) קבוצת דאם: ללא ניתוח וללא טיפול; (2) קבוצת CCI: מוכנה לניתוח ללא טיפול; (3) קבוצת טיפול CCI+FSN: טיפול FSN לאחר מידול CCI מוצלח; (4) קבוצת טיפול CCI+TENS: טיפול ב-TENS לאחר מידול מוצלח של CCI; (5) קבוצת טיפול FSN בלבד: רק טיפול FSN ללא ניתוח; (6) קבוצת טיפול TENS בלבד: רק טיפול TENS ללא ניתוח.
3. הקמת מודל חולדות CCI
הערה: מודל ניתוח CCI בחולדות שונה על פי בנט ושי שנערכו בשנת 198825.
- ודא שהמפעיל לובש מסכה כירורגית, כובע הפעלה חד פעמי וכפפות סטריליות.
- לחטא את פני השטח של שולחן הניתוחים עם 70% אתנול. עיקור מכשירים (למשל, מספריים, מלקחיים ומחזירים), גזה, סיכות וצמר גפן על ידי אוטוקלאבינג.
הערה: טכניקות אספטיות משמשות לאורך כל ההליך הכירורגי. - הרדימו את החולדות עם 4% איזופלורן לאחר הכנה סטנדרטית של העור (גילוח) ותחזקו עם 2% איזופלורן (איור 2A).
- אשר את עומק ההרדמה המתאים על ידי התבוננות בחוסר התגובה לאחר צביטת הכף האחורית ומעקב אחר החולדות המורדות לאורך כל ההליך.
- יש למרוח מספיק משחת עיניים וטרינרית על העיניים להגנה מפני ייבוש.
- הניחו את החולדה במצב נוטה על שולחן הניתוחים וגלחו את השיער בצד הרגל האחורית הימנית, ולאחר מכן חיטאו את העור בתמיסת פובידון-יוד ואתנול 75% שלוש פעמים. לספק תמיכה תרמית לאורך כל ההליך ולהשתמש וילונות סטריליים כדי לכסות את אתר הניתוח.
- בצע חתך מקביל בעור 3-4 מ"מ מתחת לעצם הירך של כ 20-50 מ"מ.
- לתעדף את זיהוי העמדות של gluteus maximus ו biceps femoris. הפרידו את השומן התת עורי ואת הפאשיה השטחית שכבה אחר שכבה באמצעות מספריים כירורגיים, וחתכו דרך רקמת החיבור שמסביב כדי לחשוף את השריר (איור 2B).
הערה: כדי להבחין בין שכבות השומן התת עורי והפאשיה השטחית, שימו לב למרקם ולצבע. שכבת השומן התת עורית צריכה להיראות רכה וגמישה עם מראה צהבהב או לבנבן. הפאשיה השטחית היא שכבה סיבית דקה הממוקמת ישירות מתחת לשומן התת עורי. הבדילו בין השכבות על ידי מישוש עדין או חיטוט במכשיר קהה, ושימו לב שהשומן התת עורי מציע עמידות רבה יותר ללחץ בהשוואה לפשיה השטחית.
- בעזרת מספריים קהות, חותכים את רקמת החיבור בין שרירי הגלוטאוס השטחיים לשרירי הירך הדו-ראשיים.
- הרחיבו את המרווח בין שני השרירים האלה באמצעות רגרקטור כדי לחשוף את העצב הסיאטי (איור 2C).
הערה: כדי לזהות חזותית את העצב הסיאטי בחולדה, התמקדו באזור הירך. אתר את נקודת האמצע של אזור הירך כדי לדמיין את העצב הסיאטי. בדרך כלל, העצב פועל לאורך האספקט האחורי של הירך, החל מאזור הירך ונמשך לכיוון הברך. - מבלי לשנות את המורפולוגיה של העצב, בחר את העצב הסיאטי עם מיקרו-מחט דרך מקור אור טוב. קשרו את העצב הסיאטי פעמיים באמצעות 3-0 ליגטורות מעיים כרומיות, תוך מיקום נקודות הליגטורה במרחק של כ-1 מ"מ זו מזו בין שני התפרים.
- מתחילים בלולאה רופפת לכל ליגטורה, תופסים את קצות הרצועה קרוב ללולאה ומהדקים עד שהלולאה צמודה, כדי להבטיח שהליגטורה לא תחליק לאורך העצב. עצור כאשר נצפתה עוויתות קלות של הגפה במהלך הקשירה (איור 2D).
- הרחיבו את המרווח בין שני השרירים האלה באמצעות רגרקטור כדי לחשוף את העצב הסיאטי (איור 2C).
- סוגרים את השרירים והעור שכבה אחר שכבה עם 4-0 קווי תפרים. לבסוף, חטאו את הפצע ביוד (איור 2E).
- עקבו מקרוב אחר הסימנים החיוניים של החולדות במהלך ההרדמה והכניסו אותן לכלובי התאוששות אישיים עד שהן ערות לפני שתחזירו אותן לכלובים. רפדו את הכלובים במצעי נייר שטוחים כדי למנוע חנק אצל בעלי חיים מחוסרי הכרה. עווית קצרה באיבר שלאחר הניתוח מצביעה על ניתוח מוצלח (איור 2F).
- בצע בדיקת רגישות יתר לכאב מספר פעמים לפני CCI (נקודת ההתחלה) ובנקודות זמן שונות לאחר CCI.
- שימו לב לכאב ספונטני ולשינויים התנהגותיים בימים 1, 3, 5 ו-7 לאחר בניית המודל.
הערה: שימו לב להליכה וליציבה של הגפה האחורית הימנית ולנוכחות של ליקוק ונשיכה על האיבר.- זהה את נוכחותו של כאב נוירופתי כדי לקבוע את הקמתו המוצלחת של המודל ולא לכלול חולדות לא מוצלחות.
הערה: להעריך את הצלחת המודל על ידי התבוננות בסימנים כגון חולשה בהליכה בגפיים התחתונות, אצבעות של הגפה הימנית המוחזקות יחד עם ולגוס קל, משתלשלים תכופים וחוסר רצון לנחות. שימו לב לחולדה עומדת כשהגפה האחורית השמאלית תומכת במשקולת, בעוד הגפה האחורית הימנית מורמת וקרובה לבטן.
- זהה את נוכחותו של כאב נוירופתי כדי לקבוע את הקמתו המוצלחת של המודל ולא לכלול חולדות לא מוצלחות.
4. ניהול מניפולציה FSN
- תקן את החולדה של קבוצת הטיפול ב- FSN (כולל CCI+FSN וקבוצת FSN בלבד) בריסון המכרסם כאשר הגפה הפגועה חשופה לרוחב. לספק תמיכה תרמית לאורך כל ההליך. שתי הקבוצות טופלו במחטים חד-פעמיות מסוג FSN (איור 3A).
- ללא הרדמה, האריכו את הגפיים האחוריות של החולדה בהדרגה ובאיטיות עד שהן נמתחו חזק (איור 3B).
הערה: ראש החולדה מכוסה בוילון כירורגי כדי לשמור על החיה רגועה ויציבה. אין להאריך את הרגל יתר על המידה כדי לגרום לפציעה של החולדה. שימו לב מקרוב לתגובת החולדה לאיתור סימני מצוקה או אי נוחות. אם החולדה מראה סימני כאב או אי נוחות, עצרו את ההרחבה וספקו הפסקה לפני שתנסו שוב. - הסר את נדן ההגנה של מחט FSN.
- הכנס את קצה מחט FSN לכיוון TMs (שרירים עם MTrPs), קרוב בערך לשריר gluteus maximus, הממוקם על הגב התחתון והאחורי.
- הניחו את מחט FSN שטוחה והיכנסו לעור בזווית של כ-15°.
- דחפו אותו בזהירות ובמהירות דרך העור לתוך החלל התת עורי כדי למנוע לחץ אצל החולדה עד להחדרה מלאה. ודא כי המחט מוחדרת מספיק כדי לקבור לחלוטין את הצינור הרך מתחת לעור.
- כשאתם דוחפים קדימה, הרימו מעט את קצה המחט כדי לראות אם בליטת העור נעה לאורך קצה המחט (איור 3C).
- בצע את התנועה המתנדנדת על ידי מאוורר חלק ורך של קצה מחט FSN עם האגודל כנקודת המשען תוך שמירה על האצבע המורה, האצבע האמצעית והקמיצה מיושרות בקו ישר.
- החזק את מחט FSN בין האצבע האמצעית לאגודל במצב פנים אל פנים, והחליף את התנועה קדימה ואחורה באמצעות האצבע המורה והטבעת.
- הגדר את התדירות ל- 100 פעימות לדקה ובצע את הפעולה במשך כדקה אחת (איור 3D).
- לאחר השלמת המניפולציה, במהירות למשוך את מחט FSN.
הערה: הפעולה בוצעה כל יומיים במשך ארבעה מפגשים בסך הכל (ימים 1, 3, 5 ו-7 לאחר יצירת מודל CCI). יש להשתמש במחטי FSN חד פעמיות פעם אחת. שימוש חוזר יקהה את המחט ויגרום לכאב מוגבר בחולדות.
5. ניהול מניפולציה של TENS
- תקן את החולדה של קבוצת הטיפול ב- TENS (כולל קבוצת CCI+TENS ו- TENS בלבד) בריסון המכרסם כאשר הגפה הפגועה חשופה לרוחב. לספק תמיכה תרמית לאורך כל ההליך. יש להקפיד על גילוח הפרווה לפני הטיפול.
הערה: אלקטרודות נחתכו ל-45 מ"מ (אורך) על 5 מ"מ (רוחב) (איור 4A). - בחר נקודת Zusanli (ST36) ונקודת Sanyinjiao (SP6) כמיקומים עבור TENS. זה מבוסס על התיאוריה לטיפול בכאב נוירופתי26,27.
- אתר את נקודת זוסנלי (ST36) כ-5 מ"מ לרוחב השחפית הקדמית של השוקה בין השוקה לפיבולה ממש מתחת לברך28.
- אתר את נקודת Sanyinjiao (SP6) בגבול האחורי של השוקה, 3 מ"מ פרוקסימלי למליאולוס המדיאלי28.
הערה: שתי נקודות הדיקור הללו ממוקמות באמצעות בדיקה ידנית כפי שמתואר על-ידי Stux ו-Pomeranz ובאטלס הדיקור של בעלי חיים28,29 (איור 4B).
- ספק גירוי חשמלי בתדר נמוך (גל סינוס רציף 2 הרץ, 3 mA) למשך 10 דקות באמצעות מכשיר TENS עם האלקטרודה המופעלת על הרגל סביב העצב. כסו את ראש החולדה בוילון כירורגי כדי לשמור עליו רגוע ויציב.
הערה: הליך זה מבוצע כל יומיים במשך ארבעה מפגשים בסך הכל (ימים 1, 3, 5 ו- 7 לאחר יצירת מודל CCI).
6. מדדים פיזיולוגיים ביצוע בדיקת התנהגות בעלי חיים
הערה: מדד תפקוד סיאטי (SFI)30 הוא מדד נפוץ על ידי חוקרים החוקרים פתולוגיה וטיפול פוטנציאלי בפגיעות עצביות, הנקבע על ידי השוואת הגיאומטריה של הכף האחורית הפגועה בחולדות פצועות לזו של הכף הנגדית והשוואתה לכפה הנגדית.
- עצבו שבילי חולדות עם פרספקס שקוף ומראות הטיה כדי ללכוד את טביעות הרגליים ואת כיוון הגוף של חולדות במהלך ההליכה.
הערה: השביל הוא משטח באורך 10 ס"מ, רוחב 50 ס"מ וגובה 15 ס"מ עם בטנת נייר לבן בתחתית (איור 5A). - הניחו את החולדות בעדינות ובחופשיות בקופסה ואפשרו להן להתאקלם בסביבתן החדשה לפחות 5 דקות לפני ההקלטה.
הערה: תשומת לב מיוחדת ננקטת כדי למזער לחץ מיותר על בעל החיים כדי למנוע את השפעתו האפשרית על מתח שרירי היציבה. - טבלו את כפות רגליה של החולדה בדיו אדום ואפשרו לחולדה ללכת לאורך רצועת השביל, תוך השארת עקבות על נייר הגב. רשום לפחות 2 שניות של הליכה רצופה בכל מבחן. גרמו לחולדה ללכת לפחות 3 פעמים בכיוון אחד (איור 5B).
הערה: יש למרוח דיו אדום מסיס במים המתייבש במהירות, אינו רעיל ומסיס במים על שתי כפות רגליו האחוריות כדי להפוך את טביעות הרגליים האחוריות לגלויות בבירור. - בסוף הניסוי, יבשו את רצועות השביל כדי למדוד את הפרמטרים. מדדו את טביעות הרגל שלהם בעזרת סרגל ועיגלו ל-0.5 מ"מ הקרובים.
הערה: נבחרו שלוש טביעות רגל ברורות מכל חולדה מתוך מספר טביעות רגל, ונמדדו שלושה פרמטרים שונים. גורמים עבור SFI כוללים אורך הדפסה (PL), פריסת בוהן (TS) ופריסת בוהן בינונית (ITS).
ערכי SFI מחושבים באמצעות הנוסחה הבאה31: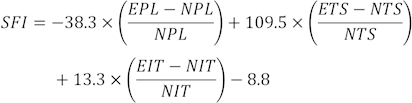
(EPL, אורך הדפסה ניסיוני; NPL, אורך הדפסה רגיל; עשן טבק סביבתי, התפשטות בוהן ניסיונית; NTS, התפשטות בוהן רגילה; EIT, התפשטות בוהן ביניים ניסיונית; NIT, התפשטות בוהן בינונית.)
SFI = 0 ו- 100 מציין תפקוד לקוי תקין ומלא. לחולדות שגררו את אצבעות רגליהן הוקצה באופן שרירותי ערך של 100-. עבור תפקוד נוירולוגי תקין, SFI מתנדנד סביב 0, בעוד סביב -100 SFI מייצג תפקוד לקוי מלא32.
7. הערכה נוירופיזיולוגית על ידי מדידה אלקטרופיזיולוגית33
הערה: אלקטרומיוגרפיה שימשה לרישום הפעילות האלקטרופיזיולוגית במחקר זה. פוטנציאל הפעולה של השריר המורכב (CMAP) נגרם על ידי הפעלת סיבי שריר בשריר המטרה המסופקים על ידי העצב. משרעת CMAP והשהיה נחקרות. משרעת CMAP נמדדת מקו הבסיס ועד לשיא שלילי. ההשהיה של CMAPs נקבעת על ידי מדידת הזמן בין הפעלת הגירוי לבין תחילת פוטנציאל הפעולה המורכב, המושפע מהמרחק בין אתר הגירוי לאתר ההקלטה. אלקטרופיזיולוגיה מספקת הערכה אובייקטיבית של תפקוד עצבי היקפי בחולדות.
- יש לתת זולטיל 50 (40 מ"ג/ק"ג, ip) כדי להרדים את החולדות. הכינו את העור על פי פרוטוקולים סטנדרטיים (גילוח).
- הניחו אלקטרודות משטח דביקות חד פעמיות (בקוטר חיצוני של 20 מ"מ) על האזורים המיועדים לכך. קבעו את אלקטרודות הרישום למשטחים הצדיים והגביים של שריר הגסטרוקנמיוס (איור 6A).
- יש להפעיל גירוי חשמלי (עוצמה 1.2 mA) על גזע העצב הסיאטי הפרוקסימלי הימני. רשמו פוטנציאל פעולת שריר מורכב (CMAP) על בטנו של שריר הגסטרוקנמיוס (איור 6B).
הערה: היזהר בעת החדרת האלקטרודות כדי למנוע את רקמת השריר. - רשמו את ההשפעה של שלוש מדידות חוזרות על כל חולדה.
הערה: CMAP מבוטא כממוצע ± SD של כל קבוצה. האות הוגבר על ידי מגבר, מסונן (0.3-3 קילוהרץ). לאחר אינטגרציה (קבוע זמן = 0.05 שניות), הן האות המקורי והן האות המשולב מוזנים. לאחר מכן, האות המקורי והאות המשולב עוברים דיגיטציה במערכת PowerLab ומאוחסנים בדיסק הקשיח של המחשב. - לאחר השלמת ההליכים האלקטרופיזיולוגיים, העבירו את החולדה לכלוב אחר ועקבו אחריה עד שהיא חוזרת להכרה מספקת כדי לשמור על תנוחת שכיבה עצם החזה. לאחר שהחולדה התאוששה לחלוטין מחומר ההרדמה, העבירו אותה בחזרה לכלוב המקורי שלה.
8. סטטיסטיקה:
- הערך הבדלים ב- SFI וב- CMAP בין קבוצות באמצעות ניתוח מדדים חוזרים ונשנים של שונות (ANOVA).
- לכמת את הנתונים על ידי עוזרים עיוורים לתנאי הניסוי. בטא את הנתונים כממוצע ± סטיית תקן.
- השווה את הנתונים, בעת הצורך, באמצעות מבחן t זוגי ולא מזווג של סטודנט. קבע מובהקות סטטיסטית כ- p < 0.05.
תוצאות
עקבות ונחישות SFI
בחנו את התפתחות SFI בקבוצות CCI בלבד, CCI+FSN ו-CCI+TENS (איור 7). לאחר 4 מפגשים של טיפולי FSN ו- TENS ביום השביעי לניתוח CCI, ה- SFI בקבוצות CCI+FSN (-15.85 ± 3.46) ו- CCI+TENS (-29.58 ± 9.19) השתפר משמעותית בהשוואה לקבוצת CCI בלבד (-87.40 ± 14.22). השיפור היה מובהק בקבוצת CCI+FSN בהשוואה לקבוצת CCI+TENS ...
Discussion
מחקר זה בוחן את ההשפעה של טיפול FSN על כאב נוירופתי במודלים של CCI חולדות. מחקר זה מציג פרוטוקול לבדיקות SFI ואלקטרופיזיולוגיות להערכת ההשפעות הטיפוליות לאחר טיפול ב- FSN או TENS. בנוסף, הוא מדגים כיצד להעריך את ההתאוששות התפקודית של העצב הפגוע באמצעות בדיקות התנהגותיות לא פולשניות ומדידות פיזיול...
Disclosures
המחברים מצהירים כי לא קיימים ניגודי עניינים מתחרים.
Acknowledgements
מחקר זה נתמך על ידי מענק ממרכז בעלי החיים של בית החולים Chang Bing Show Chwan Memorial Hospital, Changhua, טייוואן. המחברים רוצים להודות לבית החולים Show Chwan Memorial Hospital IRCAD TAIWAN על תמיכתם ועזרתם שלא יסולא בפז לאורך פרויקט מחקר זה.
Materials
| Name | Company | Catalog Number | Comments |
| Forceps | World Precision Instruments | 14098 | |
| Fu’s subcutaneous needling | Nanjing Paifu Medical Science and Technology Co. | FSN needles are designed for single use. The FSN needle is made up of three parts: a solid steel needle core (bottom), a soft casing pipe (middle), and a protecting sheath (top). | |
| Medelec Synergy electromyography | Oxford Instrument Medical Ltd. | 034W003 | Electromyogram (EMG) are used to help in the diagnosis and management of disorders such as neuropathies. Contains a portable two-channel electromyography/nerve conduction velocity system. |
| Normal saline (0.9%) 20 mL | Taiwan Biotech Co.,Ltd. | 4711916010323 | Lot: 1TKB2022 |
| POLYSORB 4-0 VIOLET 30" CV-25 | UNITED STATES SURGICAL, A DIVISION OF TYCO HEALTHC | GL-181 | |
| Retractor | COOPERSURGICAL, INC.(USA) | 3311-8G | |
| Rompun | Elanco Animal Health Korea Co. Ltd. | 27668 | |
| SCISSORS CVD 90MM | BBRUAN | XG-LBB-BC101R | |
| Transcutaneous Electrical Nerve Stimulation | Well-Life Healthcare Co. | Model Number 2205A | Digital unit which offers TENS. Supplied complete with patient leads, self-adhesive electrodes, 3 AAA batteries and instructions in a soft carry bag. Interval ON time 1–30 s. Interval OFF time 1–30 s. |
| Zoletil | VIRRBAC | 8V8HA |
References
- van Hecke, O., Austin, S. K., Khan, R. A., Smith, B. H., Torrance, N. Neuropathic pain in the general population: a systematic review of epidemiological studies. Pain. 155 (4), 654-662 (2014).
- Younes, M., et al. Prevalence and risk factors of disk-related sciatica in an urban population in Tunisia. Joint Bone Spine. 73 (5), 538-542 (2006).
- Woolf, C. J., Mannion, R. J. Neuropathic pain: aetiology, symptoms, mechanisms, and management. Lancet. 353 (9168), 1959-1964 (1999).
- Baron, R., et al. Neuropathic low back pain in clinical practice. European Journal of Pain. 20 (6), 861-873 (2016).
- Ma, X., et al. Potential mechanisms of acupuncture for neuropathic pain based on somatosensory system. Frontiers in Neuroscience. 16, 940343 (2022).
- Jang, J. H., et al. Acupuncture alleviates chronic pain and comorbid conditions in a mouse model of neuropathic pain: the involvement of DNA methylation in the prefrontal cortex. Pain. 162 (2), 514-530 (2021).
- He, K., et al. Effects of acupuncture on neuropathic pain induced by spinal cord injury: A systematic review and meta-analysis. Evidence Based Complement and Alternative Medicine. 2022, 6297484 (2022).
- Fu, Z., Lu, D. Fu's Subcutaneous Needling: A Novel Therapeutic Proposal. Acupuncture - Resolving Old Controversies and Pointing New Pathways. IntechOpen. , (2019).
- Fu, Z. H. . The Foundation of Fu's Subcutaneous Needling. , (2016).
- Fu, Z. H., Chou, L. W. . Fu's Subcutaneous Needling, Trigger Point Dry Needling: An Evidence and Clinical-Based Approach. 2nd Edition. , 255-274 (2018).
- Fu, Z., Shepher, R. Fu's Subcutaneous Needling, a Modern Style of Ancient Acupuncture? Acupuncture in Modern Medicine. IntechOpen. , (2013).
- Chiu, P. E., et al. Efficacy of Fu's subcutaneous needling in treating soft tissue pain of knee osteoarthritis: A randomized clinical trial. Journal of Clinical Medicine. 11 (23), 7184 (2022).
- Huang, C. H., Lin, C. Y., Sun, M. F., Fu, Z., Chou, L. W. Efficacy of Fu's Subcutaneous Needling on Myofascial Trigger Points for Lateral Epicondylalgia: A randomized control trial. Evidence Based Complement and Alternative Medicine. 2022, 5951327 (2022).
- Huang, C. H. Rapid improvement in neck disability, mobility, and sleep quality with chronic neck pain treated by Fu's subcutaneous needling: A randomized control study. Pain Research and Management. 2022, 7592873 (2022).
- Chou, L. W., Hsieh, Y. L., Kuan, T. S., Hong, C. Z. Needling therapy for myofascial pain: recommended technique with multiple rapid needle insertion. Biomedicine (Taipei). 4 (2), 13 (2014).
- Ye, L., et al. Depression of mitochondrial function in the rat skeletal muscle model of myofascial pain syndrome is through down-regulation of the AMPK-PGC-1α-SIRT3 axis. Journal of Pain Research. 13, 1747-1756 (2020).
- Li, Y., et al. Effects of Fu's subcutaneous needling on mitochondrial structure and function in rats with sciatica. Molecular Pain. 18, 17448069221108717 (2022).
- Perreault, T., Fernández-de-Las-Peñas, C., Cummings, M., Gendron, B. C. Needling interventions for sciatica: Choosing methods based on neuropathic pain mechanisms-A scoping review. Journal of Clinical Medicine. 10 (10), 2189 (2021).
- Weller, J. L., Comeau, D., Otis, J. A. D. Myofascial pain. Seminars in Neurology. 38 (6), 640-643 (2018).
- Grøvle, L., et al. The bothersomeness of sciatica: patients' self-report of paresthesia, weakness and leg pain. European Spine Journal. 19 (2), 263-269 (2010).
- Jaggi, A. S., Jain, V., Singh, N. Animal models of neuropathic pain. Fundament Clinical Pharmacology. 25 (1), 1-28 (2011).
- Burma, N. E., Leduc-Pessah, H., Fan, C. Y., Trang, T. Animal models of chronic pain: Advances and challenges for clinical translation. Journal of Neuroscience Research. 95 (6), 1242-1256 (2017).
- McCann, M. E., Soriano, S. G. Does general anesthesia affect neurodevelopment in infants and children. British Medical Journal. 367, 6459 (2019).
- Chan, K. Y., et al. Ameliorative potential of hot compress on sciatic nerve pain in chronic constriction injury-induced rat model. Frontiers in Synaptic Neuroscience. 14, 859278 (2022).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. 33 (1), 87-107 (1988).
- Somers, D. L., Clemente, F. R. Transcutaneous electrical nerve stimulation for the management of neuropathic pain: The effects of frequency and electrode position on prevention of allodynia in a rat model of complex regional pain syndrome type II. Physical Therapy. 86 (5), 698-709 (2006).
- Xing, G., Liu, F., Wan, Y., Yao, L., Han, J. Electroacupuncture of 2 Hz induces long-term depression of synaptic transmission in the spinal dorsal horn in rats with neuropathic pain. Beijing Da Xue Xue Bao Yi Xue Ban. 35 (5), 453-457 (2003).
- Schone, A. M. . Veterinary Acupuncture: Ancient Art to Modern Medicine. , (1999).
- Stux, G., Pomeranz, B. . Acupuncture: Textbook and Atlas. , (1987).
- de Medinaceli, L., Freed, W. J., Wyatt, R. J. An index of the functional condition of rat sciatic nerve based on measurements made from walking tracks. Experimental Neurology. 77 (3), 634-643 (1982).
- Bain, J. R., Mackinnon, S. E., Hunter, D. A. Functional evaluation of complete sciatic, peroneal, and posterior tibial nerve lesions in the rat. Plastic and Reconstructive Surgery. 83 (1), 129-138 (1989).
- Kanaya, F., Firrell, J. C., Breidenbach, W. C. Sciatic function index, nerve conduction tests, muscle contraction, and axon morphometry as indicators of regeneration. Plastic and Reconstructive Surgery. 98 (7), 1264-1271 (1996).
- Wild, B. M., et al. In vivo electrophysiological measurement of the rat ulnar nerve with axonal excitability testing. Journal of Visualized Experiments: JoVE. (132), e56102 (2018).
- Wong, J. Y., Rapson, L. M. Acupuncture in the management of pain of musculoskeletal and neurologic origin. Physical Medicine and Rehabilitation Clinics of North America. 10 (3), 531-545 (1999).
- Qin, Z., Liu, X., Yao, Q., Zhai, Y., Liu, Z. Acupuncture for treating sciatica: A systematic review protocol. BMJ Open. 5 (4), 007498 (2015).
- Zhi, M. J., et al. Application of the chronic constriction injury of the partial sciatic nerve model to assess acupuncture analgesia. Journal of Pain Research. 10, 2271-2280 (2017).
- Fu, Z. H., Xu, J. G. A brief introduction to Fu's subcutaneous needling. Pain Clinic. 17, 343-348 (2005).
- Peng, J., et al. The effect of Fu's subcutaneous needling combined with reperfusion approach on surface electromyography signals in patients with cervical spondylosis and neck pain: A clinical trial protocol. Biomed Research International. 2022, 1761434 (2022).
- Fu, Z. H., Wang, J. H., Sun, J. H., Chen, X. Y., Xu, J. G. Fu's subcutaneous needling: possible clinical evidence of the subcutaneous connective tissue in acupuncture. Journal Alternative and Complementary Medicine. 13 (1), 47-51 (2007).
- Harrison, T. M., Churgin, S. M. Acupuncture and traditional Chinese veterinary medicine in zoological and exotic animal medicine: A review and introduction of methods. Veterinary Science. 9 (2), 74 (2022).
- Gollub, R. L., Hui, K. K., Stefano, G. B. Acupuncture: pain management coupled to immune stimulation. Zhongguo Yao Li Xue Bao. 20 (9), 769-777 (1999).
- Simons, D. G., Travell, J., Simons, L. E. . Myofascial Pain and Dysfunction: The Trigger Point Manual. 2nd ed. , (1999).
- Gerwin, R. D., Dommerholt, J., Shah, J. P. An expansion of Simons' integrated hypothesis of trigger point formation. Current Pain and Headache Reports. 8 (6), 468-475 (2004).
- Hong, C. Z., Simons, D. G. Pathophysiologic and electrophysiologic mechanisms of myofascial trigger points. Archives of Physical Medicine and Rehabilitation. 79 (7), 863-872 (1998).
- Fu, Z., et al. Remote subcutaneous needling to suppress the irritability of myofascial trigger spots: an experimental study in rabbits. Evidence Based Complement and Alternative Medicine. 2012, 353916 (2012).
- Hsieh, Y. L., Yang, C. C., Liu, S. Y., Chou, L. W., Hong, C. Z. Remote dose-dependent effects of dry needling at distant myofascial trigger spots of rabbit skeletal muscles on reduction of substance P levels of proximal muscle and spinal cords. Biomed Research International. 2014, 982121 (2014).
- Ma, K., et al. Peripheral nerve adjustment for postherpetic neuralgia: a randomized, controlled clinical study. Pain Medicine. 14 (12), 1944-1953 (2013).
- Gao, Y., Sun, J., Fu, Z., Chiu, P. E., Chou, L. W. Treatment of postsurgical trigeminal neuralgia with Fu's subcutaneous needling therapy resulted in prompt complete relief: Two case reports. Medicine. 102 (9), e33126 (2023).
- Lucas, L. R., Wang, C. J., McCall, T. J., McEwen, B. S. Effects of immobilization stress on neurochemical markers in the motivational system of the male rat. Brain Research. 1155, 108-115 (2007).
- Yang, C. H., et al. Effect of electroacupuncture on response to immobilization stress. Pharmacology, Biochemistry, and Behavior. 72 (4), 847-855 (2002).
- Adams, S., Pacharinsak, C. Mouse anesthesia and analgesia. Current Protocols in Mouse Biology. 5 (1), 51-63 (2015).
- Cantwell, S. L. Traditional Chinese veterinary medicine: the mechanism and management of acupuncture for chronic pain. Topics in Companion Animal Medicine. 25 (1), 53-58 (2010).
- Liebano, R. E., Rakel, B., Vance, C. G. T., Walsh, D. M., Sluka, K. A. An investigation of the development of analgesic tolerance to TENS in humans. Pain. 152 (2), 335-342 (2011).
- Khalil, Z., Merhi, M. Effects of aging on neurogenic vasodilator responses evoked by transcutaneous electrical nerve stimulation: relevance to wound healing. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 55 (6), B257-B263 (2000).
- Sato, K. L., Sanada, L. S., Silva, M. D. D., Okubo, R., Sluka, K. A. Transcutaneous electrical nerve stimulation, acupuncture, and spinal cord stimulation on neuropathic, inflammatory and, non-inflammatory pain in rat models. The Korean Journal of Pain. 33 (2), 121-130 (2020).
- Maeda, Y., Lisi, T. L., Vance, C. G., Sluka, K. A. Release of GABA and activation of GABA(A) in the spinal cord mediates the effects of TENS in rats. Brain Research. 1136 (1), 43-50 (2007).
- Degrugillier, L., et al. A new model of chronic peripheral nerve compression for basic research and pharmaceutical drug testing. Regenerative Medicine. 16 (10), 931-947 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved