JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
좌골 신경통에 대한 Fu의 피하 침의 효능: 만성 수축 손상 쥐 모델의 행동 및 전기 생리학적 변화
* 이 저자들은 동등하게 기여했습니다
요약
쥐의 좌골 신경통을 유도하기 위해 만성 수축 손상 모델에서 Fu의 피하 침을 사용하기 위한 프로토콜을 제시합니다.
초록
중국 전통 의학에서 발명된 침술 기술인 Fu's Subcutaneous Needling(FSN)은 통증 완화를 위해 전 세계적으로 사용되고 있습니다. 그러나 작용 메커니즘은 아직 완전히 이해되지 않았습니다. FSN 치료 중에는 FSN 바늘이 삽입되어 흔들리는 움직임으로 장시간 피하 조직에 유지됩니다. 그러나 연구자를 위해 동물 모델(예: 쥐)에서 FSN을 조작하는 동안 자세를 유지하는 데 어려움이 있습니다. 불편한 치료는 FSN 바늘에 대한 두려움과 내성으로 이어져 부상 위험을 증가시키고 연구 데이터에 영향을 미칠 수도 있습니다. 마취도 연구 결과에 영향을 미칠 수 있습니다. 따라서 중재 중 부상을 최소화하는 동물에 대한 FSN 치료 전략이 필요합니다. 이 연구는 신경병증성 통증을 유발하기 위해 Sprague-Dawley 쥐의 만성 수축 손상 모델을 사용합니다. 이 모델은 신경 압박 증후군 및 말초 신경병증과 같은 상태에서 볼 수 있는 압박 또는 포착을 모방하여 말초 신경의 외과적 수축을 통해 인간에서 관찰되는 신경 손상으로 인한 통증을 재현합니다. FSN 바늘을 동물의 몸 피하층에 쉽게 삽입하기 위한 바늘 삽입 및 방향, 바늘 유지, 흔들리는 움직임 등 적절한 조작을 소개합니다. 쥐의 불편함을 최소화하면 쥐가 긴장하는 것을 방지하여 근육이 수축하여 바늘의 진입을 방해하고 연구 효율성을 향상시킵니다.
서문
신경 손상으로 인한 통증으로 정의되는 신경병증성 통증은 전 세계 인구의 6.9%-10%에 영향을 미치는 것으로 추정되며, 보고된 평생 유병률은 49%-70%입니다1,2. 또한 관리하기 가장 어려운 통증 증후군 중 하나로 간주됩니다. 신경병증성 통증을 관리하기 위한 약리학적 제제의 사용은 비스테로이드성 항염증제 및 오피오이드와 같이 일반적으로 처방되는 진통제가 이러한 유형의 통증을 완화하는 데 거의 효과가 없는 것으로 나타났기 때문에 제한적인 성공을 거두었습니다 3,4. 따라서 새로운 치료 옵션, 특히 비약물적 치료법을 모색할 필요가 있습니다. 침술은 비약물적 개입으로서 체성 감각계에 진통 효과를 발휘하여 잠재적으로 신경병증성 통증을 완화합니다. 임상 및 전임상 연구 모두에서 침 치료는 심각한 부작용 없이 신경병증성 통증 증상을 완화하는 데 효과적이라고 나타났다 5,6,7. 그러나 신경병증성 통증의 통증 완화를 위한 침 치료의 중심 메커니즘은 아직 더 연구되지 않았습니다.
최근 몇 년 동안 Fu의 피하 침(FSN)은 통증 관련 신경 질환 치료로 인기를 얻고 있습니다8. FSN은 중국 전통 침술에서 유래했으며 1996년 중국 전통 의사인 Zhonghua Fu에 의해 처음 기술되었습니다(9,10). FSN은 전통적인 침술에서 유래했지만 경락 기반 침술, 음과 양의 원리 및 경혈 개념과 기술 및 이론이 크게 다릅니다. FSN은 근막 통증을 효과적으로 해결하기 위해 신경생리학적 및 해부학적 접근에 더 중점을 두고있다 11. FSN 요법은 근육과 밀접하게 관련된 결합 조직을 표적으로 하여 다양한 고통스러운 근육 질환을 다루기 위해 임상에 적용되며, 특히 근육 조임(TM)의 치료에 중점을 둡니다12. 통증 완화를 위한 보완 요법으로서, FSN은 신속한 통증 관리와 연조직 경련의 현저한 개선을 제공할 뿐만 아니라 연조직 손상을 치료하는 데 효과적이라는 임상 증거도 있습니다13,14. FSN 요법은 질환과 관련된 근본적인 근막 통증 유발점(MTrP)을 해결하기 위해 맞춤화된 특정 기술을 사용합니다. FSN 바늘 삽입 위치는 이러한 트리거 포인트의 위치에 따라 신중하게 선택되므로 해당 부위를 정확하게 타겟팅할 수 있습니다. 시술 중에 FSN 바늘을 피하층에 삽입하여 치료 효과를 최적화하기 위해 의도적으로 멈춥니다. 그런 다음 흔들리는 움직임으로 알려진 독특한 기술이 사용되는데, 이는 조직을 자극하고 치료 반응을 촉진하기 위해 바늘의 부드러운 진동 동작을 포함합니다10. MTrP의 발달은 만성 근육 과부하, 과도한 운동, 부적절한 운동 자세, 근육 위축 및 퇴행과 같은 요인이 근육 조직 허혈 및 저산소증의 발병에 기여할 수 있다고 설명하는 에너지 위기 이론과 관련이 있습니다. 근육 조직 내의 이러한 산소 및 에너지 결핍은 MTrPs15,16의 형성에 중요한 역할을 하는 것으로 여겨집니다. 이전의 동물 연구에서는 쥐의 만성 통증에 대한 FSN 치료가 TM에서 미토콘드리아의 형태학적 구조와 기능을 어느 정도 개선한다는 사실이 밝혀졌으며, 이는 손상된 신경과 근육의 회복을 촉진하는 FSN 요법의 잠재력을 입증했다17.
좌골신경통은 신경병증성 통증으로 분류된다18. 신경병증성 통증의 기원은 운동 종판과 근육의 외부 섬유층 사이 어딘가에 있는 것으로 생각되며, 세포 수준의 미세혈관계와 신경 전달 물질과 관련이 있습니다. 근육 신경 분포의 상실과 신경 세포의 세포 사멸은 신경 손상이 발생할 때 발생하며,19 영향을 받은 사지의 통증 관련 보행으로 이어진다. 또한 신경의 만성적인 압박이나 자극은 신경 기능에 다양한 변화를 일으킬 수 있으며, 이는 좌골신경통의 증상을 더욱 악화시킬 수 있다20. 그러나 신경계의 복잡성으로 인해 시험관 내에서 복제하기가 어렵기 때문에 이러한 연구를 위해 동물 모델을 사용해야 합니다. 신경병증성 통증 장애의 연구에서, 좌골 신경 결찰, 절개술, 또는 압박과 같은 직접적인 말초 신경 손상의 다양한 방법을 포함하는 모델 유기체가 일반적으로 사용된다21,22. Sprague-Dawley 쥐의 만성 수축 손상(CCI) 모델은 신경병증성 통증을 유발하는 데 사용되었습니다. 이 모델은 신경 압박 증후군 및 말초 신경병증과 같은 상태에서 볼 수 있는 압박 또는 포착을 모방하여 말초 신경의 외과적 수축을 통해 인간에서 관찰되는 신경 손상으로 인한 통증을 재현합니다.
본 연구에서는 만성 수축 손상 및 신경병증성 통증이 있는 쥐를 대상으로 FSN 요법과 저주파 전기요법(경피적 전기 신경 자극기, TENS)의 진통 효과를 평가했다. 마취는 신경 자극을 늦추거나 차단하고 시냅스 전달 및 신경 기능에 영향을 미치기 때문에23 동물은 모든 바늘 시술과 흔들리는 움직임 하에서 마취될 수 없다. 따라서 쥐의 불편함을 줄이기 위해 적절한 바늘 기술이 필요합니다. 쥐 CCI 모델을 확립하는 단계, 마취 없이 FSN으로 쥐를 치료한 방법, 실현 가능한 동물 행동 패턴 테스트 및 전기 생리학적 조사에 대해 자세히 설명합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
동물 피험자와 관련된 모든 절차는 2022년 10월 대만 장화(111031)에 있는 Chang Bing Show Chwan Memorial Hospital의 IACUC(Institutional Animal Care and Use Committee)에서 승인되었습니다(그림 1).
1. 동물의 준비
- 48마리의 수컷Sprague-Dawley(SD) 쥐를 구입하십시오(연령: 8-10주, 체중: 250-300g).
- 24 ± 2 °C의 환기 케이지에 쥐를 개별적으로 사육하고 12 시간 동안 어둡고 밝은주기를 실시합니다.
- 쥐에게 사용할 준비가 된 멸균 식수와 함께 표준 펠릿 사료를 먹이고 부드러운 침구를 제공하십시오.
2. 동물의 그룹화
- Chan et al.24에 의해 수행된 이전 연구에서와 같이 48마리의 SD 쥐를 가짜 그룹, CCI 그룹, CCI+FSN 그룹, CCI+TENS 그룹, FSN 단독 그룹 및 TENS 단독 그룹의 6개 그룹(그룹당 n=8)으로 무작위로 나눕니다.
참고 : 6 개 그룹의 세부 사항 : (1) 가짜 그룹 : 수술 및 치료 없음; (2) CCI 그룹: 치료 없이 수술 준비; (3) CCI+FSN 치료군: 성공적인 CCI 모델링 후 FSN 치료; (4) CCI+TENS 치료군: 성공적인 CCI 모델링 후 TENS 치료; (5) FSN 단독 치료군: 수술 없이 FSN 치료만 받음; (6) TENS 단독 치료군: 수술 없이 TENS 치료만 합니다.
3. CCI 랫트 모델 구축
참고: 쥐의 CCI 수술 모델은 1988년에 수행된 Bennett과 Xie에 따라 수정되었습니다25.
- 작업자가 수술용 마스크, 일회용 작동 캡 및 멸균 장갑을 착용하는지 확인하십시오.
- 수술대 표면을 70% 에탄올로 소독합니다. 기구(예: 가위, 집게, 견인기), 거즈, 스테이플, 면봉을 고압멸균으로 소독합니다.
알림: 무균 기술은 수술 절차 전반에 걸쳐 사용됩니다. - 표준 피부 준비(면도) 후 쥐를 4% 이소플루란으로 마취하고 2% 이소플루란으로 유지합니다(그림 2A).
- 뒷발을 꼬집은 후 반응이 없는 것을 관찰하고 시술 내내 마취된 쥐를 모니터링하여 적절한 마취 깊이를 확인합니다.
- 건조를 방지하기 위해 눈 위에 수의학 안과 연고를 충분히 바르십시오.
- 쥐를 수술대에 엎드린 자세로 놓고 오른쪽 뒷다리 옆의 털을 면도한 후 포비돈 요오드 용액과 75% 에탄올로 피부를 세 번 소독합니다. 수술 과정 전반에 걸쳐 열 지원을 제공하고 멸균 드레이프를 사용하여 수술 부위를 덮습니다.
- 대퇴골 아래 3-4mm의 피부를 약 20-50mm의 평행하게 절개합니다.
- 대둔근과 대퇴이두근의 위치 식별을 우선시합니다. 수술용 가위를 사용하여 피하 지방과 표재성 근막을 층별로 분리하고 주변 결합 조직을 절단하여 근육을 노출시킵니다(그림 2B).
알림: 피하 지방층과 표재성 근막층을 구별하려면 질감과 색상을 관찰하십시오. 피하 지방층은 황색 또는 희끄무레한 외관으로 부드럽고 유연해 보여야 합니다. 표재성 근막은 피하 지방 바로 아래에 위치한 얇은 섬유층입니다. 부드럽게 촉진하거나 뭉툭한 기구로 관찰하여 층을 구별하고, 피하 지방은 표재성 근막에 비해 압력에 대한 저항력이 더 높다는 점에 주목합니다.
- 뭉툭한 가위를 사용하여 표재성 둔근과 대퇴 이두근 사이의 결합 조직을 자릅니다.
- 견인기를 사용하여 이 두 근육 사이의 간격을 넓혀 좌골 신경을 노출시킵니다(그림 2C).
알림: 쥐의 좌골 신경을 시각적으로 식별하려면 허벅지 부위에 초점을 맞춥니다. 허벅지 부위의 중간 지점을 찾아 좌골 신경을 시각화합니다. 일반적으로 신경은 허벅지의 뒤쪽을 따라 엉덩이 부위에서 시작하여 무릎 쪽으로 뻗어 있습니다. - 신경 형태를 바꾸지 않고 좋은 광원을 통해 마이크로 니들로 좌골 신경을 선택합니다. 좌골 신경을 3-0 크롬 내장 합자를 사용하여 두 개의 봉합사 사이에 약 1mm 간격으로 결찰점을 배치하여 두 개의 결찰 지점을 두 번 결찰합니다.
- 각 합자에 대해 느슨한 고리로 시작하여 고리에 가까운 합자의 끝을 잡고 고리가 꼭 맞을 때까지 조여 합자가 신경을 따라 미끄러지지 않도록 합니다. 결찰 중 사지의 경미한 경련이 관찰되면 멈춥니다(그림 2D).
- 견인기를 사용하여 이 두 근육 사이의 간격을 넓혀 좌골 신경을 노출시킵니다(그림 2C).
- 근육과 피부를 4-0 봉합선으로 층층이 닫습니다. 마지막으로 요오드로 상처를 소독한다(그림 2E).
- 마취 중 쥐의 활력 징후를 면밀히 모니터링하고 깨어날 때까지 개별 회복 케이지에 넣은 후 케이지에 다시 넣습니다. 의식을 잃은 동물의 질식을 방지하기 위해 납작한 종이 침구를 케이지에 깔아줍니다. 수술 후 팔다리의 짧은 경련은 수술이 성공적이었음을 나타냅니다(그림 2F).
- CCI(기준선) 전과 CCI 후 다른 시점에서 통증 과민증 테스트를 여러 번 수행합니다.
- 모델 구성 후 1일, 3일, 5일, 7일에 자발적인 통증과 행동 변화를 관찰합니다.
알림: 오른쪽 뒷다리의 걸음걸이와 자세, 팔다리를 핥거나 무는 것을 관찰하십시오.- 신경병증성 통증의 존재를 식별하여 모델의 성공적인 확립을 결정하고 실패한 쥐를 제외합니다.
참고: 하지 보행의 약화, 가벼운 외반과 함께 붙어있는 오른쪽 팔다리의 발가락, 잦은 매달림, 착지 거부와 같은 징후를 관찰하여 모델의 성공을 평가합니다. 왼쪽 뒷다리가 체중을 지탱하고 오른쪽 뒷다리가 들어 올려 복부에 가깝게 서 있는 쥐를 관찰합니다.
- 신경병증성 통증의 존재를 식별하여 모델의 성공적인 확립을 결정하고 실패한 쥐를 제외합니다.
4. FSN 조작 관리
- FSN 치료군(CCI+FSN 및 FSN 단독군 포함)의 쥐를 환절된 사지가 측면으로 노출된 상태로 설치류 구속구에 고정합니다. 절차 전반에 걸쳐 열 지원을 제공합니다. 두 그룹 모두 FSN 일회용 바늘로 처리되었습니다(그림 3A).
- 마취 없이 쥐의 뒷다리가 팽팽해질 때까지 서서히 천천히 뻗습니다(그림 3B).
알림: 쥐 머리는 동물을 침착하고 안정적으로 유지하기 위해 수술용 드레이프로 덮여 있습니다. 쥐에게 부상을 입히기 위해 다리를 과도하게 뻗지 마십시오. 고통이나 불편함의 징후가 있는지 쥐의 반응을 면밀히 관찰하십시오. 쥐가 통증이나 불편함의 징후를 보이면 연장을 중지하고 휴식을 취한 후 다시 시도하십시오. - FSN 바늘의 보호 덮개를 제거합니다.
- FSN 바늘 끝을 허리와 뒤쪽에 위치한 대둔근에 거의 가까운 TM(MTrP가 있는 근육) 쪽으로 삽입합니다.
- FSN 바늘을 평평하게 놓고 약 15° 각도로 피부에 들어갑니다.
- 완전히 삽입될 때까지 쥐의 스트레스를 방지하기 위해 피부를 통해 피하 공간으로 조심스럽게 빠르게 밀어 넣습니다. 부드러운 튜브가 피부 아래에 완전히 묻힐 수 있도록 바늘이 충분히 삽입되었는지 확인하십시오.
- 앞으로 밀 때 바늘 끝을 약간 들어 올려 피부가 바늘 끝을 따라 돌출되는지 관찰합니다(그림 3C).
- 검지, 중지, 약지를 일직선으로 정렬한 상태에서 엄지손가락을 받침점으로 하여 FSN 바늘 끝을 부드럽고 부드럽게 부채질하여 흔들리는 동작을 수행합니다.
- FSN 바늘을 가운데 손가락과 엄지 사이에 대고 마주 보는 자세에서 집게 손가락과 약지를 사용하여 앞뒤로 번갈아 움직입니다.
- 주파수를 분당 100스트로크로 설정하고 약 1분 동안 작업을 수행합니다(그림 3D).
- 조작을 완료 한 후 FSN 바늘을 빠르게 빼십시오.
참고: 이 작업은 총 4개의 세션(CCI 모델 생성 후 1일, 3일, 5일, 7일) 동안 2일마다 수행되었습니다. 일회용 FSN 바늘은 한 번만 사용해야 합니다. 반복적으로 사용하면 바늘이 무뎌지고 쥐의 통증이 증가합니다.
5. TENS 조작 관리
- TENS 치료군(CCI+TENS 및 TENS 단독군 포함)의 쥐를 환부가 측면으로 노출된 상태로 설치류 구속구에 고정합니다. 절차 전반에 걸쳐 열 지원을 제공합니다. 치료하기 전에 모피를 면도했는지 확인하십시오.
알림: 전극은 45mm(길이) x 5mm(너비)로 절단되었습니다(그림 4A). - TENS의 위치로 Zusanli 포인트(ST36) 및 Sanyinjiao 포인트(SP6)를 선택합니다. 이것은 신경병증성 통증 치료 이론26,27을 기반으로 합니다.
- 무릎 바로 아래 경골과 비골 사이의 경골의 전방 결절에서 약 5mm 측면에 있는 Zusanli 점(ST36)을 찾습니다28.
- 경골의 후방 경계에서 Sanyinjiao 지점(SP6)을 내측 연골 3mm에 근접한28 위치에 위치합니다.
참고: 이 두 경혈은 모두 Stux와 Pomeranz와 동물 경혈지도책 28,29(그림 4B)에 설명된 대로 수동 검사에 의해 위치합니다.
- 신경 주위 다리에 전극을 부착한 상태에서 TENS 장치를 사용하여 10분 동안 저주파 전기 자극(2Hz 연속 사인파, 3mA)을 전달합니다. 쥐 머리의 머리를 수술용 드레이프로 덮어 침착하고 안정적으로 유지하십시오.
참고: 이 절차는 총 4개의 세션(CCI 모델 생성 후 1일, 3일, 5일, 7일) 동안 2일마다 수행됩니다.
6. 동물행동시험을 실시하는 생리학적 측정
참고: 좌골 신경 기능 지수(SFI)30 은 신경 손상의 병리학 및 잠재적 치료를 연구하는 연구원들이 널리 사용하는 지수로, 부상당한 쥐의 영향을 받는 뒷발의 기하학적 구조를 반대쪽 발의 기하학적 구조와 비교하고 반대쪽 발과 비교하여 결정됩니다.
- 투명한 플렉시 유리와 틸트 거울로 쥐 통로를 디자인하여 걷는 동안 쥐의 발자국과 신체 방향을 캡처합니다.
알림: 통로는 길이 10cm, 너비 50cm, 높이 15cm의 플랫폼이며 바닥에 흰색 종이 라이닝이 있습니다(그림 5A). - 쥐를 상자에 부드럽고 자유롭게 넣고 녹음하기 전에 최소 5분 동안 새로운 환경에 적응하도록 합니다.
알림: 자세 근육 긴장에 영향을 미치지 않도록 동물에게 불필요한 스트레스를 최소화하기 위해 특별한 주의를 기울입니다. - 쥐의 발을 빨간 잉크에 담그고 쥐가 산책로를 따라 걸을 수 있도록 하여 뒷면 종이에 흔적을 남깁니다. 각 테스트에 대해 최소 2초의 연속 걷기를 기록합니다. 쥐가 한 방향으로 최소 3번 걷게 합니다(그림 5B).
알림: 속건성, 무독성, 수용성 빨간색 잉크를 양쪽 뒷발에 바르면 뒷발 발자국이 선명하게 보입니다. - 실험이 끝나면 통로 스트립을 건조시켜 매개변수를 측정합니다. 자로 발자국을 측정하고 가장 가까운 0.5mm로 반올림합니다.
참고: 여러 발자국에서 각 쥐의 세 개의 명확한 발자국을 선택하고 세 가지 다른 매개변수를 측정했습니다. SFI의 요인에는 인쇄 길이(PL), 발가락 스프레드(TS) 및 중간 토우 스프레드(ITS)가 포함됩니다.
SFI 값은 다음 공식31을 사용하여 계산됩니다.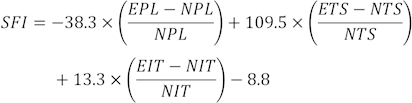
(EPL, 실험적 인쇄 길이; NPL, 일반 인쇄 길이; ETS, 실험용 발가락 퍼짐; NTS, 정상 발가락 스프레드; EIT, 실험적 중간 발가락 퍼짐; NIT, 중간 발가락 스프레드.)
SFI = 0 및 - 100은 정상적이고 완전한 기능 장애를 나타냅니다. 발가락을 질질 끄는 쥐에게는 임의로 -100의 값이 할당되었습니다. 정상적인 신경 기능의 경우, SFI는 0 부근에서 진동하는 반면, 약 -100 SFI는 완전한 기능 장애를 나타낸다32.
7. 전기생리학적 측정에 의한 신경생리학적 평가33
참고: 이 연구에서 전기생리학적 활동을 기록하기 위해 근전도를 사용했습니다. 복합 근육 활동 전위(CMAP)는 신경에 의해 공급되는 표적 근육의 근섬유가 활성화되어 발생합니다. CMAP 진폭 및 지연 시간을 조사합니다. CMAP 진폭은 기준선에서 음의 피크까지 측정됩니다. CMAP의 잠복기는 자극 적용과 복합 활동 전위의 시작 사이의 시간을 측정하여 결정되며, 이는 자극 부위와 기록 부위 사이의 거리에 의해 영향을 받습니다. 전기생리학은 쥐의 말초 신경 기능에 대한 객관적인 평가를 제공합니다.
- 쥐를 마취시키기 위해 Zoletil 50(40mg/kg, ip)을 투여합니다. 표준 프로토콜(면도)에 따라 피부를 준비합니다.
- 일회용 접착 표면 전극(외경 20mm)을 지정된 부위에 놓습니다. 기록 전극을 비복근의 측면 및 등쪽 표면에 고정합니다(그림 6A).
- 오른쪽 근위 좌골 신경간에 전기 자극(강도 1.2mA)을 가합니다. 비복근의 복부에 복합 근육 활동 전위(CMAP)를 기록합니다(그림 6B).
알림: 전극을 삽입할 때 근육 조직을 피하기 위해 주의하십시오. - 각 쥐에 대해 세 번 반복된 측정의 효과를 기록합니다.
참고: CMAP는 각 그룹의 평균 ± SD로 표현됩니다. 신호는 증폭기에 의해 증폭되고 필터링되었습니다 (0.3-3kHz). 적분 후(시간 상수 = 0.05초) 원래 신호와 적분 신호가 모두 입력됩니다. 그런 다음 원래 신호와 통합 신호가 PowerLab 시스템에서 디지털화되어 컴퓨터 하드 디스크에 저장됩니다. - 전기생리학 절차를 마친 후 쥐를 다른 케이지로 옮기고 흉골 누운 자세를 유지할 수 있을 만큼 충분한 의식을 회복할 때까지 모니터링합니다. 쥐가 마취제에서 완전히 회복되면 원래 케이지로 다시 옮깁니다.
8. 통계:
- ANOVA(반복 측정 분산 분석)를 사용하여 그룹 간 SFI 및 CMAP의 차이를 평가합니다.
- 실험 조건에 대해 눈이 먼 조수에 의해 데이터를 정량화합니다. 데이터를 평균± 표준편차로 표현합니다.
- 적절한 경우 스튜던트의 양측 쌍체 t-검정과 쌍체하지 않은 t-검정을 사용하여 데이터를 비교합니다. 통계적 유의성을 p < 0.05로 설정합니다.
Access restricted. Please log in or start a trial to view this content.
결과
SFI의 발자국과 결정
CCI 단독, CCI+FSN 및 CCI+TENS 그룹에서 SFI의 발달을 조사했습니다(그림 7). CCI 수술 7일차에 FSN 및 TENS 치료를 4회 시행한 결과, CCI+FSN(-15.85 ± 3.46) 및 CCI+TENS(-29.58 ± 9.19) 그룹의 SFI가 CCI 단독 그룹(-87.40 ± 14.22)에 비해 유의하게 개선되었습니다. CCI+FSN 그룹은 CCI+TENS 그룹에 비해 상당한 개선이 이루어졌습니다(그림 7A).
Access restricted. Please log in or start a trial to view this content.
토론
이 연구는 쥐 CCI 모델에서 신경병증성 통증에 대한 FSN 치료의 효과를 관찰합니다. 이 연구는 FSN 또는 TENS 치료 후 치료 효과를 평가하기 위한 SFI 및 전기생리학적 검사에 대한 프로토콜을 제시합니다. 또한 비침습적 행동 검사 및 생리학적 측정을 사용하여 손상된 신경의 기능적 회복을 평가하는 방법을 보여줍니다. 그 결과, CCI로 인한 좌골신경통 후 FSN 치료는 TENS 치료보다 모든 예후 지표에서 유...
Access restricted. Please log in or start a trial to view this content.
공개
저자들은 상충되는 이해 상충이 존재하지 않는다고 선언합니다.
감사의 말
이 연구는 대만 장화에 있는 Chang Bing Show Chwan Memorial Hospital의 동물 센터의 보조금으로 지원되었습니다. 저자들은 이 연구 프로젝트 전반에 걸쳐 귀중한 지원과 도움을 준 Show Chwan Memorial Hospital IRCAD TAIWAN에 감사의 뜻을 전합니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Forceps | World Precision Instruments | 14098 | |
| Fu’s subcutaneous needling | Nanjing Paifu Medical Science and Technology Co. | FSN needles are designed for single use. The FSN needle is made up of three parts: a solid steel needle core (bottom), a soft casing pipe (middle), and a protecting sheath (top). | |
| Medelec Synergy electromyography | Oxford Instrument Medical Ltd. | 034W003 | Electromyogram (EMG) are used to help in the diagnosis and management of disorders such as neuropathies. Contains a portable two-channel electromyography/nerve conduction velocity system. |
| Normal saline (0.9%) 20 mL | Taiwan Biotech Co.,Ltd. | 4711916010323 | Lot: 1TKB2022 |
| POLYSORB 4-0 VIOLET 30" CV-25 | UNITED STATES SURGICAL, A DIVISION OF TYCO HEALTHC | GL-181 | |
| Retractor | COOPERSURGICAL, INC.(USA) | 3311-8G | |
| Rompun | Elanco Animal Health Korea Co. Ltd. | 27668 | |
| SCISSORS CVD 90MM | BBRUAN | XG-LBB-BC101R | |
| Transcutaneous Electrical Nerve Stimulation | Well-Life Healthcare Co. | Model Number 2205A | Digital unit which offers TENS. Supplied complete with patient leads, self-adhesive electrodes, 3 AAA batteries and instructions in a soft carry bag. Interval ON time 1–30 s. Interval OFF time 1–30 s. |
| Zoletil | VIRRBAC | 8V8HA |
참고문헌
- van Hecke, O., Austin, S. K., Khan, R. A., Smith, B. H., Torrance, N. Neuropathic pain in the general population: a systematic review of epidemiological studies. Pain. 155 (4), 654-662 (2014).
- Younes, M., et al. Prevalence and risk factors of disk-related sciatica in an urban population in Tunisia. Joint Bone Spine. 73 (5), 538-542 (2006).
- Woolf, C. J., Mannion, R. J. Neuropathic pain: aetiology, symptoms, mechanisms, and management. Lancet. 353 (9168), 1959-1964 (1999).
- Baron, R., et al. Neuropathic low back pain in clinical practice. European Journal of Pain. 20 (6), 861-873 (2016).
- Ma, X., et al. Potential mechanisms of acupuncture for neuropathic pain based on somatosensory system. Frontiers in Neuroscience. 16, 940343(2022).
- Jang, J. H., et al. Acupuncture alleviates chronic pain and comorbid conditions in a mouse model of neuropathic pain: the involvement of DNA methylation in the prefrontal cortex. Pain. 162 (2), 514-530 (2021).
- He, K., et al. Effects of acupuncture on neuropathic pain induced by spinal cord injury: A systematic review and meta-analysis. Evidence Based Complement and Alternative Medicine. 2022, 6297484(2022).
- Fu, Z., Lu, D. Fu's Subcutaneous Needling: A Novel Therapeutic Proposal. Acupuncture - Resolving Old Controversies and Pointing New Pathways. IntechOpen. , (2019).
- Fu, Z. H. The Foundation of Fu's Subcutaneous Needling. , People's Medical Publishing House, Co, Ltd. China. (2016).
- Fu, Z. H., Chou, L. W. Fu's Subcutaneous Needling, Trigger Point Dry Needling: An Evidence and Clinical-Based Approach. 2nd Edition. , Elsevier Health Sciences. Chapter 16 255-274 (2018).
- Fu, Z., Shepher, R. Fu's Subcutaneous Needling, a Modern Style of Ancient Acupuncture? Acupuncture in Modern Medicine. IntechOpen. , (2013).
- Chiu, P. E., et al. Efficacy of Fu's subcutaneous needling in treating soft tissue pain of knee osteoarthritis: A randomized clinical trial. Journal of Clinical Medicine. 11 (23), 7184(2022).
- Huang, C. H., Lin, C. Y., Sun, M. F., Fu, Z., Chou, L. W. Efficacy of Fu's Subcutaneous Needling on Myofascial Trigger Points for Lateral Epicondylalgia: A randomized control trial. Evidence Based Complement and Alternative Medicine. 2022, 5951327(2022).
- Huang, C. H. Rapid improvement in neck disability, mobility, and sleep quality with chronic neck pain treated by Fu's subcutaneous needling: A randomized control study. Pain Research and Management. 2022, 7592873(2022).
- Chou, L. W., Hsieh, Y. L., Kuan, T. S., Hong, C. Z. Needling therapy for myofascial pain: recommended technique with multiple rapid needle insertion. Biomedicine (Taipei). 4 (2), 13(2014).
- Ye, L., et al. Depression of mitochondrial function in the rat skeletal muscle model of myofascial pain syndrome is through down-regulation of the AMPK-PGC-1α-SIRT3 axis. Journal of Pain Research. 13, 1747-1756 (2020).
- Li, Y., et al. Effects of Fu's subcutaneous needling on mitochondrial structure and function in rats with sciatica. Molecular Pain. 18, 17448069221108717(2022).
- Perreault, T., Fernández-de-Las-Peñas, C., Cummings, M., Gendron, B. C. Needling interventions for sciatica: Choosing methods based on neuropathic pain mechanisms-A scoping review. Journal of Clinical Medicine. 10 (10), 2189(2021).
- Weller, J. L., Comeau, D., Otis, J. A. D. Myofascial pain. Seminars in Neurology. 38 (6), 640-643 (2018).
- Grøvle, L., et al. The bothersomeness of sciatica: patients' self-report of paresthesia, weakness and leg pain. European Spine Journal. 19 (2), 263-269 (2010).
- Jaggi, A. S., Jain, V., Singh, N. Animal models of neuropathic pain. Fundament Clinical Pharmacology. 25 (1), 1-28 (2011).
- Burma, N. E., Leduc-Pessah, H., Fan, C. Y., Trang, T. Animal models of chronic pain: Advances and challenges for clinical translation. Journal of Neuroscience Research. 95 (6), 1242-1256 (2017).
- McCann, M. E., Soriano, S. G. Does general anesthesia affect neurodevelopment in infants and children. British Medical Journal. 367, 6459(2019).
- Chan, K. Y., et al. Ameliorative potential of hot compress on sciatic nerve pain in chronic constriction injury-induced rat model. Frontiers in Synaptic Neuroscience. 14, 859278(2022).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. 33 (1), 87-107 (1988).
- Somers, D. L., Clemente, F. R. Transcutaneous electrical nerve stimulation for the management of neuropathic pain: The effects of frequency and electrode position on prevention of allodynia in a rat model of complex regional pain syndrome type II. Physical Therapy. 86 (5), 698-709 (2006).
- Xing, G., Liu, F., Wan, Y., Yao, L., Han, J. Electroacupuncture of 2 Hz induces long-term depression of synaptic transmission in the spinal dorsal horn in rats with neuropathic pain. Beijing Da Xue Xue Bao Yi Xue Ban. 35 (5), 453-457 (2003).
- Schone, A. M. Veterinary Acupuncture: Ancient Art to Modern Medicine. , American Veterinary Publication. (1999).
- Stux, G., Pomeranz, B. Acupuncture: Textbook and Atlas. , Springer-Verlag. Berlin. (1987).
- de Medinaceli, L., Freed, W. J., Wyatt, R. J. An index of the functional condition of rat sciatic nerve based on measurements made from walking tracks. Experimental Neurology. 77 (3), 634-643 (1982).
- Bain, J. R., Mackinnon, S. E., Hunter, D. A. Functional evaluation of complete sciatic, peroneal, and posterior tibial nerve lesions in the rat. Plastic and Reconstructive Surgery. 83 (1), 129-138 (1989).
- Kanaya, F., Firrell, J. C., Breidenbach, W. C. Sciatic function index, nerve conduction tests, muscle contraction, and axon morphometry as indicators of regeneration. Plastic and Reconstructive Surgery. 98 (7), 1264-1271 (1996).
- Wild, B. M., et al. In vivo electrophysiological measurement of the rat ulnar nerve with axonal excitability testing. Journal of Visualized Experiments: JoVE. (132), e56102(2018).
- Wong, J. Y., Rapson, L. M. Acupuncture in the management of pain of musculoskeletal and neurologic origin. Physical Medicine and Rehabilitation Clinics of North America. 10 (3), 531-545 (1999).
- Qin, Z., Liu, X., Yao, Q., Zhai, Y., Liu, Z. Acupuncture for treating sciatica: A systematic review protocol. BMJ Open. 5 (4), 007498(2015).
- Zhi, M. J., et al. Application of the chronic constriction injury of the partial sciatic nerve model to assess acupuncture analgesia. Journal of Pain Research. 10, 2271-2280 (2017).
- Fu, Z. H., Xu, J. G. A brief introduction to Fu's subcutaneous needling. Pain Clinic. 17, 343-348 (2005).
- Peng, J., et al. The effect of Fu's subcutaneous needling combined with reperfusion approach on surface electromyography signals in patients with cervical spondylosis and neck pain: A clinical trial protocol. Biomed Research International. 2022, 1761434(2022).
- Fu, Z. H., Wang, J. H., Sun, J. H., Chen, X. Y., Xu, J. G. Fu's subcutaneous needling: possible clinical evidence of the subcutaneous connective tissue in acupuncture. Journal Alternative and Complementary Medicine. 13 (1), 47-51 (2007).
- Harrison, T. M., Churgin, S. M. Acupuncture and traditional Chinese veterinary medicine in zoological and exotic animal medicine: A review and introduction of methods. Veterinary Science. 9 (2), 74(2022).
- Gollub, R. L., Hui, K. K., Stefano, G. B. Acupuncture: pain management coupled to immune stimulation. Zhongguo Yao Li Xue Bao. 20 (9), 769-777 (1999).
- Simons, D. G., Travell, J., Simons, L. E. Myofascial Pain and Dysfunction: The Trigger Point Manual. 2nd ed. , Williams and Wilkins. Baltimore, MD. (1999).
- Gerwin, R. D., Dommerholt, J., Shah, J. P. An expansion of Simons' integrated hypothesis of trigger point formation. Current Pain and Headache Reports. 8 (6), 468-475 (2004).
- Hong, C. Z., Simons, D. G. Pathophysiologic and electrophysiologic mechanisms of myofascial trigger points. Archives of Physical Medicine and Rehabilitation. 79 (7), 863-872 (1998).
- Fu, Z., et al. Remote subcutaneous needling to suppress the irritability of myofascial trigger spots: an experimental study in rabbits. Evidence Based Complement and Alternative Medicine. 2012, 353916(2012).
- Hsieh, Y. L., Yang, C. C., Liu, S. Y., Chou, L. W., Hong, C. Z. Remote dose-dependent effects of dry needling at distant myofascial trigger spots of rabbit skeletal muscles on reduction of substance P levels of proximal muscle and spinal cords. Biomed Research International. 2014, 982121(2014).
- Ma, K., et al. Peripheral nerve adjustment for postherpetic neuralgia: a randomized, controlled clinical study. Pain Medicine. 14 (12), 1944-1953 (2013).
- Gao, Y., Sun, J., Fu, Z., Chiu, P. E., Chou, L. W. Treatment of postsurgical trigeminal neuralgia with Fu's subcutaneous needling therapy resulted in prompt complete relief: Two case reports. Medicine. 102 (9), e33126(2023).
- Lucas, L. R., Wang, C. J., McCall, T. J., McEwen, B. S. Effects of immobilization stress on neurochemical markers in the motivational system of the male rat. Brain Research. 1155, 108-115 (2007).
- Yang, C. H., et al. Effect of electroacupuncture on response to immobilization stress. Pharmacology, Biochemistry, and Behavior. 72 (4), 847-855 (2002).
- Adams, S., Pacharinsak, C. Mouse anesthesia and analgesia. Current Protocols in Mouse Biology. 5 (1), 51-63 (2015).
- Cantwell, S. L. Traditional Chinese veterinary medicine: the mechanism and management of acupuncture for chronic pain. Topics in Companion Animal Medicine. 25 (1), 53-58 (2010).
- Liebano, R. E., Rakel, B., Vance, C. G. T., Walsh, D. M., Sluka, K. A. An investigation of the development of analgesic tolerance to TENS in humans. Pain. 152 (2), 335-342 (2011).
- Khalil, Z., Merhi, M. Effects of aging on neurogenic vasodilator responses evoked by transcutaneous electrical nerve stimulation: relevance to wound healing. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 55 (6), B257-B263 (2000).
- Sato, K. L., Sanada, L. S., Silva, M. D. D., Okubo, R., Sluka, K. A. Transcutaneous electrical nerve stimulation, acupuncture, and spinal cord stimulation on neuropathic, inflammatory and, non-inflammatory pain in rat models. The Korean Journal of Pain. 33 (2), 121-130 (2020).
- Maeda, Y., Lisi, T. L., Vance, C. G., Sluka, K. A. Release of GABA and activation of GABA(A) in the spinal cord mediates the effects of TENS in rats. Brain Research. 1136 (1), 43-50 (2007).
- Degrugillier, L., et al. A new model of chronic peripheral nerve compression for basic research and pharmaceutical drug testing. Regenerative Medicine. 16 (10), 931-947 (2021).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유