Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Fu'nun Deri Altı İğnelemesinin Siyatik Sinir Ağrısı Üzerindeki Etkinliği: Kronik Konstriksiyon Yaralanmalı Sıçan Modelinde Davranışsal ve Elektrofizyolojik Değişiklikler
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Sıçanlarda siyatik sinir ağrısını indüklemek için kronik bir daralma yaralanması modelinde Fu'nun deri altı iğnelemesini kullanmak için bir protokol sunuyoruz.
Özet
Geleneksel Çin tıbbından icat edilmiş bir akupunktur tekniği olan Fu'nun deri altı iğnelemesi (FSN), dünya çapında ağrı kesici olarak kullanılmaktadır. Bununla birlikte, etki mekanizmaları hala tam olarak anlaşılamamıştır. FSN tedavisi sırasında FSN iğnesi cilt altı dokulara sokulur ve sallanma hareketi ile uzun süre tutulur. Bununla birlikte, araştırmacılar için hayvan modellerinde (örneğin sıçanlar) FSN'yi manipüle ederken bir duruşun korunmasından kaynaklanan zorluklar ortaya çıkar. Rahatsız edici tedavi, FSN iğnelerine karşı korku ve dirence yol açarak yaralanma riskini artırabilir ve hatta araştırma verilerini etkileyebilir. Anestezi de çalışma sonuçlarını etkileyebilir. Bu nedenle, hayvanlar üzerinde FSN tedavisinde, müdahale sırasında yaralanmayı en aza indiren stratejilere ihtiyaç vardır. Bu çalışma, nöropatik ağrıyı indüklemek için Sprague-Dawley sıçanlarında kronik bir daralma yaralanması modeli kullanmaktadır. Bu model, sinir sıkışması sendromları ve periferik nöropatiler gibi durumlarda görülen kompresyon veya sıkışmayı taklit ederek, periferik bir sinirin cerrahi daralması yoluyla insanlarda gözlenen sinir hasarının neden olduğu ağrıyı çoğaltır. İğne yerleştirme ve yönü, iğne tutma ve sallanma hareketi dahil olmak üzere bir FSN iğnesini hayvanın vücudunun deri altı tabakasına kolayca yerleştirmek için uygun bir manipülasyon sunuyoruz. Sıçanın rahatsızlığını en aza indirmek, sıçanın gergin olmasını önler, bu da kasın kasılmasına ve iğnenin girişini engellemesine neden olur ve çalışma verimliliğini artırır.
Giriş
Sinir hasarının neden olduğu ağrı olarak tanımlanan nöropatik ağrının dünya nüfusunun %6,9-10'unu etkilediği tahmin edilmektedir ve bildirilen yaşam boyu prevalansı %49-70'tir1,2. Aynı zamanda yönetilmesi en zor ağrı sendromlarından biri olarak kabul edilir. Nöropatik ağrıyı yönetmek için farmakolojik ajanların kullanımı, steroid olmayan antienflamatuar ilaçlar ve opioidler gibi yaygın olarak reçete edilen ağrı kesici ilaçların bu tip ağrıyı hafifletmede çok az etkinlik göstermesi nedeniyle sınırlı başarı sağlamıştır 3,4. Bu nedenle, özellikle farmakolojik olmayan tedaviler olmak üzere yeni tedavi seçeneklerinin araştırılmasına büyük ihtiyaç vardır. Akupunktur, farmakolojik olmayan bir müdahale olarak, somatosensoriyel sistem üzerinde analjezik etkiler uygulayarak nöropatik ağrıyı potansiyel olarak hafifletir. Hem klinik hem de klinik öncesi çalışmalar, akupunkturun önemli yan etkiler olmaksızın nöropatik ağrı semptomlarını hafifletmede etkili olduğunu göstermiştir 5,6,7. Bununla birlikte, nöropatik ağrıda ağrının giderilmesi için akupunktur tedavisinin merkezi mekanizması daha fazla araştırılmaya devam etmektedir.
Son yıllarda, Fu'nun deri altı iğnelemesi (FSN), ağrıya bağlı nörolojik bozuklukların tedavisinde popülerlik kazanmıştır8. FSN, geleneksel Çin akupunkturundan kaynaklanmaktadır ve ilk olarak 1996yılında geleneksel Çinli doktor Zhonghua Fu tarafından tanımlanmıştır 9,10. Geleneksel akupunkturdan kaynaklanırken, FSN teknik ve teorilerinde meridyen bazlı akupunktur, yin ve yang prensipleri ve akupunktur noktası kavramlarından önemli ölçüde farklıdır. FSN, miyofasiyal ağrıyı etkili bir şekilde ele almak için nörofizyolojik ve anatomik yaklaşımlara daha fazla önem vermektedir11. FSN tedavisi, klinik uygulamada, özellikle gergin kasların (TM'ler) tedavisine odaklanarak, kaslarla yakından ilişkili bağ dokularını hedef alan çeşitli ağrılı kas bozukluklarını ele almak için uygulanır12. Ağrının giderilmesi için tamamlayıcı bir tedavi olarak, FSN'nin hızlı ağrı yönetimi ve yumuşak doku spazmlarında önemli iyileşme sağlamanın yanı sıra yumuşak doku yaralanmalarının tedavisinde etkili olduğuna dair klinik kanıtlar da vardır13,14. FSN tedavisi, durumla ilişkili altta yatan miyofasiyal tetik noktalarını (MTrP'ler) ele almak için uyarlanmış özel teknikleri içerir. FSN iğne yerleştirme konumu, bu tetik noktalarının konumuna göre dikkatlice seçilir ve etkilenen alanların hassas bir şekilde hedeflenmesine olanak tanır. Prosedür sırasında, FSN iğnesi, terapötik etkileri optimize etmek için kasıtlı olarak durdurulduğu deri altı tabakasına yerleştirilir. Daha sonra, dokuları uyarmak ve terapötik tepkileri teşvik etmek için iğnenin hafif bir salınım hareketini içeren, sallanma hareketi olarak bilinen ayırt edici bir teknik kullanılır10. MTrP'lerin gelişimi, kronik kas aşırı yüklenmesi, aşırı egzersiz, uygun olmayan efor duruşları, kas atrofisi ve dejenerasyon gibi faktörlerin kas dokusu iskemisi ve hipoksinin başlamasına katkıda bulunabileceğini açıklayan enerji krizi teorisi ile ilişkilidir. Kas dokusundaki bu oksijen ve enerji eksikliğinin MTrP'lerinoluşumunda önemli bir rol oynadığına inanılmaktadır 15,16. Önceki hayvan çalışmaları, sıçanlarda kronik ağrı için FSN tedavisinin, TM'lerdeki mitokondrinin morfolojik yapısını ve işlevini bir dereceye kadar iyileştirdiğini ve FSN tedavisinin hasarlı sinirlerin ve kasların iyileşmesini teşvik etme potansiyelini doğruladığını bulmuştur17.
Siyatik nöropatik ağrı olarak sınıflandırılmıştır18. Nöropatik ağrının kökeninin, motor uç plakası ile kasın dış fibröz tabakası arasında, mikrovasküler sistemi ve hücresel düzeyde nörotransmiterleri içeren herhangi bir yerde olduğu düşünülmektedir. Kas innervasyonu kaybı ve innerve sinir hücrelerinin apoptozu, sinir hasarımeydana geldiğinde meydana gelir 19 ve etkilenen uzuvda ağrıya bağlı yürüyüşe yol açar. Ek olarak, sinirin kronik sıkışması veya tahrişi, sinir fonksiyonlarında çeşitli değişikliklere yol açabilir ve bu da siyatik semptomlarını daha da şiddetlendirebilir20. Bununla birlikte, sinir sisteminin karmaşıklığı, in vitro olarak kopyalanmasını zorlaştırmakta, bu nedenle bu tür çalışmalar için hayvan modellerinin kullanılmasını gerektirmektedir. Nöropatik ağrı bozukluklarının araştırılmasında, siyatik sinir bağı, transeksiyon veya kompresyon gibi çeşitli doğrudan periferik sinir hasarı yöntemlerini içeren model organizmalar yaygın olarak kullanılmaktadır21,22. Nöropatik ağrıyı indüklemek için Sprague-Dawley sıçanlarında kronik daralma hasarı (CCI) modeli kullanılmıştır. Bu model, sinir sıkışması sendromları ve periferik nöropatiler gibi durumlarda görülen kompresyon veya sıkışmayı taklit ederek, periferik bir sinirin cerrahi daralması yoluyla insanlarda gözlenen sinir hasarının neden olduğu ağrıyı çoğaltır.
Bu çalışmada, kronik konstriksiyon yaralanması ve nöropatik ağrısı olan sıçanlarda FSN tedavisi ve düşük frekanslı elektroterapinin (transkutanöz elektriksel sinir stimülatörü, TENS) analjezik etkileri değerlendirildi. Anestezi, sinir uyarılarını yavaşlattığından veya bloke ettiğinden ve sinaptik iletimi ve nöronal fonksiyonuetkilediğinden 23, hayvanlar tüm iğneleme prosedürleri ve sallanma hareketleri altında uyuşturulamaz. Bu nedenle, sıçanlarda rahatsızlığı azaltmak için uygun bir iğne tekniği gereklidir. Sıçan CCI modeli oluşturma adımları, sıçanların FSN ile anestezi olmadan kombine sallanma hareketi ile tedavi edilme şekli, uygulanabilir hayvan davranış paterni testleri ve elektrofizyolojik araştırmalar ayrıntılı olarak açıklanmaktadır.
Protokol
Hayvan denekleri içeren tüm prosedürler, Ekim 2022'de Changhua, Tayvan'daki Chang Bing Show Chwan Memorial Hastanesi'nin (111031) Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından onaylandı (Şekil 1).
1. Hayvanların hazırlanması
- 48 erkek Sprague-Dawley (SD) sıçan satın alın (yaş: 8-10 hafta, ağırlık: 250-300 g).
- Ev fareleri, 24 ± 2 ° C'de ve 12 saatlik karanlık ve aydınlık bir döngüde havalandırmalı kafeslerde ayrı ayrı.
- Fareleri, kullanıma hazır steril içme suyu ile standart bir pelet diyetiyle besleyin ve yumuşak yataklar sağlayın.
2. Hayvanların gruplandırılması
- 48 SD sıçanı rastgele altı gruba ayırın (grup başına n = 8): sham grubu, CCI grubu, CCI + FSN grubu, CCI + TENS grubu, FSN tek başına grup ve Chan ve ark.24 tarafından yapılan önceki çalışmada olduğu gibi TENS tek başına grup.
NOT: Altı grubun ayrıntıları: (1) Sahte grup: ameliyat ve tedavi yok; (2) CCI grubu: tedavi olmaksızın ameliyat için hazırlanmış; (3) CCI + FSN tedavi grubu: Başarılı CCI modellemesinden sonra FSN tedavisi; (4) CCI + TENS tedavi grubu: Başarılı CCI modellemesinden sonra TENS tedavisi; (5) Tek başına FSN tedavisi: sadece ameliyatsız FSN tedavisi; (6) Tek başına TENS tedavisi: ameliyatsız sadece TENS tedavisi.
3. CCI sıçan modelinin oluşturulması
NOT: Sıçanlarda CCI cerrahi modeli, 1988'de yapılan Bennett ve Xie'ye göre değiştirildi25.
- Operatörün cerrahi maske, tek kullanımlık ameliyat başlığı ve steril eldiven taktığından emin olun.
- Ameliyat masasının yüzeyini% 70 etanol ile dezenfekte edin. Aletleri (örn. makas, forseps ve ekartörler), gazlı bezleri, zımbaları ve pamuklu çubukları otoklavlayarak sterilize edin.
NOT: Cerrahi prosedür boyunca aseptik teknikler kullanılır. - Standart cilt hazırlığından (tıraş) sonra sıçanları %4 izofluran ile uyuşturun ve %2 izofluran ile koruyun (Şekil 2A).
- Arka pençeyi sıkıştırdıktan ve işlem boyunca anestezi uygulanmış sıçanları izledikten sonra yanıt eksikliğini gözlemleyerek uygun anestezi derinliğini onaylayın.
- Kurumaya karşı koruma için gözlerin üzerine yeterince veteriner oftalmik merhem sürün.
- Fareyi ameliyat masasına yüzüstü pozisyonda yerleştirin ve sağ arka bacağın yan tarafındaki saçları tıraş edin, ardından cildi üç kez povidon-iyot çözeltisi ve% 75 etanol ile dezenfekte edin. Prosedür boyunca termal destek sağlayın ve ameliyat bölgesini örtmek için steril örtüler kullanın.
- Femurun 3-4 mm altındaki deride yaklaşık 20-50 mm'lik paralel bir kesi yapın.
- Gluteus maximus ve biceps femoris'in pozisyonlarının belirlenmesine öncelik verin. Deri altı yağını ve yüzeysel fasyayı cerrahi makas kullanarak katman katman ayırın, kası ortaya çıkarmak için çevredeki bağ dokusunu kesin (Şekil 2B).
NOT: Deri altı yağ ve yüzeysel fasya katmanlarını ayırt etmek için dokuya ve renge dikkat edin. Deri altı yağ tabakası sarımsı veya beyazımsı bir görünümle yumuşak ve esnek görünmelidir. Yüzeysel fasya, deri altı yağın hemen altında yer alan ince lifli bir tabakadır. Deri altı yağının yüzeysel fasyaya kıyasla basınca karşı daha fazla direnç gösterdiğine dikkat ederek, künt bir aletle hafifçe palpe ederek veya sondalayarak katmanlar arasında ayrım yapın.
- Künt makas kullanarak yüzeysel gluteus ve biceps femoris kasları arasındaki bağ dokusunu kesin.
- Siyatik siniri ortaya çıkarmak için bir ekartör kullanarak bu iki kas arasındaki boşluğu genişletin (Şekil 2C).
NOT: Bir sıçanda siyatik siniri görsel olarak tanımlamak için uyluk bölgesine odaklanın. Siyatik siniri görselleştirmek için uyluk bölgesinin orta noktasını bulun. Tipik olarak sinir, kalça bölgesinden başlayıp dize doğru uzanarak uyluğun arka yüzü boyunca uzanır. - Sinir morfolojisini değiştirmeden, siyatik siniri iyi bir ışık kaynağından bir mikroiğne ile seçin. Siyatik siniri 3-0 kromik bağırsak bağları kullanarak iki kez bağlayın ve bağ noktalarını iki sütür arasında yaklaşık 1 mm aralıklarla konumlandırın.
- Her bağ için gevşek bir halka ile başlayarak, bağın uçlarını ilmeğin yakınından kavrayın ve ilmek tam oturana kadar sıkın, bağın sinir boyunca kaymamasını sağlayın. Ligasyon sırasında uzuvda hafif seğirme gözlendiğinde durun (Şekil 2D).
- Siyatik siniri ortaya çıkarmak için bir ekartör kullanarak bu iki kas arasındaki boşluğu genişletin (Şekil 2C).
- Kas ve cildi 4-0 dikiş çizgileri ile katman katman kapatın. Son olarak, yarayı iyotla dezenfekte edin (Şekil 2E).
- Anestezi sırasında sıçanların yaşamsal belirtilerini yakından izleyin ve kafeslerine geri koymadan önce uyanık olana kadar bireysel iyileşme kafeslerine yerleştirin. Bilinçsiz hayvanlarda boğulmayı önlemek için kafesleri düz kağıt yataklarla hizalayın. Ameliyat sonrası ekstremitede kısa bir seğirme, operasyonun başarılı olduğunu gösterir (Şekil 2F).
- CCI'dan önce (başlangıç) birkaç kez ve CCI'dan sonra farklı zaman noktalarında ağrı aşırı duyarlılık testi yapın.
- Model yapımını takip eden 1, 3, 5 ve 7. günlerde spontan ağrı ve davranış değişikliklerini gözlemleyin.
NOT: Sağ arka uzuvun yürüyüşünü ve duruşunu ve uzuvda yalama ve ısırma varlığını gözlemleyin.- Modelin başarılı bir şekilde kurulmasını belirlemek ve başarısız sıçanları dışlamak için nöropatik ağrının varlığını tanımlayın.
NOT: Alt ekstremite yürüyüşünde zayıflık, sağ ekstremitenin ayak parmaklarının hafif valgus ile bir arada tutulması, sık sık sarkma ve yere inme isteksizliği gibi belirtileri gözlemleyerek modelin başarısını değerlendirin. Sağ arka bacak kaldırılırken ve karnına yakınken, sol arka bacak ağırlığı destekleyecek şekilde duran sıçanı gözlemleyin.
- Modelin başarılı bir şekilde kurulmasını belirlemek ve başarısız sıçanları dışlamak için nöropatik ağrının varlığını tanımlayın.
4. FSN manipülasyonunun yönetimi
- FSN tedavi grubunun sıçanını (CCI + FSN ve tek başına FSN grubu dahil), etkilenen uzuv yanal olarak açıkta kalacak şekilde kemirgen kısıtlamasına sabitleyin. Prosedür boyunca termal destek sağlayın. Her iki grup da FSN tek kullanımlık iğnelerle tedavi edildi (Şekil 3A).
- Anestezi olmadan, sıçanın arka bacaklarını sıkıca gerilene kadar kademeli ve yavaşça uzatın (Şekil 3B).
NOT: Sıçan kafası, hayvanı sakin ve sabit tutmak için cerrahi bir örtü ile kaplanmıştır. Sıçanın yaralanmasına neden olmak için bacağınızı aşırı uzatmayın. Herhangi bir sıkıntı veya rahatsızlık belirtisi için farenin tepkisini yakından gözlemleyin. Sıçan ağrı veya rahatsızlık belirtileri gösteriyorsa, uzatmayı durdurun ve tekrar denemeden önce bir mola verin. - FSN iğnesinin koruyucu kılıfını çıkarın.
- FSN iğnesinin ucunu, alt sırt ve arkada bulunan gluteus maximus kasına yaklaşık olarak yakın olan TM'lere (MTrP'li kaslar) doğru sokun.
- FSN iğnesini düz bir şekilde yerleştirin ve cilde yaklaşık 15°'lik bir açıyla girin.
- Tamamen yerleştirilene kadar sıçanda stresi önlemek için deriden ve deri altı boşluğuna dikkatlice ve hızlı bir şekilde itin. Yumuşak tüpü derinin altına tamamen gömmek için iğnenin yeterince yerleştirildiğinden emin olun.
- İleri doğru iterken, cilt çıkıntısının iğne ucu boyunca hareket edip etmediğini gözlemlemek için iğne ucunu hafifçe kaldırın (Şekil 3C).
- İşaret parmağını, orta parmağı ve yüzük parmağını düz bir çizgide hizalı tutarken FSN iğne ucunu dayanak noktası olarak başparmakla yumuşak ve yumuşak bir şekilde havalandırarak sallanma hareketini gerçekleştirin.
- FSN iğnesini orta parmak ve başparmak arasında yüz yüze konumda tutun ve işaret ve yüzük parmaklarını kullanarak hareketi ileri geri değiştirin.
- Frekansı dakikada 100 vuruşa ayarlayın ve işlemi yaklaşık 1 dakika boyunca gerçekleştirin (Şekil 3D).
- Manipülasyonu tamamladıktan sonra, FSN iğnesini hızla geri çekin.
NOT: Operasyon 2 günde bir toplam dört seans (CCI modeli oluşturulduktan sonra 1, 3, 5 ve 7. günler) gerçekleştirildi. Tek kullanımlık FSN iğneleri bir kez kullanılmalıdır. Tekrarlanan kullanım iğneyi köreltecek ve sıçanlarda ağrının artmasına neden olacaktır.
5. TENS manipülasyonunun uygulanması
- TENS tedavi grubunun sıçanını (CCI + TENS ve tek başına TENS grubu dahil), etkilenen uzuv yanal olarak açıkta kalacak şekilde kemirgen kısıtlamasına sabitleyin. Prosedür boyunca termal destek sağlayın. Tedavi edilmeden önce kürkün traş edildiğinden emin olun.
NOT: Elektrotlar 45 mm (uzunluk) x 5 mm (genişlik) olacak şekilde kesilmiştir (Şekil 4A). - TENS için konum olarak Zusanli noktasını (ST36) ve Sanyinjiao noktasını (SP6) seçin. Bu, nöropatik ağrıyı tedavi etme teorisine dayanmaktadır 26,27.
- Tibia ön tüberkülünün yaklaşık 5 mm lateralinde diz28'in hemen altında tibia ve fibula arasındaki Zusanlı noktasını (ST36) bulun.
- Sanyinjiao noktasını (SP6) tibianın arka sınırında, medial malleolus28'in 3 mm proksimalinde bulun.
NOT: Bu iki akupunktur noktasının her ikisi de Stux ve Pomeranz tarafından tarif edildiği gibi ve hayvan akupunktur atlası 28,29'da manuel muayene ile yerleştirilmiştir (Şekil 4B).
- Sinir çevresine bacak üzerine uygulanan elektrot ile TENS cihazını kullanarak 10 dakika boyunca düşük frekanslı bir elektrik stimülasyonu (2 Hz sürekli sinüs dalgası, 3 mA) verin. Sakin ve sabit tutmak için sıçan kafasının başını cerrahi bir örtü ile örtün.
NOT: Bu prosedür toplam dört seans için her 2 günde bir gerçekleştirilir (CCI modeli oluşturulduktan sonra 1, 3, 5 ve 7. günler).
6. Hayvan davranış testini gerçekleştiren fizyolojik ölçümler
NOT: Siyatik fonksiyon indeksi (SFI)30 , sinir yaralanmalarının patolojisini ve potansiyel tedavisini inceleyen araştırmacılar tarafından yaygın olarak kullanılan bir indekstir ve yaralı sıçanlarda etkilenen arka pençenin geometrisinin kontralateral pençeninkiyle karşılaştırılması ve karşı pençe ile karşılaştırılmasıyla belirlenir.
- Yürüyüş sırasında sıçanların ayak izlerini ve vücut oryantasyonunu yakalamak için şeffaf pleksiglas ve eğimli aynalarla sıçan yürüyüş yolları tasarlayın.
NOT: Geçit, 10 cm uzunluğunda, 50 cm genişliğinde ve 15 cm yüksekliğinde, altta beyaz bir kağıt astarı olan bir platformdur (Şekil 5A). - Fareleri nazikçe ve serbestçe kutuya yerleştirin ve kayıttan önce en az 5 dakika boyunca yeni ortamlarına alışmalarına izin verin.
NOT: Postüral kas gerginliği üzerindeki olası etkisini önlemek için hayvan üzerindeki gereksiz stresi en aza indirmek için özel dikkat gösterilir. - Sıçanın pençelerini kırmızı mürekkebe batırın ve sıçanın geçit şeridi boyunca yürümesine izin verin ve arka kağıtta izler bırakın. Her test için en az 2 saniye sürekli yürüme kaydedin. Sıçanın bir yönde en az 3 kez yürümesini sağlayın (Şekil 5B).
NOT: Arka ayak izlerini net bir şekilde görünür hale getirmek için her iki arka ayağa çabuk kuruyan, toksik olmayan, suda çözünür kırmızı mürekkep uygulayın. - Deneyin sonunda, parametreleri ölçmek için geçit şeritlerini kurutun. Ayak izlerini bir cetvelle ölçün ve en yakın 0,5 mm'ye yuvarlayın.
NOT: Her sıçandan üç net ayak izi birkaç ayak izinden seçildi ve üç farklı parametre ölçüldü. SFI faktörleri arasında baskı uzunluğu (PL), burun yayılımı (TS) ve orta burun yayılımı (ITS) bulunur.
SFI değerleri aşağıdaki formül31 kullanılarak hesaplanır: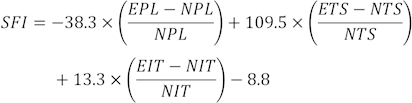
(EPL, deneysel baskı uzunluğu; NPL, normal baskı uzunluğu; ETS, deneysel ayak parmağı yayılımı; NTS, normal ayak parmağı yayılımı; EIT, deneysel orta parmak yayılımı; NIT, orta parmak yayılımı.)
SFI = 0 ve - 100 normal ve tam işlev bozukluğunu gösterir. Ayak parmaklarını sürükleyen sıçanlara keyfi olarak -100 değeri verildi. Normal nörolojik fonksiyon için, SFI 0 civarında salınırken, yaklaşık -100 SFI tam işlev bozukluğunu temsil eder32.
7. Elektrofizyolojik ölçümle nörofizyolojik değerlendirme33
NOT: Bu çalışmada elektrofizyolojik aktiviteyi kaydetmek için elektromiyografi kullanıldı. Bileşik kas aksiyon potansiyeli (CMAP), sinir tarafından sağlanan hedef kasta kas liflerinin aktivasyonundan kaynaklanır. CMAP genliği ve latansı incelenir. CMAP genliği, taban çizgisinden negatif tepe noktasına kadar ölçülür. CMAP'lerin gecikmesi, uyaranın uygulanması ile stimülasyon bölgesi ile kayıt bölgesi arasındaki mesafeden etkilenen bileşik aksiyon potansiyelinin başlangıcı arasındaki sürenin ölçülmesiyle belirlenir. Elektrofizyoloji, sıçanlarda periferik sinir fonksiyonunun objektif bir değerlendirmesini sağlar.
- Sıçanları uyuşturmak için Zoletil 50 (40 mg / kg, ip) uygulayın. Cildi standart protokollere göre hazırlayın (tıraş).
- Tek kullanımlık yapışkan yüzey elektrotlarını (20 mm dış çap) belirlenen alanlara yerleştirin. Kayıt elektrotlarını gastroknemius kasının lateral ve dorsal yüzeylerine sabitleyin (Şekil 6A).
- Sağ proksimal siyatik sinir sapına elektrik stimülasyonu (yoğunluk 1.2 mA) uygulayın. Gastroknemius kasının göbeğinde bir bileşik kas aksiyon potansiyeli (CMAP) kaydedin (Şekil 6B).
NOT: Kas dokusunu önlemek için elektrotları yerleştirirken dikkatli olun. - Her sıçan için tekrarlanan üç ölçümün etkisini kaydedin.
NOT: CMAP, her grubun ortalama ± SD olarak ifade edilir. Sinyal, filtrelenmiş (0.3-3 kHz) bir amplifikatör tarafından yükseltildi. Entegrasyondan sonra (zaman sabiti = 0,05 s), hem orijinal sinyal hem de entegre sinyal girilir. Orijinal sinyal ve entegre sinyal daha sonra PowerLab sisteminde sayısallaştırılır ve bilgisayarın sabit diskinde saklanır. - Elektrofizyoloji prosedürlerini tamamladıktan sonra, sıçanı farklı bir kafese taşıyın ve sternal yaslanmış bir pozisyonu korumak için yeterli bilinci geri kazanana kadar izleyin. Sıçan anesteziden tamamen kurtulduktan sonra, orijinal kafesine geri aktarın.
8. İstatistik:
- Tekrarlanan ölçümler varyans analizi (ANOVA) kullanarak gruplar arasındaki SFI ve CMAP'lerdeki farklılıkları değerlendirin.
- Verileri, deneysel koşullara kör olan asistanlar tarafından ölçün. Verileri ortalama ± standart sapma olarak ifade edin.
- Uygun olduğunda, Student'ın iki kuyruklu eşleştirilmiş ve eşleştirilmemiş t-testini kullanarak verileri karşılaştırın. İstatistiksel anlamlılığı p < 0.05 olarak belirleyin.
Sonuçlar
Ayak izleri ve SFI'nin belirlenmesi
SFI'nin gelişimini tek başına CCI, CCI+FSN ve CCI+TENS gruplarında inceledik (Şekil 7). CCI cerrahisi için 7. günde 4 seans FSN ve TENS tedavisinden sonra, CCI + FSN (-15.85 ± 3.46) ve CCI + TENS (-29.58 ± 9.19) gruplarındaki SFI, tek başına CCI grubuna (-87.40 ± 14.22) kıyasla önemli ölçüde iyileşti. CCI+FSN grubunda CCI+TENS grubuna göre iyileşme anlamlıydı (Şekil 7A).
Tartışmalar
Bu çalışma, sıçan CCI modellerinde FSN tedavisinin nöropatik ağrı üzerindeki etkisini gözlemlemektedir. Bu çalışma, FSN veya TENS tedavisinden sonra terapötik etkileri değerlendirmek için SFI ve elektrofizyolojik testler için bir protokol sunmaktadır. Ek olarak, noninvaziv davranış testleri ve fizyolojik ölçümler kullanılarak yaralanan sinirin fonksiyonel iyileşmesinin nasıl değerlendirileceğini gösterir. Sonuçlar, CCI'ye bağlı siyatik sinir ağrısı sonrası FSN tedavisinin tüm prognost...
Açıklamalar
Yazarlar, birbiriyle rekabet eden herhangi bir çıkar çatışmasının bulunmadığını beyan ederler.
Teşekkürler
Bu çalışma, Changhua, Tayvan'daki Chang Bing Show Chwan Memorial Hastanesi'nin hayvan merkezinden bir hibe ile desteklenmiştir. Yazarlar, bu araştırma projesi boyunca paha biçilmez destek ve yardımları için Show Chwan Memorial Hastanesi IRCAD TAYVAN'a teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Forceps | World Precision Instruments | 14098 | |
| Fu’s subcutaneous needling | Nanjing Paifu Medical Science and Technology Co. | FSN needles are designed for single use. The FSN needle is made up of three parts: a solid steel needle core (bottom), a soft casing pipe (middle), and a protecting sheath (top). | |
| Medelec Synergy electromyography | Oxford Instrument Medical Ltd. | 034W003 | Electromyogram (EMG) are used to help in the diagnosis and management of disorders such as neuropathies. Contains a portable two-channel electromyography/nerve conduction velocity system. |
| Normal saline (0.9%) 20 mL | Taiwan Biotech Co.,Ltd. | 4711916010323 | Lot: 1TKB2022 |
| POLYSORB 4-0 VIOLET 30" CV-25 | UNITED STATES SURGICAL, A DIVISION OF TYCO HEALTHC | GL-181 | |
| Retractor | COOPERSURGICAL, INC.(USA) | 3311-8G | |
| Rompun | Elanco Animal Health Korea Co. Ltd. | 27668 | |
| SCISSORS CVD 90MM | BBRUAN | XG-LBB-BC101R | |
| Transcutaneous Electrical Nerve Stimulation | Well-Life Healthcare Co. | Model Number 2205A | Digital unit which offers TENS. Supplied complete with patient leads, self-adhesive electrodes, 3 AAA batteries and instructions in a soft carry bag. Interval ON time 1–30 s. Interval OFF time 1–30 s. |
| Zoletil | VIRRBAC | 8V8HA |
Referanslar
- van Hecke, O., Austin, S. K., Khan, R. A., Smith, B. H., Torrance, N. Neuropathic pain in the general population: a systematic review of epidemiological studies. Pain. 155 (4), 654-662 (2014).
- Younes, M., et al. Prevalence and risk factors of disk-related sciatica in an urban population in Tunisia. Joint Bone Spine. 73 (5), 538-542 (2006).
- Woolf, C. J., Mannion, R. J. Neuropathic pain: aetiology, symptoms, mechanisms, and management. Lancet. 353 (9168), 1959-1964 (1999).
- Baron, R., et al. Neuropathic low back pain in clinical practice. European Journal of Pain. 20 (6), 861-873 (2016).
- Ma, X., et al. Potential mechanisms of acupuncture for neuropathic pain based on somatosensory system. Frontiers in Neuroscience. 16, 940343 (2022).
- Jang, J. H., et al. Acupuncture alleviates chronic pain and comorbid conditions in a mouse model of neuropathic pain: the involvement of DNA methylation in the prefrontal cortex. Pain. 162 (2), 514-530 (2021).
- He, K., et al. Effects of acupuncture on neuropathic pain induced by spinal cord injury: A systematic review and meta-analysis. Evidence Based Complement and Alternative Medicine. 2022, 6297484 (2022).
- Fu, Z., Lu, D. Fu's Subcutaneous Needling: A Novel Therapeutic Proposal. Acupuncture - Resolving Old Controversies and Pointing New Pathways. IntechOpen. , (2019).
- Fu, Z. H. . The Foundation of Fu's Subcutaneous Needling. , (2016).
- Fu, Z. H., Chou, L. W. . Fu's Subcutaneous Needling, Trigger Point Dry Needling: An Evidence and Clinical-Based Approach. 2nd Edition. , 255-274 (2018).
- Fu, Z., Shepher, R. Fu's Subcutaneous Needling, a Modern Style of Ancient Acupuncture? Acupuncture in Modern Medicine. IntechOpen. , (2013).
- Chiu, P. E., et al. Efficacy of Fu's subcutaneous needling in treating soft tissue pain of knee osteoarthritis: A randomized clinical trial. Journal of Clinical Medicine. 11 (23), 7184 (2022).
- Huang, C. H., Lin, C. Y., Sun, M. F., Fu, Z., Chou, L. W. Efficacy of Fu's Subcutaneous Needling on Myofascial Trigger Points for Lateral Epicondylalgia: A randomized control trial. Evidence Based Complement and Alternative Medicine. 2022, 5951327 (2022).
- Huang, C. H. Rapid improvement in neck disability, mobility, and sleep quality with chronic neck pain treated by Fu's subcutaneous needling: A randomized control study. Pain Research and Management. 2022, 7592873 (2022).
- Chou, L. W., Hsieh, Y. L., Kuan, T. S., Hong, C. Z. Needling therapy for myofascial pain: recommended technique with multiple rapid needle insertion. Biomedicine (Taipei). 4 (2), 13 (2014).
- Ye, L., et al. Depression of mitochondrial function in the rat skeletal muscle model of myofascial pain syndrome is through down-regulation of the AMPK-PGC-1α-SIRT3 axis. Journal of Pain Research. 13, 1747-1756 (2020).
- Li, Y., et al. Effects of Fu's subcutaneous needling on mitochondrial structure and function in rats with sciatica. Molecular Pain. 18, 17448069221108717 (2022).
- Perreault, T., Fernández-de-Las-Peñas, C., Cummings, M., Gendron, B. C. Needling interventions for sciatica: Choosing methods based on neuropathic pain mechanisms-A scoping review. Journal of Clinical Medicine. 10 (10), 2189 (2021).
- Weller, J. L., Comeau, D., Otis, J. A. D. Myofascial pain. Seminars in Neurology. 38 (6), 640-643 (2018).
- Grøvle, L., et al. The bothersomeness of sciatica: patients' self-report of paresthesia, weakness and leg pain. European Spine Journal. 19 (2), 263-269 (2010).
- Jaggi, A. S., Jain, V., Singh, N. Animal models of neuropathic pain. Fundament Clinical Pharmacology. 25 (1), 1-28 (2011).
- Burma, N. E., Leduc-Pessah, H., Fan, C. Y., Trang, T. Animal models of chronic pain: Advances and challenges for clinical translation. Journal of Neuroscience Research. 95 (6), 1242-1256 (2017).
- McCann, M. E., Soriano, S. G. Does general anesthesia affect neurodevelopment in infants and children. British Medical Journal. 367, 6459 (2019).
- Chan, K. Y., et al. Ameliorative potential of hot compress on sciatic nerve pain in chronic constriction injury-induced rat model. Frontiers in Synaptic Neuroscience. 14, 859278 (2022).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. 33 (1), 87-107 (1988).
- Somers, D. L., Clemente, F. R. Transcutaneous electrical nerve stimulation for the management of neuropathic pain: The effects of frequency and electrode position on prevention of allodynia in a rat model of complex regional pain syndrome type II. Physical Therapy. 86 (5), 698-709 (2006).
- Xing, G., Liu, F., Wan, Y., Yao, L., Han, J. Electroacupuncture of 2 Hz induces long-term depression of synaptic transmission in the spinal dorsal horn in rats with neuropathic pain. Beijing Da Xue Xue Bao Yi Xue Ban. 35 (5), 453-457 (2003).
- Schone, A. M. . Veterinary Acupuncture: Ancient Art to Modern Medicine. , (1999).
- Stux, G., Pomeranz, B. . Acupuncture: Textbook and Atlas. , (1987).
- de Medinaceli, L., Freed, W. J., Wyatt, R. J. An index of the functional condition of rat sciatic nerve based on measurements made from walking tracks. Experimental Neurology. 77 (3), 634-643 (1982).
- Bain, J. R., Mackinnon, S. E., Hunter, D. A. Functional evaluation of complete sciatic, peroneal, and posterior tibial nerve lesions in the rat. Plastic and Reconstructive Surgery. 83 (1), 129-138 (1989).
- Kanaya, F., Firrell, J. C., Breidenbach, W. C. Sciatic function index, nerve conduction tests, muscle contraction, and axon morphometry as indicators of regeneration. Plastic and Reconstructive Surgery. 98 (7), 1264-1271 (1996).
- Wild, B. M., et al. In vivo electrophysiological measurement of the rat ulnar nerve with axonal excitability testing. Journal of Visualized Experiments: JoVE. (132), e56102 (2018).
- Wong, J. Y., Rapson, L. M. Acupuncture in the management of pain of musculoskeletal and neurologic origin. Physical Medicine and Rehabilitation Clinics of North America. 10 (3), 531-545 (1999).
- Qin, Z., Liu, X., Yao, Q., Zhai, Y., Liu, Z. Acupuncture for treating sciatica: A systematic review protocol. BMJ Open. 5 (4), 007498 (2015).
- Zhi, M. J., et al. Application of the chronic constriction injury of the partial sciatic nerve model to assess acupuncture analgesia. Journal of Pain Research. 10, 2271-2280 (2017).
- Fu, Z. H., Xu, J. G. A brief introduction to Fu's subcutaneous needling. Pain Clinic. 17, 343-348 (2005).
- Peng, J., et al. The effect of Fu's subcutaneous needling combined with reperfusion approach on surface electromyography signals in patients with cervical spondylosis and neck pain: A clinical trial protocol. Biomed Research International. 2022, 1761434 (2022).
- Fu, Z. H., Wang, J. H., Sun, J. H., Chen, X. Y., Xu, J. G. Fu's subcutaneous needling: possible clinical evidence of the subcutaneous connective tissue in acupuncture. Journal Alternative and Complementary Medicine. 13 (1), 47-51 (2007).
- Harrison, T. M., Churgin, S. M. Acupuncture and traditional Chinese veterinary medicine in zoological and exotic animal medicine: A review and introduction of methods. Veterinary Science. 9 (2), 74 (2022).
- Gollub, R. L., Hui, K. K., Stefano, G. B. Acupuncture: pain management coupled to immune stimulation. Zhongguo Yao Li Xue Bao. 20 (9), 769-777 (1999).
- Simons, D. G., Travell, J., Simons, L. E. . Myofascial Pain and Dysfunction: The Trigger Point Manual. 2nd ed. , (1999).
- Gerwin, R. D., Dommerholt, J., Shah, J. P. An expansion of Simons' integrated hypothesis of trigger point formation. Current Pain and Headache Reports. 8 (6), 468-475 (2004).
- Hong, C. Z., Simons, D. G. Pathophysiologic and electrophysiologic mechanisms of myofascial trigger points. Archives of Physical Medicine and Rehabilitation. 79 (7), 863-872 (1998).
- Fu, Z., et al. Remote subcutaneous needling to suppress the irritability of myofascial trigger spots: an experimental study in rabbits. Evidence Based Complement and Alternative Medicine. 2012, 353916 (2012).
- Hsieh, Y. L., Yang, C. C., Liu, S. Y., Chou, L. W., Hong, C. Z. Remote dose-dependent effects of dry needling at distant myofascial trigger spots of rabbit skeletal muscles on reduction of substance P levels of proximal muscle and spinal cords. Biomed Research International. 2014, 982121 (2014).
- Ma, K., et al. Peripheral nerve adjustment for postherpetic neuralgia: a randomized, controlled clinical study. Pain Medicine. 14 (12), 1944-1953 (2013).
- Gao, Y., Sun, J., Fu, Z., Chiu, P. E., Chou, L. W. Treatment of postsurgical trigeminal neuralgia with Fu's subcutaneous needling therapy resulted in prompt complete relief: Two case reports. Medicine. 102 (9), e33126 (2023).
- Lucas, L. R., Wang, C. J., McCall, T. J., McEwen, B. S. Effects of immobilization stress on neurochemical markers in the motivational system of the male rat. Brain Research. 1155, 108-115 (2007).
- Yang, C. H., et al. Effect of electroacupuncture on response to immobilization stress. Pharmacology, Biochemistry, and Behavior. 72 (4), 847-855 (2002).
- Adams, S., Pacharinsak, C. Mouse anesthesia and analgesia. Current Protocols in Mouse Biology. 5 (1), 51-63 (2015).
- Cantwell, S. L. Traditional Chinese veterinary medicine: the mechanism and management of acupuncture for chronic pain. Topics in Companion Animal Medicine. 25 (1), 53-58 (2010).
- Liebano, R. E., Rakel, B., Vance, C. G. T., Walsh, D. M., Sluka, K. A. An investigation of the development of analgesic tolerance to TENS in humans. Pain. 152 (2), 335-342 (2011).
- Khalil, Z., Merhi, M. Effects of aging on neurogenic vasodilator responses evoked by transcutaneous electrical nerve stimulation: relevance to wound healing. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 55 (6), B257-B263 (2000).
- Sato, K. L., Sanada, L. S., Silva, M. D. D., Okubo, R., Sluka, K. A. Transcutaneous electrical nerve stimulation, acupuncture, and spinal cord stimulation on neuropathic, inflammatory and, non-inflammatory pain in rat models. The Korean Journal of Pain. 33 (2), 121-130 (2020).
- Maeda, Y., Lisi, T. L., Vance, C. G., Sluka, K. A. Release of GABA and activation of GABA(A) in the spinal cord mediates the effects of TENS in rats. Brain Research. 1136 (1), 43-50 (2007).
- Degrugillier, L., et al. A new model of chronic peripheral nerve compression for basic research and pharmaceutical drug testing. Regenerative Medicine. 16 (10), 931-947 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır