A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
فحص وحدة تشكيل المستعمرات الدقيقة لتقييم فعالية اللقاحات ضد السل
In This Article
Summary
تحديد وحدات تشكيل المستعمرات (CFU) هو الأسلوب القياسي الذهبي لقياس البكتيريا ، بما في ذلك المتفطرة السلية التي قد تستغرق أسابيع لتشكيل مستعمرات مرئية. هنا نصف وحدة CFU الصغيرة لتحديد CFU مع زيادة كفاءة الوقت ، وتقليل مساحة المختبر وتكلفة الكاشف ، وقابلية التوسع في تجارب الإنتاجية المتوسطة والعالية.
Abstract
قتل السل (TB) ، وهو السبب الرئيسي للوفاة في جميع أنحاء العالم بسبب عامل معدي ، 1.6 مليون شخص في عام 2022 ، ولم يتجاوزه سوى COVID-19 خلال جائحة 2019-2021. هذا المرض ناجم عن بكتيريا المتفطرة السلية (M.tb). سلالة المتفطرة البوفية Bacillus Calmette-Guérin (BCG) ، لقاح السل الوحيد ، هي أقدم لقاح مرخص في العالم ، ولا يزال قيد الاستخدام. حاليا ، هناك 12 لقاحا في التجارب السريرية وعشرات اللقاحات قيد التطوير قبل السريري. الطريقة المفضلة المستخدمة لتقييم فعالية لقاحات السل في الدراسات قبل السريرية هي تعداد المستعمرات البكتيرية بواسطة فحص وحدات تكوين المستعمرات (CFU). يستغرق هذا الفحص الذي يستغرق وقتا طويلا من 4 إلى 6 أسابيع حتى ينتهي ، ويتطلب مساحة كبيرة للمختبر والحاضنة ، وله تكاليف كاشف عالية ، وعرضة للتلوث. نصف هنا طريقة محسنة لتعداد المستعمرات ، وهي micro-CFU (mCFU) ، والتي تقدم حلا بسيطا وسريعا لتحليل نتائج فعالية لقاح السل . يتطلب اختبار mCFU كواشف أقل بعشرة أضعاف ، ويقلل من فترة الحضانة ثلاثة أضعاف ، ويستغرق من 1 إلى 2 أسابيع للانتهاء ، ويقلل من مساحة المختبر وتكلفة الكاشف ، ويقلل من مخاطر الصحة والسلامة المرتبطة بالعمل مع أعداد كبيرة من M.tb. علاوة على ذلك ، لتقييم فعالية لقاح السل ، يمكن الحصول على عينات من مجموعة متنوعة من المصادر ، بما في ذلك الأنسجة من الملقحة المصابة بالمتفطرات. كما وصفنا طريقة محسنة لإنتاج ثقافة متفطرات أحادية الخلية وموحدة وعالية الجودة لدراسات العدوى. وأخيرا، نقترح اعتماد هذه الأساليب عالميا في الدراسات قبل السريرية لتحديد فعالية اللقاح، مما يؤدي في نهاية المطاف إلى تقليل الوقت في تطوير لقاحات ضد السل.
Introduction
السل (TB) هو السبب الرئيسي للوفاة في جميع أنحاء العالم من قبل عامل معدي واحد ، بكتيريا المتفطرة السلية (M.tb) ، مما يؤدي إلى مقتل عدد أكبر من الناس أكثر من أي ممرض آخر. في عام 2021 ، كان السل مسؤولا عن 1.6 مليون حالة وفاة وتجاوزه COVID-19 خلال جائحة 2019-20211. علاوة على ذلك ، وفقا لتقرير السل العالمي الصادر عن منظمة الصحة العالمية لعام 2022 ، كانت جائحة COVID-19 مسؤولة عن زيادة حالات السل الجديدة. كما أبلغت منظمة الصحة العالمية عن انخفاض كبير في عدد الأشخاص الذين تم تشخيص إصابتهم بالسل خلال هذه الفترة ، مما قد يزيد من عدد حالات السل1.
Bacillus Calmette-Guérin (BCG) هي سلالة حية موهنة من المتفطرة البوفية المسببة للأمراض ، والتي استخدمت لأول مرة كلقاح منذ أكثر من 100 عام. هذا هو اللقاح الوحيد ضد السل وهو أقدم لقاح مرخص في العالم لا يزال قيد الاستخدام 2,3. حاليا ، هناك 12 لقاحا في مراحل مختلفة من التجارب السريرية4 ، وعشرات اللقاحات قيد التطوير قبل السريري 5,6. يشمل التقييم قبل السريري للقاحات ضد السل تقييم السلامة والمناعة7 ، والتي يمكن الحصول عليها في نماذج حيوانية متنوعة مثل الزرد والفئران وخنازير غينيا والأرانب والماشية والرئيسيات غير البشرية8،9،10. بالإضافة إلى ذلك ، يتطلب تقييم قدرة اللقاح على تحفيز الحماية من عدوى السل المتعدد الأطراف و / أو انتقاله ، أي فعالية اللقاح ، تحدي السل متعدد السل في الجسم الحي 5,11. ومن المثير للاهتمام ، أن تطعيم BCG يحفز تأثيرات غير محددة تؤثر على بقاء مسببات الأمراض البكتيرية والفيروسية الأخرى12,13 من خلال آلية المناعة المدربة14. لتحديد العبء البكتيري القابل للحياة في مصاب ، فإن الطريقة المفضلة هي تعداد المستعمرات البكتيرية من خلال فحص وحدات تكوين المستعمرات (CFU) 5,15. CFU هي وحدة تقدر عدد الكائنات الحية الدقيقة (البكتيريا أو الفطريات) التي تشكل مستعمرات في ظل ظروف نمو محددة. تنشأ وحدات CFU من الكائنات الحية الدقيقة القابلة للحياة والقابلة للتكرار ، ويصعب تقدير العدد المطلق للكائنات الحية الدقيقة داخل كل مستعمرة. من غير المؤكد ما إذا كانت المستعمرة قد نشأت من واحد أو أكثر من الكائنات الحية الدقيقة. تعكس وحدة CFU عدم اليقين هذا ، وبالتالي يمكن ملاحظة تباين كبير في النسخ المتماثلة لنفس العينة. يتطلب هذا الفحص الذي يستغرق وقتا طويلا فنيين متخصصين مدربين للعمل في مرفق من مستوى السلامة الأحيائية 3 (BSL3) ، ومساحة كبيرة للمختبر والحاضنة ، ويستغرق من 4 إلى 6 أسابيع للانتهاء ، وهو عرضة للتلوث.
في هذه الدراسة ، وصفنا طريقة محسنة لتعداد المستعمرات ، micro-CFU (mCFU) ، ونقدم حلا بسيطا وسريعا لتحليل النتائج15،16،17،18،19،20. يتطلب اختبار mCFU كواشف أقل بعشرة أضعاف ، ويقلل من فترة الحضانة ثلاثة أضعاف ، ويستغرق من 1 إلى 2 أسابيع للانتهاء ، ويقلل من مساحة المختبر وتكلفة الكاشف ، ويقلل من مخاطر الصحة والسلامة المرتبطة بالعمل مع أعداد كبيرة من M.tb. نقترح اعتماد هذه الطريقة عالميا للدراسات قبل السريرية لتحديد فعالية اللقاح ، مما يؤدي في النهاية إلى تقليل الوقت في تطوير لقاحات ضد السل. أخيرا ، تم استخدام هذه الطريقة المثلى لتعداد CFU لتحديد ليس فقط المتفطرات ولكن أيضا البكتيريا الأخرى ، مثل الإشريكية القولونية ورالستونيا سولاناسيروم21.
Access restricted. Please log in or start a trial to view this content.
Protocol
ملاحظة: البروتوكول الموضح هنا خاص ب BCG ولكن يمكن تطبيقه على أي متفطرات. يمكن استخدام BCG كبكتيريا بديلة لتجارب السل عندما لا تتوفر مرافق BSL322. يجب تنفيذ الإجراءات التالية باستخدام BCG في مختبر مستوى السلامة البيولوجية 2 (BSL2) واتباع إرشادات السلامة البيولوجية المناسبة والممارسات المختبرية الجيدة لمعالجة الكائنات الحية الدقيقة من المجموعة الخطرة 2.
1. إعداد الإعلام الثقافي
- قم بإعداد مرق Middlebrook 7H9 المكمل بتخصيب 10٪ (v / v) من حمض الأوليك والألبومين وسكر العنب والكاتلاز (OADC) ، وفقا لتعليمات المورد. تكملة المرق مع 0.05 ٪ (v / v) من tyloxapol.
ملاحظة: Tyloxapol هو بوليمر سائل غير أيوني تم استخدامه كخافض للتوتر السطحي لمنع تكوين التكتل البكتيري16. - قم بإعداد وسط Middlebrook 7H10 الصلب المكمل بتخصيب OADC بنسبة 10٪ (v / v) وفقا لتعليمات المورد.
- توزيع 40 مل من المتوسط لكل طبق بتري مربع (120 مم × 120 مم). اترك الألواح تجف لتقليل التكثيف على سطح الأجار.
ملاحظة: هذا الحجم المحدد لطبق بتري أساسي للسماح بالنقل المباشر لما لا يقل عن 96 قطرة من لوحة 96 بئرا. سيسهل التجفيف الفعال للألواح لاحقا طلاء قطرات صغيرة من التعليق البكتيري ويمنع انتشار القطرات. - قم بإعداد إما وسيط معهد روزويل بارك التذكاري (RPMI 1640) أو وسيط النسر المعدل من Dulbecco (DMEM) لإنتاج وسط العدوى. في كلتا الحالتين ، استكمل الوسط بمصل عجل الجنين 10٪ ، و 1٪ L-glutamine ، و 1 mM بيروفات الصوديوم. لا تضيف البنسلين والستربتومايسين إلى الوسط.
2. إعداد عينة
- الحصول على عينات من مجموعة متنوعة من المصادر. عادة ، لتحديد CFU لتقييم فعالية لقاح السل ، والحصول على عينات من الأنسجة الحيوانية الملقحة وغير المحصنة. على سبيل المثال ، رئة الفأر والطحال11 أو رئة المكاك والغدد الليمفاوية الصدرية والمحيطية والطحال والكبد والجلد والدم ونخاع العظام وغسل القصباتالهوائية 23. بدلا من ذلك ، احصل على عينات من الثقافات المختبرية للبلاعم / الخلايا المتغصنة / العدلات المصابة ب BCG18،19،20،24،25،26.
3. إنتاج ثقافة BCG
ملاحظة: بالنسبة للدراسات في الجسم الحي للقاحات السل ، فإن الهدف هو تحسين فعالية BCG. لذلك ، عادة ما تستخدم المجموعات الملقحة ضد BCG كعنصر تحكم. تعتبر سلالات BCG المستخدمة للتطعيم البشري مثالية للاختبار في النماذج الحيوانية. في هذه الحالة ، يجب إعادة تشكيل ثقافة BCG وفقا لتعليمات المورد27. ومع ذلك ، يمكن أيضا إنتاج ثقافة BCG للدراسات في الجسم الحي داخليا11. تم إنتاج زراعة BCG أحادية الخلية وموحدة وعالية الجودة لبروتوكولات العدوى في المختبر بنجاح كبير في العديد من الدراسات11،16،18،19،20،26،28،29 ، باستخدام البروتوكول التالي ، والذي يمكن استخدامه أيضا لدراسات التحدي الحيواني.
- استزرع 50 مل من BCG في مرق 7H9 ، عند 37 درجة مئوية ، مع التحريك عند 200 دورة في الدقيقة. قم بتغيير الحجم وفقا لاحتياجات التجربة.
- كل يوم ، لمدة 8-10 أيام ، اجمع 100 ميكرولتر من الثقافة وقم بتخفيفها بإضافة 900 ميكرولتر من PBS في كفيت سعة 1 مل. ثم تابع بقياس الكثافة البصرية للبكتيريا (OD عند λ = 600 نانومتر ؛ OD600) في مقياس الطيف الضوئي. ارسم منحنى نمو من تلك القيم. حدد مرحلة منتصف السجل للثقافة (عندما يتضاعف التطوير التنظيمي باستمرار لكل وحدة زمنية).
- قم بإعداد مزرعة لاحقة واحتضانها حتى الوصول إلى مرحلة نمو السجل المتوسط / المتأخر كما في الخطوتين 3.1 و 3.2. استخدم القيم التي تم الحصول عليها في الخطوة السابقة كإرشاد. تأكد من أن المزرعة لا تصل إلى مرحلة النمو الثابت (عندما يبدأ OD في الاستقرار) للحفاظ على ثقافة ذات نوعية جيدة من البكتيريا القابلة للحياة.
- اجمع الثقافة في مرحلة نمو السجل المتوسطة / المتأخرة. أجهزة الطرد المركزي في 3000 × ز لمدة 10 دقائق. إزالة الطاف.
- أضف 10 مل من برنامج تلفزيوني لغسل البكتيريا. أجهزة الطرد المركزي في 3000 × ز لمدة 10 دقائق. إزالة الطاف.
- أعد تعليق البكتيريا ب 5 مل من وسائط العدوى. ضع الأنبوب في حمام الموجات فوق الصوتية لمدة 15 دقيقة ، بكامل طاقته عند 80 هرتز.
- أجهزة الطرد المركزي في 1000 × ز لمدة 10 دقائق. اجمع المادة الطافية مع تجنب الحبيبات لأنها غنية بالكتل البكتيرية التي يجب تجنبها في ثقافة BCG عالية الجودة وتخلص منها.
- قياس OD من طاف. هنا ، الثقافات في مرحلة النمو الأسي ، معOD 600 من 0.1 ، تعادل 1 × 107 CFU / mL.
ملاحظة: يجب على كل مختبر إنتاج منحنيات نمو BCG الخاصة به قبل بدء التجارب لإنشاء انحدار خطي بين OD600 و CFU باستخدام مقياس الطيف الضوئي. يرجى ملاحظة أن مقاييس الطيف الضوئي لها مسافات مسار ضوئية مختلفة ، والتي يمكن أن تختلف القراءات التي تم الحصول عليها لنفس العينة. - قم بإجراء حسابات بسيطة لتحديد عدد البكتيريا المراد إضافتها إلى كل مزرعة خلية مضيفة. عدد البكتيريا لكل خلية مضيفة هو تعدد العدوى (MOI). استخدم MOI من 10 بكتيريا لكل خلية مضيفة ، وهو MOI الأكثر شيوعا المستخدم في تجارب عدوى BCG.
4. فحص وحدة تشكيل المستعمرة الدقيقة
ملاحظة: بعد الانتهاء من تجربة العدوى في الجسم الحي أو في المختبر ، يمكن إجراء تعداد البكتيريا بواسطة mCFU. بالنسبة للدراسات في الجسم الحي ، يجب أولا تجانس العينات في مضرب حبة أو خالط آخر للأنسجة. بالنسبة للمزارع المختبرية للبلاعم / الخلايا المتغصنة / العدلات المصابة ب BCG ، يجب تحليل العينات باستخدام منظف غير أيوني (على سبيل المثال ، محلول 0.05٪ من منظف غير أيوني وغير مسخ).
- التخفيفات التسلسلية باستخدام صفيحة 96 بئرا: قم بإجراء تخفيفات تسلسلية 10 أضعاف من الليزات ، في لوحة معقمة ذات 96 بئرا وفقا للمخطط في الشكل 1 أ. وزع المحللات على الصفين A و E. لكل لوحة ، الحد الأقصى لعدد العينات و / أو النسخ المتماثلة هو 24.
- أضف 180 ميكرولتر من dH2O إلى الآبار المتبقية لإجراء التخفيف التسلسلي.
- باستخدام ماصة ذات 12 قناة ، أعد تعليق المحللين في الصف A وانقل 20 ميكرولتر إلى الصف B (20 ميكرولتر محللة + 180 ميكرولتر dH2O). تجانس جيدا. كرر هذه الخطوة بالتتابع للصفين B و C حتى تصل إلى التخفيف الأخير في الصف D.
ملاحظة: نقوم عادة بإجراء ثلاثة تخفيفات (100 ، 101 ، 102 ، 103) ، وبالتالي نستخدم 4 صفوف من اللوحة (A-D أو E-H) لكل مجموعة من 12 عينة و / أو مكررة. - طلاء القطيرات الدقيقة: استخدم ماصة متعددة القنوات 0.5-10 ميكرولتر (يفضل أطراف رفيعة) لنقل 5 ميكرولتر من كل صف من لوحة 96 بئرا إلى اللوحة المربعة المتوسطة الصلبة ، وفقا للشكل 1 ب.
- أثناء سحب قطرات 5 ميكرولتر ببطء ، اسمح لها بلمس الأجار قليلا. سيساعد ذلك على خلع القطرة من الحافة باتجاه الآجار وتقليل إمكانية الاحتفاظ بالسائل داخل الحافة.
- اترك القطرات تجف ، وأغلق صفيحة الآجار ، واحتضنها عند 37 درجة مئوية أثناء مراقبة نمو البكتيريا. اختياريا ، احتضان ألواح أجار في كيس بلاستيكي مغلق لمنع الألواح من الجفاف.
- عد المستعمرات الدقيقة: بعد حوالي 6-10 أيام من الحضانة ، تحقق من وجود مستعمرات فردية مرئية للعين المجردة (الشكل 2).
- عد المستعمرات باستخدام أقل هدف تكبير (4x أو أقل) للمجهر البصري المقلوب أو العدسة المكبرة. يجب إجراء العد في التخفيفات حيث يكون عدد المستعمرات أقل من 300 وأعلى من 30. بدلا من ذلك ، استخدم كاميرا لالتقاط صورة للقطرات لحساب المستعمرات يدويا على الكمبيوتر أو استخدم برنامجا مثل ImageJ لأتمتة عد المستعمرات.
- للتعبير عن أرقام الخلايا في CFU / mL ، استخدم المعادلة التالية:
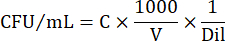
حيث C = عدد المستعمرات التي تم حسابها ، V = الحجم مطلي بالميكرولتر ، و Dil = التخفيف حيث تم حساب المستعمرات (100 ، 101 ، 102 ، 103). على سبيل المثال ، إذا تم حساب 30 مستعمرة في قطرة 5 ميكرولتر في التخفيف 102 ، فعندئذ: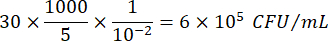
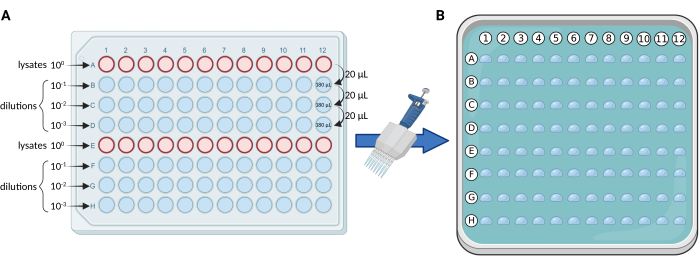
الشكل 1. تمثيل تخطيطي لبروتوكول mCFU. (أ) التخفيفات المتسلسلة بمقدار 10 أضعاف للمحللات المحتوية على BCG في صفيحة 96 بئرا. (ب) طبق بتري مربع يحتوي على وسط استزراع صلب ومغطى ب 96 قطرة كل منها 5 ميكرولتر. يتم سحب القطرات مباشرة من لوحة 96 بئرا باستخدام ماصة متعددة القنوات. تم إنشاؤها باستخدام BioRender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
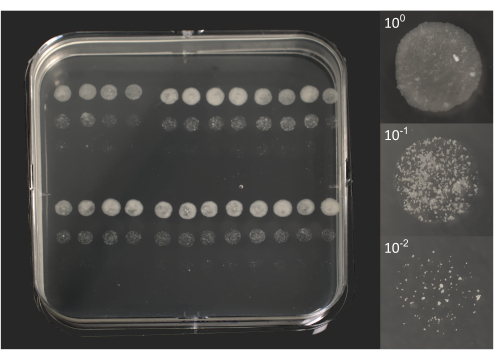
الشكل 2. وحدات تشكيل مستعمرة صغيرة من BCG بعد 10 أيام من الحضانة. على اليسار ، صورة لطبق بتري مربع مغطى ب 96 قطرة كل منها 5 ميكرولتر ، كما هو موضح سابقا في الشكل 1ب. على اليمين ، تتوافق الصور الفردية المكونة من 3 قطرات مع محللة أصلية (100) وتخفيفين (101 ، 102). تم التقاط الصور باستخدام كاميرا DSRL مزودة بعدسة تكبير 18-55 مم (لوحة) أو عدسة ماكرو 105 مم (قطرات). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. عد وحدات تشكيل المستعمرات الصغيرة في فيجي (ImageJ)
ملاحظة: تسمح طريقة mCFU بتحديد كمية CFU لمجموعات كبيرة من العينات. يمكن تسجيل صور القطرات للتحليل الخلفي لتسهيل عد المستعمرات. يمكن للعديد من أجهزة التصوير الفوتوغرافي إنتاج صور بجودة كافية لهذا الغرض. وتشمل هذه الكاميرات الرقمية وكاميرات الويب والمجاهر المرفقة بالكاميرا والنظارات المكبرة والهواتف المحمولة. يوفر برنامج تحليل الصور المجاني مثل ImageJ إمكانية عد المستعمرات يدويا أو آليا في تلك الصور. لإثبات كلتا الطريقتين ، سيتم استخدام فيجي ، وهو توزيع ل ImageJ الذي يحزم عدة أدوات لتحليل الصور العلمية30. يمكن تنزيل فيجي من https://fiji.sc/.
- طريقة العد اليدوي
- افتح الصورة التي تحتوي على mCFU في فيجي. حدد المكونات الإضافية > تحليل عداد الخلايا >.
- من القائمة عداد الخلايا، حدد تهيئة ثم حدد عداد (على سبيل المثال، النوع 1).
- تابع بالنقر فوق كل مستعمرة. سيتم عرض كل نقرة على الصورة وسيتم تحديث العداد (الشكل 3). للتراجع عن النقرات غير المقصودة، اختر حذف.
- سجل القيمة المعروضة على العداد. انقر فوق الزر "إعادة تعيين " لإعادة تعيين العدد وفتح صورة جديدة لحساب عينات إضافية.
ملاحظة: يمكن العثور على مزيد من التعليمات حول هذا المكون الإضافي على https://imagej.net/plugins/cell-counter.
- طريقة العد الآلي
- افتح الصورة التي تحتوي على mCFU في فيجي. حدد نوع > الصورة > 8 بت. سيؤدي هذا إلى تحويل الصورة إلى صورة ذات مقياس رمادي 8 بت.
- حدد الأداة البيضاوية في شريط الأدوات وارسم بيضاويا حول المنطقة مع المستعمرات (الشكل 4 أ). يمكن تعديل الشكل البيضاوي بعد رسمه.
- حدد تحرير > مسح من الخارج ، لإزالة أي تداخل من المنطقة الخارجية (الشكل 4B). حدد > الصورة ضبط > الحد.
- حرك أشرطة التمرير في قائمة العتبة حتى تظهر المستعمرات باللون الأحمر ويتم تقليل ضوضاء الخلفية (الشكل 4C).
- حدد تطبيق واخرج من نافذة العتبة. يتم إنشاء صورة بالأبيض والأسود (الشكل 4D).
- حدد تحليل > تحليل الجسيمات. في نافذة تحليل الجسيمات ، حدد نطاق مساحة المستعمرة (بين 1 واللانهاية ، مقاسة بالبكسل التربيعي) والدائرية (بين 0 و 1 ، حيث 1 هي دائرة مثالية ؛ الشكل 4E).
- حدد الخطوط العريضة في القائمة المنبثقة إظهار. تحقق من عرض النتائج للحصول على قياسات مفصلة لكل مستعمرة في نافذة النتائج. تحقق من مسح النتائج لمسح أي قياسات سابقة. حدد مربع التلخيص لعرض النتائج الملخصة للقياسات (الشكل 4E).
- ابدأ المحلل عن طريق تحديد موافق. تظهر نافذة جديدة تعرض جميع المستعمرات المحددة التي تم اكتشافها وعدها. تعرض نافذة النتائج تفاصيل كل مستعمرة ، وتعرض نافذة النتائج الملخصة إجمالي المستعمرات التي تم حسابها (الشكل 4F).
ملاحظة: ستختلف إعدادات الحجم والدوران باختلاف دقة الصورة وتكبيرها وحجم المستعمرات وشكلها. كرر العملية عدة مرات حتى يتم العثور على أفضل الإعدادات التي تكتشف جميع المستعمرات. يمكن العثور على مزيد من التعليمات حول المكون الإضافي لتحليل الجسيمات على https://imagej.nih.gov/ij/docs/menus/analyze.html#ap.
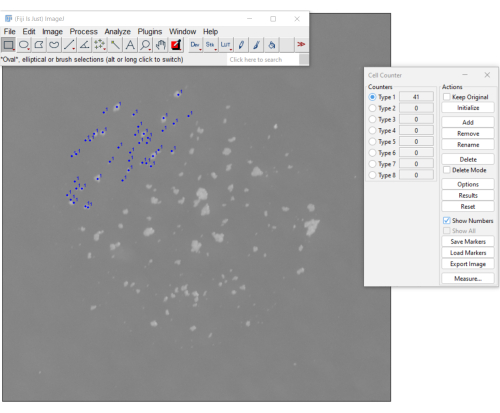
الشكل 3. طريقة يدوية لحساب mCFU باستخدام المكون الإضافي لعداد الخلايا على برنامج فيجي. تشير النقاط الزرقاء إلى المستعمرات التي نقر عليها المستخدم بالفعل. تعرض القائمة الموجودة على اليمين عدد المستعمرات التي تم حسابها حتى الآن (العدد هو 41). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4. طريقة آلية لحساب mCFU باستخدام برنامج فيجي. (أ، ب) يتم تحديد المنطقة ذات الأهمية مع المستعمرات باستخدام أداة التحديد البيضاوي ، ويتم إزالة المنطقة الخارجية باستخدام الأمر الخارجي الواضح. (ج، د) يتم إنشاء صورة بالأبيض والأسود للمستعمرات باستخدام أداة العتبة. (ه، واو) يتم تحديد عدد المستعمرات باستخدام أداة تحليل الجسيمات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
النتائج
يزيد اختبار mCFU الموصوف هنا من كمية المعلومات التي يمكن استرجاعها من طبق بتري واحد إلى 96 ضعفا على الأقل. يصور الشكل 5 مقارنة بين طريقتين لتوصيل الدواء للاستخدام المعاد استخدامه لساكوينافير (SQV)31,32 كدواء موجه للمضيف لعلاج السل. في هذا الفحص ، تم...
Access restricted. Please log in or start a trial to view this content.
Discussion
السل مشكلة صحية عمومية هامة تزداد أهميتها، ولا سيما في البلدان المنخفضة والمتوسطة الدخل. تسبب تعطل أماكن الرعاية الصحية لتشخيص السل وعلاجه أثناء جائحة كوفيد-19 في تأثير سلبي على حدوث الحالات الجديدة1. وبالإضافة إلى ذلك، يجب التصدي على وجه الاستعجال لسلالات السل المتعددة ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
تعلن DP و PJGB أن الدراسة أجريت في غياب أي علاقات تجارية أو مالية يمكن تفسيرها على أنها تضارب محتمل في المصالح.
Acknowledgements
تم دعم هذا العمل بتمويل داخلي من كلية الطب ، الجامعة الكاثوليكية البرتغالية ، وتمويل خارجي من Fundação para a Ciência e a Tecnologia (FCT) ، في إطار المنح UIDP / 04279/2020 و UIDB / 04279/2020 و EXPL / SAU-INF / 0742/2021.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 96-well plates | VWR | 734-2781 | |
| DSLR 15-55 mm lens | Nikon | AF-P DX NIKKOR 18-55mm f/3.5-5.6G VR | |
| DSLR camera | Nikon | D3400 | |
| DSLR macro lens | Sigma | MACRO 105mm F2.8 EX DG OS HSM | |
| Fetal calf serum | Gibco | 10270106 | |
| Fiji Software | https://fiji.sc/ | Fiji is an open-source software supported by several laboratories, institutions, and individuals. All the required plugins are included. | |
| Igepal CA-630 | Sigma-Aldrich | 18896 | |
| L-glutamine | Gibco | 25030-081 | |
| Middlebrook 7H10 | BD | 262710 | |
| Middlebrook 7H9 | BD | 271310 | |
| Multichannel pipette (0.5 - 10 µl) | Gilson | FA10013 | |
| Multichannel pipette (20 - 200 µl) | Gilson | FA10011 | |
| Mycobacterium bovis BCG | American Type Culture Collection | ATCC35734 | strain TMC 1011 [BCG Pasteur] |
| OADC enrichment | BD | 211886 | |
| Phosphate buffered saline (PBS) | NZYTech | MB25201 | |
| RPMI 1640 medium | Gibco | 21875091 | |
| Sodium pyruvate | Gibco | 11360-070 | |
| Spectrophotometer UV-6300PC | VWR | 634-6041 | |
| Square Petri dish 120 x 120 mm | Corning | BP124-05 | |
| Tyloxapol | Sigma-Aldrich | T8761 | |
| Ultrasound bath Elma P 30 H | VWR | 142-0051 |
References
- World Health Organization. Global Tuberculosis Report 2022. , World Health Organization. Geneva. (2022).
- Bettencourt, P. J. G., Joosten, S. A., Lindestam Arlehamn, C. S., Behr, M. A., Locht, C., Neyrolles, O. 100 years of the Bacillus Calmette-Guérin vaccine. Vaccine. 39 (50), 7221-7222 (2021).
- Bettencourt, P. J. G. The 100th anniversary of bacille Calmette-Guérin (BCG) and the latest vaccines against COVID-19. The International Journal of Tuberculosis and Lung Disease. 25 (8), 611-613 (2021).
- Scriba, T. J., Netea, M. G., Ginsberg, A. M. Key recent advances in TB vaccine development and understanding of protective immune responses against Mycobacterium tuberculosis. Seminars in Immunology. 50, 101431(2020).
- McShane, H., Williams, A. A review of preclinical animal models utilised for TB vaccine evaluation in the context of recent human efficacy data. Tuberculosis. 94 (2), 105-110 (2014).
- Voss, G., et al. Progress and challenges in TB vaccine development. F1000Research. 7, 199(2018).
- Satti, I., McShane, H. Current approaches toward identifying a correlate of immune protection from tuberculosis. Expert Review of Vaccines. 18 (1), 43-59 (2019).
- Young, D. Animal models of tuberculosis. European Journal of Immunology. 39 (8), 2011-2014 (2009).
- Pedroza-Roldán, C., Flores-Valdez, M. A. Recent mouse models and vaccine candidates for preventing chronic/latent tuberculosis infection and its reactivation. Pathogens and disease. 75 (6), (2017).
- Gong, W., Liang, Y., Wu, X. Animal Models of Tuberculosis Vaccine Research: An Important Component in the Fight against Tuberculosis. BioMed Research International. 2020, 1-21 (2020).
- Bettencourt, P., et al. Identification of antigens presented by MHC for vaccines against tuberculosis. NPJ vaccines. 5 (1), 2(2020).
- Moorlag, S. J. C. F. M., Arts, R. J. W., van Crevel, R., Netea, M. G. Non-specific effects of BCG vaccine on viral infections. Clinical Microbiology and Infection. 25 (12), 1473-1478 (2019).
- Wilkie, M., et al. Functional in-vitro evaluation of the non-specific effects of BCG vaccination in a randomised controlled clinical study. Scientific Reports. 12 (1), 7808(2022).
- Netea, M. G., et al. Trained immunity: A program of innate immune memory in health and disease. Science. 352 (6284), aaf1098(2016).
- Bettencourt, P., Pires, D., Carmo, N., Anes, E. Application of Confocal Microscopy for Quantification of Intracellular Mycobacteria in Macrophages. Microscopy: Science, Technology, Applications and Education. 1, 614-621 (2010).
- Bettencourt, P., Carmo, N., Pires, D., Timóteo, P., Anes, E. Mycobacterial infection of macrophages: the effect of the multiplicity of infection. Antimicrobial research: Novel bioknowledge and educational programs. , 651-664 (2017).
- Pires, D., Bettencourt, P., Carmo, N., Niederweis, M., Anes, E. Role of Mycobacterium tuberculosis outer-membrane porins in bacterial survival within macrophages. Drug Discovery Today. 15 (23-24), 1112-1113 (2010).
- Pires, D., et al. Mycobacterium tuberculosis Modulates miR-106b-5p to Control Cathepsin S Expression Resulting in Higher Pathogen Survival and Poor T-Cell Activation. Frontiers in immunology. 8 (DEC), 1819(2017).
- Pires, D., et al. Role of Cathepsins in Mycobacterium tuberculosis Survival in Human Macrophages. Scientific reports. 6 (August), 32247(2016).
- Bettencourt, P., et al. Actin-binding protein regulation by microRNAs as a novel microbial strategy to modulate phagocytosis by host cells: the case of N-Wasp and miR-142-3p. Frontiers in cellular and infection microbiology. 3 (June), 19(2013).
- Bhuyan, S., et al. Microliter spotting and micro-colony observation: A rapid and simple approach for counting bacterial colony forming units. Journal of Microbiological Methods. 207, 106707(2023).
- Jackson, S., McShane, H. Challenges in Developing a Controlled Human Tuberculosis Challenge Model. Current topics in microbiology and immunology. , 1-27 (2022).
- Darrah, P. A., et al. Prevention of tuberculosis in macaques after intravenous BCG immunization. Nature. 577 (7788), 95-102 (2020).
- Madura Larsen, J., et al. BCG stimulated dendritic cells induce an interleukin-10 producing T-cell population with no T helper 1 or T helper 2 bias in vitro. Immunology. 121 (2), 276-282 (2007).
- Bickett, T. E., et al. Characterizing the BCG-Induced Macrophage and Neutrophil Mechanisms for Defense Against Mycobacterium tuberculosis. Frontiers in immunology. 11, 1202(2020).
- Pires, D., et al. Interference of Mycobacterium tuberculosis with the endocytic pathways on macrophages and dendritic cells from healthy donors: role of cathepsins. Drug Discovery Today. 15 (23-24), 1112-1112 (2010).
- Betts, G., et al. Optimising Immunogenicity with Viral Vectors: Mixing MVA and HAdV-5 Expressing the Mycobacterial Antigen Ag85A in a Single Injection. PLoS ONE. 7 (12), e50447(2012).
- Tanner, R., et al. The influence of haemoglobin and iron on in vitro mycobacterial growth inhibition assays. Scientific reports. 7 (1), 43478(2017).
- McNeill, E., et al. Regulation of mycobacterial infection by macrophage Gch1 and tetrahydrobiopterin. Nature communications. 9 (1), 5409(2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Pereira, M., Vale, N. Saquinavir: From HIV to COVID-19 and Cancer Treatment. Biomolecules. 12 (7), 944(2022).
- Pires, D., et al. Repurposing Saquinavir for Host-Directed Therapy to Control Mycobacterium Tuberculosis Infection. Frontiers in immunology. 12, 647728(2021).
- Pires, D., et al. Liposomal Delivery of Saquinavir to Macrophages Overcomes Cathepsin Blockade by Mycobacterium tuberculosis and Helps Control the Phagosomal Replicative Niches. International journal of molecular sciences. 24 (2), (2023).
- Maartens, G., Wilkinson, R. J. Tuberculosis. The Lancet. 370 (9604), 2030-2043 (2007).
- Matarazzo, L., Bettencourt, P. J. G. mRNA vaccines: a new opportunity for malaria, tuberculosis and HIV. Frontiers in Immunology. 14, 1172691(2023).
- Young, D., Dye, C. The Development and Impact of Tuberculosis Vaccines. Cell. 124 (4), 683-687 (2006).
- Kommareddi, S., Abramowsky, C. R., Swinehart, G. L., Hrabak, L. Nontuberculous mycobacterial infections: Comparison of the fluorescent auramine-o and Ziehl-Neelsen techniques in tissue diagnosis. Human Pathology. 15 (11), 1085-1089 (1984).
- Sabiiti, W., et al. A Tuberculosis Molecular Bacterial Load Assay (TB-MBLA). Journal of visualized experiments: JoVE. (158), e60460(2020).
- Somoskövi, A., et al. Comparison of Recoveries of Mycobacterium tuberculosis Using the Automated BACTEC MGIT 960 System, the BACTEC 460 TB System, and Löwenstein-Jensen Medium. Journal of Clinical Microbiology. 38 (6), 2395-2397 (2000).
- Tanner, R., et al. The in vitro direct mycobacterial growth inhibition assay (MGIA) for the early evaluation of TB vaccine candidates and assessment of protective immunity: a protocol for non-human primate cells. F1000Research. 10, 257(2021).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved