需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于结核病疫苗功效评估的微集落形成单位测定
摘要
菌落形成单位 (CFU) 的测定是定量细菌的金标准技术,包括 结核分枝杆菌,结核分枝杆 菌可能需要数周时间才能形成可见菌落。在这里,我们描述了一种用于 CFU 测定的微型 CFU,它提高了时间效率,减少了实验室空间和试剂成本,并可扩展到中高通量实验。
摘要
结核病 (TB) 是全球传染性病原体导致死亡的主要原因,2022 年造成 160 万人死亡,仅在 2019-2021 年大流行期间被 COVID-19 超越。该病由 结核分枝杆菌 (M.tb)引起。 牛分枝杆菌 卡介苗(BCG)是唯一的结核病疫苗,是世界上获得许可的最古老的疫苗,仍在使用。目前,有12种疫苗处于临床试验阶段,数十种疫苗处于临床前开发阶段。在临床前研究中,用于评估结核病疫苗疗效的首选方法是通过菌落形成单位 (CFU) 测定法对细菌菌落进行计数。这种耗时的检测需要 4 到 6 周才能完成,需要大量的实验室和培养箱空间,试剂成本高,并且容易受到污染。在这里,我们描述了一种优化的菌落计数方法,即微 CFU (mCFU),它为分析 结核分枝杆 菌疫苗的功效结果提供了一种简单而快速的解决方案。mCFU 检测所需的试剂数量减少了 10 倍,潜伏期缩短了 3 倍,需要 1 到 2 周才能完成,减少了实验室空间和试剂成本,并将与大量 M.tb 相关的健康和安全风险降至最低。此外,为了评估结核病疫苗的功效,可以从各种来源获得样本,包括感染分枝杆菌的接种疫苗动物的组织。我们还描述了一种优化的方法,用于感染研究生产单细胞、均匀和高质量的分枝杆菌培养物。最后,我们建议将这些方法普遍用于疫苗功效测定的临床前研究,最终缩短结核病疫苗开发的时间。
引言
结核病(TB)是全球单一传染性病原体结 核分枝杆菌 (M.tb)死亡的主要原因,其死亡人数超过任何其他病原体。2021年,结核病导致160万人死亡,在2019-2021年大流行期间被COVID-19超过1。此外,根据世界卫生组织的 2022 年全球结核病报告,COVID-19 大流行是导致新发结核病病例增加的原因。世卫组织还报告说,在此期间,被诊断患有结核病的人数大幅下降,这可能会进一步增加结核病病例数1。
卡介苗 (BCG) 是致病性牛分枝杆菌的减毒活菌株,100 多年前首次用作疫苗。这是唯一的结核病疫苗,也是世界上仍在使用的最古老的许可疫苗2,3。目前,有 12 种疫苗处于临床试验的不同阶段4,数十种疫苗正在临床前开发中 5,6。结核病疫苗的临床前评估包括安全性和免疫原性评估7,这可以在斑马鱼、小鼠、豚鼠、兔子、牛和非人灵长类动物等各种动物模型中获得 8,9,10。此外,评估疫苗诱导对结核分枝杆菌感染和/或传播的保护能力,即疫苗效力,需要在体内进行结核分枝杆菌攻击5,11。有趣的是,卡介苗疫苗接种通过训练有素的免疫机制 12,13 诱导影响其他细菌和病毒病原体存活的非特异性效应14。为了量化受感染动物的活细菌负荷,选择的方法是通过菌落形成单位 (CFU) 测定法 5,15 对细菌菌落进行计数。CFU是一个单位,用于估计在特定生长条件下形成菌落的微生物(细菌或真菌)的数量。CFU起源于可存活和可复制的微生物,每个菌落中活微生物的绝对数量难以估计。尚不确定菌落是否起源于一种或多种微生物。CFU单位反映了这种不确定性,因此在同一样品的重复中可以观察到很大的变异性。这种耗时的检测需要经过培训的专业技术人员在生物安全 3 级 (BSL3) 设施、大量实验室和培养箱空间中工作,需要 4 到 6 周才能完成,并且容易受到污染。
在这项研究中,我们描述了一种优化的菌落计数方法,即 micro-CFU (mCFU),并提供了一种简单快速的解决方案来分析结果 15,16,17,18,19,20。mCFU 检测所需的试剂数量减少了 10 倍,潜伏期缩短了 3 倍,需要 1 到 2 周才能完成,减少了实验室空间和试剂成本,并将与大量 M.tb 相关的健康和安全风险降至最低。我们建议将这种方法普遍用于疫苗功效测定的临床前研究,最终缩短结核病疫苗的开发时间。最后,这种优化的CFU计数方法不仅用于定量分枝杆菌,还用于定量其他细菌,如大肠杆菌和Ralstonia solanacearum21。
Access restricted. Please log in or start a trial to view this content.
研究方案
注意:此处描述的方案适用于BCG,但可以应用于任何分枝杆菌。当 BSL3 设施不可用时,BCG 可用作结核病实验的替代细菌22.使用卡介苗的以下程序应在生物安全 2 级 (BSL2) 实验室下进行,并遵循适当的生物安全指南和操作危险组 2 微生物的良好实验室规范。
1. 培养基制备
- 根据供应商的说明,准备补充有 10% (v/v) 油酸、白蛋白、葡萄糖和过氧化氢酶 (OADC) 富集的 Middlebrook 7H9 肉汤。用 0.05% (v/v) 的泰洛沙泊补充肉汤。
注意:Tyloxapol 是一种非离子液体聚合物,已用作表面活性剂以防止细菌团块形成16. - 根据供应商的说明制备补充有10%(v / v)OADC富集的Middlebrook 7H10固体培养基。
- 每个方形培养皿 (120 mm x 120 mm) 分配 40 mL 培养基。让平板干燥,以尽量减少琼脂表面的冷凝。
注意:这种特定尺寸的培养皿对于允许从 96 孔板直接转座至少 96 个液滴至关重要。板的有效干燥将促进细菌悬浮液小液滴的电镀,并防止液滴扩散。 - 制备 Roswell Park Memorial Institute 培养基 (RPMI 1640) 或 Dulbecco 改良 Eagle 培养基 (DMEM) 以产生感染培养基。无论哪种情况,都应用 10% 胎牛血清、1% L-谷氨酰胺和 1 mM 丙酮酸钠补充培养基。不要向培养基中加入青霉素和链霉素。
2. 样品制备
- 从各种来源获取样品。通常,为了量化 CFU 以评估结核病疫苗的功效,请从已接种疫苗和未接种疫苗的动物组织中获取样本。例如,用小鼠肺和脾脏11或猕猴肺、胸和外周淋巴结、脾脏、肝脏、皮肤、血液、骨髓和支气管肺泡灌洗液23。或者,从感染 BCG18、19、20、24、25、26 的巨噬细胞/树突状细胞/中性粒细胞的体外培养物中获取样本。
3. BCG培养物的生产
注:对于结核病疫苗的体内研究,目的是提高卡介苗的疗效。因此,通常使用接种卡介苗的组作为对照。用于人类疫苗接种的卡介苗菌株非常适合在动物模型中进行测试。在这种情况下,必须根据供应商的指示27 重组 BCG 培养物。然而,用于体内研究的 BCG 培养也可以在内部生产11。在几项研究11、16、18、19、20、26、28、29 中,使用以下方案,也可用于动物激发研究,已非常成功地生产用于体外感染方案的单细胞、均匀和高质量的 BCG 培养物,也可用于动物激发研究。
- 在37°C下,在7H9肉汤中培养50mL BCG,以200rpm搅拌。根据实验的需要改变体积。
- 每天,持续 8-10 天,收集 100 μL 培养物,并通过在 1 mL 比色皿中加入 900 μL PBS 来稀释。然后继续测量细菌的光密度(λ=600nm处的OD;OD600)在分光光度计中。从这些值绘制一条增长曲线。确定培养物的对数中期(当 OD 每单位时间持续加倍时)。
- 准备后续培养物并孵育至达到中/晚期对数生长阶段,如步骤3.1和3.2所示。使用在上一步中获取的值作为指导。确保培养物不会达到固定生长阶段(当OD开始稳定时),以保持活菌的高质量培养。
- 在对数生长的中/后期收集培养物。以3000× g 离心10分钟。除去上清液。
- 加入 10 mL PBS 清洗细菌。以3000× g 离心10分钟。除去上清液。
- 用 5 mL 感染培养基重悬细菌。将试管置于超声浴中 15 分钟,全功率为 80 Hz。
- 以1000× g 离心10分钟。收集上清液,避开沉淀,因为它富含细菌团块,在高质量的BCG培养物中应避免,并将其丢弃。
- 测量上清液的OD。在这里,处于指数生长期的培养物,OD600 为 0.1,相当于 1 x 107 CFU/mL。
注意:每个实验室在开始实验之前应生成自己的 BCG 生长曲线,以使用分光光度计在 OD600 和 CFU 之间建立线性回归。请注意,分光光度计具有不同的光程距离,这可能会改变同一样品获得的读数。 - 进行简单的计算,以确定要添加到每个宿主细胞培养物中的细菌数量。每个宿主细胞的细菌数量是感染的多重性 (MOI)。每个宿主细胞使用 10 个细菌的 MOI,这是用于 BCG 感染实验的最常见 MOI。
4. 微菌落形成单元测定
注: 体内 或 体外 感染实验完成后,可以通过mCFU进行细菌计数。对于 体内 研究,必须首先在微珠打浆器或其他组织匀浆器中对样品进行均质化。对于感染卡介苗的巨噬细胞/树突状细胞/中性粒细胞的 体外 培养,必须使用非离子去污剂(例如,0.05% 非离子、非变性去污剂溶液)裂解样品。
- 使用 96 孔板进行连续稀释:根据 图 1A 中的方案,在无菌 96 孔板中对裂解物进行连续 10 倍稀释。将裂解物分布在 A 行和 E 行上。对于每个板,最大样品和/或重复次数为 24。
- 向剩余的孔中加入 180 μLdH 2O,以进行连续稀释。
- 使用 12 通道移液管,重悬 A 行中的裂解物,并将 20 μL 转移到 B 行(20 μL 裂解物 + 180 μL dH2O)。均匀化良好。依次对 B 行和 C 行重复此步骤,直到达到 D 行的最后一个稀释度。
注意:我们通常进行三次稀释(100、101、102、103),因此每组 12 个样品和/或重复使用 4 行板(AD 或 E-H)。 - 微液滴铺板:根据 图1B,使用0.5-10 μL(首选细吸头)多通道移液器将5 μL从每排96孔板转移到固体介质方板上。
- 在缓慢移液 5 μL 液滴的同时,让它们轻轻接触琼脂。这将有助于去除从尖端向琼脂方向的液滴,并减少液体滞留在尖端内的可能性。
- 让液滴干燥,关闭琼脂平板,并在37°C下孵育,同时监测细菌生长。或者,将琼脂平板在密封的塑料袋中孵育,以防止平板干燥。
- 微菌落计数:孵育约6-10天后,检查肉眼可见的单个菌落(图2)。
- 使用倒置光学显微镜或放大镜的最低放大倍率物镜(4倍或更低)计数菌落。应在菌落数低于 300 且高于 30 的稀释液中进行计数。或者,使用相机拍摄液滴的照片以在计算机上手动计数菌落,或使用 ImageJ 等软件自动计数菌落计数。
- 要以 CFU/mL 表示细胞数,请使用以下公式:
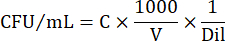
其中 C = 计数的菌落数,V = 以 μL 为单位的铺板体积,Dil = 计数菌落的稀释度 (100, 101, 102, 103)。例如,如果在稀释 102 的 5 μL 液滴中计数 30 个菌落,则: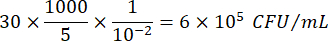
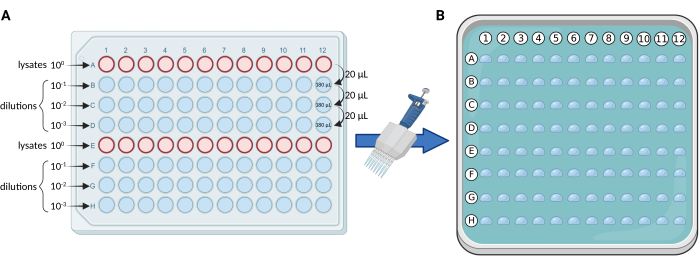
图 1.mCFU协议的示意图。 (A) 在 96 孔板中对含 BCG 的裂解物进行连续 10 倍稀释。(B) 含有固体培养基的方形培养皿,并由 96 个液滴覆盖,每个液滴 5 μL。使用多通道移液器直接从96孔板中移液液滴。用 BioRender.com 创建。 请点击这里查看此图的较大版本.
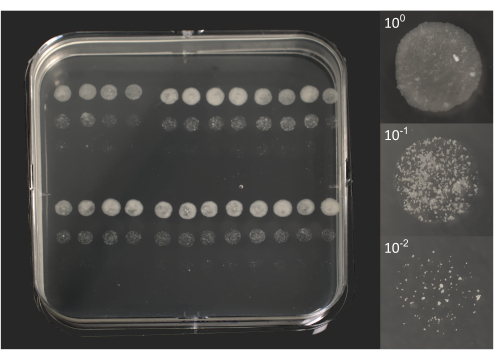
图2.孵育 10 天后 BCG 的微菌落形成单位。在左边,一个方形培养皿的照片,上面覆盖着96个5 μL的液滴,如图1B所示。 在右侧,3 个液滴的单个照片对应于原始裂解物 (100) 和两个稀释液 (101, 102)。照片使用配备 18-55 毫米变焦镜头(板)或 105 毫米微距镜头(液滴)的 DSRL 相机拍摄。请点击这里查看此图的较大版本.
5. 斐济的微菌落形成单位计数 (ImageJ)
注:mCFU 方法允许对大量样品进行 CFU 定量。可以记录液滴的图片以进行后验分析,以促进菌落计数。为此,几种摄影设备可以产生足够质量的图像。这些包括数码相机、网络摄像头、相机连接显微镜和放大镜以及手机。ImageJ 等免费图像分析软件提供了在这些图像中手动或自动进行菌落计数的可能性。为了演示这两种方法,将使用 Fiji,它是 ImageJ 的发行版,它打包了几种用于科学图像分析的工具 30。斐济可以从 https://fiji.sc/ 下载。
- 手动计数方式
- 在斐济打开包含 mCFU 的图像。选择 插件>分析>细胞计数器。
- 在"细胞计数器"菜单上,选择 "初始化 ",然后选择一个计数器(例如,键入 1)。
- 通过单击每个菌落继续。每次单击都会显示在图片上,并将更新计数器(图 3)。若要撤消意外点击,请选择 "删除"。
- 注册计数器上显示的值。单击 "重置 "按钮重置计数并打开新图像以计数其他样本。
注意:有关此插件的更多说明,请参见 https://imagej.net/plugins/cell-counter。
- 自动计数方式
- 在斐济打开包含 mCFU 的图像。选择 "映像>键入 > 8 位"。这会将图像转换为 8 位灰度图像。
- 在工具栏中选择 "椭圆 "工具,并在具有菌落的区域周围绘制一个椭圆(图4A)。椭圆可以在绘制后进行调整。
- 选择 "编辑">"清除外部",以消除外部区域的任何干扰(图4B)。选择 图像>调整>阈值。
- 移动阈值菜单中的滑块,直到菌落显示为红色并且背景噪音最小化(图4C)。
- 选择 "应用 "并退出阈值窗口。生成黑白图像(图4D)。
- 选择 "分析"(Analyze) >"分析粒子"(Analyze Particles)。在分析粒子窗口中,指定菌落面积(介于 1 和无穷大之间,以平方像素为单位)和圆度(介于 0 和 1 之间,其中 1 为完美圆; 图4E)。
- 在显示弹出菜单中选择 轮廓 。在结果窗口中查看显示 结果 ,了解每个菌落的详细测量值。选中 "清除结果 "以擦除任何先前的测量值。选中 "汇总 "框以显示测量的汇总结果(图4E)。
- 通过选择" 确定"启动分析器。将出现一个新窗口,显示所有已检测和计数的轮廓菌落。结果窗口显示每个菌落的详细信息,汇总结果窗口显示计数的总菌落(图4F)。
注意:大小和圆度的设置将随图像的分辨率和放大倍率以及菌落的大小和形状而变化。重复该过程几次,直到找到检测所有菌落的最佳设置。有关分析粒子插件的更多说明,请参见 https://imagej.nih.gov/ij/docs/menus/analyze.html#ap。
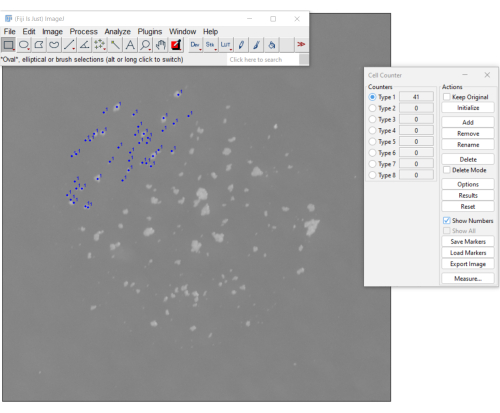
图3.使用斐济软件上的细胞计数仪插件对 mCFU 进行计数的手动方法。 蓝点表示用户已点击的菌落。右侧的菜单显示到目前为止计数的菌落数(计数为 41)。 请点击这里查看此图的较大版本.

图4.一种使用 Fiji 软件计算 mCFU 的自动化方法。 (甲、乙)使用椭圆形选择工具选择具有菌落的感兴趣区域,并使用清除外部命令删除外部区域。(C、D)使用阈值工具生成菌落的黑白图像。(E、F)使用分析颗粒工具对菌落数量进行量化。 请点击这里查看此图的较大版本.
Access restricted. Please log in or start a trial to view this content.
结果
这里描述的mCFU测定将可以从单个培养皿中检索到的信息量增加到至少96倍。图 5 描述了两种药物递送方法的比较,用于重新利用沙奎那韦 (SQV)31,32 作为宿主定向药物治疗结核病。在该测定中,使用四种不同的结核分枝杆菌菌株感染原代人巨噬细胞。结核分枝杆菌葡萄牙国立卫生研究院的Ricardo Jorge博士(INSA)从活?...
Access restricted. Please log in or start a trial to view this content.
讨论
结核病是一个重要的公共卫生问题,其重要性日益增加,特别是在低收入和中等收入国家。在COVID-19大流行期间,诊断和治疗结核病的医疗机构中断,对新发病例的发病率产生了负面影响1。此外,必须紧急解决多药和广泛耐药的结核分枝杆菌菌株以及结核分枝杆菌和艾滋病毒的合并感染,以控制这一流行病1,34。替代或改?...
Access restricted. Please log in or start a trial to view this content.
披露声明
DP 和 PJGB 声明,该研究是在没有任何可被解释为潜在利益冲突的商业或财务关系的情况下进行的。
致谢
这项工作得到了葡萄牙天主教大学医学院的内部资金和科学与技术基金会 (FCT) 的外部资金支持,赠款为 UIDP/04279/2020、UIDB/04279/2020 和 EXPL/SAU-INF/0742/2021。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 96-well plates | VWR | 734-2781 | |
| DSLR 15-55 mm lens | Nikon | AF-P DX NIKKOR 18-55mm f/3.5-5.6G VR | |
| DSLR camera | Nikon | D3400 | |
| DSLR macro lens | Sigma | MACRO 105mm F2.8 EX DG OS HSM | |
| Fetal calf serum | Gibco | 10270106 | |
| Fiji Software | https://fiji.sc/ | Fiji is an open-source software supported by several laboratories, institutions, and individuals. All the required plugins are included. | |
| Igepal CA-630 | Sigma-Aldrich | 18896 | |
| L-glutamine | Gibco | 25030-081 | |
| Middlebrook 7H10 | BD | 262710 | |
| Middlebrook 7H9 | BD | 271310 | |
| Multichannel pipette (0.5 - 10 µl) | Gilson | FA10013 | |
| Multichannel pipette (20 - 200 µl) | Gilson | FA10011 | |
| Mycobacterium bovis BCG | American Type Culture Collection | ATCC35734 | strain TMC 1011 [BCG Pasteur] |
| OADC enrichment | BD | 211886 | |
| Phosphate buffered saline (PBS) | NZYTech | MB25201 | |
| RPMI 1640 medium | Gibco | 21875091 | |
| Sodium pyruvate | Gibco | 11360-070 | |
| Spectrophotometer UV-6300PC | VWR | 634-6041 | |
| Square Petri dish 120 x 120 mm | Corning | BP124-05 | |
| Tyloxapol | Sigma-Aldrich | T8761 | |
| Ultrasound bath Elma P 30 H | VWR | 142-0051 |
参考文献
- World Health Organization. Global Tuberculosis Report 2022. , World Health Organization. Geneva. (2022).
- Bettencourt, P. J. G., Joosten, S. A., Lindestam Arlehamn, C. S., Behr, M. A., Locht, C., Neyrolles, O. 100 years of the Bacillus Calmette-Guérin vaccine. Vaccine. 39 (50), 7221-7222 (2021).
- Bettencourt, P. J. G. The 100th anniversary of bacille Calmette-Guérin (BCG) and the latest vaccines against COVID-19. The International Journal of Tuberculosis and Lung Disease. 25 (8), 611-613 (2021).
- Scriba, T. J., Netea, M. G., Ginsberg, A. M. Key recent advances in TB vaccine development and understanding of protective immune responses against Mycobacterium tuberculosis. Seminars in Immunology. 50, 101431(2020).
- McShane, H., Williams, A. A review of preclinical animal models utilised for TB vaccine evaluation in the context of recent human efficacy data. Tuberculosis. 94 (2), 105-110 (2014).
- Voss, G., et al. Progress and challenges in TB vaccine development. F1000Research. 7, 199(2018).
- Satti, I., McShane, H. Current approaches toward identifying a correlate of immune protection from tuberculosis. Expert Review of Vaccines. 18 (1), 43-59 (2019).
- Young, D. Animal models of tuberculosis. European Journal of Immunology. 39 (8), 2011-2014 (2009).
- Pedroza-Roldán, C., Flores-Valdez, M. A. Recent mouse models and vaccine candidates for preventing chronic/latent tuberculosis infection and its reactivation. Pathogens and disease. 75 (6), (2017).
- Gong, W., Liang, Y., Wu, X. Animal Models of Tuberculosis Vaccine Research: An Important Component in the Fight against Tuberculosis. BioMed Research International. 2020, 1-21 (2020).
- Bettencourt, P., et al. Identification of antigens presented by MHC for vaccines against tuberculosis. NPJ vaccines. 5 (1), 2(2020).
- Moorlag, S. J. C. F. M., Arts, R. J. W., van Crevel, R., Netea, M. G. Non-specific effects of BCG vaccine on viral infections. Clinical Microbiology and Infection. 25 (12), 1473-1478 (2019).
- Wilkie, M., et al. Functional in-vitro evaluation of the non-specific effects of BCG vaccination in a randomised controlled clinical study. Scientific Reports. 12 (1), 7808(2022).
- Netea, M. G., et al. Trained immunity: A program of innate immune memory in health and disease. Science. 352 (6284), aaf1098(2016).
- Bettencourt, P., Pires, D., Carmo, N., Anes, E. Application of Confocal Microscopy for Quantification of Intracellular Mycobacteria in Macrophages. Microscopy: Science, Technology, Applications and Education. 1, 614-621 (2010).
- Bettencourt, P., Carmo, N., Pires, D., Timóteo, P., Anes, E. Mycobacterial infection of macrophages: the effect of the multiplicity of infection. Antimicrobial research: Novel bioknowledge and educational programs. , 651-664 (2017).
- Pires, D., Bettencourt, P., Carmo, N., Niederweis, M., Anes, E. Role of Mycobacterium tuberculosis outer-membrane porins in bacterial survival within macrophages. Drug Discovery Today. 15 (23-24), 1112-1113 (2010).
- Pires, D., et al. Mycobacterium tuberculosis Modulates miR-106b-5p to Control Cathepsin S Expression Resulting in Higher Pathogen Survival and Poor T-Cell Activation. Frontiers in immunology. 8 (DEC), 1819(2017).
- Pires, D., et al. Role of Cathepsins in Mycobacterium tuberculosis Survival in Human Macrophages. Scientific reports. 6 (August), 32247(2016).
- Bettencourt, P., et al. Actin-binding protein regulation by microRNAs as a novel microbial strategy to modulate phagocytosis by host cells: the case of N-Wasp and miR-142-3p. Frontiers in cellular and infection microbiology. 3 (June), 19(2013).
- Bhuyan, S., et al. Microliter spotting and micro-colony observation: A rapid and simple approach for counting bacterial colony forming units. Journal of Microbiological Methods. 207, 106707(2023).
- Jackson, S., McShane, H. Challenges in Developing a Controlled Human Tuberculosis Challenge Model. Current topics in microbiology and immunology. , 1-27 (2022).
- Darrah, P. A., et al. Prevention of tuberculosis in macaques after intravenous BCG immunization. Nature. 577 (7788), 95-102 (2020).
- Madura Larsen, J., et al. BCG stimulated dendritic cells induce an interleukin-10 producing T-cell population with no T helper 1 or T helper 2 bias in vitro. Immunology. 121 (2), 276-282 (2007).
- Bickett, T. E., et al. Characterizing the BCG-Induced Macrophage and Neutrophil Mechanisms for Defense Against Mycobacterium tuberculosis. Frontiers in immunology. 11, 1202(2020).
- Pires, D., et al. Interference of Mycobacterium tuberculosis with the endocytic pathways on macrophages and dendritic cells from healthy donors: role of cathepsins. Drug Discovery Today. 15 (23-24), 1112-1112 (2010).
- Betts, G., et al. Optimising Immunogenicity with Viral Vectors: Mixing MVA and HAdV-5 Expressing the Mycobacterial Antigen Ag85A in a Single Injection. PLoS ONE. 7 (12), e50447(2012).
- Tanner, R., et al. The influence of haemoglobin and iron on in vitro mycobacterial growth inhibition assays. Scientific reports. 7 (1), 43478(2017).
- McNeill, E., et al. Regulation of mycobacterial infection by macrophage Gch1 and tetrahydrobiopterin. Nature communications. 9 (1), 5409(2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Pereira, M., Vale, N. Saquinavir: From HIV to COVID-19 and Cancer Treatment. Biomolecules. 12 (7), 944(2022).
- Pires, D., et al. Repurposing Saquinavir for Host-Directed Therapy to Control Mycobacterium Tuberculosis Infection. Frontiers in immunology. 12, 647728(2021).
- Pires, D., et al. Liposomal Delivery of Saquinavir to Macrophages Overcomes Cathepsin Blockade by Mycobacterium tuberculosis and Helps Control the Phagosomal Replicative Niches. International journal of molecular sciences. 24 (2), (2023).
- Maartens, G., Wilkinson, R. J. Tuberculosis. The Lancet. 370 (9604), 2030-2043 (2007).
- Matarazzo, L., Bettencourt, P. J. G. mRNA vaccines: a new opportunity for malaria, tuberculosis and HIV. Frontiers in Immunology. 14, 1172691(2023).
- Young, D., Dye, C. The Development and Impact of Tuberculosis Vaccines. Cell. 124 (4), 683-687 (2006).
- Kommareddi, S., Abramowsky, C. R., Swinehart, G. L., Hrabak, L. Nontuberculous mycobacterial infections: Comparison of the fluorescent auramine-o and Ziehl-Neelsen techniques in tissue diagnosis. Human Pathology. 15 (11), 1085-1089 (1984).
- Sabiiti, W., et al. A Tuberculosis Molecular Bacterial Load Assay (TB-MBLA). Journal of visualized experiments: JoVE. (158), e60460(2020).
- Somoskövi, A., et al. Comparison of Recoveries of Mycobacterium tuberculosis Using the Automated BACTEC MGIT 960 System, the BACTEC 460 TB System, and Löwenstein-Jensen Medium. Journal of Clinical Microbiology. 38 (6), 2395-2397 (2000).
- Tanner, R., et al. The in vitro direct mycobacterial growth inhibition assay (MGIA) for the early evaluation of TB vaccine candidates and assessment of protective immunity: a protocol for non-human primate cells. F1000Research. 10, 257(2021).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。