A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الفيروسات الزائفة كأداة جزيئية لمراقبة الاستجابات المناعية الخلطية ضد SARS-CoV-2 عن طريق مقايسة التحييد
* These authors contributed equally
In This Article
Summary
الفيروسات الزائفة (PVs) هي فيروسات معيبة في النسخ المتماثل تستخدم لدراسة تفاعلات الفيروس المضيف في ظل ظروف أكثر أمانا من التعامل مع الفيروسات الأصلية. يظهر هنا بروتوكول مفصل يوضح كيف يمكن استخدام SARS-CoV-2 PVs لاختبار قدرة مصل المرضى على التحييد بعد التطعيم ضد COVID-19.
Abstract
الفيروسات الزائفة (PVs) هي أدوات جزيئية يمكن استخدامها لدراسة تفاعلات الفيروس المضيف واختبار القدرة المعادلة لعينات المصل ، بالإضافة إلى استخدامها المعروف في العلاج الجيني لتوصيل جين مهم. PVs معيبة في النسخ المتماثل لأن الجينوم الفيروسي ينقسم إلى بلازميدات مختلفة غير مدمجة في PVs. يسمح هذا النظام الآمن والمتعدد الاستخدامات باستخدام PVs في مختبرات مستوى السلامة البيولوجية 2. هنا ، نقدم منهجية عامة لإنتاج PVs lentiviral على أساس ثلاثة بلازميدات كما هو مذكور هنا: (1) البلازميد الفقري الذي يحمل جين المراسل اللازم لمراقبة العدوى. (2) بلازميد العبوة الذي يحمل الجينات لجميع البروتينات الهيكلية اللازمة لتوليد PVs ؛ (3) تعبير البروتين السكري السطحي المغلف البلازميد الذي يحدد انتحاء الفيروس ويتوسط الدخول الفيروسي إلى الخلية المضيفة. في هذا العمل ، SARS-CoV-2 Spike هو البروتين السكري المغلف المستخدم لإنتاج فيروسات عدسية غير متماثلة من النوع الكاذب SARS-CoV-2.
باختصار ، تم نقل خلايا التغليف (HEK293T) مع البلازميدات الثلاثة المختلفة باستخدام الطرق القياسية. بعد 48 ساعة ، تم حصاد المادة الطافية التي تحتوي على PVs وتصفيتها وتخزينها عند -80 درجة مئوية. تم اختبار عدوى SARS-CoV-2 PVs من خلال دراسة تعبير الجين المراسل (luciferase) في خط الخلية المستهدف بعد 48 ساعة من الإصابة. كلما زادت قيمة وحدات التلألؤ النسبية (RLUs) ، زاد معدل العدوى / النقل. علاوة على ذلك ، تمت إضافة PVs المعدية إلى عينات المصل المخففة بشكل متسلسل لدراسة عملية تحييد دخول الفيروسات الكاذبة إلى الخلايا المستهدفة ، والتي تم قياسها على أنها انخفاض في كثافة RLU: قيم أقل تتوافق مع نشاط تحييد عالي.
Introduction
الفيروسات الزائفة (PVs) هي أدوات جزيئية تستخدم في علم الأحياء الدقيقة لدراسة تفاعلات الفيروس المضيف ومسببات الأمراضالممرضة 1،2،3،4. تتكون PVs من جزء داخلي ، النواة الفيروسية التي تحمي الجينوم الفيروسي ، وجزء خارجي ، البروتينات السكرية المغلفة على سطح الفيروس الذي يحدد الانتحاء5. الفيروس الكاذب غير كفء للتكاثر في الخلية المستهدفة لأنه لا يحتوي على جميع المعلومات الوراثية لتوليد جزيئات فيروسية جديدة. هذا المزيج من الميزات الغريبة يجعل PVs بديلا آمنا لفيروس من النوع البري. من ناحية أخرى ، فإن الفيروسات البرية شديدة الإمراض ولا يمكن استخدامها في مختبرات BSL 2 للتحليل6.
يمكن مراقبة عدوى PVs بواسطة جين مراسل ، وعادة ما يتم ترميزه لبروتين فلوري (GFP ، RFP ، YFP) أو إنزيم ينتج منتجات كيميائية مضيئة (luciferase). ويرد هذا في واحدة من البلازميدات المستخدمة لإنتاج الكهروضوئية ودمجها في جينوم الفيروس الكاذب7.
توجد حاليا عدة أنواع من النوى الكهروضوئية ، بما في ذلك الجسيمات المشتقة من العدس بناء على جينوم HIV-1. الميزة الكبيرة للخلايا الكهروضوئية القائمة على فيروس نقص المناعة البشرية -1 على المنصات الأخرى هي عملية التكامل الجوهرية في جينوم الخلية المستهدفة8. على الرغم من أن فيروس HIV-1 هو فيروس شديد العدوى وهو العامل المسبب للإيدز ، إلا أن هذه النواقل الفيروسية عدسية آمنة للاستخدام بسبب خطوات التحسين الواسعة النطاق على مر السنين. تم تحقيق ظروف السلامة المثلى مع إدخال 2 من ناقلات الفيروسات العدسية من الجيلالثاني ، حيث تم استنفاد الجينات الفيروسية دون التأثير على قدرات النقل9. ساهمالجيلين الثالث و 4 في زيادة سلامة التعامل مع ناقلات الفيروسات العدسية مع زيادة تقسيم الجينوم الفيروسي إلى بلازميدات منفصلة10,11. يتم استخدام أحدث أجيال من PVs بشكل عام لإنتاج ناقلات الفيروسات العدسية للعلاج الجيني.
يمكن استخدام PVs لدراسة التفاعلات بين الفيروسات والخلايا المضيفة ، خلال كل من مراحل الإنتاج والعدوى. تستخدم PVs بشكل خاص في مقايسات تحييد الفيروس الكاذب (PVNA). يتم التحقق من صحة PVNAs على نطاق واسع لتقييم إمكانات تحييد المصل أو البلازما من خلال استهداف البروتين السكري الفيروسي على غلاف PV12,13. يتم تعريف نشاط التحييد ، معبرا عنه بالتركيز المثبط 50 (IC50) ، على أنه تخفيف المصل / البلازما الذي يمنع 50٪ من دخول الجسيمات الفيروسية14. في هذا البروتوكول ، وصفنا إعداد PVNA لاختبار نشاط الأجسام المضادة ضد المتلازمة التنفسية الحادة الوخيمة - فيروس كورونا 2 (SARS-CoV-2) في الأمصال التي تم جمعها قبل وبعد تلقي جرعة لقاح معززة.
Protocol
تمت الموافقة على هذا البروتوكول من قبل اللجنة الأخلاقية بجامعة فيرونا ويتبع المبادئ التوجيهية لها (رقم بروتوكول الموافقة 1538). تم الحصول على موافقة خطية مستنيرة من الأشخاص المشاركين في الدراسة. تم جمع عينات الدم الكامل من متطوعي العاملين في مجال الرعاية الصحية (HCW) الذين كانوا بصدد تلقي لقاحات مضادة ل SARS-CoV-2. تم جمع هذه العينات في أنابيب بلاستيكية تحتوي على مضادات التخثر للعزل اللاحق للمصل15.
يجب إجراء جميع العمليات التالية في غطاء بيولوجي من الفئة 2 ، يعمل في ظل ظروف معقمة. يجب إجراء معالجة الفيروسات بعناية ، ويجب تحييد جميع منتجات النفايات في محلول مبيض مخفف. يتم عرض نظرة عامة على البروتوكول في الشكل 1.
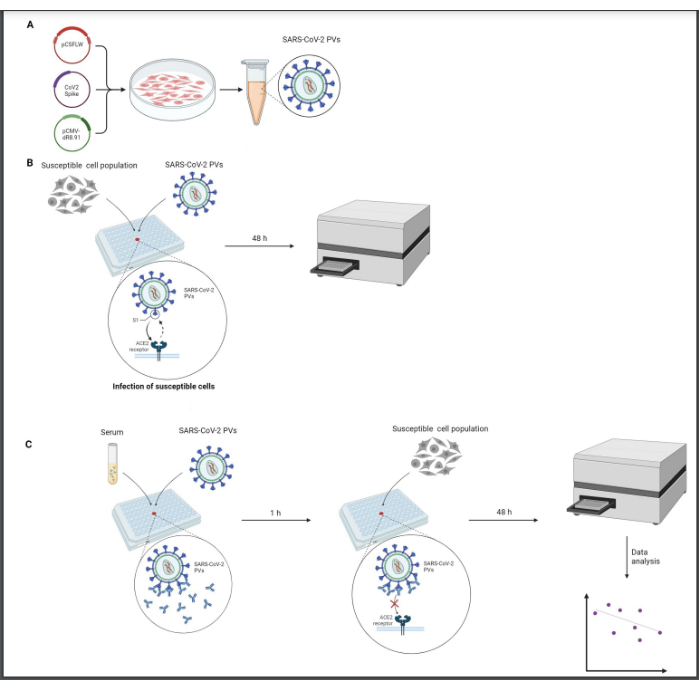
الشكل 1: تمثيل بياني لمقايسة التحييد. (أ) إنتاج الكهروضوئية، (ب) معايرة الطاقة الكهروضوئية، (ج) مقايسة التحييد. يتم تنفيذ جميع الإجراءات في غطاء بيولوجي من الفئة 2 في ظل ظروف معقمة. يجب إجراء خطوة المعايرة (B) لتوحيد مستويات العدوى للخلايا الكهروضوئية قبل استخدامها في مقايسة التحييد (C). تم إنشاء هذا الرقم باستخدام BioRender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. اختبار إنتاج وعدوى SARS-CoV-2 PVs
- بذر 5 × 105 خلايا HEK293T في وسط النسر المعدل الكامل من Dulbecco (DMEM ، نسبة عالية من الجلوكوز ، مصل بقري الجنين 10٪ (FBS) ، 1٪ L-glutamine ، 1٪ بنسلين / ستربتومايسين) في صفيحة ذات 6 آبار (6WP) للوصول إلى كثافة خلية مناسبة متوافقة مع كاشف النقل المستخدم. في حالة إجراء النقل باستخدام polyehtylenimine (PEI) (تحضير الكاشف باتباع تعليمات الشركة المصنعة) ، تأكد من أن الخلايا تصل إلى كثافة 40-60٪ في يوم النقل (الخطوة 1.3). الحفاظ على الخلايا في حاضنة رطبة عند 37 درجة مئوية و 5٪ CO2.
- قبل النقل ، استبدل وسط الخلية المستهلك بوسط جديد بدون مضادات حيوية (DMEM ، جلوكوز عالي ، 10٪ FBS ، 1٪ L-glutamine) لتحقيق كفاءة نقل أعلى.
ملاحظة: في اليوم التالي للبذر ، تكون خلايا HEK293T جاهزة للنقل. - نقل الخلايا HEK293T الملتصقة بكاشف نقل مناسب وفقا لتعليمات الشركة المصنعة. في حالة استخدام جزيرة برنس إدوارد ، قم بإعداد مزيجين واتبع الخطوات أدناه.
- لتحضير المزيج A ، أضف 500 نانوغرام من بلازميد التغليف pCMV-dR8.9116 ، و 750 نانوغرام من بلازميد مراسل pCSFLW16 ، و 450 نانوغرام من SARS-CoV-2 Spike الذي يعبر عن البلازميد في 100 ميكرولتر من وسط المصل المختزل.
- لتحضير المزيج B ، أضف 17.5 ميكرولتر من PEI (التركيز: 1 مجم / مل) إلى 100 ميكرولتر من وسط المصل المختزل.
- اترك كلا المزيجين في درجة حرارة الغرفة (RT) لمدة 5 دقائق. بعد ذلك، امزج محتويات كلا الأنبوبين معا عن طريق إضافة مزيج PEI B إلى مزيج DNA A .
- احتضن الأنبوب لمدة 20-30 دقيقة في RT. حرك الأنبوب برفق كل 3-4 دقائق لتعزيز الخلط. أخيرا ، أضف الخليط إلى الخلايا HEK293T.
- بعد 16-20 ساعة من النقل ، استبدل وسيط الاستزراع ب DMEM جديد وكامل. احتضان عند 37 درجة مئوية و 5 ٪ CO2 ، للسماح بإنتاج PVs بواسطة الخلايا المنقولة.
- 72 ساعة بعد النقل ، احصد المادة الطافية التي تحتوي على PVs. ثم أجهزة الطرد المركزي عند 1600 × جم لمدة 7 دقائق في درجة حرارة الغرفة لإزالة حطام الخلايا والخلايا الميتة وتصفيتها من خلال مرشح خلات السليلوز 0.45 ميكرومتر.
- خطوة اختيارية: لزيادة العائد النهائي للعيار الكهروضوئي ، قم بإجراء عمليات نقل متعددة ، وتجميع وسائط الخلية التي تحتوي على PVs ، وتركيزها باستخدام أنابيب التركيز.
- تابع مباشرة الخطوات التالية ("معايرة PVs" ، القسم 2) أو قسمة الوسط المحتوي على PV في أنابيب مناسبة لتخزينها عند -80 درجة مئوية حتى الاستخدام. قم بإعداد قسمة إضافية (400-500 ميكرولتر) لاستخدامها في المعايرة.
ملاحظة: سيضمن عمل حصص متعددة قابلية التكاثر بين التجارب عن طريق تجنب دورات الذوبان والتجميد المفرطة.
2. معايرة PVs
- استخدم الوسط الطازج المحتوي على PV للخطوات التالية أو قم بإذابة قسمة الاختبار (الخطوة 1.7) لإجراء معايرة المخزون الفيروسي الجديد. سيضمن تجميد الحصص من نفس المخزون الكهروضوئي قابلية التكاثر.
- أضف 50 ميكرولتر من DMEM الكامل (أو الوسط الكامل المتوافق مع خط الخلية المستهدف قيد الاستخدام) في جميع آبار 96 صفيحة بئر (96WP) اللازمة لاختبار المخزون الكهروضوئي المكرر ، مع ترك الصف "A" فارغا. أضف 100 ميكرولتر من مخزون PVs إلى الصف "A". بناء على عدد المستحضرات المراد اختبارها ، اترك عمودا واحدا بدون الفيروس كعنصر تحكم "خلية فقط" (الشكل 2).
- ماصة 50 ميكرولتر من الصف A إلى الصف B وكرر هذه العملية حتى الصف G للحصول على التخفيفات التسلسلية للمخزون الأولي. تجاهل الحجم الزائد من الصف الأخير.
- فصل الخلايا باستخدام حمض التربسين / الإيثيلين ديامينيترايتيك 1x (EDTA) في محلول ملحي فوسفات Dulbecco 1x (DPBS 1x) ، بعد إزالة الوسط المستهلك وغسل الخلايا باستخدام DPBS 1x مرتين. تحضير الخلايا بكثافة 4 × 105 خلايا / مل.
ملاحظة: في هذا البروتوكول ، تم اختبار عدوى PVs على خط الخلية الحساسة HEK293T / ACE2 ؛ تم اشتقاق هذه الخلايا من HEK293T ، وتم تحويلها باستخدام ناقل عدسي فيروسي للتعبير عن مستقبلات ACE2. - أضف 50 ميكرولتر من تعليق الخلية في كل بئر لضمان عدد خلايا 2 × 104 خلايا لكل بئر.
- احتضان في 37 درجة مئوية و 5 ٪ CO2 ، لمدة 48 ساعة.
- بعد الحضانة ، قم بإجراء اختبار Luciferase للحصول على القراءة وفقا لتعليمات الشركة المصنعة. أضف 100 ميكرولتر من كاشف لوسيفيراز إلى الآبار واحتضانها في الظلام في RT لمدة 2 دقيقة. انقل محتوى كل بئر إلى لوحة بئر سوداء 96 (متوافقة مع قارئ الألواح المتاح) واقرأ الألواح في قارئ لوحة بئر 96.
ملاحظة: سينتج مقياس الإنارة المستخدم في قراءات لوسيفيراز ملف جدول بيانات يحتوي على البيانات الأولية غير المعالجة التي سيتم استخدامها لتحليل المصب (في هذه الحالة ، ملف Excel). سيتم التعبير عن عدوى الفيروس كوحدات تلألؤ نسبية (RLU) (موصوفة في الفقرة 4.1).
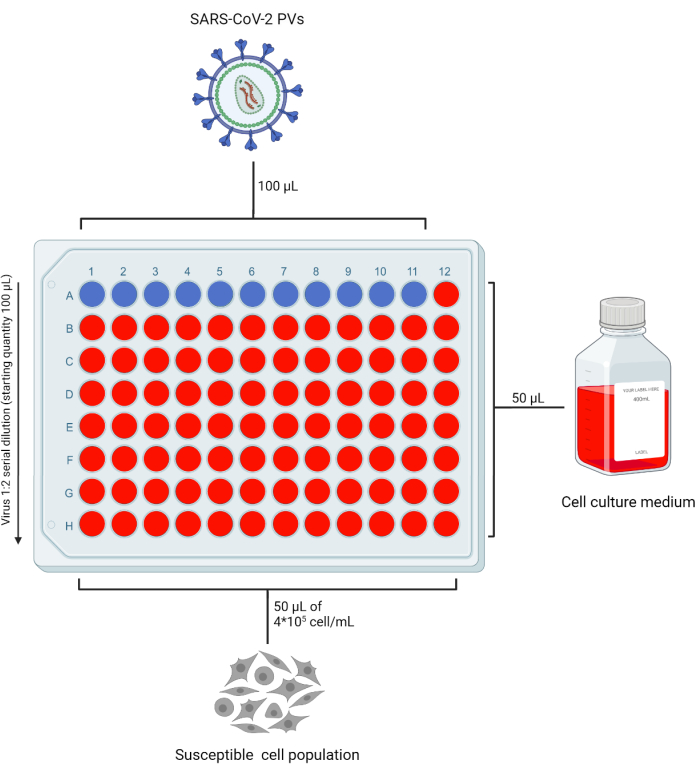
الشكل 2: تخطيط تمثيلي للوحة بئر 96 لمعايرة الخلايا الكهروضوئية. يضاف حجم ثابت من المادة الطافية المحتوية على PV إلى الصف A ، الأعمدة 1-11 ، ويتم تخفيفه بشكل متسلسل. يتم ترك العمود الأخير كعنصر تحكم "الخلية فقط". تم إنشاء هذا الرقم باستخدام BioRender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. مقايسة التحييد
- ذوبان الأمصال المرضى على الجليد. قم بتعطيل عينات المصل عن طريق احتضانها على حرارة 56 درجة مئوية لمدة 30 دقيقة.
- في صفيحة بئر 96 ، أضف 50 ميكرولتر من DMEM الطازج والكامل (أو الوسط الكامل المتوافق مع خط الخلية المستهدف المستخدم) في كل من الآبار التالية: من الصف B (الأعمدة 1-10) إلى الصف H (الأعمدة 1-10). ضع 95 ميكرولتر من DMEM الطازج والكامل في الصف A (الأعمدة 1-10). أضف 50 ميكرولتر و 100 ميكرولتر من DMEM الكامل إلى آبار العمودين 11 و 12 على التوالي. ستكون هذه هي عناصر التحكم المصابة (مكافحة الفيروسات ، أو VC) وغير المصابة (الخلية فقط ، أو CC) ، على التوالي (الشكل 3).
- أضف 5 ميكرولتر من عينات المصل / البلازما المعطلة بالحرارة في الصف A (الأعمدة 1-10). ستكون كل عينة من نسختين. باستخدام ماصة متعددة القنوات ، امزج العينات في الصف الأول وانقل 50 ميكرولتر من المصل المحتوي على وسط من الصف A إلى الصف B. كرر هذه العملية حتى الصف الأخير (الشكل 3). تخلص من ال 50 ميكرولتر المتبقية.
- قم بإذابة العدد اللازم من حصص PVs وقم بتخفيفها إلى ≥ 104 RLU / mL. أضف 50 ميكرولتر من الوسط المحتوي على PV المخفف إلى كل بئر (من العمود 1 إلى العمود 11) باستخدام ماصة متعددة القنوات للوصول إلى تخفيف 1: 1 من المصل / البلازما المعطل بالحرارة إلى الفيروس. احتضان عند 37 درجة مئوية و 5٪ CO2 ، لمدة 1 ساعة للسماح للأجسام المضادة في عينات المصل بالارتباط ببروتين ارتفاع SARS-CoV-2 على PVs.
- تحضير ما لا يقل عن 5 مل معلق للخلايا الحساسة (HEK293T / ACE2) بكثافة خلية 4 × 105 خلايا / مل. أضف 50 ميكرولتر من معلق الخلية إلى كل بئر واحتضانها عند 37 درجة مئوية و 5٪ CO2 ، لمدة 48 ساعة.
- بعد الحضانة ، قم بإجراء قراءة مقايسة luciferase وفقا لتعليمات الشركة الصانعة ، كما هو موضح في الخطوة 2.7.
ملاحظة: سينتج مقياس الإنارة المستخدم في قراءات لوسيفيراز ملف جدول بيانات (في هذه الحالة ، .xlsx) مع البيانات الخام غير المعالجة التي سيتم استخدامها لتحليل المصب (ملف فحص Luciferase ).
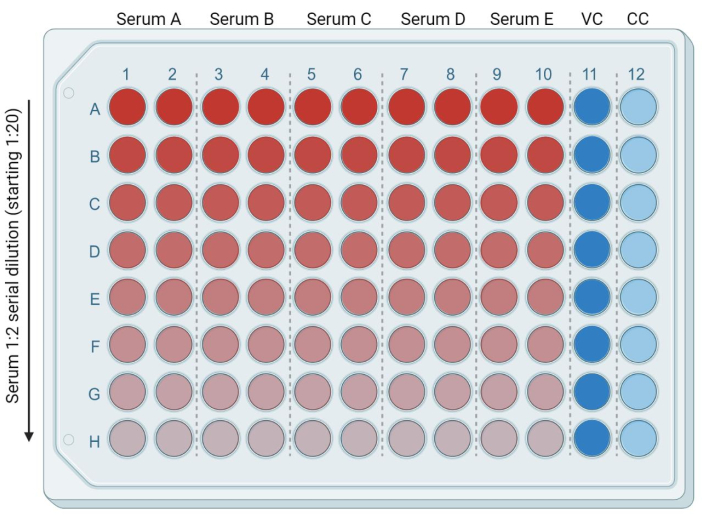
الشكل 3: تمثيل اللوحة على أساس تخفيف المصل. يتوافق اللون الأحمر الفاتح مع كمية أكبر من المصل ، ويتوافق الممر الأزرق الساطع (العمود 11) مع التحكم في الخلايا المصابة (VC ، مكافحة الفيروسات). الممر الأزرق الفاتح (العمود 12) يتوافق مع الخلايا غير المصابة (CC ، التحكم في الخلية). تم إنشاء هذا الرقم باستخدام BioRender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. تحليل المعايرة بالتحليل الحجمي
- في ملف فحص Luciferase ، قم بتعيين الأسماء / العناوين للعينات المقابلة.
- اضرب مقياس RLU في عوامل التخفيف (من أعلى الشبكة إلى أسفلها: 20x ، 40x ، 80x ، 160x ، 320x ، 640x ، 1,280x ، 2,560x) للحصول على RLU / mL. إذا تم استخدام عوامل تخفيف مختلفة ، فقم بتغيير عوامل الضرب وفقا لذلك.
- احسب متوسط RLU / mL لكل تحضير PV.
5. تحليل مقايسة تحييد PVs
- في ملف جدول بيانات فحص Luciferase (في هذه الحالة ، .xlsx) ، قم بتعيين العناوين المقابلة للعينات التي تم اختبارها. أدخل عامل التخفيف للعينة (40 ثانية ، 80 ضعفا ، 160 ضعفا ، 320 ضعفا ، 640 ضعفا ، 1280 × ، 2560 × ، 5120 ضعفا). احسب log10 لعوامل التخفيف.
- احسب متوسط RLU للسيطرة غير المصابة والمصابة (الشكل 3 ، العمودين 11 و 12 ، على التوالي). ستكون هذه القيم مفيدة للتطبيع في الخطوة 5.5.
- افتح مستندا جديدا لتحليل البيانات. حدد تحليل X / Y ، وأدخل X كأرقام و Y ك Enter 2 قيم النسخ المتماثل في أعمدة فرعية جنبا إلى جنب.
- أدخل قيم Log10 (التخفيف) كأرقام X. أدخل RLU المكررة للعينات.
- انتقل إلى تحليل > تطبيع > وضع علامة على جميع العينات الموجودة على نفس الورقة. أدخل متوسط قيم VC و CC في كيف يتم تعريف 0٪؟، وكيف يتم تعريف 100٪؟، على التوالي. انقر فوق موافق.
- في ورقة البيانات التي تمت تسويتها، انتقل إلى تحليل > تحليلات XY > التحليلات غير الخطية (ملاءمة المنحنى). ضع علامة على كافة العينات وانقر فوق موافق. بالنسبة لاستجابة الجرعة - التثبيط ، حدد log (المانع) مقابل الاستجابة الطبيعية - المنحدر المتغير.
- ضمن قيد ، قم بتغيير HillSlope إلى يجب أن يكون أقل من 0.
- ضمن الإخراج، ضع علامة على إنشاء جدول ملخص ورسم بياني. انقر فوق موافق للحصول على التحليلات النهائية. وترد في الملف التكميلي 1 صحيفة عمل تتضمن نموذجا للتحليل.
النتائج
يصف هذا البروتوكول إنتاج الخلايا الكهروضوئية SARS-CoV-2 والتطبيق النهائي لهذه الخلايا الكهروضوئية لتحليل نشاط تحييد المصل / البلازما للأشخاص الذين يتلقون التطعيم المضاد ل COVID-1917. علاوة على ذلك ، يمكن تطبيق هذا البروتوكول لإنتاج أنماط زائفة لكل متغير مثير للقلق SARS-CoV-2 (VOC) لاختبار ت...
Discussion
على الرغم من أن استخدام فيروس من النوع البري يحاكي العدوى الفعلية ، إلا أن الفيروسات العدسية PVs هي خيار أكثر أمانا لدراسة الآليات المرتبطة بدخول الفيروس والعدوى دون متطلبات السلامة الصارمة اللازمة للعمل مع الفيروسات المسببة للأمراض4،20،21
Disclosures
يعلن أصحاب البلاغ أنه ليس لديهم تضارب في المصالح.
Acknowledgements
ونعترف بمساهمة المتطوعين العاملين في مجال الرعاية الصحية. تم دعم هذا المشروع من قبل إدارة التميز 2023/2027 ، MUR ، إيطاليا. تم دعم AR و DZ من قبل PRIN2022 (تمويل الاتحاد الأوروبي; الجيل القادمالاتحاد الأوروبي)
Materials
| Name | Company | Catalog Number | Comments |
| 0.45 μm filter | SARSTEDT | 83 1826 | |
| 6-well plate | SARSTEDT | 83 3920 | |
| 96-well plate | SARSTEDT | 8,33,924 | |
| Amicon Ultra-15 Centrifugal Filter Units | Merck | 10403892 | |
| Black Opaque 96-well Microplate | Perkin Elmer | 60005270 | |
| Dulbecco's Modified Eagle Medium | SIGMA-ALDRICH | D6546 - 500ML | |
| Dulbecco's phosphate buffered saline (PBS 1x) | AUROGENE | AU-L0615-500 | |
| Foetal Bovine Serum | AUROGENE | AU-S1810-500 | |
| Graphpad Prism version 7 | graphpad dotmatics | NA | In the manuscript, we replace the commercial name with 'data analysis program' |
| HEK293T cells | ATCC | CRL-3216 | |
| HEK293T/ACE2 cells | ATCC | CRL-3216 | HEK293T has been transduced to overexpress ACE2 with a lentiviral vector. |
| L-glutamine | AUROGENE | AU-X0550-100 | |
| Luminometer - Victor3 | Perkin Elmer | HH35000500 | In the manuscript, we replace the commercial name with 'luminometer' |
| Opti-MEM | Thermo Fisher Scientific | 11058021 | In the manuscript, we replace the commercial name with 'reduced serum medium' |
| p8.91 packaging plasmid | Di Genova et al., 2021 | A kind gift from Prof. Nigel Temperton (ref 16.) | |
| pCSFLW reporter plasmid | Di Genova et al., 2021 | A kind gift from Prof. Nigel Temperton (ref 16.) | |
| Penicillin/streptomycin | AUROGENE | AU-L0022-100 | |
| Polyethylenimine, branched (PEI) (25 kDa) | SIGMA-ALDRICH | 408727 | |
| RRL.sin.cPPT.SFFV/Ace2.IRES-puro.WPRE (MT126) | Addgene | 145839 | This plasmid was used to generate HEK293Tcells/ACE2 |
| SARS-CoV-2 Spike expressing plasmid | Addgene | pGBW-m4137382 | |
| steadylite plus Reporter Gene Assay System | Perkin Elmer | 6066759 | In the manuscript, we replaced the commercial name with 'luciferase reading reagent' |
| Trypsin EDTA 1x | AUROGENE | AU-L0949-100 |
References
- Ozaki, D. A., et al. International technology transfer of a GCLP-compliant HIV-1 neutralizing antibody assay for human clinical trials. Plos One. 7 (1), e30963 (2012).
- Pouget, M., et al. Generation of liposomes to study the effect of Mycobacterium tuberculosis lipids on HIV-1 cis- and trans-infections. International Journal of Molecular Sciences. 22 (4), 1945 (2021).
- McKay, L. G. A., et al. The HCV envelope glycoprotein down-modulates NF-κB signalling and associates with stimulation of the host endoplasmic reticulum stress pathway. Frontiers in Immunology. 13, 831695 (2022).
- Xiang, Q., Li, L., Wu, J., Tian, M., Fu, Y. Application of pseudovirus system in the development of vaccine, antiviral-drugs, and neutralizing antibodies. Microbiological Research. 258, 126993 (2022).
- Li, Q., Liu, Q., Huang, W., Li, X., Wang, Y. Current status on the development of pseudoviruses for enveloped viruses. Reviews in Medical Virology. 28, e1963 (2018).
- D'Apice, L., et al. Comparative analysis of the neutralizing activity against SARS-CoV-2 Wuhan-Hu-1 strain and variants of concern: Performance evaluation of a pseudovirus-based neutralization assay. Frontiers in Immunology. 13, 981693 (2022).
- Falzarano, D., Groseth, A., Hoenen, T. Development and application of reporter-expressing mononegaviruses: current challenges and perspectives. Antiviral Research. 103, 78-87 (2014).
- Gutierrez-Guerrero, A., Cosset, F. -. L., Verhoeyen, E. Lentiviral vector pseudotypes: Precious tools to improve gene modification of hematopoietic cells for research and gene therapy. Viruses. 12, 1016 (2020).
- Zufferey, R., Nagy, D., Mandel, R. J., Naldini, L., Trono, D. Multiply attenuated lentiviral vector achieves efficient gene delivery in vivo. Nature Biotechnology. 15 (9), 871-875 (1997).
- Dull, T. A third-generation lentivirus vector with a conditional packaging system. Journal of Virology. 72 (11), 8463-8471 (1998).
- Berkhout, B. A Fourth generation lentiviral Vector: Simplifying genomic gymnastics. Molecular Therapy. 25 (8), 1741-1743 (2017).
- Wu, X. Development and evaluation of a pseudovirus-luciferase assay for rapid and quantitative detection of neutralizing antibodies against Enterovirus 71. Plos One. 8 (6), e64116 (2013).
- Ferrara, F., et al. Development of lentiviral vectors pseudotyped with Influenza B hemagglutinins: application in vaccine immunogenicity, mAb potency, and sero-surveillance studies. Frontiers in Immunology. 12, 661379 (2021).
- Hu, J., et al. Development of cell-based pseudovirus entry assay to identify potential viral entry inhibitors and neutralizing antibodies against SARS-CoV-2. Genes & Diseases. 7 (4), 551-557 (2020).
- Dalle Carbonare, L., et al. Serology study after BTN162b2 vaccination in participants previously infected with SARS-CoV-2 in two different waves versus naïve. Communications Medicine. 1 (1), 38 (2021).
- Di Genova, C., et al. Production, titration, neutralisation, storage and lyophilisation of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) lentiviral pseudotypes. Bio-protocol. 11 (21), e4236 (2021).
- Chmielewska, A. M., Czarnota, A., Bieńkowska-Szewczyk, K., Grzyb, K. Immune response against SARS-CoV-2 variants: The role of neutralization assays. NPJ Vaccines. 6 (1), 1-8 (2021).
- Chen, Q., et al. Development and optimization of a sensitive pseudovirus-based assay for HIV-1 neutralizing antibodies detection using A3R5 cells. Human Vaccines & Immunotherapeutics. 14 (1), 199-208 (2018).
- Gauger, P. C., Vincent, A. L. Serum virus neutralization assay for detection and quantitation of serum neutralizing antibodies to influenza A virus in swine. Methods in Molecular Biology (Clifton, N.J). 2123, 321-333 (2020).
- Miglietta, R., Pastori, C., Venuti, A., Ochsenbauer, C., Lopalco, L. Synergy in monoclonal antibody neutralization of HIV-1 pseudoviruses and infectious molecular clones. Journal of Translational Medicine. 12 (1), 346 (2014).
- Chen, M., Zhang, X. -. E. Construction and applications of SARS-CoV-2 pseudoviruses: A mini review. International Journal of Biological Sciences. 17 (6), 1574-1580 (2021).
- Zipeto, D., et al. Induction of human immunodeficiency virus neutralizing antibodies using fusion complexes. Microbes and Infection. 8 (6), 1424-1433 (2006).
- WHO Coronavirus (COVID-19) Dashboard. Available from: https://covid19.who.int (2022)
- Zhou, P. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 579 (7798), 270-273 (2020).
- Chen, X., Huang, H., Ju, J., Sun, R., Zhang, J. Impact of vaccination on the COVID-19 pandemic in U.S. states. Scientific Reports. 12 (1), 1554 (2022).
- Stefani, C., Fantoni, T., Bissoli, M., Thomas, J., Ruggiero, A. HIV and SARS-CoV-2 Co-Infection: From Population Study Evidence to In Vitro Studies. Life. 12 (12), 2089 (2022).
- Watson, O. J., et al. Global impact of the first year of COVID-19 vaccination: a mathematical modelling study. The Lancet Infectious Diseases. 22 (9), 1293-1302 (2022).
- Cantoni, D. Analysis of antibody neutralisation activity against SARS-CoV-2 variants and seasonal human coronaviruses NL63, HKU1, and 229E induced by three different COVID-19 vaccine olatforms. Vaccines. 11 (1), 58 (2023).
- Siracusano, G., et al. Different decay of antibody response and VOC sensitivity in naïve and previously infected subjects at 15 weeks following vaccination with BNT162b2. Journal of Translational Medicine. 20 (1), 22 (2022).
- Ruggiero, A. SARS-CoV-2 vaccination elicits unconventional IgM specific responses in naïve and previously COVID-19-infected individuals. eBioMedicine. 77, (2022).
- Piubelli, C. Subjects who developed SARS-CoV-2 specific IgM after vaccination show a longer humoral immunity and a lower frequency of infection. eBioMedicine. 89, 104471 (2023).
- Zhang, G. F. Infectivity of pseudotyped SARS-CoV-2 variants of concern in different human cell types and inhibitory effects of recombinant spike protein and entry-related cellular factors. Journal of Medical Virology. 95 (1), e28437 (2023).
- da Costa, K. A. S. Influenza A (N1-N9) and Influenza B (B/Victoria and B/Yamagata) neuraminidase pseudotypes as tools for pandemic preparedness and improved influenza vaccine design. Vaccines. 10 (9), 1520 (2022).
- Condor Capcha, J. M. Generation of SARS-CoV-2 spike pseudotyped virus for viral entry and neutralization assays: a 1-week protocol. Frontiers in Cardiovascular Medicine. 7, 618651 (2021).
- Diomede, L., et al. Doxycycline inhibition of a pseudotyped virus transduction does not translate to inhibition of SARS-CoV-2 infectivity. Viruses. 13 (9), 1745 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved