需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
假型病毒作为通过中和测定监测针对 SARS-CoV-2 的体液免疫反应的分子工具
* 这些作者具有相同的贡献
摘要
假型病毒 (PV) 是复制缺陷的病毒粒子,用于在比处理真实病毒更安全的条件下研究宿主-病毒相互作用。这里介绍的是一个详细的方案,显示了如何使用 SARS-CoV-2 PV 来测试 COVID-19 疫苗接种后患者血清的中和能力。
摘要
假型病毒 (PV) 是一种分子工具,可用于研究宿主-病毒相互作用和测试血清样本的中和能力,此外,它们在基因治疗中更广为人知的用途是递送目标基因。PV 具有复制缺陷,因为病毒基因组被分成不同的质粒,这些质粒未掺入 PV 中。这种安全且多功能的系统允许在生物安全 2 级实验室中使用 PV。在这里,我们提出了一种基于此处提到的三种质粒生产慢病毒 PV 的通用方法:(1) 携带监测感染所需的报告基因的骨架质粒;(2)包装质粒携带产生PV所需的所有结构蛋白的基因;(3)包膜表面糖蛋白表达质粒,决定病毒嗜性并介导病毒进入宿主细胞。在这项工作中,SARS-CoV-2 Spike 是用于生产非复制性 SARS-CoV-2 假型慢病毒的包膜糖蛋白。
简而言之,使用标准方法将包装细胞 (HEK293T) 与三种不同的质粒共转染。48小时后,收获含有PV的上清液,过滤,并在-80°C下储存。 通过研究感染后 48 小时靶细胞系中报告基因(荧光素酶)的表达来测试 SARS-CoV-2 PV 的感染性。相对发光单位 (RLU) 的值越高,感染/转导率越高。此外,将传染性PV添加到连续稀释的血清样品中,以研究假病毒进入靶细胞的中和过程,以RLU强度的降低来衡量:较低的值对应于高中和活性。
引言
假型病毒 (PV) 是微生物学中用于研究宿主-病毒和病原体-病原体相互作用的分子工具 1,2,3,4。PV 由内部部分(保护病毒基因组的病毒核心)和外部部分(定义向性5 的病毒表面的包膜糖蛋白)组成。假病毒在靶细胞中是复制不合格的,因为它不包含产生新病毒颗粒的所有遗传信息。这种特殊特征的组合使PV成为野生型病毒的安全替代品。另一方面,野生型病毒具有高致病性,不能在 BSL 2 实验室中用于分析6。
PV的传染性可以通过报告基因来监测,报告基因通常编码荧光蛋白(GFP、RFP、YFP)或产生化学发光产物的酶(荧光素酶)。它包含在用于 PV 生产的质粒之一中,并掺入假病毒7 的基因组中。
目前存在几种类型的 PV 核心,包括基于 HIV-1 基因组的慢病毒衍生颗粒。与其他平台相比,基于 HIV-1 的 PV 的最大优势在于它们在靶细胞基因组中的内在整合过程8。尽管HIV-1是一种高度传染性的病毒,并且是艾滋病的病原体,但由于多年来进行了广泛的优化步骤,这些慢病毒载体可以安全使用。通过引入第二代慢病毒载体实现了最佳安全条件,其中病毒基因在不影响转导能力的情况下被耗尽9。第 3 代和第 4 代有助于提高慢病毒载体处理的安全性,将病毒基因组进一步分裂为单独的质粒10,11。最新一代的PV通常用于生产用于基因治疗的慢病毒载体。
PV可用于研究病毒和宿主细胞之间的相互作用,包括生产和感染阶段。PV 特别用于假病毒中和测定 (PVNA)。PVNA 经过广泛验证,可通过靶向 PV 包膜上的病毒糖蛋白来评估血清或血浆的中和潜力12,13。中和活性,表示为抑制浓度 50 (IC50),定义为血清/血浆的稀释,阻断 50% 的病毒颗粒进入14。在该方案中,我们描述了 PVNA 的设置,以测试在接受加强疫苗剂量之前和之后收集的血清中针对严重急性呼吸系统综合症 - 冠状病毒 2 (SARS-CoV-2) 的抗体活性。
研究方案
本协议已获得维罗纳大学伦理委员会的批准并遵循其指导方针(批准协议编号 1538)。从参与研究的人类受试者那里获得知情书面同意。从正在接种抗SARS-CoV-2疫苗的医护人员(HCW)志愿者身上采集全血样本。将这些样品收集在含有抗凝剂的塑料管中,以便随后分离血清15。
以下所有过程必须在 2 类生物罩中执行,在无菌条件下工作。必须小心处理病毒,所有废物必须在稀释的漂白剂溶液中中和。该协议的概述如 图 1 所示。
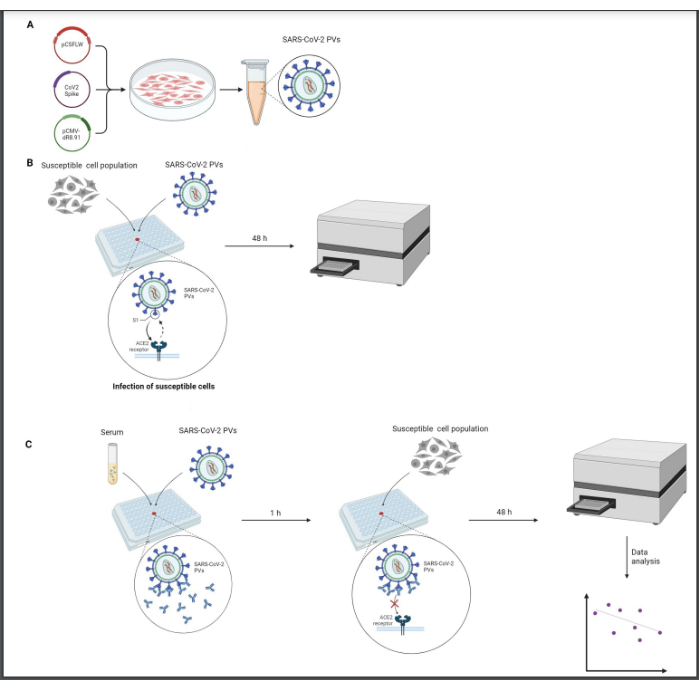
图 1:中和测定的图形表示。 (A)PV生产,(B)PV滴定和(C)中和测定。所有程序均在无菌条件下在 2 级生物罩中进行。在用于中和测定 (C) 之前,需要执行滴定步骤 (B) 以标准化 PV 的感染性水平。本矢量图使用BioRender创作。 请点击这里查看此图的较大版本.
1. SARS-CoV-2 PVs的产生和感染性检测
- 将 5 x 105 HEK293T细胞接种在完整的 Dulbecco 改良 Eagle 培养基(DMEM、高葡萄糖、10% 胎牛血清 (FBS)、1% L-谷氨酰胺、1% 青霉素/链霉素)中,放入 6 孔板 (6WP) 中,以达到与所用转染试剂相容的合适细胞密度。在用聚乙烯亚胺(PEI)进行转染的情况下(按照制造商的说明制备试剂),确保细胞在转染当天达到40-60%的密度(步骤1.3)。将细胞保存在37°C和5%CO2的加湿培养箱中。
- 转染前,用不含抗生素的新鲜培养基(DMEM、高糖、10% FBS、1% L-谷氨酰胺)替换废细胞培养基,以获得更高的转染效率。
注意:接种后的第二天,HEK293T细胞就可以转染了。 - 根据制造商的说明,使用合适的转染试剂转染贴壁HEK293T细胞。如果使用 PEI,请准备两种混合物并按照以下步骤操作。
- 要制备混合物 A,请在 100 μL 还原血清培养基中加入 500 ng pCMV-dR8.91 包装质粒16、750 ng pCSFLW 报告质粒16 和 450 ng SARS-CoV-2 Spike 表达质粒。
- 要制备混合物 B,将 17.5 μL PEI(浓度:1 mg/mL)加入 100 μL 还原血清培养基中。
- 让两种混合物在室温 (RT) 下孵育 5 分钟。接下来,通过将PEI混合物B添加到DNA混合物A中,将两个试管的内容物混合在一起。
- 将试管在室温下孵育20-30分钟,每3-4分钟轻弹一次试管以增强混合。最后,将混合物添加到HEK293T细胞中。
- 转染后16-20小时,用新鲜的完全DMEM替换培养基。在37°C和5%CO2下孵育,以便通过转染细胞产生PV。
- 转染后72小时,收获含有PV的上清液。然后在室温下以1600× g 离心7分钟以除去细胞碎片和死细胞,并通过0.45μm醋酸纤维素过滤器过滤。
- 可选步骤:为了提高 PV 滴度的最终产量,进行多次转染,将含有 PV 的细胞培养基混合起来,并使用浓缩管进行浓缩。
- 直接进行后续步骤(“PV滴定”,第2节)或将含有PV的介质等分装在合适的管中,以在-80°C下储存直至使用。准备额外的等分试样(400-500μL)用于滴定。
注意:制作多个等分试样将避免过多的解冻-冷冻循环,从而保证实验之间的可重复性。
2. PV滴定
- 使用新鲜的含PV的培养基进行后续步骤或解冻测试等分试样(步骤1.7)以对新病毒储备液进行滴定。冷冻相同光伏原料的等分试样将保证可重复性。
- 在 96 孔板 (96WP) 的所有孔中加入 50 μL 完全 DMEM(或与正在使用的靶细胞系兼容的完全培养基),以重复测试 PV 原液,使行“A”留空。将 100 μL PV 原液加入“A”行。根据要测试的制剂数量,留下一根没有病毒的色谱柱作为“仅细胞”对照(图2)。
- 将 50 μL 从 A 行移液到 B 行,并重复此过程直至行 G 以获得初始储备液的连续稀释度。丢弃最后一行的多余音量。
- 在除去用过的培养基并用DPBS 1x洗涤细胞两次后,在Dulbecco的磷酸盐缓冲盐水1x(DPBS 1x)中使用胰蛋白酶/乙二胺四乙酸1x(EDTA)分离细胞。制备细胞的密度为 4 x 105 个细胞/mL。
注意:在该方案中,在易感细胞系HEK293T / ACE2上测试了PVs感染;这些细胞来源于HEK293T,使用慢病毒载体转导以表达ACE2受体。 - 向每个孔中加入 50 μL 细胞悬液,以确保每孔细胞计数为 2 x 104 个细胞。
- 在37°C和5%CO2下孵育48小时。
- 孵育后,按照制造商的说明进行荧光素酶测定以获得读数。向孔中加入 100 μL 荧光素酶试剂,并在室温下避光孵育 2 分钟。将每个孔的内容物移动到黑色 96 孔板(与可用的酶标仪兼容)中,并在 96 孔板读数仪中读取板。
注意:用于荧光素酶读数的光度计将生成一个电子表格文件,其中包含将用于下游分析的原始未处理数据(在本例中为 Excel 文件)。病毒的传染性将表示为相对发光单位 (RLU)(见第 4.1 段)。
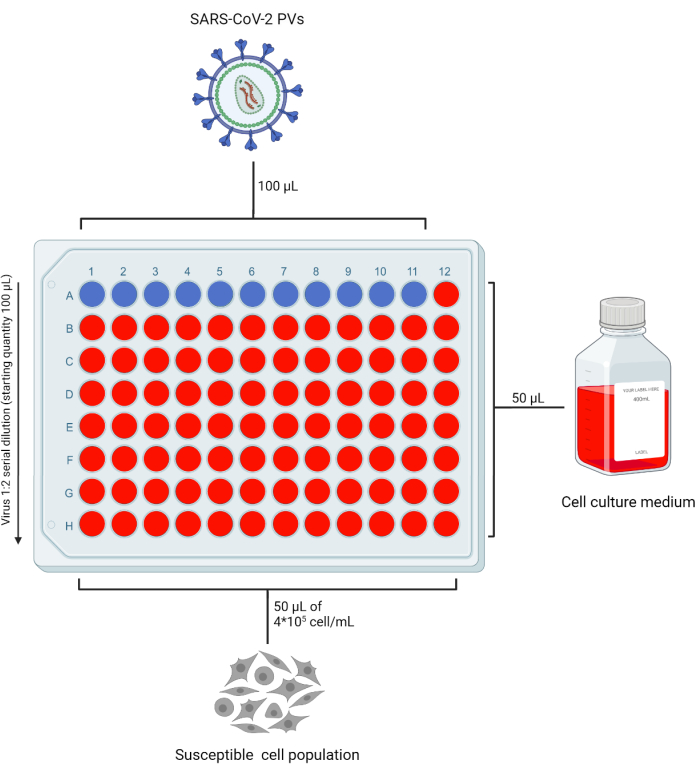
图 2:用于 PV 滴定的 96 孔板的代表性布局。 将固定体积的含PV的上清液加入到A行第1-11列中,并连续稀释。最后一列保留为“仅单元格”控件。本矢量图使用BioRender创作。 请点击这里查看此图的较大版本.
3.中和试验
- 在冰上解冻患者的血清。通过在56°C下孵育30分钟灭活血清样品。
- 在 96 孔板中,在以下每个孔中加入 50 μL 新鲜的完全 DMEM(或与所用靶细胞系兼容的完全培养基):从 B 行(1-10 列)到 H 行(1-10 列)。将 95 μL 新鲜、完整的 DMEM 放入 A 行(第 1-10 列)。将 50 μL 和 100 μL 完全 DMEM 分别加入 11 和 12 列的孔中。这些将分别是受感染的(病毒对照或VC)和未感染的(仅细胞或CC)对照(图3)。
- 在 A 行(第 1-10 列)中加入 5 μL 热灭活血清/血浆样品。每个样本将一式两份。使用多通道移液器,将第一行中的样品混合,并将50μL含有血清的培养基从A行移动到B行,重复此过程至最后一行(图3)。弃去剩余的 50 μL。
- 解冻必要数量的 PV 等分试样并稀释至 ≥ 104 RLU/mL。使用多通道移液器向每个孔(从第 1 列到第 11 列)中加入 50 μL 稀释的含 PV 培养基,以达到热灭活血清/血浆对病毒的 1:1 稀释。在37°C和5%CO2下孵育1小时,以使血清样品中的抗体与PV上的SARS-CoV-2刺突蛋白结合。
- 制备至少 5 mL 的敏感细胞悬浮液 (HEK293T/ACE2),细胞密度为 4 x 105 个细胞/mL。向每个孔中加入50μL细胞悬液,并在37°C和5%CO2下孵育48小时。
- 孵育后,按照制造商的说明进行荧光素酶测定读数,如步骤2.7中所述。
注意:用于荧光素酶读数的光度计将生成一个电子表格文件(在本例中为 .xlsx),其中包含将用于下游分析的原始未处理数据(荧光素酶测定文件)。
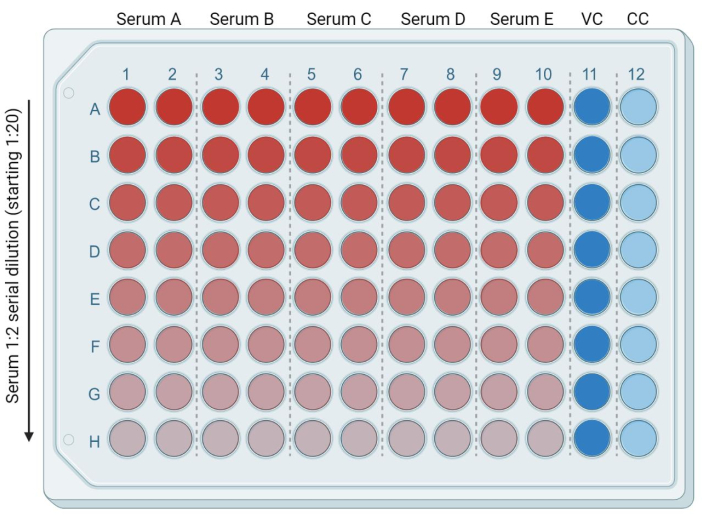
图 3:基于血清稀释度的平板表示。 鲜红色对应于较高量的血清,亮蓝色泳道(第 11 列)对应于受感染的细胞对照(VC、病毒对照)。浅蓝色泳道(第 12 列)对应于未感染的细胞(CC,细胞对照)。本矢量图使用BioRender创作。 请点击这里查看此图的较大版本.
4. 滴定分析
- 在荧光素酶检测文件上,为相应的样品指定名称/标题。
- 将 RLU 测量值乘以稀释因子(从网格的顶部到底部:20x、40x、80x、160x、320x、640x、1,280x、2,560x)得到 RLU/mL。如果使用不同的稀释因子,请相应地更改乘法因子。
- 计算每种 PV 制备的平均 RLU/mL。
5. PVs中和分析
- 在荧光素酶检测电子表格文件(在本例中为 .xlsx)上,为测试样品指定相应的标题。输入样品的稀释系数(40s、80x、160x、320x、640x、1,280x、2,560x、5,120x)。计算稀释因子的 Log10。
- 计算未感染和感染对照的平均RLU(图3,分别为第11列和第12列)。这些值对于步骤 5.5 中的归一化很有用。
- 打开一个新文档进行数据分析。选择 X/Y 分析,输入 X 作为 数字 ,将 Y 输入为并 排子列中的 2 个重复值。
- 输入 Log10(稀释)值作为 X 数字。输入样本的重复 RLU。
- 转到 分析>归一化>标记 同一张纸上的所有样品。分别在 “如何定义 0%?”和 “如何定义 100%?”中输入平均 VC 和 CC 值。单击 “确定”。
- 在归一化数据表上,转至 分析> XY 分析>非线性分析(曲线拟合)。标记所有示例,然后单击 “确定”。对于 剂量反应 - 抑制,选择 对数(抑制剂)与归一化反应 - 可变斜率。
- 在 “约束”下,将 “HillSlope ”更改为 “必须小于 0”。
- 在 “输出”下,标记 “创建汇总表和图形”。单击“ 确定 ”获取最终分析。 补充文件 1 中提供了带有分析模板的工作表。
结果
该协议描述了 SARS-CoV-2 PV 的产生以及这些 PV 的下游应用,以分析接受抗 COVID-19 疫苗接种的受试者血清/血浆的中和活性17。此外,该协议可用于产生每个 SARS-CoV-2 关注变体 (VOC) 的假型,以测试中和反应的演变。尽管该协议有助于研究 COVID-19 疫苗接种后的体液免疫反应,但它可以适应于轻松测试不同血清/血浆对不同病毒的中和作用 13,18,19。
讨论
尽管使用野生型病毒模拟实际感染,但慢病毒 PV 是研究与病毒进入和感染相关的机制的更安全选择,而无需处理致病病毒所需的严格安全要求 4,20,21。PV 由复制缺陷的病毒核心组成,该核心被致病病毒的表面包膜糖蛋白包围,这是研究的目的。
基于 HIV-1 的 PV 是使用最广泛的平台之一,这些平台已在该协?...
披露声明
作者声明没有利益冲突。
致谢
我们感谢卫生保健工作者志愿者的贡献。该项目得到了意大利 MUR 2023/2027 卓越部的支持。AR 和 DZ 得到了 PRIN2022(欧盟资助;下一代欧盟)
材料
| Name | Company | Catalog Number | Comments |
| 0.45 μm filter | SARSTEDT | 83 1826 | |
| 6-well plate | SARSTEDT | 83 3920 | |
| 96-well plate | SARSTEDT | 8,33,924 | |
| Amicon Ultra-15 Centrifugal Filter Units | Merck | 10403892 | |
| Black Opaque 96-well Microplate | Perkin Elmer | 60005270 | |
| Dulbecco's Modified Eagle Medium | SIGMA-ALDRICH | D6546 - 500ML | |
| Dulbecco's phosphate buffered saline (PBS 1x) | AUROGENE | AU-L0615-500 | |
| Foetal Bovine Serum | AUROGENE | AU-S1810-500 | |
| Graphpad Prism version 7 | graphpad dotmatics | NA | In the manuscript, we replace the commercial name with 'data analysis program' |
| HEK293T cells | ATCC | CRL-3216 | |
| HEK293T/ACE2 cells | ATCC | CRL-3216 | HEK293T has been transduced to overexpress ACE2 with a lentiviral vector. |
| L-glutamine | AUROGENE | AU-X0550-100 | |
| Luminometer - Victor3 | Perkin Elmer | HH35000500 | In the manuscript, we replace the commercial name with 'luminometer' |
| Opti-MEM | Thermo Fisher Scientific | 11058021 | In the manuscript, we replace the commercial name with 'reduced serum medium' |
| p8.91 packaging plasmid | Di Genova et al., 2021 | A kind gift from Prof. Nigel Temperton (ref 16.) | |
| pCSFLW reporter plasmid | Di Genova et al., 2021 | A kind gift from Prof. Nigel Temperton (ref 16.) | |
| Penicillin/streptomycin | AUROGENE | AU-L0022-100 | |
| Polyethylenimine, branched (PEI) (25 kDa) | SIGMA-ALDRICH | 408727 | |
| RRL.sin.cPPT.SFFV/Ace2.IRES-puro.WPRE (MT126) | Addgene | 145839 | This plasmid was used to generate HEK293Tcells/ACE2 |
| SARS-CoV-2 Spike expressing plasmid | Addgene | pGBW-m4137382 | |
| steadylite plus Reporter Gene Assay System | Perkin Elmer | 6066759 | In the manuscript, we replaced the commercial name with 'luciferase reading reagent' |
| Trypsin EDTA 1x | AUROGENE | AU-L0949-100 |
参考文献
- Ozaki, D. A., et al. International technology transfer of a GCLP-compliant HIV-1 neutralizing antibody assay for human clinical trials. Plos One. 7 (1), e30963 (2012).
- Pouget, M., et al. Generation of liposomes to study the effect of Mycobacterium tuberculosis lipids on HIV-1 cis- and trans-infections. International Journal of Molecular Sciences. 22 (4), 1945 (2021).
- McKay, L. G. A., et al. The HCV envelope glycoprotein down-modulates NF-κB signalling and associates with stimulation of the host endoplasmic reticulum stress pathway. Frontiers in Immunology. 13, 831695 (2022).
- Xiang, Q., Li, L., Wu, J., Tian, M., Fu, Y. Application of pseudovirus system in the development of vaccine, antiviral-drugs, and neutralizing antibodies. Microbiological Research. 258, 126993 (2022).
- Li, Q., Liu, Q., Huang, W., Li, X., Wang, Y. Current status on the development of pseudoviruses for enveloped viruses. Reviews in Medical Virology. 28, e1963 (2018).
- D'Apice, L., et al. Comparative analysis of the neutralizing activity against SARS-CoV-2 Wuhan-Hu-1 strain and variants of concern: Performance evaluation of a pseudovirus-based neutralization assay. Frontiers in Immunology. 13, 981693 (2022).
- Falzarano, D., Groseth, A., Hoenen, T. Development and application of reporter-expressing mononegaviruses: current challenges and perspectives. Antiviral Research. 103, 78-87 (2014).
- Gutierrez-Guerrero, A., Cosset, F. -. L., Verhoeyen, E. Lentiviral vector pseudotypes: Precious tools to improve gene modification of hematopoietic cells for research and gene therapy. Viruses. 12, 1016 (2020).
- Zufferey, R., Nagy, D., Mandel, R. J., Naldini, L., Trono, D. Multiply attenuated lentiviral vector achieves efficient gene delivery in vivo. Nature Biotechnology. 15 (9), 871-875 (1997).
- Dull, T. A third-generation lentivirus vector with a conditional packaging system. Journal of Virology. 72 (11), 8463-8471 (1998).
- Berkhout, B. A Fourth generation lentiviral Vector: Simplifying genomic gymnastics. Molecular Therapy. 25 (8), 1741-1743 (2017).
- Wu, X. Development and evaluation of a pseudovirus-luciferase assay for rapid and quantitative detection of neutralizing antibodies against Enterovirus 71. Plos One. 8 (6), e64116 (2013).
- Ferrara, F., et al. Development of lentiviral vectors pseudotyped with Influenza B hemagglutinins: application in vaccine immunogenicity, mAb potency, and sero-surveillance studies. Frontiers in Immunology. 12, 661379 (2021).
- Hu, J., et al. Development of cell-based pseudovirus entry assay to identify potential viral entry inhibitors and neutralizing antibodies against SARS-CoV-2. Genes & Diseases. 7 (4), 551-557 (2020).
- Dalle Carbonare, L., et al. Serology study after BTN162b2 vaccination in participants previously infected with SARS-CoV-2 in two different waves versus naïve. Communications Medicine. 1 (1), 38 (2021).
- Di Genova, C., et al. Production, titration, neutralisation, storage and lyophilisation of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) lentiviral pseudotypes. Bio-protocol. 11 (21), e4236 (2021).
- Chmielewska, A. M., Czarnota, A., Bieńkowska-Szewczyk, K., Grzyb, K. Immune response against SARS-CoV-2 variants: The role of neutralization assays. NPJ Vaccines. 6 (1), 1-8 (2021).
- Chen, Q., et al. Development and optimization of a sensitive pseudovirus-based assay for HIV-1 neutralizing antibodies detection using A3R5 cells. Human Vaccines & Immunotherapeutics. 14 (1), 199-208 (2018).
- Gauger, P. C., Vincent, A. L. Serum virus neutralization assay for detection and quantitation of serum neutralizing antibodies to influenza A virus in swine. Methods in Molecular Biology (Clifton, N.J). 2123, 321-333 (2020).
- Miglietta, R., Pastori, C., Venuti, A., Ochsenbauer, C., Lopalco, L. Synergy in monoclonal antibody neutralization of HIV-1 pseudoviruses and infectious molecular clones. Journal of Translational Medicine. 12 (1), 346 (2014).
- Chen, M., Zhang, X. -. E. Construction and applications of SARS-CoV-2 pseudoviruses: A mini review. International Journal of Biological Sciences. 17 (6), 1574-1580 (2021).
- Zipeto, D., et al. Induction of human immunodeficiency virus neutralizing antibodies using fusion complexes. Microbes and Infection. 8 (6), 1424-1433 (2006).
- WHO Coronavirus (COVID-19) Dashboard. Available from: https://covid19.who.int (2022)
- Zhou, P. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 579 (7798), 270-273 (2020).
- Chen, X., Huang, H., Ju, J., Sun, R., Zhang, J. Impact of vaccination on the COVID-19 pandemic in U.S. states. Scientific Reports. 12 (1), 1554 (2022).
- Stefani, C., Fantoni, T., Bissoli, M., Thomas, J., Ruggiero, A. HIV and SARS-CoV-2 Co-Infection: From Population Study Evidence to In Vitro Studies. Life. 12 (12), 2089 (2022).
- Watson, O. J., et al. Global impact of the first year of COVID-19 vaccination: a mathematical modelling study. The Lancet Infectious Diseases. 22 (9), 1293-1302 (2022).
- Cantoni, D. Analysis of antibody neutralisation activity against SARS-CoV-2 variants and seasonal human coronaviruses NL63, HKU1, and 229E induced by three different COVID-19 vaccine olatforms. Vaccines. 11 (1), 58 (2023).
- Siracusano, G., et al. Different decay of antibody response and VOC sensitivity in naïve and previously infected subjects at 15 weeks following vaccination with BNT162b2. Journal of Translational Medicine. 20 (1), 22 (2022).
- Ruggiero, A. SARS-CoV-2 vaccination elicits unconventional IgM specific responses in naïve and previously COVID-19-infected individuals. eBioMedicine. 77, (2022).
- Piubelli, C. Subjects who developed SARS-CoV-2 specific IgM after vaccination show a longer humoral immunity and a lower frequency of infection. eBioMedicine. 89, 104471 (2023).
- Zhang, G. F. Infectivity of pseudotyped SARS-CoV-2 variants of concern in different human cell types and inhibitory effects of recombinant spike protein and entry-related cellular factors. Journal of Medical Virology. 95 (1), e28437 (2023).
- da Costa, K. A. S. Influenza A (N1-N9) and Influenza B (B/Victoria and B/Yamagata) neuraminidase pseudotypes as tools for pandemic preparedness and improved influenza vaccine design. Vaccines. 10 (9), 1520 (2022).
- Condor Capcha, J. M. Generation of SARS-CoV-2 spike pseudotyped virus for viral entry and neutralization assays: a 1-week protocol. Frontiers in Cardiovascular Medicine. 7, 618651 (2021).
- Diomede, L., et al. Doxycycline inhibition of a pseudotyped virus transduction does not translate to inhibition of SARS-CoV-2 infectivity. Viruses. 13 (9), 1745 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。