Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Псевдотипированные вирусы как молекулярный инструмент мониторинга гуморальных иммунных реакций против SARS-CoV-2 с помощью нейтрализационного анализа
* Эти авторы внесли равный вклад
В этой статье
Резюме
Псевдотипированные вирусы (ЛВ) представляют собой вирионы с дефектами репликации, которые используются для изучения взаимодействий между хозяином и вирусом в более безопасных условиях, чем при работе с подлинными вирусами. Здесь представлен подробный протокол, показывающий, как ПВ SARS-CoV-2 можно использовать для проверки нейтрализующей способности сыворотки крови пациентов после вакцинации против COVID-19.
Аннотация
Псевдотипированные вирусы (ЛВ) представляют собой молекулярные инструменты, которые могут быть использованы для изучения взаимодействий между вирусом хозяина и для проверки нейтрализующей способности образцов сыворотки, в дополнение к их более известному использованию в генной терапии для доставки интересующего гена. ФВ являются дефектными для репликации, потому что вирусный геном разделен на различные плазмиды, которые не включены в ФВ. Эта безопасная и универсальная система позволяет использовать фотоэлектрические элементы в лабораториях 2-го уровня биобезопасности. Здесь мы представляем общую методологию получения лентивирусных ВП на основе трех плазмид, упомянутых здесь: (1) основная плазмида, несущая репортерный ген, необходимый для мониторинга инфекции; (2) упаковочная плазмида, несущая гены всех структурных белков, необходимых для генерации PV; (3) плазмида экспрессии гликопротеина на поверхности оболочки, которая определяет тропизм вируса и опосредует проникновение вируса в клетку-хозяина. В этой работе SARS-CoV-2 Spike представляет собой гликопротеин оболочки, используемый для производства нерепликативных псевдотипированных лентивирусов SARS-CoV-2.
Вкратце, упаковочные клетки (HEK293T) были котрансфицированы тремя различными плазмидами с использованием стандартных методов. Через 48 ч надосадочную жидкость, содержащую PV, собирали, фильтровали и хранили при -80 °C. Инфекционность ВВ SARS-CoV-2 проверяли путем изучения экспрессии репортерного гена (люциферазы) в клеточной линии-мишени через 48 ч после заражения. Чем выше значение единиц относительной люминесценции (RLU), тем выше частота заражения/трансдукции. Кроме того, к последовательно разбавленным образцам сыворотки крови добавляли инфекционные ФВ для изучения процесса нейтрализации проникновения псевдовирусов в клетки-мишени, измеряемого как снижение интенсивности РЛУ: более низкие значения, соответствующие высокой нейтрализующей активности.
Введение
Псевдотипированные вирусы (ФВ) — это молекулярные инструменты, используемые в микробиологии для изучения взаимодействий вируса-хозяина и патоген-патоген 1,2,3,4. PV состоят из внутренней части, вирусного ядра, которое защищает вирусный геном, и внешней части, гликопротеинов оболочки на поверхности вируса, которые определяюттропизм. Псевдовирус неспособен к репликации в клетке-мишени, потому что он не содержит всей генетической информации для генерации новых вирусных частиц. Такое сочетание специфических особенностей делает PV безопасной альтернативой вирусу дикого типа. Вирусы дикого типа, с другой стороны, высокопатогенны и не могут быть использованы в лабораториях BSL 2 для анализа6.
Инфекционность ФВ может контролироваться репортерным геном, обычно кодирующим флуоресцентный белок (GFP, RFP, YFP) или фермент, продуцирующий хемилюминесцентные продукты (люциферазу). Он содержится в одной из плазмид, используемых для производства ФВ, и включен в геном псевдовируса7.
В настоящее время существует несколько типов фотоэлектрических ядер, в том числе лентивиральные частицы, основанные на геноме ВИЧ-1. Большим преимуществом ПВ на основе ВИЧ-1 перед другими платформами является их внутренний процесс интеграции в геном клетки-мишени8. Несмотря на то, что ВИЧ-1 является высококонтагиозным вирусом и возбудителем СПИДа, эти лентивирусные векторы безопасны для использования благодаря обширным этапам оптимизации, которые были предприняты на протяжении многих лет. Оптимальные условия безопасности были достигнуты при введении 2-х лентивирусных векторовnd-го поколения, в которых вирусные гены истощались без влияния на трансдукционные возможности9. 3-е и4-е поколения способствовали повышению безопасности работы с лентивирусным вектором с дальнейшим расщеплением вирусного генома на отдельные плазмиды10,11. Последние поколения ФВ, как правило, используются для производства лентивирусных векторов для генной терапии.
PV могут быть использованы для изучения взаимодействия между вирусами и клетками хозяина, как на этапе производства, так и на этапе заражения. ФВ особенно используются в анализах на нейтрализацию псевдовирусов (ПВНК). ПВНК широко валидированы для оценки потенциала нейтрализации сыворотки или плазмы путем воздействия на вирусный гликопротеин на оболочке ЛП12,13. Нейтрализационная активность, выраженная как ингибирующая концентрация 50 (IC50), определяется как разбавление сыворотки/плазмы, которое блокирует 50% проникновения вирусных частиц14. В этом протоколе мы описали настройку ПВНА для проверки активности антител против тяжелого острого респираторного синдрома - коронавируса 2 (SARS-CoV-2) в сыворотках, собранных до и после получения бустерной дозы вакцины.
протокол
Настоящий протокол был одобрен и соответствует руководящим принципам Этического комитета Университета Вероны (протокол утверждения No 1538). От людей, участвовавших в исследовании, было получено информированное письменное согласие. Образцы цельной крови были взяты у добровольцев из числа медицинских работников, которые находились в процессе получения вакцин против SARS-CoV-2. Эти образцы собирали в пластиковые пробирки, содержащие антикоагулянты, для последующего выделения сыворотки15.
Все последующие процессы должны выполняться в биологическом колпаке класса 2, работающем в стерильных условиях. Обращение с вирусами должно выполняться осторожно, а все отходы должны быть нейтрализованы в разбавленном растворе хлорной извести. Обзор протокола показан на рисунке 1.
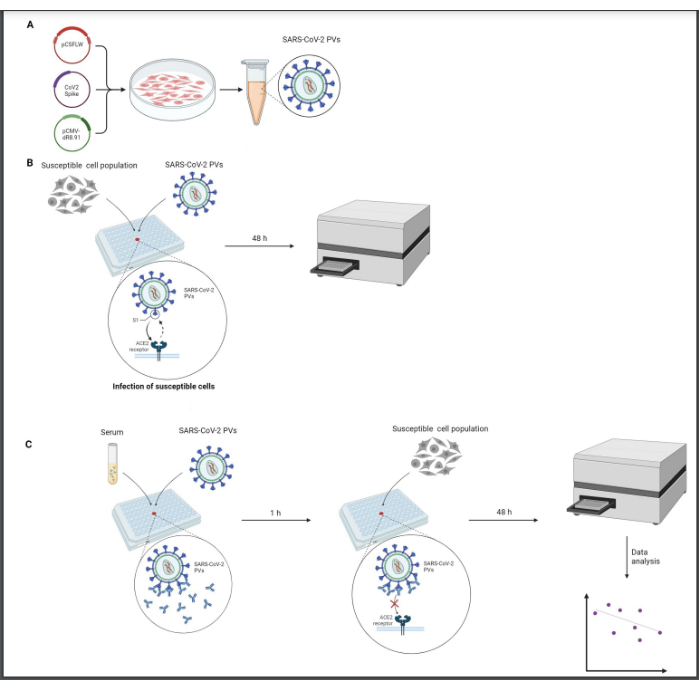
Рисунок 1: Графическое представление анализа нейтрализации. (A) производство PV, (B) титрование PV и (C) анализ нейтрализации. Все процедуры проводятся в биологическом колпаке 2 класса в стерильных условиях. Этап титрования (B) должен быть выполнен для стандартизации уровней инфекционности PV перед использованием в анализе нейтрализации (C). Эта фигура была создана с помощью BioRender. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
1. Тест на производство и инфекционность SARS-CoV-2
- Засейте 5 x 105 HEK293T клеток в полную модифицированную среду Dulbecco Modified Eagle Medium (DMEM, высокое содержание глюкозы, 10% эмбриональной бычьей сыворотки (FBS), 1% L-глютамин, 1% пенициллин/стрептомицин) в 6-луночную планшет (6WP) для достижения подходящей плотности клеток, совместимой с используемым реагентом для трансфекции. В случае проведения трансфекции полиэтиленинимином (PEI) (приготовьте реагент в соответствии с инструкциями производителя), убедитесь, что клетки достигают 40-60% плотности в день трансфекции (шаг 1.3). Хранят клетки в увлажненном инкубаторе при температуре 37 °C и 5%CO2.
- Перед трансфекцией замените отработанную клеточную среду свежей средой без антибиотиков (DMEM, с высоким содержанием глюкозы, 10% FBS, 1% L-глютамина) для достижения более высокой эффективности трансфекции.
ПРИМЕЧАНИЕ: На следующий день после посева HEK293T клетки готовы к трансфекции. - Трансфицируйте адгектные HEK293T клетки подходящим реагентом для трансфекции в соответствии с инструкциями производителя. Если вы используете PEI, приготовьте две смеси и выполните следующие действия.
- Для приготовления смеси А добавляют 500 нг упаковочной плазмиды pCMV-dR8.9116, 750 нг репортерной плазмидыpCSFLW 16 и 450 нг плазмиды, экспрессирующей SARS-CoV-2 Spike, в 100 мкл восстановленной сывороточной среды.
- Для приготовления смеси В добавляют 17,5 мкл ПЭИ (концентрация: 1 мг/мл) к 100 мкл восстановленной сывороточной среды.
- Дайте обеим смесям инкубироваться при комнатной температуре (RT) в течение 5 минут. Затем смешайте содержимое обеих пробирок вместе, добавив смесь PEI B в смесь ДНК A.
- Инкубируйте пробирку в течение 20-30 минут при RT. Осторожно встряхивайте пробирку каждые 3-4 минуты, чтобы усилить перемешивание. Наконец, добавьте смесь в HEK293T ячейки.
- Через 16-20 ч после трансфекции заменяют питательную среду свежей, полной ДМЭМ. Инкубируют при 37 °C и 5%CO2, чтобы обеспечить производство PV трансфицированными клетками.
- Через 72 ч после трансфекции соберите надосадочную жидкость, содержащую ФВ. Затем центрифугу при 1600 x g в течение 7 мин при комнатной температуре удалить клеточный мусор и мертвые клетки и отфильтровать их через фильтр из ацетата целлюлозы 0,45 мкм.
- НЕОБЯЗАТЕЛЬНЫЙ ШАГ: Чтобы увеличить окончательный выход титра PV, выполните несколько трансфектов, объедините клеточные среды, содержащие PV, и концентрируйте их с помощью концентрирующих пробирок.
- Приступайте непосредственно к следующим шагам («титрование PVs», раздел 2) или аликвотируйте PV-содержащую среду в подходящих пробирках для хранения при -80 °C до использования. Приготовьте дополнительную аликвоту (400-500 мкл) для титрования.
ПРИМЕЧАНИЕ: Изготовление нескольких аликвот гарантирует воспроизводимость между экспериментами, избегая чрезмерных циклов оттаивания-замораживания.
2. Титрование PVs
- Используйте свежую PV-содержащую среду для следующих этапов или разморозьте тестовую аликвоту (шаг 1.7) для титрования нового вирусного материала. Замораживание аликвот одного и того же фотоэлектрического материала гарантирует воспроизводимость.
- Добавьте 50 мкл полного DMEM (или полной среды, совместимой с используемой целевой клеточной линией) во все лунки 96-луночного планшета (96WP), необходимые для тестирования в двух экземплярах фотоэлектрического материала, оставив строку «А» пустой. Добавьте 100 мкл фотокарт в строку «А». В зависимости от количества препаратов, подлежащих испытанию, оставьте одну колонку без вируса в качестве контроля «только клетки» (рис. 2).
- Пипетку 50 мкл из ряда A в ряд B и повторить этот процесс до ряда G, чтобы получить серийные разведения исходного материала. Выбросьте лишний объем из последнего ряда.
- Отделите клетки, используя трипсин/этилендиаминтетрауксусную кислоту 1x (ЭДТА) в фосфатном солевом буфере Dulbecco 1x (DPBS 1x), после удаления отработанной среды и двойной промывки клеток DPBS 1x. Подготовьте клетки до плотности 4 x 105 клеток/мл.
ПРИМЕЧАНИЕ: В этом протоколе инфекция PVs была протестирована на чувствительной клеточной линии HEK293T/ACE2; такие клетки были получены из HEK293T, трансдуцированного с помощью лентивирусного вектора для экспрессии рецептора ACE2. - Добавьте 50 мкл клеточной суспензии в каждую лунку, чтобы обеспечить количество клеток 2 x 104 клетки в лунке.
- Инкубировать при температуре 37 °C и 5%CO2 в течение 48 ч.
- После инкубации проведите анализ люциферазы, чтобы получить показания в соответствии с инструкциями производителя. Добавляют 100 мкл реагента люциферазы в лунки и инкубируют в темноте при RT в течение 2 мин. Переместите содержимое каждой лунки на черную пластину на 96 лунок (совместимую с имеющимся устройством для чтения пластин) и считайте пластины в считывателе пластин на 96 лунок.
ПРИМЕЧАНИЕ: Люминометр, используемый для считывания люциферазы, создаст файл электронной таблицы с необработанными, необработанными данными, которые будут использоваться для последующего анализа (в данном случае файл Excel). Инфекционность вируса будет выражаться в единицах относительной люминесценции (RLU) (описанных в пункте 4.1).
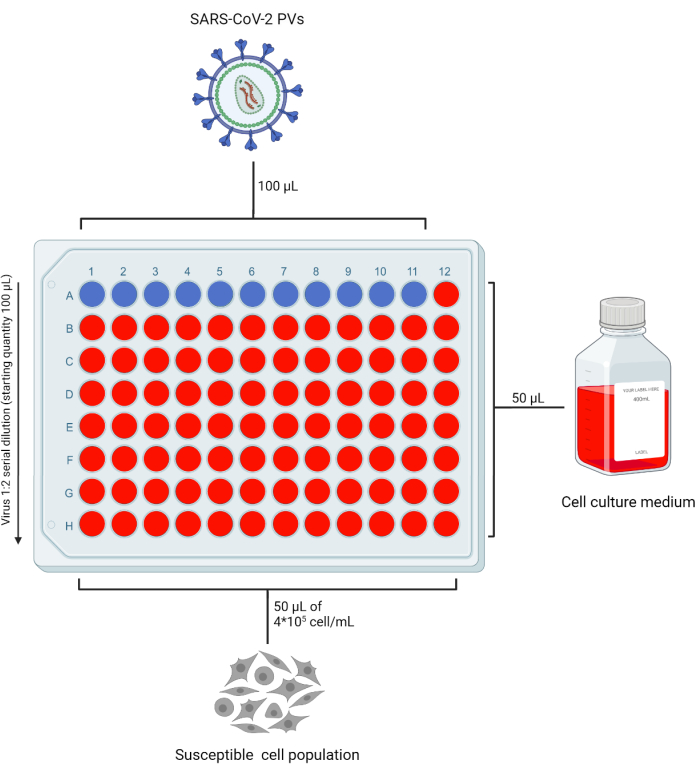
Иллюстрация 2: Репрезентативная схема 96-луночного планшета для титрования PVs. Фиксированный объем PV-содержащей надосадочной жидкости добавляют в строку А, столбцы 1-11 и последовательно разбавляют. Последний столбец остается в качестве элемента управления "только ячейка". Эта фигура была создана с помощью BioRender. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
3. Нейтрализационный анализ
- Размораживание сывороток пациентов на льду. Инактивируйте образцы сыворотки, инкубируя их при 56 °C в течение 30 мин.
- В 96-луночный планшет добавьте 50 мкл свежего, полного DMEM (или полной среды, совместимой с используемой целевой клеточной линией) в каждую из следующих лунок: от ряда B (столбцы 1-10) до ряда H (столбцы 1-10). Поместите 95 мкл свежего, полного DMEM в ряд A (столбцы 1-10). Добавьте 50 мкл и 100 мкл полного DMEM в лунки колонн 11 и 12 соответственно. Это будут зараженные (вирусный контроль, или VC) и неинфицированные (только клетки, или CC) контрольные группы, соответственно (рисунок 3).
- Добавьте 5 мкл инактивированных при нагревании образцов сыворотки/плазмы в ряд А (столбцы 1-10). Каждый образец будет в двух экземплярах. С помощью многоканальной пипетки смешайте образцы в первом ряду и переместите 50 мкл среды, содержащей сыворотку, из ряда А в ряд В. Повторите этот процесс до последнего ряда (рисунок 3). Оставшиеся 50 мкл выбросьте.
- Разморозить необходимое количество аликвот ЛВ и разбавить до ≥ 104 RLU/мл. Добавьте 50 мкл разбавленной PV-содержащей среды в каждую лунку (от столбца 1 до столбца 11) с помощью многоканальной пипетки, чтобы получить разбавление сыворотки/плазмы инактивированной теплом сыворотки/плазмы в соотношении 1:1 к вирусу. Инкубируют при 37 °C и 5% CO2 в течение 1 ч, чтобы антитела в образцах сыворотки могли связываться со спайковым белком SARS-CoV-2 на PV.
- Приготовьте не менее 5 мл суспензии чувствительных клеток (HEK293T/ACE2) с плотностью клеток 4 x 105 клеток/мл. Добавьте 50 мкл клеточной суспензии в каждую лунку и инкубируйте при 37 °C и 5%CO2 в течение 48 ч.
- После инкубации выполните анализ люциферазы в соответствии с инструкциями производителя, как описано в шаге 2.7.
ПРИМЕЧАНИЕ: Люминометр, используемый для считывания люциферазы, создаст файл электронной таблицы (в данном случае .xlsx) с необработанными, необработанными данными, которые будут использоваться для последующего анализа (файл анализа люциферазы).
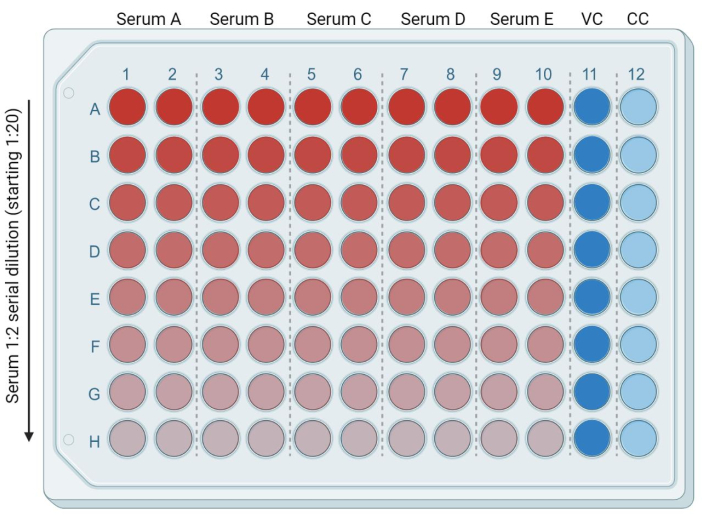
Рисунок 3: Представление пластин на основе разведения сыворотки. Ярко-красный цвет соответствует большему количеству сыворотки, а ярко-синий цвет (столбец 11) соответствует контролю инфицированных клеток (VC, virus control). Светло-голубая полоса (столбец 12) соответствует неинфицированным клеткам (CC, cell control). Эта фигура была создана с помощью BioRender. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
4. Анализ титрования
- В файле анализа Luciferase присвойте имена/названия соответствующим образцам.
- Умножьте показатель RLU на коэффициенты разбавления (сверху вниз: 20x, 40x, 80x, 160x, 320x, 640x, 1,280x, 2,560x), чтобы получить RLU/мл. Если используются разные коэффициенты разбавления, измените коэффициенты умножения соответствующим образом.
- Рассчитайте среднее значение RLU/мл для каждого препарата PV.
5. Анализ нейтрализации ПВ
- В файле электронной таблицы анализа люциферазы (в данном случае .xlsx) присвойте испытуемым образцам соответствующие названия. Введите коэффициент разбавления образца (40с, 80х, 160х, 320х, 640х, 1,280х, 2,560х, 5,120х). Вычислите Log10 коэффициентов разбавления.
- Рассчитайте средний RLU неинфицированного и инфицированного контрольного звена (рис. 3, столбцы 11 и 12 соответственно). Эти значения будут полезны для нормализации на шаге 5.5.
- Откройте новый документ для анализа данных. Выберите анализ X/Y, введите X в качестве чисел и Y в качестве Введите 2 реплицируемых значения в параллельных подстолбцах.
- Введите значения Log10 (разбавление) в виде чисел X. Введите дубликаты RLU образцов.
- Перейдите в раздел Анализ > нормализация > пометка всех образцов на одном листе. Введите средние значения VC и CC в полях Как определяется 0 % и Как определяется 100 % соответственно. Нажмите кнопку ОК.
- В нормализованном листе данных перейдите в раздел Анализ > анализа XY > Нелинейный анализ (подгонка кривой). Отметьте все примеры и нажмите кнопку ОК. Для параметра Dose-response - Inhibition (Доза-реакция - Ингибирование) выберите log(ингибитор) vs нормализованный ответ - переменный наклон.
- В разделе "Ограничение" измените значение параметра "Уклон холма" на "Должно быть меньше 0".
- В разделе Выходные данные установите флажок Создать сводную таблицу и график. Нажмите кнопку ОК , чтобы получить окончательный анализ. Рабочий лист с шаблоном для анализа представлен в Дополнительном файле 1.
Результаты
В настоящем протоколе описывается производство ПВ SARS-CoV-2 и последующее применение этих ПВ для анализа нейтрализующей активности сыворотки/плазмы у субъектов, получающих вакцинацию против COVID-1917. Кроме того, этот протокол может быть применен для получения псевдотипов кажд?...
Обсуждение
Несмотря на то, что использование вируса дикого типа имитирует реальную инфекцию, лентивирусные ФВ являются более безопасным вариантом для изучения механизмов, связанных с проникновением вируса и инфекцией, без строгих требований безопасности, необходимых для работы с патогенными ви...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Мы выражаем признательность волонтерам из числа медицинских работников. Этот проект был поддержан Департаментом передового опыта 2023/2027, MUR, Италия. AR и DZ были поддержаны PRIN2022 (финансирование ЕС; NextGenerationEU)
Материалы
| Name | Company | Catalog Number | Comments |
| 0.45 μm filter | SARSTEDT | 83 1826 | |
| 6-well plate | SARSTEDT | 83 3920 | |
| 96-well plate | SARSTEDT | 8,33,924 | |
| Amicon Ultra-15 Centrifugal Filter Units | Merck | 10403892 | |
| Black Opaque 96-well Microplate | Perkin Elmer | 60005270 | |
| Dulbecco's Modified Eagle Medium | SIGMA-ALDRICH | D6546 - 500ML | |
| Dulbecco's phosphate buffered saline (PBS 1x) | AUROGENE | AU-L0615-500 | |
| Foetal Bovine Serum | AUROGENE | AU-S1810-500 | |
| Graphpad Prism version 7 | graphpad dotmatics | NA | In the manuscript, we replace the commercial name with 'data analysis program' |
| HEK293T cells | ATCC | CRL-3216 | |
| HEK293T/ACE2 cells | ATCC | CRL-3216 | HEK293T has been transduced to overexpress ACE2 with a lentiviral vector. |
| L-glutamine | AUROGENE | AU-X0550-100 | |
| Luminometer - Victor3 | Perkin Elmer | HH35000500 | In the manuscript, we replace the commercial name with 'luminometer' |
| Opti-MEM | Thermo Fisher Scientific | 11058021 | In the manuscript, we replace the commercial name with 'reduced serum medium' |
| p8.91 packaging plasmid | Di Genova et al., 2021 | A kind gift from Prof. Nigel Temperton (ref 16.) | |
| pCSFLW reporter plasmid | Di Genova et al., 2021 | A kind gift from Prof. Nigel Temperton (ref 16.) | |
| Penicillin/streptomycin | AUROGENE | AU-L0022-100 | |
| Polyethylenimine, branched (PEI) (25 kDa) | SIGMA-ALDRICH | 408727 | |
| RRL.sin.cPPT.SFFV/Ace2.IRES-puro.WPRE (MT126) | Addgene | 145839 | This plasmid was used to generate HEK293Tcells/ACE2 |
| SARS-CoV-2 Spike expressing plasmid | Addgene | pGBW-m4137382 | |
| steadylite plus Reporter Gene Assay System | Perkin Elmer | 6066759 | In the manuscript, we replaced the commercial name with 'luciferase reading reagent' |
| Trypsin EDTA 1x | AUROGENE | AU-L0949-100 |
Ссылки
- Ozaki, D. A., et al. International technology transfer of a GCLP-compliant HIV-1 neutralizing antibody assay for human clinical trials. Plos One. 7 (1), e30963 (2012).
- Pouget, M., et al. Generation of liposomes to study the effect of Mycobacterium tuberculosis lipids on HIV-1 cis- and trans-infections. International Journal of Molecular Sciences. 22 (4), 1945 (2021).
- McKay, L. G. A., et al. The HCV envelope glycoprotein down-modulates NF-κB signalling and associates with stimulation of the host endoplasmic reticulum stress pathway. Frontiers in Immunology. 13, 831695 (2022).
- Xiang, Q., Li, L., Wu, J., Tian, M., Fu, Y. Application of pseudovirus system in the development of vaccine, antiviral-drugs, and neutralizing antibodies. Microbiological Research. 258, 126993 (2022).
- Li, Q., Liu, Q., Huang, W., Li, X., Wang, Y. Current status on the development of pseudoviruses for enveloped viruses. Reviews in Medical Virology. 28, e1963 (2018).
- D'Apice, L., et al. Comparative analysis of the neutralizing activity against SARS-CoV-2 Wuhan-Hu-1 strain and variants of concern: Performance evaluation of a pseudovirus-based neutralization assay. Frontiers in Immunology. 13, 981693 (2022).
- Falzarano, D., Groseth, A., Hoenen, T. Development and application of reporter-expressing mononegaviruses: current challenges and perspectives. Antiviral Research. 103, 78-87 (2014).
- Gutierrez-Guerrero, A., Cosset, F. -. L., Verhoeyen, E. Lentiviral vector pseudotypes: Precious tools to improve gene modification of hematopoietic cells for research and gene therapy. Viruses. 12, 1016 (2020).
- Zufferey, R., Nagy, D., Mandel, R. J., Naldini, L., Trono, D. Multiply attenuated lentiviral vector achieves efficient gene delivery in vivo. Nature Biotechnology. 15 (9), 871-875 (1997).
- Dull, T. A third-generation lentivirus vector with a conditional packaging system. Journal of Virology. 72 (11), 8463-8471 (1998).
- Berkhout, B. A Fourth generation lentiviral Vector: Simplifying genomic gymnastics. Molecular Therapy. 25 (8), 1741-1743 (2017).
- Wu, X. Development and evaluation of a pseudovirus-luciferase assay for rapid and quantitative detection of neutralizing antibodies against Enterovirus 71. Plos One. 8 (6), e64116 (2013).
- Ferrara, F., et al. Development of lentiviral vectors pseudotyped with Influenza B hemagglutinins: application in vaccine immunogenicity, mAb potency, and sero-surveillance studies. Frontiers in Immunology. 12, 661379 (2021).
- Hu, J., et al. Development of cell-based pseudovirus entry assay to identify potential viral entry inhibitors and neutralizing antibodies against SARS-CoV-2. Genes & Diseases. 7 (4), 551-557 (2020).
- Dalle Carbonare, L., et al. Serology study after BTN162b2 vaccination in participants previously infected with SARS-CoV-2 in two different waves versus naïve. Communications Medicine. 1 (1), 38 (2021).
- Di Genova, C., et al. Production, titration, neutralisation, storage and lyophilisation of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) lentiviral pseudotypes. Bio-protocol. 11 (21), e4236 (2021).
- Chmielewska, A. M., Czarnota, A., Bieńkowska-Szewczyk, K., Grzyb, K. Immune response against SARS-CoV-2 variants: The role of neutralization assays. NPJ Vaccines. 6 (1), 1-8 (2021).
- Chen, Q., et al. Development and optimization of a sensitive pseudovirus-based assay for HIV-1 neutralizing antibodies detection using A3R5 cells. Human Vaccines & Immunotherapeutics. 14 (1), 199-208 (2018).
- Gauger, P. C., Vincent, A. L. Serum virus neutralization assay for detection and quantitation of serum neutralizing antibodies to influenza A virus in swine. Methods in Molecular Biology (Clifton, N.J). 2123, 321-333 (2020).
- Miglietta, R., Pastori, C., Venuti, A., Ochsenbauer, C., Lopalco, L. Synergy in monoclonal antibody neutralization of HIV-1 pseudoviruses and infectious molecular clones. Journal of Translational Medicine. 12 (1), 346 (2014).
- Chen, M., Zhang, X. -. E. Construction and applications of SARS-CoV-2 pseudoviruses: A mini review. International Journal of Biological Sciences. 17 (6), 1574-1580 (2021).
- Zipeto, D., et al. Induction of human immunodeficiency virus neutralizing antibodies using fusion complexes. Microbes and Infection. 8 (6), 1424-1433 (2006).
- WHO Coronavirus (COVID-19) Dashboard. Available from: https://covid19.who.int (2022)
- Zhou, P. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 579 (7798), 270-273 (2020).
- Chen, X., Huang, H., Ju, J., Sun, R., Zhang, J. Impact of vaccination on the COVID-19 pandemic in U.S. states. Scientific Reports. 12 (1), 1554 (2022).
- Stefani, C., Fantoni, T., Bissoli, M., Thomas, J., Ruggiero, A. HIV and SARS-CoV-2 Co-Infection: From Population Study Evidence to In Vitro Studies. Life. 12 (12), 2089 (2022).
- Watson, O. J., et al. Global impact of the first year of COVID-19 vaccination: a mathematical modelling study. The Lancet Infectious Diseases. 22 (9), 1293-1302 (2022).
- Cantoni, D. Analysis of antibody neutralisation activity against SARS-CoV-2 variants and seasonal human coronaviruses NL63, HKU1, and 229E induced by three different COVID-19 vaccine olatforms. Vaccines. 11 (1), 58 (2023).
- Siracusano, G., et al. Different decay of antibody response and VOC sensitivity in naïve and previously infected subjects at 15 weeks following vaccination with BNT162b2. Journal of Translational Medicine. 20 (1), 22 (2022).
- Ruggiero, A. SARS-CoV-2 vaccination elicits unconventional IgM specific responses in naïve and previously COVID-19-infected individuals. eBioMedicine. 77, (2022).
- Piubelli, C. Subjects who developed SARS-CoV-2 specific IgM after vaccination show a longer humoral immunity and a lower frequency of infection. eBioMedicine. 89, 104471 (2023).
- Zhang, G. F. Infectivity of pseudotyped SARS-CoV-2 variants of concern in different human cell types and inhibitory effects of recombinant spike protein and entry-related cellular factors. Journal of Medical Virology. 95 (1), e28437 (2023).
- da Costa, K. A. S. Influenza A (N1-N9) and Influenza B (B/Victoria and B/Yamagata) neuraminidase pseudotypes as tools for pandemic preparedness and improved influenza vaccine design. Vaccines. 10 (9), 1520 (2022).
- Condor Capcha, J. M. Generation of SARS-CoV-2 spike pseudotyped virus for viral entry and neutralization assays: a 1-week protocol. Frontiers in Cardiovascular Medicine. 7, 618651 (2021).
- Diomede, L., et al. Doxycycline inhibition of a pseudotyped virus transduction does not translate to inhibition of SARS-CoV-2 infectivity. Viruses. 13 (9), 1745 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены