Method Article
تحضير العينة للتصوير بالتبريد في الموقع لخلايا الثدييات
In This Article
Summary
توفر هذه الطريقة بروتوكولا مرنا يسهل الوصول إليه لإعداد شبكات المجهر الإلكتروني (EM) للتصوير بالتبريد الخلوي في الموقع والمجهر الضوئي والإلكتروني المرتبط (CLEM).
Abstract
يعد التصوير بالتبريد الخلوي في الموقع تقنية قوية لدراسة الأجسام المعقدة في سياقها الخلوي الأصلي المجمد ، مما يجعلها ذات صلة كبيرة بالبيولوجيا الخلوية وعلم الفيروسات. إن إمكانية الجمع بين التصوير بالتبريد وطرق الفحص المجهري الأخرى تجعله تقنية مثالية للتصوير التكاملي والمترابط. ومع ذلك ، فإن تحضير العينة للتصوير المقطعي الخلوي في الموقع ليس سهلا ، حيث لا تلتصق الخلايا بسهولة وتمتد فوق شبكة المجهر الإلكتروني. بالإضافة إلى ذلك ، فإن الشبكات نفسها هشة ويمكن أن تنكسر إذا تم التعامل معها بقوة كبيرة ، مما يؤدي إلى فقدان المناطق القابلة للتصوير. يمكن أن تشكل هندسة أطباق زراعة الأنسجة أيضا تحديا عند التلاعب بالشبكات باستخدام الملقط. هنا ، نصف النصائح والحيل للتغلب على هذه التحديات (وغيرها) وإعداد عينات عالية الجودة للتصوير بالتبريد الخلوي في الموقع والتصوير المترابط لخلايا الثدييات الملتصقة. مع التقدم المستمر في تقنية الفحص المجهري بالتبريد ، تحمل هذه التقنية وعدا هائلا لتعزيز فهمنا للأنظمة البيولوجية المعقدة.
Introduction
التصوير بالتبريد الخلوي في الموقع هو تقنية قوية تسمح بدراسة الهياكل ذات الصلة بيولوجيا في الخلايا دون تثبيت كيميائي. من خلال ربط الخلايا بشبكات EM وتجميد الشبكات في المبرد ، يتم تجميد الأشياء ذات الأهمية في سياقاتها الخلوية الطبيعية دون تكوين جليد بلوري من الماء داخل الخلايا 1,2. يمكن أن يؤدي كل من التثبيت الكيميائي وتكوين الجليد البلوري إلى تعطيل هياكل الجزيئات ذات الصلة ، مثل البروتينات والدهون ، مما يقلل من الدقة البيولوجية للصور التي تم الحصول عليها باستخدام هذه التقنيات 3,4. في التصوير المقطعي ، يتم تصوير الشبكات بزوايا تدريجية باستخدام المجهر الإلكتروني ، ثم يتم استخدام هذه الصور لبناء تمثيلات ثلاثية الأبعاد للمنطقة المستهدفة المصورة5. يمكن استخدام التصوير بالتبريد في الموقع جنبا إلى جنب مع تقنيات الفحص المجهري الأخرى للتصوير التكاملي والمترابط ، مثل التصوير بالتبريد ، والتصوير المقطعي بالأشعة السينية الناعمة ، و cryoFIB / SEM (شعاع الأيونات المركزة المبردة / المجهر الإلكتروني الماسح) 6،7،8،9،10،11. يسمح تكامل التقنيات المتعددة بالحصول على مزيد من المعلومات حول بنية أو عملية أكثر مما يمكن أن تحققه أي تقنية مجهرية واحدة.
على الرغم من كل فوائد التصوير بالتبريد الخلوي في الموقع ، يمكن أن يكون تحضير العينة أمرا صعبا لعدة أسباب. نظرا لهشاشتها ، يمكن أن يؤدي التلاعب القوي بشبكات المجهر الإلكتروني إلى تلف ، حيث تكون طبقة الكربون الرقيقة على وجه الخصوص حساسة وعرضة للتمزق ، مما يقلل من المساحة التي يمكن تصويرها للشبكات. من الصعب أيضا معالجة شبكات المجهر الإلكتروني نظرا لصغر حجمها وهي عرضة للانفصال عن سطح الآبار أو الشريحة الدقيقة المستخدمة في نمو الخلايا. يمكن أن يكون التلاعب بالشبكات داخل الآبار أو الشرائح الدقيقة أمرا صعبا بسبب هندستها. يمكن أن يؤدي التحضير غير الصحيح للشبكات (على سبيل المثال ، السماح لها بالطفو) إلى انخفاض كثافة الخلايا وتقليل عدد مناطق التصوير المحتملة ، خاصة عندما لا تكون الخلايا عرضة للالتصاق بالشبكات نفسها. بالنسبة للتصوير بالتبريد الخلوي المباشر ، يجب أن تنتشر الخلايا بشكل رقيق للغاية ، والذي يمكن أن يتعطل لأسباب عديدة ، بما في ذلك درجات الحرارة غير المناسبة أو التعامل الخشن مع الشبكات.
من خلال مجموعة متنوعة من التحسينات ، تهدف التقنيات المقدمة في هذه المقالة إلى التعامل مع هذه المزالق الأكثر شيوعا التي تنشأ أثناء إعداد شبكات المجهر الإلكتروني للتصوير بالتبريد. يسمح استخدام ملاقط بزاوية 5/15 بمعالجة الشبكات داخل ألواح الآبار أو الشرائح الدقيقة. محلول الفبرونيكتين المطبق على جانبي الشبكات قبل الطلاء يجعل الشبكات العائمة أقل احتمالا ، وهو أمر مفيد في ضمان أن الشبكات لديها كثافة خلايا كافية وأن الشبكات أقل عرضة للتلف بسبب التلاعب. من خلال الحفاظ على تحضين الشبكات عند 37 درجة مئوية حتى قبل التجمد مباشرة ، نضمن أيضا الاحتفاظ بالخلايا في بيئة مريحة لمنع الخلايا من التراجع عن حوافها الرقيقة. كما أن تنشيف الشبكات من الجانب الخلفي يمنع تلف الخلايا من القوة الميكانيكية. إجمالا ، تزيد هذه التدابير من معدل نجاح تحضير العينات لدراسات التصوير بالتبريد الخلوي في الموقع ، مما يزيد من إمكانية الوصول إلى نهج التصوير هذا.
Protocol
1. إعداد الشبكة
ملاحظة: في التصميم التجريبي ، خطط بحد أقصى 8-12 شبكة إجمالا لكل جلسة تجميد غطس و 4-5 شبكات لكل بئر. أكثر من ذلك سيؤدي إلى جلسة تجميد طويلة جدا ، مما قد يتسبب في زيادة إجهاد الخلايا وتلوث الجليد وأخطاء المستخدم.
- توهج التفريغ
- قم بتحميل عدد مناسب من الشبكات بفيلم دعم كربوني مثقب ليتم تفريغه عند 15 مللي أمبير لمدة 45 ثانية عند 0.39 مللي بار في جو 0.39 مللي بار.
- تأكد من أن جانب الكربون من الشبكة متجها لأعلى. عند الانتهاء ، انقل الشبكات إلى حاوية نظيفة مبطنة بورق الترشيح (الشكل 1 أ 1).
ملاحظة: يمكن استخدام شبكات أخرى طالما أن المادة ليست سامة للخلايا (والتي تستبعد أي شبكة نحاسية). شبكات Finder مفيدة للدراسات المترابطة. الشبكات المصنوعة من مواد أخرى ممكنة أيضا. حققت العديد من المختبرات نتائج جيدة في زراعة الخلايا فوق شبكات دعم SiO2 8,9.
- علاج ملتصق
- انقل الشبكات والفبرونيكتين و PBS والألواح والملاقط إلى خزانة السلامة البيولوجية. عالج جانبي الشبكات ب 20 ميكروغرام / مل من الفبرونيكتين البقري عن طريق سحب نقطتين كبيرتين من المحلول الملتصق على سطح معقم ، مثل غطاء صفيحة بئر 6. تأكد من أن النقاط كبيرة بما يكفي لتغليف الشبكة بأكملها (يوصى بحوالي 100 ميكرولتر).
ملاحظة: قبل المعالجة بالمحلول الملتصق المحدد ، هناك خيار للتصوير الدقيق للشبكة هنا لتحسين ارتباط الخلايا في مركز مربعات الشبكة. سيؤدي تقليل قدرة الخلايا على الالتصاق بالأشرطة إلى زيادة عدد الخلايا القابلة للتصوير. هذا مثالي للتجارب التي تنطوي على طحن cryoFIB. - استخدم ملاقط 5/15 لمعالجة الشبكات. تأكد من علاج جانبي الشبكة في الحل.
ملاحظة: يمكن استخدام محاليل لاصقة أخرى (الفيبرينوجين ، الكولاجين ، مكونات المصفوفة الأخرى خارج الخلية ، إلخ). يستخدم الفبرونيكتين هنا ، لأنه يعطي نتائج جيدة مع مجموعة واسعة من خطوط الخلايا. (U2OS ، هيلا ، فيرو ، كالو -3 ، Tzm-bl). الملقط 5/15 مفيد لأن هندسته تسمح بتحسين القدرة على المناورة حول الألواح ذات 6 آبار والأطباق مقاس 35 مم والشرائح الصغيرة. ينتج عن هذا ضغط ميكانيكي أقل على الشبكات وفيلم كربون أكثر سلامة. تأكد من وضع جميع المواد المطلوبة في خزانة السلامة الحيوية قبل البدء ، لأن هذا يقلل من احتمال تلوث الشبكة.
- انقل الشبكات والفبرونيكتين و PBS والألواح والملاقط إلى خزانة السلامة البيولوجية. عالج جانبي الشبكات ب 20 ميكروغرام / مل من الفبرونيكتين البقري عن طريق سحب نقطتين كبيرتين من المحلول الملتصق على سطح معقم ، مثل غطاء صفيحة بئر 6. تأكد من أن النقاط كبيرة بما يكفي لتغليف الشبكة بأكملها (يوصى بحوالي 100 ميكرولتر).
- ربط الشبكات
- بمجرد معالجتها بالفبرونيكتين البقري ، ستصبح الشبكة لزجة. باستخدام ملاقط 5/15 ، المس برفق السطح الخالي من الكربون للشبكة في قاع طبق / طبق فارغ وافتح الملقط. يجب أن تعلق الشبكة بسهولة على السطح الجديد (الشكل 1A2).
ملاحظة: حاول تجنب وضع الشبكات في المنتصف المباشر أو حواف الطبق / الطبق. عند إضافة الخلايا ، هناك ميل لتراكم كثافة الخلية في وسط اللوحة. هذا يمكن أن يؤدي إلى شبكات ذات كثافة خلوية مفرطة. بدلا من ذلك ، يمكن استخدام حوامل الشبكة المطبوعة 3D هنا بدلا من ربط الخلايا مباشرة بسطح الطبق / اللوحة12.
- بمجرد معالجتها بالفبرونيكتين البقري ، ستصبح الشبكة لزجة. باستخدام ملاقط 5/15 ، المس برفق السطح الخالي من الكربون للشبكة في قاع طبق / طبق فارغ وافتح الملقط. يجب أن تعلق الشبكة بسهولة على السطح الجديد (الشكل 1A2).
- حضانة المرض
- احتضان الشبكات لمدة 30 دقيقة في محلول الفبرونيكتين الملتصق (20 ميكروغرام / مل). لضمان عدم جفاف الشبكات أثناء هذه العملية ، فإن الماصة الدقيقة 1-2 قطرات من محلول أكثر التصاقا مباشرة فوق الشبكات كل 15 دقيقة (الشكل 1 أ3).
ملاحظة: ستختلف فترة الحضانة اعتمادا على المحلول الملتصق المستخدم. بالنسبة للفيبرونيكتين البقري ، فإن الوقت الموصى به هو 30 دقيقة.
- احتضان الشبكات لمدة 30 دقيقة في محلول الفبرونيكتين الملتصق (20 ميكروغرام / مل). لضمان عدم جفاف الشبكات أثناء هذه العملية ، فإن الماصة الدقيقة 1-2 قطرات من محلول أكثر التصاقا مباشرة فوق الشبكات كل 15 دقيقة (الشكل 1 أ3).
- غسل
- بعد فترة الحضانة ، قم بإزالة المحلول الملتصق الزائد عن طريق micropipetting. اغسل الشبكات عن طريق قطرات micropipetting من PBS مباشرة فوق الشبكات. كرر هذا 2-3 مرات. (الشكل 1 أ4).
- تعقيم
- استخدم ضوء الأشعة فوق البنفسجية لتعقيم الشبكات في خزانة السلامة الحيوية لمدة 1 ساعة. ضع الشبكات بالقرب من مصدر الأشعة فوق البنفسجية قدر الإمكان لزيادة التعقيم (الشكل 1 أ5). لضمان عدم جفاف الشبكات أثناء هذه العملية ، فإن الماصة الدقيقة 1-2 قطرات من PBS مباشرة فوق الشبكات كل 10 دقائق.
ملاحظة: يمكن تنفيذ الخطوات 1.4-1.6 بشكل متزامن.
- استخدم ضوء الأشعة فوق البنفسجية لتعقيم الشبكات في خزانة السلامة الحيوية لمدة 1 ساعة. ضع الشبكات بالقرب من مصدر الأشعة فوق البنفسجية قدر الإمكان لزيادة التعقيم (الشكل 1 أ5). لضمان عدم جفاف الشبكات أثناء هذه العملية ، فإن الماصة الدقيقة 1-2 قطرات من PBS مباشرة فوق الشبكات كل 10 دقائق.
2. شبكات البذر
- عد الخلايا:
- فصل الخلايا وعدها باستخدام الطرق الميكانيكية أو الأنزيمية. حدد العدد الأمثل للخلايا لاستخدامها في البذر قبل العد. بالنسبة إلى U2OS المصنف في لوحة ذات 6 آبار ، استخدم في أي مكان بين 6 × 104 إلى 1.6 × 105 خلايا لكل بئر (الشكل 1B1).
ملاحظة: سيختلف عدد الخلايا المصنفة وفقا لنوع الخلية ، ومساحة سطح البئر ، والطبق أو الشريحة الدقيقة المستخدمة ، والوقت بين البذر وتجميد الغطس ، والتصميم التجريبي. اختبر نطاقا من أرقام الخلايا لتحديد الظروف التي ستؤدي إلى 0.25-1 خلية لكل مربع شبكة في وقت تجميد الغطس. من المهم ملاحظة أن كثافة الخلايا العالية تقلل من سرعة نقل الحرارة وقد تؤثر على عملية التزجيج. لمكافحة هذا ، وجدت بعض المختبرات نجاحا باستخدام مصافي الخلايا ، والتي تعمل على منع كتل الخلايا من تكوين13. أخيرا ، ينتج عن هذا البروتوكول ارتباط عشوائي للخلايا بطبقة الكربون. إذا كان المرفق المستهدف ضروريا، فيمكن استخدام التنميط الدقيق للصور (انظر الخطوة 1.3)14.
- فصل الخلايا وعدها باستخدام الطرق الميكانيكية أو الأنزيمية. حدد العدد الأمثل للخلايا لاستخدامها في البذر قبل العد. بالنسبة إلى U2OS المصنف في لوحة ذات 6 آبار ، استخدم في أي مكان بين 6 × 104 إلى 1.6 × 105 خلايا لكل بئر (الشكل 1B1).
- إضافة الخلايا ووسط النمو : أضف الخلايا عبر الماصة الدقيقة إلى الآبار ، وتجنب الفقاعات (الشكل 1B2). في لوحة 6 آبار ، يوصى بحجم إجمالي للبئر يتراوح بين 1.5 و 2.0 مل.
ملاحظة: يوصى بالتبليل حول الشبكات بعناية قبل إضافة الحجم بالكامل. سيساعد ذلك في منع الشبكات من الانفصال والطفو في المحلول. حرك اللوحة برفق من جانب إلى آخر لتسهيل توزيع الخلايا المتجانسة على البئر. لا تقم بتدوير اللوحة بحركة دائرية ، لأن ذلك سيؤدي إلى تخصيص كثافة الخلايا المفرطة في وسط البئر. - الحضانة: احتضان الشرائح عند 37 درجة مئوية لفترة مناسبة وفقا للتصميم التجريبي ، والذي سيعتمد على تطبيقات المصب. في هذا المثال (نقل المستنسخة الجزيئية لفيروس نقص المناعة البشرية) ، احتضان بين 16-24 ساعة (الشكل 1B3).
ملاحظة: ستؤدي أوقات الحضانة الأطول إلى المزيد من دورات انقسام الخلايا. لذلك ، اضبط عدد الخلايا الأولية للبذر وفقا لذلك.
3. النقل
- تحضير خليط النقل:
- قم بإعداد كاشف ليبوزوم كاتيوني مناسب لنقل البلازميد إلى خط الخلية المحدد.
- في مثال النقل هذا ، استخدم 1 ميكروغرام من إجمالي الحمض النووي للبلازميد لكل بئر (في لوحة 6 آبار) ليتم نقلها بنسبة 1: 3 من بلازميد HIViΔEnv إلى بلازميد psPAX2. لكل بئر ، قم بتخفيف 1 ميكروغرام من الحمض النووي إلى 50 ميكرولتر من DMEM الخالي من المصل. قم بتجانس الخليط عن طريق السحب الدقيق المتكرر أو الدوران اللطيف للوحة.
- لكل بئر ، قم بتخفيف 3 ميكرولتر من كاشف النقل في DMEM الخالي من المصل ، ثم قم بتجانس الخليط مرة أخرى عن طريق micropipetting أو الدوران اللطيف. أضف خليط كاشف النقل المخفف بالكامل إلى خليط الحمض النووي المخفف (الخطوة 3.1.2) واحتضانه في درجة حرارة الغرفة (RT) لمدة 15 دقيقة (الشكل 1C1).
ملاحظة: أثناء احتضان هذا الخليط ، استبدل الوسائط الموجودة في الآبار ب 1.5 مل من DMEM الطازج. احرص على عدم إزاحة الشبكات من قاع البئر.
- لتطبيق خليط النقل ، ماصة 100 ميكرولتر من الخليط من الخطوة 3.1.3 بالتنقيط على كل بئر ، مع تركيز القطرات على الشبكات لضمان التلامس (الشكل 1 ج2). قم بتغيير وسط النمو بعد 16-24 ساعة من النقل (الشكل 1C3).
4. يغرق تجميد
ملاحظة: احتفظ بالخلايا عند 37 درجة مئوية لحين الحاجة إليها للتنشيف. بالإضافة إلى ذلك ، تأكد من تدوين جانب الكربون للشبكات طوال العملية.
- كثافة الخلية
- تحقق من الشبكات في مجهر بصري مقلوب ولاحظ كثافات الخلايا على كل شبكة.
ملاحظة: تعتبر الشبكات التي تحتوي على أقل من 0.25 خلية لكل مربع شبكة (أو خلية واحدة لكل 4 مربعات شبكة) "فارغة". تعتبر الشبكات التي تحتوي على 0.25-1 خلية لكل مربع شبكة "طبيعية". تعتبر الشبكات التي تحتوي على أكثر من 1 خلية لكل مربع شبكة "ممتلئة". - لاحظ كثافة الخلية على كل شبكة للسماح بطلب أوقات النشاف لاحقا أثناء تجميد الغطس. أضف 2-3 مل من PBS إلى طبق / طبق فارغ ودافئ إلى 37 درجة مئوية.
- تحقق من الشبكات في مجهر بصري مقلوب ولاحظ كثافات الخلايا على كل شبكة.
- تحضير الإيمانات
- لتحضير إيمان الذهب لتطبيقات التصوير بالتبريد في اتجاه مجرى النهر ، ماصة 50 ميكرولتر من محلول حبة الذهب الغروية 10 نانومتر في أنبوب نظيف سعة 1.5 مل. أضف 2 ميكرولتر من 1 مجم / مل BSA إلى الأنبوب وقم بالتجانس عن طريق micropipetting بشكل متكرر.
- جهاز طرد مركزي الأنبوب عند 15000-20000 × جم لمدة 15 دقيقة. Micropipette لإزالة أكبر قدر ممكن من المادة الطافية دون إزعاج الحبيبات.
ملاحظة: ستكون الحبيبات فضفاضة جدا. - أضف 50 ميكرولتر من PBS إلى الحبيبات وأعيد استخدامها. جهاز الطرد المركزي الأنبوب مرة أخرى في 15000-20000 × غرام لمدة 15 دقيقة.
- باستخدام طرف 10 ميكرولتر ، قم بشفط 4 ميكرولتر مباشرة من الحبيبات ، وانقلها إلى أنبوب نظيف سعة 1.5 مل (الشكل 1D1). استخدم 1 ميكرولتر من الذهب المغسول والمركز لكل شبكة.
ملاحظة: يعتمد نوع fiducials المستخدمة على التطبيقات النهائية. للتصوير المقطعي TEM ، استخدم حبات الذهب 10 نانومتر. للتصوير المقطعي بالأشعة السينية الناعمة ، استخدم حبات الذهب 200 نانومتر. للفحص المجهري للارتباط ، استخدم حبات اللاتكس الفلورية. عادة لا تكون Fiducials ضرورية للتجارب التي تتضمن الطحن بالتبريد ، لأن عملية الطحن ستدمرها.
- النشاف
- قم بإعداد الغرفة البيئية بنسبة رطوبة 95٪ و 30 درجة مئوية (الشكل 1D1). حدد شبكة باستخدام ملاقط 5/15.
- اغسل الشبكات باستخدام PBS وانقلها إلى ملاقط الغطس (الشكل 1D2). بمجرد التثبيت ، قم بإزالة الملقط 5/15 وحرك المشبك على الملقط الغاطس.
- أدخل الشبكة في الفريزر المغطس ، مع الحفاظ على المشبك آمنا (الشكل 1D3). أضف 1 ميكرولتر من الإيمانات الذهبية إلى الجانب الخلفي من الشبكة (الشكل 1D4). أضف 2-3 ميكرولتر من PBS إلى جانب الكربون من الشبكة. استخدم النشاف الآلي لمسح الجانب الخلفي من الشبكة وغمر التجميد في الإيثان السائل (الشكل 1D5).
ملاحظة: يوصى بالحصول على ما بين 3-4 ميكرولتر من الحجم لكل شبكة للحصول على النشاف الأمثل. قد تحتفظ الشبكات بكمية متغيرة من PBS بعد الغسيل. اضبط الحجم الإضافي ل PBS لحساب احتباس السائل الموجود مسبقا على الشبكة. يوصى بإضافة fiducials الذهب إلى الجزء الخلفي من الشبكة. يمكن أن تؤدي الإضافة إلى الأمام إلى وجود مجموعات من الإيمانات الذهبية بالقرب من نقطة الإدخال ، في حين أن الإضافة من الخلف تؤدي إلى حل أكثر تجانسا. تعتمد مدة النشاف على طب الأسنان الخلوي للشبكة. 2 ثانية للفارغة ، و 3 ثوان للعادي ، و 4 ثوان للشبكات الكاملة ، على التوالي. قد يحدد نوع الفريزر الغاطس المتاح كيفية التعامل مع النشاف: الفريزر الغاطس Leica GP2 هو المستخدم في هذا البروتوكول وهو قادر على النشاف الآلي من جانب واحد افتراضيا. يقوم Thermo Fisher Vitrobot بالنشاف الآلي على الوجهين ، على الرغم من أن هذا غالبا ما يتلف الخلايا المرتبطة بجانب الكربون. من الممكن أيضا النشاف اليدوي في Vitrobot ، بالإضافة إلى غطاسات الجاذبية اليدوية.
النتائج
بعد النقل المشترك ل HIViGFPΔEnv و psPAX2 ، كان لدى جميع الشبكات الحد الأدنى من التمزق في طبقة الكربون. تم تصوير الشبكات باستخدام المجهر الضوئي الطوري والمجهر الضوئي الفلوري بعد 24 ساعة من الحضانة باستخدام كاشف النقل (الشكل 2). احتوت الخلايا الموجودة على كل من الشبكات الوهمية والشبكات المنقولة بشكل مشترك على خلايا قابلة للحياة في مربعات شبكية متعددة.
يرمز psPAX2 لجميع البروتينات الهيكلية والأنزيمية لفيروس نقص المناعة البشرية -1 دون أي علامات مضانة. يشبه HIViGFPΔEnv psPAX2 ولكن مع رموز لبروتين هفوة فيروس نقص المناعة البشرية الموسوم ب GFP. كلا البلازميدات هي ΔEالمغلف. ينتج عن النقل المشترك تجميع وتبرعم لجزيئات HIV-1 الفلورية ، مما يجعل هذا نظاما رائعا لدراسات CLEM لفيروس نقص المناعة البشرية في حالة السلامة الحيوية من المستوى 1. أظهرت الشبكات المشتركة مجموعة فرعية من الخلايا تظهر مضان أخضر ، مما يشير إلى نجاح النقل المشترك. لم تظهر أي خلايا على الشبكة الوهمية مضان ، مما زاد من التحقق من صحة النقل المشترك باستخدام HIViGFPΔEnv و psPAX2. بعد مشاهدة الشبكات باستخدام المجهر القائم على الضوء ، تم تجميد الشبكات ونقلها إلى التخزين طويل الأجل في النيتروجين السائل.
يصور الشكل 3 النتائج من الشبكات المنتجة باستخدام نفس الطريقة التجريبية ولكن باستخدام تركيبات بلازميدية مختلفة قليلا. تم نقل الشبكات المحتوية على U2OS باستخدام مستنسخات مختلفة من فيروس نقص المناعة البشرية (HIVmCherryΔEnv و NL4-3ΔEnvGFP بنسبة 1: 6). نظرا لاستخدام كتلة أعلى من البلازميدات الموسومة بالفلورسنت ، مكنت هذه الشبكات من مراقبة عدد أكبر من الخلايا المنقولة ، مما يوفر ميزة أثناء التقاط الصور باستخدام cryoCLEM و cryoET. باستخدام cryoCLEM ، تم إنشاء أطالس شبكية كاملة لكل شبكة باستخدام الفحص المجهري للتألق بالتبريد لتسجيل مواقع جميع الخلايا المنقولة بشكل مشترك. مع مواقع الخلايا المعروفة ، تم إجراء cryoET. تم جمع أطلس شبكي كامل منخفض التكبير وتغطيته بأطلس الفلورسنت الذي تم جمعه عند التألق بالتبريد (الشكل 3 أ). تم جمع مخططات التبريد في المواقع الخلوية لالتقاط تفاصيل معقدة لدورة الحياة الفيروسية ، بما في ذلك تجميع وتبرعم فيروس نقص المناعة البشرية من الخلايا (الشكل 3 ب).
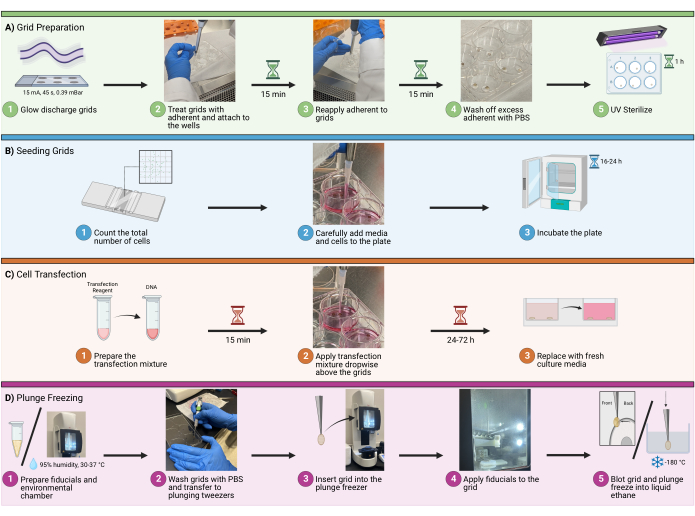
الشكل 1: بذر الخلايا على سير عمل الشبكات. رسم تخطيطي يصور الإجراء العام لزرع الخلايا على شبكات cryoEM. تنقسم العملية إلى أربع خطوات رئيسية ، بما في ذلك (أ) تحضير الشبكات في الآبار للبذر ، (ب) إضافة الكمية المناسبة من الخلايا إلى كل بئر ، (ج) النقل الاختياري للخلايا للتصوير الفلوري ، و (د) تجميد الغرق للشبكات للسماح بتزجيج العينة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: النقل المشترك ل U2OS باستخدام HIViGFPΔEnv و psPAX2. تم نقل خلايا U2OS بشكل مشترك مع HIViGFPΔEnv و psPAX2 المحتويين على GFP بنسبة 1: 3. تم تصوير الشبكات عن طريق تباين الطور والمجهر الفلوري. تشير الخلايا التي يظهر أنها تحتوي على تعبير GFP إلى نجاح النقل المشترك. شريط المقياس: 500 ميكرومتر. شريط المقياس (إدخال): 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
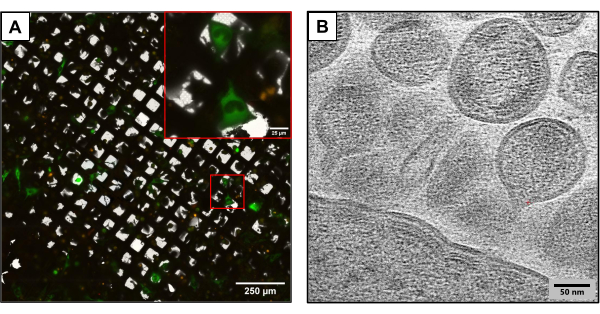
الشكل 3: الطرق المحتملة القائمة على التبريد في اتجاه مجرى النهر . (أ) صورة cryoCLEM مع خلايا U2OS المتحولة بشكل مشترك. تمثل الخلايا باللون الأخضر الخلايا المنتجة لفيروس نقص المناعة البشرية وتستخدم لقياس نجاح النقل المشترك. تمثل النقاط الحمراء mCherry الموسومة بفيروس نقص المناعة البشرية -1 هفوة. شريط المقياس: 250 ميكرومتر. شريط المقياس (أقحم): 25 ميكرومتر (B) صورة cryoET لجزيئات فيروس نقص المناعة البشرية المتعددة التي تتبرعم من غشاء البلازما لخلايا U2OS. شريط المقياس: 50 نانومتر الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
هنا ، قدمنا بروتوكولا يمكن الوصول إليه ومرنا وقابلا للتكرار لخلايا البذور على شبكات المجهر الإلكتروني لتطبيقات التصوير المقطعي بالتبريد في الموقع . يمكن تكييف هذه الطريقة بسهولة لتناسب احتياجات التطبيقات النهائية و / أو المتطلبات التجريبية. بالإضافة إلى المرونة الكبيرة ، قمنا بوصف سير العمل الذي يحسن ويقلل من المزالق الشائعة في بذر الشبكة ، ولا سيما الأضرار الجسيمة لطبقة الكربون ، وكثافة الخلايا المنخفضة ، والسلامة الهيكلية الضعيفة لإسقاطات الخلايا الرقيقة.
على الرغم من أن البروتوكول الموصوف هنا يوفر العديد من البدائل ، إلا أن هناك بعض الخطوات الحاسمة التي يجب اتباعها لتحسين النتائج العامة. واحدة من أكبر المشكلات المتعلقة ببذر الخلايا الشبكية هي انفصال وتعويم الشبكات من البئر أو الانزلاق الصغير. لذلك ، من المهم أن تبلل الشبكة بالكامل بمحلول ملتصق على كلا الجانبين وتمنعها من الجفاف خلال فترة الحضانة. إذا كنت تستخدم حوامل الشبكة المطبوعة 3D ، فاعلم أن التغييرات المتعددة للوسائط لهؤلاء الحوامل لديها القدرة على إنتاج شبكات عائمة لأن الهواء المحبوس تحت الشبكة يمكن أن يجبرها على الخروج من الحامل.
يعمل اختيارنا للملاقط أيضا على تحسين جودة الشبكة من خلال توفير طريقة مواتية هندسيا لمعالجة الشبكات دون ثني الشبكة الواسع النطاق الذي من شأنه أن يتلف طبقة الكربون. إن الحفاظ على الخلايا عند 37 درجة مئوية لأطول فترة ممكنة قبل الغطس يقلل من معاناة الخلايا ويحسن عدد الخلايا الرقيقة التي يمكن تصويرها على الشبكة. أخيرا ، النشاف من الجانب الذهبي سيحمي الخلايا من القوى الميكانيكية القاسية التي قد تؤدي إلى تلف الهياكل الخلوية الهشة.
على الرغم من عدم تضمينه في هذا البروتوكول ، فقد ثبت أن التنميط الدقيق للصور الشبكية يزيد من عدد الخلايا القابلة للتصوير من خلال تحسين ارتباطها بمركز مربعات الشبكة14. أخيرا ، تم استخدام حوامل الشبكة المطبوعة 3D مؤخرا لتقليل تلف الشبكة عن طريق الحد من التلاعب المباشربالشبكة 12.
قد يكون من المهم ملاحظة أن هذا البروتوكول محسن لتصوير الحواف الرفيعة والنتوءات من الخلايا لتطبيق التصوير بالتبريد. نقترح استكشاف الأخطاء وإصلاحها لمجموعة متنوعة من الشروط من توصياتنا في البروتوكول للعثور على أفضل نتيجة للتطبيقات النهائية المفضلة. بشكل عام ، يوفر هذا البروتوكول طريقة موثوقة ومتعددة الاستخدامات لبذر الخلايا على شبكات يمكن تعديلها لتلبية احتياجات محددة.
Disclosures
يعلن المؤلفون عدم وجود مصالح متنافسة.
Acknowledgements
نود أن نشكر مختبر مانسكي على الوصول إلى معدات التجميد الغطس. تم تنفيذ أجزاء من هذا العمل في مرفق التوصيف بجامعة مينيسوتا ، والذي يتلقى دعما جزئيا من المؤسسة الوطنية للعلوم (NSF) من خلال مركز علوم وهندسة أبحاث المواد (MRSEC; رقم الجائزة DMR-2011401) والمبادرة الوطنية لمناهج علم الأعصاب (NNCI; رقم الجائزة ECCS-2025124) البرامج. نود أن نشكر التمويل من مركز سلوك فيروس نقص المناعة البشرية في البيئات الفيروسية (B-HIVE ؛ 1U54AI170855-01) ومركز ديوك للبيولوجيا الهيكلية لفيروس نقص المناعة البشرية (DCHSB; U54AI170752) المركز.
Materials
| Name | Company | Catalog Number | Comments |
| 10 nm colloidal gold bead solution | Sigma-Aldrich | 741957 | |
| 6 well multidish, 100/CS | Fisher Scientific | FB012927 | |
| Allegra V-15R Benchtop Centrifuge, IVD 120 V 60 Hz | Beckman-Coulter | C63125 | |
| Au G300F1 with R2/2 Quantifoil carbon | Quantifoil | TEM-G300F1-AU | |
| Bovine serum albumin | MilliporeSigma | A9647 | |
| BRAND counting chamber BLAUBRAND Neubauer improved | Sigma-Aldrich | BR717805-1EA | |
| DMi1 Inverted Microscope | Leica | 22A00G119 | |
| Dulbecco's modified eagle's medium - high glucose, no glutamine | Gibco | 11-960-044 | |
| Dumont 5/15 tweezer | Electron Microscopy Sciences | 0103-5/15-PO | |
| EM GP2 | Leica | 587085 | Automated plunge freezer |
| Fetal Bovine Serum | Gibco | A5209 | |
| Fibronectin from bovine plasma, cell culture grade | MilliporeSigma | F1141 | |
| GenJet version II in vitro DNA transfection reagent | SignaGen Laboratories | SL100489 | |
| GlutaMAX I 100x | Fisher Scientific | 35050061 | Media supplement |
| Neslab EX-211 Heating Circulator | Neslab | Out of production | Water bath for media warming |
| Original Portable Pipet-Aid Pipette Controller | Drummond Scientific | 4-000-100 | |
| PBS, pH 7.4 | Gibco | 10010023 | |
| Pelco easyGlow device | Pelco | 91000S | Glow discharge device |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | Media supplement |
| Pipetman P1000, 100–1000 µL, Metal Ejector | Gilson | F144059M | |
| Pipetman P2, 0.2–2 µL, Metal Ejector | Gilson | F144054M | |
| Pipetman P20, 2–20 µL, Metal Ejector | Gilson | F144056M | |
| Whatman number 2 filter paper, 55 mm | Whatman | 28455-041 | Blotting paper |
References
- Zhang, P., Mendonça, L. Analysis of Viruses in the Cellular Context by Electron Tomography. Encyclopedia of Virology. 1, Elsevier, Academic Press. 242-247 (2021).
- Fäßler, F., Dimchev, G., Hodirnau, V. -V., Wan, W., Schur, F. K. M. Cryo-electron tomography structure of Arp2/3 complex in cells reveals new insights into the branch junction. Nature Communications. 11, 6437(2020).
- McDowall, A. W., et al. Electron microscopy of frozen hydrated sections of vitreous ice and vitrified biological samples. Journal of Microscopy. 131 (Pt 1), 1-9 (1983).
- Stewart, M., Vigers, G. Electron microscopy of frozen-hydrated biological material. Nature. 319 (6055), 631-636 (1986).
- Gan, L., Jensen, G. J. Electron tomography of cells. Quarterly Reviews of Biophysics. 45 (1), 27-56 (2012).
- Yang, J. E., Larson, M. R., Sibert, B. S., Shrum, S., Wright, E. R. CorRelator: Interactive software for real-time high precision cryo-correlative light and electron microscopy. Journal of Structural Biology. 213 (2), 107709(2021).
- Mendonça, L., et al. Correlative multi-scale cryo-imaging unveils SARS-CoV-2 assembly and egress. Nature Communications. 12 (1), 4629(2021).
- Klumpe, S., et al. A modular platform for automated cryo-FIB workflows. eLife. 10, e70506(2021).
- Wagner, F. R., et al. Preparing samples from whole cells using focused-ion-beam milling for cryo-electron tomography. Nature Protocols. 15 (6), 2041-2070 (2020).
- Klein, S., et al. IFITM3 blocks influenza virus entry by sorting lipids and stabilizing hemifusion. Cell Host & Microbe. 31 (4), 616.e20-633.e20 (2023).
- Shah, P. N. M., et al. Characterization of the rotavirus assembly pathway in situ using cryoelectron tomography. Cell Host & Microbe. 31 (4), 604.e4-615.e4 (2023).
- Fäßler, F., Zens, B., Hauschild, R., Schur, F. K. M. 3D printed cell culture grid holders for improved cellular specimen preparation in cryo-electron microscopy. Journal of Structural Biology. 212 (3), 107633(2020).
- Hoffmann, P. C., et al. Electron cryo-tomography reveals the subcellular architecture of growing axons in human brain organoids. eLife. 10, e70269(2021).
- Toro-Nahuelpan, M., et al. Tailoring cryo-electron microscopy grids by photo-micropatterning for in-cell structural studies. Nature Methods. 17 (1), 50-54 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved