Method Article
포유류 세포의 In Situ Cryotomography를 위한 시료 전처리
요약
이 방법은 in situ 세포 cryotomography 및 correlative light and electron microscopy(CLEM)를 위한 전자 현미경(EM) 그리드 준비를 위한 접근 가능하고 유연한 프로토콜을 제공합니다.
초록
In situ 세포 냉동 단층촬영은 원래의 동결 수화 세포 맥락에서 복잡한 물체를 연구하기 위한 강력한 기술로, 세포 생물학 및 바이러스학과 매우 관련이 있습니다. 냉동 단층학을 다른 현미경 기법과 결합할 수 있는 잠재력은 통합 및 상관 이미징을 위한 완벽한 기술입니다. 그러나 in situ 세포 단층 촬영을 위한 시료 준비는 세포가 전자 현미경 그리드 위에 쉽게 부착되고 늘어나지 않기 때문에 간단하지 않습니다. 또한 그리드 자체는 깨지기 쉬우며 너무 세게 다루면 깨질 수 있어 이미지 영역이 손실될 수 있습니다. 조직 배양 접시의 형상은 핀셋으로 그리드를 조작할 때도 문제가 될 수 있습니다. 여기에서는 이러한 (및 기타) 문제를 극복하고 부착성 포유류 세포의 in situ 세포 cryotomography 및 상관 이미징을 위한 양질의 샘플을 준비하기 위한 팁과 요령을 설명합니다. 극저온 현미경 기술의 지속적인 발전으로 이 기술은 복잡한 생물학적 시스템에 대한 이해를 증진할 수 있는 엄청난 가능성을 가지고 있습니다.
서문
In situ 세포 냉동 단층촬영은 화학적 고정 없이 세포에서 생물학적으로 관련된 구조를 연구할 수 있는 강력한 기술입니다. 세포를 EM 그리드에 부착하고 그리드를 극저온에서 플런지 동결시킴으로써, 관심 물체는 세포 내 물로부터 결정질 얼음을 형성하지 않고 자연 세포 맥락에서 동결됩니다 1,2. 화학적 고정과 결정질 얼음 형성은 모두 단백질 및 지질과 같은 관련 분자의 구조를 파괴하여 이러한 기술을 사용하여 얻은 이미지의 생물학적 정확도를 감소시킬 수 있습니다 3,4. 단층 촬영에서 그리드는 전자 현미경을 사용하여 증분 각도로 이미지화되며, 이러한 이미지는 이미징된 대상 영역의 3차원 표현을 구성하는 데 사용됩니다5. In situ cryotomography는 cryofluorescence imaging, soft X-ray tomography 및 cryoFIB/SEM(cryogenic Focused Ion Beam/Scanning Electron Microscopy)과 같은 통합 및 상관 이미징을 위한 다른 현미경 기술과 함께 사용할 수 있습니다.6,7,8,9,10,11 . 여러 기술의 통합으로 단일 현미경 기술로 얻을 수 있는 것보다 구조 또는 공정에 대한 더 많은 정보를 얻을 수 있습니다.
in situ 세포 cryotomography의 모든 이점에도 불구하고 샘플 준비는 다양한 이유로 어려울 수 있습니다. 전자 현미경 그리드의 취약성으로 인해 강제로 조작하면 손상이 발생할 수 있으며, 특히 얇은 탄소 층은 섬세하고 찢어지기 쉬워 그리드의 이미지 영역을 줄일 수 있습니다. 전자 현미경 그리드는 크기가 작기 때문에 조작하기 어렵고 세포를 성장시키는 데 사용되는 웰 또는 마이크로슬라이드의 표면에서 분리되기 쉽습니다. 우물 또는 마이크로슬라이드 내의 그리드 조작은 이러한 형상으로 인해 어려울 수 있습니다. 그리드를 부적절하게 준비하면(예: 그리드가 떠 있도록 허용) 세포 밀도가 낮아지고 잠재적인 이미징 영역의 수가 줄어들 수 있으며, 특히 세포가 그리드 자체에 부착되기 쉽지 않은 경우 더욱 그렇습니다. 직접 세포 냉동 단층촬영의 경우 세포가 매우 얇게 퍼져야 하며, 이는 부적절한 온도나 그리드의 거친 취급 등 여러 가지 이유로 중단될 수 있습니다.
다양한 최적화를 통해 이 기사에 제시된 기술은 극저온 단층촬영을 위한 전자 현미경 그리드를 준비하는 동안 발생하는 가장 일반적인 함정을 처리하기 위한 것입니다. 5/15 각진 핀셋을 사용하면 웰 플레이트 또는 마이크로슬라이드 내에서 그리드를 조작할 수 있습니다. 도금 전에 그리드의 양쪽에 피브로넥틴 용액을 적용하면 플로팅 그리드가 발생할 가능성이 낮아져 그리드가 적절한 셀 밀도를 갖도록 하고 그리드가 조작으로 인해 손상될 가능성이 적어지도록 하는 데 도움이 됩니다. 또한 플런지 동결 직전까지 그리드를 37°C에서 배양함으로써 세포가 얇은 가장자리가 수축되는 것을 방지하기 위해 세포를 편안한 환경에 보관합니다. 뒷면에서 그리드를 블로팅하면 기계적 힘으로 인한 셀 손상도 방지할 수 있습니다. 전체적으로 이러한 조치는 현장 세포 냉동 단층촬영 연구를 위한 시료 전처리의 성공률을 높여 이 이미징 접근법의 접근성을 높입니다.
프로토콜
1. 그리드 준비
참고: 실험 설계에서 플런지 동결 세션당 총 최대 8-12개의 그리드와 웰당 4-5개의 그리드를 계획합니다. 그 이상은 매우 긴 플런지 동결 세션으로 이어져 세포 스트레스, 얼음 오염 및 사용자 오류를 증가시킬 수 있습니다.
- 글로우 방전
- 글로우 방전 장치에서 0.39mBar 대기에서 45초 동안 15mA로 글로우 방전할 천공된 탄소 지지 필름이 있는 적절한 수의 그리드를 로드합니다.
- 그리드의 탄소 면이 위를 향하도록 하십시오. 완료되면 그리드를 여과지를 깐 깨끗한 용기로 옮깁니다(그림 1A1).
알림: 재료가 세포에 독성이 없는 한 다른 그리드를 사용할 수 있습니다(구리 그리드 제외). 파인더 격자는 상관 연구에 유용합니다. 다른 재료로 만든 그리드도 가능합니다. 많은 실험실에서 SiO2 지지 그리드 8,9 위에 세포를 성장시키는 좋은 결과를 얻었습니다.
- 부착 치료
- 그리드, 피브로넥틴, PBS, 플레이트 및 핀셋을 생물 안전 작업대로 옮깁니다. 6웰 플레이트의 뚜껑과 같은 멸균 표면에 넉넉한 크기의 접착 용액 두 개를 마이크로피펫팅하여 그리드의 양쪽을 20μg/mL 소 피브로넥틴으로 처리합니다. 도트가 전체 그리드를 감쌀 수 있을 만큼 충분히 큰지 확인합니다(약 100μL 권장).
참고: 선택한 부착 용액으로 처리하기 전에 그리드 사각형 중앙에 세포 부착을 최적화하기 위해 여기에서 그리드를 포토 마이크로 패터닝하는 옵션이 있습니다. 세포가 막대에 부착되는 기능을 줄이면 표현 가능한 세포의 수가 늘어납니다. 이는 cryoFIB 밀링과 관련된 실험에 이상적입니다. - 5/15 핀셋을 사용하여 그리드를 조작합니다. 용액에서 그리드의 양쪽을 처리해야 합니다.
참고: 다른 접착 용액(피브리노겐, 콜라겐, 기타 세포외 기질 성분 등)을 사용할 수 있습니다. 피브로넥틴은 다양한 세포주에서 좋은 결과를 제공하기 때문에 여기에 사용됩니다. (U2OS, HeLa, Vero, Calu-3, Tzm-bl). 5/15 핀셋은 형상이 6웰 플레이트, 35mm 접시 및 마이크로 슬라이드 주변에서 기동성을 향상시킬 수 있기 때문에 유용합니다. 그 결과 그리드에 가해지는 기계적 응력이 줄어들고 탄소 필름이 더 손상되지 않습니다. 그리드 오염 가능성을 줄이려면 시작하기 전에 필요한 모든 재료를 생물 안전 캐비닛에 넣으십시오.
- 그리드, 피브로넥틴, PBS, 플레이트 및 핀셋을 생물 안전 작업대로 옮깁니다. 6웰 플레이트의 뚜껑과 같은 멸균 표면에 넉넉한 크기의 접착 용액 두 개를 마이크로피펫팅하여 그리드의 양쪽을 20μg/mL 소 피브로넥틴으로 처리합니다. 도트가 전체 그리드를 감쌀 수 있을 만큼 충분히 큰지 확인합니다(약 100μL 권장).
- 격자 연결
- 소 피브로넥틴으로 치료하면 그리드가 끈적끈적해집니다. 5/15 핀셋을 사용하여 그리드의 비탄소 표면을 빈 접시/접시 바닥에 부드럽게 대고 핀셋을 엽니다. 그리드는 새 표면에 쉽게 부착되어야 합니다(그림 1A2).
알림: 접시/접시의 정중앙이나 가장자리에 격자를 배치하지 마십시오. 세포를 추가할 때 플레이트 중앙에 세포 밀도가 축적되는 경향이 있습니다. 이로 인해 과도한 세포 밀도를 가진 그리드가 생성될 수 있습니다. 대안적으로, 3D 프린팅된 격자 홀더는 접시/플레이트(12)의 표면에 셀을 직접 부착하는 대신 여기에서 사용될 수 있다.
- 소 피브로넥틴으로 치료하면 그리드가 끈적끈적해집니다. 5/15 핀셋을 사용하여 그리드의 비탄소 표면을 빈 접시/접시 바닥에 부드럽게 대고 핀셋을 엽니다. 그리드는 새 표면에 쉽게 부착되어야 합니다(그림 1A2).
- 잠복
- 그리드를 피브로넥틴 부착 용액(20μg/mL)에서 30분 동안 배양합니다. 이 과정에서 그리드가 건조되지 않도록 마이크로피펫은 15분마다 그리드 위에 더 부착성이 높은 용액을 1-2방울 떨어뜨립니다(그림 1A3).
알림: 잠복기는 사용된 접착 용액에 따라 다릅니다. 소 피브로넥틴의 경우 권장 시간은 30분입니다.
- 그리드를 피브로넥틴 부착 용액(20μg/mL)에서 30분 동안 배양합니다. 이 과정에서 그리드가 건조되지 않도록 마이크로피펫은 15분마다 그리드 위에 더 부착성이 높은 용액을 1-2방울 떨어뜨립니다(그림 1A3).
- 세탁
- 배양 기간 후, 마이크로피펫팅을 통해 과도한 부착 용액을 제거합니다. 그리드 위에 직접 PBS 방울을 마이크로피펫으로 세척하여 그리드를 세척합니다. 이것을 2-3회 반복한다. (그림 1A4).
- 멸균
- UV 광선을 사용하여 생물 안전 캐비닛의 그리드를 1시간 동안 살균합니다. 멸균을 최대화하기 위해 그리드를 UV 소스에 최대한 가깝게 배치합니다(그림 1A5). 이 과정에서 그리드가 건조되지 않도록 10분마다 그리드 바로 위에 PBS 1-2방울을 마이크로피펫팅합니다.
참고 : 1.4-1.6단계를 동시에 수행할 수 있습니다.
- UV 광선을 사용하여 생물 안전 캐비닛의 그리드를 1시간 동안 살균합니다. 멸균을 최대화하기 위해 그리드를 UV 소스에 최대한 가깝게 배치합니다(그림 1A5). 이 과정에서 그리드가 건조되지 않도록 10분마다 그리드 바로 위에 PBS 1-2방울을 마이크로피펫팅합니다.
2. 그리드 시드
- 셀 계산:
- 기계적 또는 효소적 방법을 사용하여 세포를 분리하고 계수합니다. 계수하기 전에 시드에 사용할 최적의 셀 수를 결정합니다. 6웰 플레이트에 시드된 U2OS의 경우 웰당 6 x 104 - 1.6 x 105 셀 사이에서 사용합니다(그림 1B1).
참고: 파종된 세포의 수는 세포 유형, 웰의 표면적, 사용된 접시 또는 마이크로슬라이드, 파종과 플런지 동결 사이의 시간, 실험 설계에 따라 달라집니다. 플런지 동결 시 그리드 제곱당 0.25-1개의 셀이 생성되는 조건을 식별하기 위해 셀 수 범위를 테스트합니다. 셀 밀도가 높으면 열 전달 속도가 느려지고 유리화 과정에 영향을 미칠 수 있다는 점에 유의해야 합니다. 이를 방지하기 위해 일부 실험실에서는 세포 덩어리가 형성되는 것을 방지하는 역할을 하는 세포 여과기를 사용하여성공을 거두었습니다 13. 마지막으로, 이 프로토콜은 세포를 탄소층에 무작위로 부착하는 결과를 낳습니다. 표적 부착이 필요한 경우 포토 마이크로 패터닝을 사용할 수 있습니다(1.3단계 참조)14.
- 기계적 또는 효소적 방법을 사용하여 세포를 분리하고 계수합니다. 계수하기 전에 시드에 사용할 최적의 셀 수를 결정합니다. 6웰 플레이트에 시드된 U2OS의 경우 웰당 6 x 104 - 1.6 x 105 셀 사이에서 사용합니다(그림 1B1).
- 세포 및 성장 배지 추가: 기포를 피하면서 마이크로피펫을 통해 웰에 세포를 추가합니다(그림 1B2). 6-웰 플레이트의 경우 총 웰 부피는 1.5-2.0mL가 권장됩니다.
알림: 전체 볼륨을 추가하기 전에 그리드 주변을 조심스럽게 적시는 것이 좋습니다. 이렇게 하면 그리드가 분리되어 솔루션에서 부동하는 것을 방지할 수 있습니다. 웰에서 균일한 세포 분포를 촉진하기 위해 플레이트를 좌우로 부드럽게 움직입니다. 플레이트를 원을 그리며 소용돌이치면 웰 중앙에 과도한 셀 밀도가 할당될 수 있습니다. - 배양: 실험 설계에 따라 적절한 시간 동안 37°C에서 슬라이드를 배양하며, 이는 다운스트림 응용 분야에 따라 다릅니다. 이 예(HIV 분자 클론의 형질주입)의 경우, 16-24시간 사이에 배양합니다(그림 1B3).
알림: 배양 시간이 길수록 세포 분열 주기가 길어집니다. 따라서 그에 따라 시드를 위한 시작 셀 수를 조정합니다.
3. 형질주입
- 형질주입 혼합물 준비:
- 선택한 세포주에 플라스미드 transfection을 위한 적절한 양이온성 리포좀 시약을 준비합니다.
- 이 transfection 예제에서는 HIViΔEnv plasmid 대 psPAX2 plasmid의 1:3 비율로 transfection할 웰당 1μg의 총 plasmid DNA(6웰 플레이트)를 사용합니다. 각 웰에 대해 1μg의 DNA를 50μL의 무혈청 DMEM에 희석합니다. 마이크로피펫팅을 반복하거나 플레이트를 부드럽게 휘젓는 방식으로 혼합물을 균질화합니다.
- 각 웰에 대해 3μL의 transfection 시약을 무혈청 DMEM에 희석한 다음 마이크로피펫팅 또는 부드럽게 소용돌이쳐 혼합물을 다시 균질화합니다. 희석된 전체 transfection 시약 혼합물을 희석된 DNA 혼합물에 추가하고(단계 3.1.2) 실온(RT)에서 15분 동안 배양합니다(그림 1C1).
참고: 이 혼합물이 배양되는 동안 웰의 배지를 1.5mL의 새 DMEM으로 교체합니다. 우물 바닥에서 그리드가 빠지지 않도록 주의하십시오.
- transfection 혼합물을 적용하기 위해 3.1.3단계에서 혼합물 100μL를 각 웰에 적가하고 격자 위에 점적을 농축하여 접촉을 확인합니다(그림 1C2). transfection 후 16-24시간 후에 성장 배지를 교체합니다(그림 1C3).
4. 플런지 냉동
알림: 블로팅이 필요할 때까지 셀을 37°C로 유지하십시오. 또한 프로세스 전반에 걸쳐 그리드의 탄소 측면을 기록해 두십시오.
- 세포 밀도
- 도립 광학 현미경으로 그리드를 확인하고 각 그리드의 셀 밀도를 기록하십시오.
참고: 그리드 정사각형당 셀이 0.25개 미만인 그리드(또는 4개의 그리드 사각형당 하나의 셀)는 '비어 있는' 것으로 간주됩니다. 그리드 제곱당 0.25-1개의 셀이 있는 그리드는 '정상'으로 간주됩니다. 정사각형 그리드당 셀이 1개 이상인 그리드는 '꽉 찼음'으로 간주됩니다. - 각 그리드의 셀 밀도를 기록하여 나중에 플런지 동결 중에 블로팅 시간을 조정할 수 있습니다. 빈 접시/접시에 PBS 2-3mL를 넣고 37°C로 데웁니다.
- 도립 광학 현미경으로 그리드를 확인하고 각 그리드의 셀 밀도를 기록하십시오.
- 기준점 준비
- 다운스트림 극저온 단층학 응용 분야를 위한 금 기준점을 준비하기 위해 50μL의 10nm 콜로이드 금 비드 용액을 깨끗한 1.5mL 튜브에 피펫팅합니다. 2 μL의 1 mg/mL BSA를 튜브에 첨가하고 마이크로피펫팅을 반복하여 균질화합니다.
- 튜브를 15,000-20,000 x g 에서 15분 동안 원심분리합니다. 펠릿을 방해하지 않고 가능한 한 많은 상층액을 제거하기 위한 마이크로피펫.
알림: 펠릿은 매우 느슨합니다. - 펠릿에 50μL의 PBS를 추가하고 재현탁시킵니다. 튜브를 15,000-20,000 x g 에서 15분 동안 다시 원심분리합니다.
- 10μL 팁을 사용하여 펠릿 4μL를 직접 흡입하고 깨끗한 1.5mL 튜브로 옮깁니다(그림 1D1). 그리드당 1μL의 세척 및 농축 금을 사용합니다.
알림: 사용되는 기준점의 유형은 다운스트림 응용 프로그램에 따라 다릅니다. TEM 단층 촬영의 경우 10nm 금 구슬을 사용합니다. 연질 X선 단층 촬영의 경우 200nm 금 구슬을 사용합니다. 상관 현미경 검사의 경우 형광 라텍스 비드를 사용하십시오. 기준점은 일반적으로 CryoFIB 밀링과 관련된 실험에는 밀링 공정에서 파괴되므로 필요하지 않습니다.
- 더 럽 히기
- 환경 챔버를 습도 95% 및 30°C로 설정합니다(그림 1D1). 5/15 핀셋을 사용하여 그리드를 선택합니다.
- PBS로 그리드를 세척하고 플런지 핀셋으로 옮깁니다(그림 1D2). 고정되면 5/15 핀셋을 제거하고 플런지 핀셋에 클램프를 밉니다.
- 그리드를 플런지 냉동고에 삽입하고 cl을 유지합니다.amp 안전합니다(그림 1D3). 그리드의 뒷면에 1μL의 금 기준점을 추가합니다(그림 1D4). 그리드의 탄소 쪽에 2-3μL의 PBS를 추가합니다. 자동 블로팅을 사용하여 그리드의 뒷면을 블링하고 동결을 액체 에탄에 담급니다(그림 1D5).
참고: 최적의 블로팅을 위해 그리드당 3-4μL의 부피를 갖는 것이 좋습니다. 그리드는 세척 후 다양한 양의 PBS를 유지할 수 있습니다. 그리드에 이미 존재하는 액체 보유량을 고려하여 PBS의 추가된 부피를 조정합니다. 금 기준점을 그리드 뒷면에 추가하는 것이 좋습니다. 앞쪽에 추가하면 삽입 지점 근처에 금 기준점 웅덩이가 생길 수 있는 반면, 뒤쪽에서 추가하면 더 균질한 용액이 생성됩니다. 블로팅 지속 시간은 그리드의 세포 치과에 따라 다릅니다. 비어 있는 경우 2초, 정상인 경우 3초, 전체 그리드의 경우 각각 4초입니다. 사용 가능한 플런지 프리져의 유형에 따라 블로팅에 접근하는 방식이 결정될 수 있습니다: 라이카 GP2 플런지 프리져는 이 프로토콜에서 사용되는 프리져이며 기본적으로 자동 단면 블로팅이 가능합니다. Thermo Fisher Vitrobot은 자동 양면 블로팅을 수행하지만, 이로 인해 탄소 면에 부착된 셀이 손상되는 경우가 많습니다. Vitrobot의 수동 블로팅과 수동 중력 플런저도 가능합니다.
결과
HIViGFPΔEnv 및 psPAX2의 cotransfection 후, 모든 그리드는 탄소층의 찢어짐을 최소화했습니다. 그리드는 transfection 시약으로 배양한 후 24시간 후에 위상 광 현미경 및 형광 현미경을 사용하여 이미지화되었습니다(그림 2). 모의 그리드와 co-transfection된 그리드의 세포는 여러 그리드 사각형에 생존 가능한 세포를 포함했습니다.
psPAX2는 형광 태깅 없이 HIV-1의 모든 구조 및 효소 단백질을 암호화합니다. HIViGFPΔEnv는 psPAX2와 유사하지만 GFP 태그가 부착된 HIV Gag 단백질에 대한 코드가 있습니다. 두 플라스미드 모두 ΔEnvelope입니다. cotransfection은 형광 HIV-1 입자의 네이티브 유사 조립 및 발아를 초래하여 생물 안전 레벨 1 조건에서 HIV의 CLEM 연구에 적합한 시스템입니다. co-transfection된 그리드는 녹색 형광을 나타내는 세포의 subset을 보여주었으며, 이는 성공적인 cotransfection을 나타냅니다. 모의 그리드에서 형광을 나타내는 세포는 없었으며, HIViGFPΔEnv 및 psPAX2를 사용하여 cotransfection을 추가로 검증했습니다. 광 기반 현미경을 사용하여 그리드를 관찰한 후 그리드를 급락 동결하여 액체 질소의 장기 저장으로 옮겼습니다.
그림 3은 동일한 실험 방법을 사용하지만 약간 다른 플라스미드 구조를 사용하여 생성된 그리드의 결과를 보여줍니다. U2OS 함유 그리드는 서로 다른 HIV 클론(1:6 비율의 HIVmCherryΔEnv 및 NL4-3ΔEnvGFP)을 사용하여 동시 형질주입되었습니다. 더 많은 질량의 형광 태깅 플라스미드가 사용되었기 때문에 이러한 그리드를 통해 더 많은 수의 transfection된 세포를 관찰할 수 있어 cryoCLEM 및 cryoET를 사용하여 이미지를 캡처할 때 이점을 얻을 수 있습니다. cryoCLEM을 사용하여 cryofluorescence 현미경을 사용하여 각 그리드에 대해 전체 그리드 아틀라스를 생성하여 모든 동시 형질주입된 세포의 위치를 기록했습니다. 세포의 위치를 알고 cryoET를 수행했습니다. 전체 저배율 그리드 아틀라스를 수집하여 cryofluorescence에서 수집된 형광 아틀라스와 겹쳤습니다(그림 3A). 냉동 토모그램은 세포에서 HIV의 조립 및 발아를 포함하여 바이러스 수명 주기의 복잡한 세부 사항을 캡처하는 세포 부위에서 수집되었습니다(그림 3B).
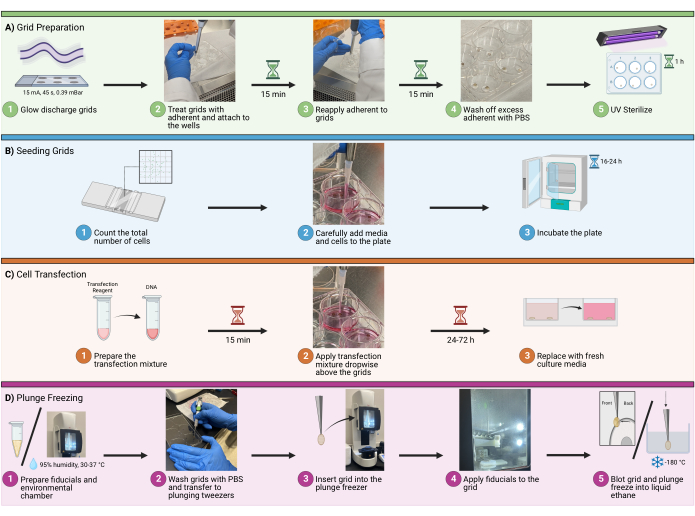
그림 1: 그리드의 셀 시드 워크플로. CryoEM 그리드에서 세포를 파종하는 전체 절차를 보여주는 회로도. 이 공정은 (A) 파종을 위해 웰에 그리드 준비, (B) 각 웰에 적절한 양의 세포 추가, (C) 형광 이미징을 위한 선택적 세포 transfection, (D) 샘플의 유리화를 위한 그리드의 플런지 동결 등 4가지 주요 단계로 나뉩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: HIViGFPΔEnv 및 psPAX2를 사용한 U2OS의 동시 형질주입. U2OS 세포는 GFP 함유 HIViGFPΔEnv 및 psPAX2와 1:3 비율로 동시 형질주입되었습니다. 그리드는 위상차와 형광 현미경으로 이미지화되었습니다. GFP 발현이 있는 것으로 나타난 세포는 성공적인 cotransfection을 나타냅니다. 척도 막대: 500 μm. 축척 막대(삽입물): 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
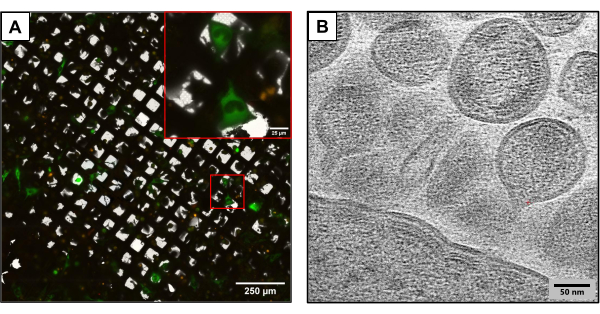
그림 3: 잠재적인 다운스트림 극저온 기반 분석법 . (A) co-transfection된 U2OS 세포가 있는 cryoCLEM 이미지. 녹색으로 표시된 세포는 HIV 생성 세포를 나타내며 cotransfection 성공을 측정하는 데 사용됩니다. 빨간색 반점은 mCherry 태그가 지정된 HIV-1 개그를 나타냅니다. 척도 막대: 250 μm. 눈금 막대(삽입물): 25μm(B) U2OS 세포의 원형질막에서 싹트는 여러 HIV 입자의 cryoET 이미지. 스케일 바: 50nm 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에서 우리는 in situ cryoelectron tomography 응용 분야를 위해 전자 현미경 그리드에서 세포를 시드하기 위해 접근 가능하고 유연하며 재현 가능한 프로토콜을 제공했습니다. 이 방법은 다운스트림 응용 분야 및/또는 실험 요구 사항의 요구 사항에 맞게 쉽게 조정할 수 있습니다. 뛰어난 유연성 외에도 그리드 시딩의 일반적인 함정, 특히 탄소층의 광범위한 손상, 낮은 셀 밀도 및 얇은 셀 돌출부의 열악한 구조적 무결성을 최적화하고 줄이는 워크플로우를 설명했습니다.
여기에 설명된 프로토콜은 몇 가지 대안을 제공하지만 일반적인 결과를 최적화하기 위해 따라야 하는 몇 가지 중요한 단계가 있습니다. 그리드 셀 시딩의 가장 큰 문제 중 하나는 우물이나 마이크로슬라이드에서 그리드를 분리하고 부유하는 것입니다. 따라서 양쪽에 부착 용액으로 그리드를 완전히 적시고 배양 기간 동안 건조되지 않도록 하는 것이 중요합니다. 3D 프린팅 그리드 홀더를 사용하는 경우 그리드 아래에 갇힌 공기가 홀더 밖으로 밀어낼 수 있으므로 이러한 홀더에 대한 미디어를 여러 번 변경하면 플로팅 그리드가 생성될 가능성이 있습니다.
핀셋을 선택하면 탄소층을 손상시킬 수 있는 광범위한 그리드 벤딩 없이 그리드를 조작하는 기하학적으로 유리한 방법을 제공하는 방식으로 그리드 품질도 향상됩니다. 급락하기 전에 세포를 가능한 한 오랫동안 37°C로 유지하면 세포 통증이 줄어들고 그리드에서 이미징 가능한 얇은 세포의 수가 개선됩니다. 마지막으로, 금 쪽에서 블로팅하면 깨지기 쉬운 세포 구조를 손상시킬 수 있는 가혹한 기계적 힘으로부터 세포를 보호할 수 있습니다.
이 프로토콜에는 포함되지 않았지만, 격자 광-미세패터닝은 격자 사각형(14)의 중심에 대한 부착을 최적화함으로써 imageable 세포의 수를 증가시키는 것으로 나타났다. 마지막으로, 3D 프린팅 그리드 홀더는 최근 직접적인 그리드 조작을 제한하여 그리드 손상을 줄이는 데 사용되고있다 12.
이 프로토콜은 cryotomography 적용을 위해 세포의 얇은 가장자리와 돌출부를 이미징하는 데 최적화되어 있다는 점에 유의하는 것이 중요할 수 있습니다. 선택한 다운스트림 애플리케이션에 대한 최상의 결과를 찾기 위해 프로토콜의 권장 사항에서 다양한 조건을 해결하는 것이 좋습니다. 전반적으로 이 프로토콜은 특정 요구 사항에 맞게 조정할 수 있는 그리드에 셀을 파종하는 안정적이면서도 다재다능한 방법을 제공합니다.
공개
저자는 상충되는 이해관계가 없음을 선언합니다.
감사의 말
플런지 냉동 장비를 이용할 수 있게 해주신 Mansky 연구소에 감사드립니다. 이 작업의 일부는 미네소타 대학의 특성화 시설에서 수행되었으며, 미네소타 대학교는 재료 연구 과학 및 엔지니어링 센터(MRSEC; 수상 번호 DMR-2011401) 및 NNCI(National Neuroscience Curriculum Initiative; 수상 번호 ECCS-2025124) 프로그램. 바이러스 환경에서의 HIV 행동 센터(B-HIVE; 1U54AI170855-01)와 듀크 HIV 구조 생물학 센터(DCHSB; U54AI170752) 센터.
자료
| Name | Company | Catalog Number | Comments |
| 10 nm colloidal gold bead solution | Sigma-Aldrich | 741957 | |
| 6 well multidish, 100/CS | Fisher Scientific | FB012927 | |
| Allegra V-15R Benchtop Centrifuge, IVD 120 V 60 Hz | Beckman-Coulter | C63125 | |
| Au G300F1 with R2/2 Quantifoil carbon | Quantifoil | TEM-G300F1-AU | |
| Bovine serum albumin | MilliporeSigma | A9647 | |
| BRAND counting chamber BLAUBRAND Neubauer improved | Sigma-Aldrich | BR717805-1EA | |
| DMi1 Inverted Microscope | Leica | 22A00G119 | |
| Dulbecco's modified eagle's medium - high glucose, no glutamine | Gibco | 11-960-044 | |
| Dumont 5/15 tweezer | Electron Microscopy Sciences | 0103-5/15-PO | |
| EM GP2 | Leica | 587085 | Automated plunge freezer |
| Fetal Bovine Serum | Gibco | A5209 | |
| Fibronectin from bovine plasma, cell culture grade | MilliporeSigma | F1141 | |
| GenJet version II in vitro DNA transfection reagent | SignaGen Laboratories | SL100489 | |
| GlutaMAX I 100x | Fisher Scientific | 35050061 | Media supplement |
| Neslab EX-211 Heating Circulator | Neslab | Out of production | Water bath for media warming |
| Original Portable Pipet-Aid Pipette Controller | Drummond Scientific | 4-000-100 | |
| PBS, pH 7.4 | Gibco | 10010023 | |
| Pelco easyGlow device | Pelco | 91000S | Glow discharge device |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | Media supplement |
| Pipetman P1000, 100–1000 µL, Metal Ejector | Gilson | F144059M | |
| Pipetman P2, 0.2–2 µL, Metal Ejector | Gilson | F144054M | |
| Pipetman P20, 2–20 µL, Metal Ejector | Gilson | F144056M | |
| Whatman number 2 filter paper, 55 mm | Whatman | 28455-041 | Blotting paper |
참고문헌
- Zhang, P., Mendonça, L. Analysis of Viruses in the Cellular Context by Electron Tomography. Encyclopedia of Virology. 1, 242-247 (2021).
- Fäßler, F., Dimchev, G., Hodirnau, V. -. V., Wan, W., Schur, F. K. M. Cryo-electron tomography structure of Arp2/3 complex in cells reveals new insights into the branch junction. Nature Communications. 11, 6437 (2020).
- McDowall, A. W., et al. Electron microscopy of frozen hydrated sections of vitreous ice and vitrified biological samples. Journal of Microscopy. 131 (Pt 1), 1-9 (1983).
- Stewart, M., Vigers, G. Electron microscopy of frozen-hydrated biological material. Nature. 319 (6055), 631-636 (1986).
- Gan, L., Jensen, G. J. Electron tomography of cells. Quarterly Reviews of Biophysics. 45 (1), 27-56 (2012).
- Yang, J. E., Larson, M. R., Sibert, B. S., Shrum, S., Wright, E. R. CorRelator: Interactive software for real-time high precision cryo-correlative light and electron microscopy. Journal of Structural Biology. 213 (2), 107709 (2021).
- Mendonça, L., et al. Correlative multi-scale cryo-imaging unveils SARS-CoV-2 assembly and egress. Nature Communications. 12 (1), 4629 (2021).
- Klumpe, S., et al. A modular platform for automated cryo-FIB workflows. eLife. 10, e70506 (2021).
- Wagner, F. R., et al. Preparing samples from whole cells using focused-ion-beam milling for cryo-electron tomography. Nature Protocols. 15 (6), 2041-2070 (2020).
- Klein, S., et al. IFITM3 blocks influenza virus entry by sorting lipids and stabilizing hemifusion. Cell Host & Microbe. 31 (4), 616.e20-633.e20 (2023).
- Shah, P. N. M., et al. Characterization of the rotavirus assembly pathway in situ using cryoelectron tomography. Cell Host & Microbe. 31 (4), 604.e4-615.e4 (2023).
- Fäßler, F., Zens, B., Hauschild, R., Schur, F. K. M. 3D printed cell culture grid holders for improved cellular specimen preparation in cryo-electron microscopy. Journal of Structural Biology. 212 (3), 107633 (2020).
- Hoffmann, P. C., et al. Electron cryo-tomography reveals the subcellular architecture of growing axons in human brain organoids. eLife. 10, e70269 (2021).
- Toro-Nahuelpan, M., et al. Tailoring cryo-electron microscopy grids by photo-micropatterning for in-cell structural studies. Nature Methods. 17 (1), 50-54 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유