Method Article
הכנת דגימה לקריוטומוגרפיה באתרו של תאי יונקים
In This Article
Summary
שיטה זו מספקת פרוטוקול נגיש וגמיש להכנת רשתות מיקרוסקופ אלקטרונים (EM) עבור קריוטומוגרפיה תאית באתרה ומיקרוסקופ אור ואלקטרונים מתאמי (CLEM).
Abstract
קריוטומוגרפיה תאית באתרה היא טכניקה רבת עוצמה לחקר עצמים מורכבים בהקשר התאי הקפוא הטבעי שלהם, מה שהופך אותה לרלוונטית מאוד לביולוגיה תאית ווירולוגיה. הפוטנציאל של שילוב קריוטומוגרפיה עם שיטות מיקרוסקופיה אחרות הופך אותה לטכניקה מושלמת לדימות אינטגרטיבי ומתאם. עם זאת, הכנת הדגימה לטומוגרפיה תאית באתרה אינה פשוטה, מכיוון שתאים אינם מתחברים ונמתחים בקלות על רשת מיקרוסקופ האלקטרונים. בנוסף, הרשתות עצמן שבריריות ועלולות להישבר אם מטפלים בהן בכוח רב מדי, מה שגורם לאובדן אזורים הניתנים לצילום. הגיאומטריה של צלחות תרבית רקמות יכולה גם להוות אתגר בעת מניפולציה של הרשתות עם פינצטה. כאן, אנו מתארים את הטיפים והטריקים להתגבר על אתגרים אלה (ואחרים) ולהכין דגימות באיכות טובה עבור קריוטומוגרפיה תאית באתרו והדמיה מתאמת של תאי יונקים דבקים. עם ההתקדמות המתמשכת בטכנולוגיית קריומיקרוסקופיה, טכניקה זו טומנת בחובה הבטחה עצומה לקידום הבנתנו של מערכות ביולוגיות מורכבות.
Introduction
קריוטומוגרפיה תאית באתרה היא טכניקה רבת עוצמה המאפשרת לחקור מבנים רלוונטיים ביולוגית בתאים ללא קיבוע כימי. על ידי חיבור תאים לרשתות EM והקפאת הרשתות בקריוגן, אובייקטים מעניינים מוקפאים בהקשרים התאיים הטבעיים שלהם ללא היווצרות קרח גבישי ממים תוך-תאיים 1,2. הן קיבוע כימי והן היווצרות קרח גבישי יכולים לשבש את המבנים של מולקולות רלוונטיות, כגון חלבונים ושומנים, ולהפחית את הדיוק הביולוגי של תמונות המתקבלות באמצעות טכניקות אלה 3,4. בטומוגרפיה, רשתות מצולמות בזוויות מצטברות באמצעות מיקרוסקופ אלקטרונים, ותמונות אלה משמשות לבניית ייצוגים תלת-ממדיים של אזור המטרה המצולם5. ניתן להשתמש בקריוטומוגרפיה באתרו לצד טכניקות מיקרוסקופיה אחרות לדימות אינטגרטיבי ומתאם, כגון דימות קריופלואורסצנטי, טומוגרפיית רנטגן רכה ו- cryoFIB/SEM (מיקרוסקופ יונים ממוקד קריוגני/מיקרוסקופ אלקטרונים סורק)6,7,8,9,10,11 . שילוב של טכניקות מרובות מאפשר לקבל יותר מידע על מבנה או תהליך מאשר כל טכניקה מיקרוסקופית בודדת יכולה להשיג.
למרות כל היתרונות של קריוטומוגרפיה תאית באתרה , הכנת הדגימה יכולה להיות מאתגרת ממגוון סיבות. בשל שבריריותן, מניפולציה כוחנית של רשתות מיקרוסקופ אלקטרונים עלולה להוביל לנזק, כאשר שכבת הפחמן הדקה בפרט עדינה ומועדת להיקרע, מה שמקטין את השטח הניתן לצילום של הרשתות. רשתות מיקרוסקופיית אלקטרונים גם קשות למניפולציה בשל גודלן הקטן והן נוטות להתנתק מפני השטח של הבארות או המיקרו-שקופיות המשמשות לגידול תאים. מניפולציה של רשתות בתוך בארות או microslides יכול להיות קשה בשל הגיאומטריה של אלה. הכנה לא נכונה של הרשתות (למשל, לאפשר להן לצוף) עלולה להוביל לצפיפות תאים נמוכה ולהפחתת מספר אזורי הדימות הפוטנציאליים, במיוחד כאשר התאים אינם נוטים להיצמד לרשתות עצמן. עבור קריוטומוגרפיה תאית ישירה, התאים חייבים להתפשט דק מאוד, אשר יכול להיות משובש מסיבות רבות, כולל טמפרטורות לא תקינות או טיפול גס של הרשתות.
באמצעות מגוון אופטימיזציות, הטכניקות המוצגות במאמר זה נועדו להתמודד עם מלכודות נפוצות אלה המתעוררות במהלך הכנת רשתות מיקרוסקופ אלקטרונים עבור קריוטומוגרפיה. השימוש בפינצטה זוויתית 5/15 מאפשר מניפולציה של רשתות בתוך לוחות באר או מיקרו-שקופיות. תמיסת פיברונקטין המיושמת על שני צידי הרשתות לפני הציפוי מפחיתה את הסבירות לרשתות צפות, מה שמועיל להבטיח שלרשתות יש צפיפות תאים נאותה ושהרשתות נוטות פחות להיפגע עקב מניפולציה. על ידי שמירה על הרשתות מודגרות בטמפרטורה של 37 מעלות צלזיוס עד רגע לפני הקפאה, אנו גם מבטיחים שהתאים נשמרים בסביבה נוחה כדי למנוע מהתאים לסגת מהקצוות הדקים שלהם. הכתמת הרשתות מהצד האחורי גם מונעת נזק לתאים מכוח מכני. בסך הכל, מדדים אלה מגבירים את שיעור ההצלחה של הכנת הדגימות למחקרי קריוטומוגרפיה תאית באתרם , ומגבירים את הנגישות של גישת הדמיה זו.
Protocol
1. הכנת הרשת
הערה: בתכנון הניסוי, תכננו מקסימום של 8-12 רשתות בסך הכל לכל מפגש הקפאה של צלילה ו-4-5 רשתות לכל באר. יותר מזה יוביל לסשן ארוך מאוד של הקפאת צלילה, מה שעלול לגרום ללחץ מוגבר על התא, זיהום קרח וטעויות משתמש.
- פריקה זוהרת
- טען מספר מתאים של רשתות עם סרט תמיכת פחמן מחורר כדי להיות זוהר נפלט ב 15 mA במשך 45 שניות ב 0.39 mBar אטמוספירה במכשיר פריקה זוהר.
- ודא שצד הפחמן של הרשת פונה כלפי מעלה. בסיום, העבירו את הרשתות למכל נקי מרופד בנייר סינון (איור 1A1).
הערה: ניתן להשתמש ברשתות אחרות כל עוד החומר אינו רעיל לתאים (שאינו כולל כל רשת נחושת). רשתות Finder שימושיות למחקרי מתאמים. רשתות עשויות מחומרים אחרים אפשריות גם כן. מעבדות רבות השיגו תוצאות טובות בגידול תאים על גבי רשתות תמיכה SiO2 8,9.
- טיפול דבק
- העבירו את הרשתות, פיברונקטין (fibronectin), PBS, צלחות ופינצטה לארון בטיחות ביולוגית. טפל בשני צידי הרשתות עם פיברונקטין בקר 20 מיקרוגרם / מ"ל על ידי מיקרופיפטין שתי נקודות בגודל נדיב של תמיסה דבקה על משטח סטרילי, כגון מכסה של צלחת 6 בארות. ודא שהנקודות גדולות מספיק כדי לעטוף את הרשת כולה (מומלץ בסביבות 100 μL).
הערה: לפני הטיפול בתמיסה הדבקה שנבחרה, קיימת כאן אפשרות של מיקרו-תבניות צילום של הרשת כדי לייעל את החיבור של תאים במרכז ריבועי הרשת. הפחתת היכולת של תאים להיצמד לסורגים תגדיל את מספר התאים הניתנים לצילום. זה אידיאלי לניסויים הכוללים כרסום cryoFIB. - השתמש בפינצטה 5/15 כדי לתפעל את הרשתות. הקפד לטפל בשני צידי הרשת בתמיסה.
הערה: ניתן להשתמש בתמיסות דבק אחרות (פיברינוגן, קולגן, רכיבי מטריצה חוץ-תאיים אחרים וכו'). פיברונקטין משמש כאן, כפי שהוא נותן תוצאות טובות עם מגוון רחב של קווי התא. (U2OS, HeLa, Vero, Calu-3, Tzm-bl). פינצטה 5/15 שימושית מכיוון שהגיאומטריה שלה מאפשרת יכולת תמרון משופרת סביב לוחות 6 בארות, צלחות 35 מ"מ ומגלשות מיקרו. התוצאה היא פחות לחץ מכני על הרשתות וסרט פחמן שלם יותר. ודא שכל החומרים הדרושים ממוקמים בארון הבטיחות הביולוגית לפני תחילת העבודה, מכיוון שהדבר מפחית את האפשרות לזיהום רשת.
- העבירו את הרשתות, פיברונקטין (fibronectin), PBS, צלחות ופינצטה לארון בטיחות ביולוגית. טפל בשני צידי הרשתות עם פיברונקטין בקר 20 מיקרוגרם / מ"ל על ידי מיקרופיפטין שתי נקודות בגודל נדיב של תמיסה דבקה על משטח סטרילי, כגון מכסה של צלחת 6 בארות. ודא שהנקודות גדולות מספיק כדי לעטוף את הרשת כולה (מומלץ בסביבות 100 μL).
- חיבור רשתות
- לאחר הטיפול בפיברונקטין בקר, הרשת תהפוך לדביקה. בעזרת פינצטה 5/15, געו בעדינות במשטח נטול הפחמן של הרשת בתחתית צלחת/צלחת ריקה ופתחו את הפינצטה. הרשת אמורה להתחבר בקלות למשטח החדש (איור 1A2).
הערה: נסו להימנע ממיקום רשתות במרכז הישיר או בשולי המנה/צלחת. בעת הוספת תאים, קיימת נטייה להצטברות צפיפות תאים במרכז הצלחת. זה יכול לגרום לרשתות עם צפיפות תאים מוגזמת. לחלופין, ניתן להשתמש כאן במחזיקי רשת מודפסים בתלת-ממד במקום לחבר תאים ישירות לפני השטח של המנה/צלחת12.
- לאחר הטיפול בפיברונקטין בקר, הרשת תהפוך לדביקה. בעזרת פינצטה 5/15, געו בעדינות במשטח נטול הפחמן של הרשת בתחתית צלחת/צלחת ריקה ופתחו את הפינצטה. הרשת אמורה להתחבר בקלות למשטח החדש (איור 1A2).
- דגירה
- דוגרים על הרשתות למשך 30 דקות בתמיסה הדבקת פיברונקטין (20 מיקרוגרם/מ"ל). כדי להבטיח שהרשתות לא יתייבשו במהלך התהליך הזה, מיקרופיפטה 1-2 טיפות של תמיסה נצמדת יותר ישירות על גבי הרשתות כל 15 דקות (איור 1A3).
הערה: תקופת הדגירה תשתנה בהתאם לתמיסה הדבקה בה נעשה שימוש. עבור פיברונקטין בקר, הזמן המומלץ הוא 30 דקות.
- דוגרים על הרשתות למשך 30 דקות בתמיסה הדבקת פיברונקטין (20 מיקרוגרם/מ"ל). כדי להבטיח שהרשתות לא יתייבשו במהלך התהליך הזה, מיקרופיפטה 1-2 טיפות של תמיסה נצמדת יותר ישירות על גבי הרשתות כל 15 דקות (איור 1A3).
- כביסה
- לאחר תקופת הדגירה, יש לסלק את עודפי התמיסה הנצמדת באמצעות מיקרופיפטינג. שטפו את הרשתות על ידי טיפות מיקרופיפטינג של PBS ישירות על גבי הרשתות. חזור על פעולה זו 2-3 פעמים. (איור 1A4).
- עיקור
- השתמש באור UV כדי לעקר את הרשתות בארון הבטיחות הביולוגית למשך שעה אחת. מקמו את הרשתות קרוב ככל האפשר למקור העל-סגול כדי למקסם את העיקור (איור 1A5). כדי להבטיח שהרשתות לא יתייבשו במהלך תהליך זה, מיקרופיפטה 1-2 טיפות PBS ישירות על גבי הרשתות כל 10 דקות.
הערה: ניתן לבצע את שלבים 1.4-1.6 בו-זמנית.
- השתמש באור UV כדי לעקר את הרשתות בארון הבטיחות הביולוגית למשך שעה אחת. מקמו את הרשתות קרוב ככל האפשר למקור העל-סגול כדי למקסם את העיקור (איור 1A5). כדי להבטיח שהרשתות לא יתייבשו במהלך תהליך זה, מיקרופיפטה 1-2 טיפות PBS ישירות על גבי הרשתות כל 10 דקות.
2. רשתות זריעה
- ספירת תאים:
- נתק וספור את התאים בשיטות מכניות או אנזימטיות. קבע את מספר התאים המיטבי לשימוש לזריעה לפני הספירה. עבור U2OS שנזרע בצלחת של 6 בארות, השתמש בכל מקום בין 6 x 104 ל 1.6 x 105 תאים לכל באר (איור 1B1).
הערה: מספר התאים שנזרעו ישתנה בהתאם לסוג התא, שטח הפנים של הבאר, צלחת או מיקרו-מגלשה בשימוש, הזמן בין הזריעה להקפאה והקפאה, ותכנון הניסוי. בדוק טווח של מספרי תאים כדי לזהות תנאים שיובילו ל- 0.25-1 תאים לכל ריבוע רשת בזמן הקפאה. חשוב לציין כי צפיפות תאים גבוהה מפחיתה את מהירות העברת החום ועלולה להשפיע על תהליך הוויטריפיקציה. כדי להילחם בכך, כמה מעבדות מצאו הצלחה בשימוש במסננות תאים, הפועלות למניעת היווצרות גושי תאים13. לבסוף, פרוטוקול זה גורם לחיבור אקראי של תאים לשכבת הפחמן. אם יש צורך בקובץ מצורף ממוקד, ניתן להשתמש במיקרו-תבניות צילום (ראה שלב 1.3)14.
- נתק וספור את התאים בשיטות מכניות או אנזימטיות. קבע את מספר התאים המיטבי לשימוש לזריעה לפני הספירה. עבור U2OS שנזרע בצלחת של 6 בארות, השתמש בכל מקום בין 6 x 104 ל 1.6 x 105 תאים לכל באר (איור 1B1).
- הוספת תאים ומדיום גדילה: הוסיפו תאים באמצעות מיקרופיפטה לבארות, תוך הימנעות מבועות (איור 1B2). בצלחת 6 בארות, נפח באר כולל של 1.5-2.0 מ"ל מומלץ.
הערה: מומלץ להרטיב היטב סביב הרשתות לפני הוספת כל הנפח. פעולה זו תסייע למנוע התנתקות של רשתות וציפה בפתרון. הזיזו בעדינות את הצלחת מצד לצד כדי להקל על פיזור תאים הומוגני על הבאר. אין לסובב את הצלחת בתנועה סיבובית, מכיוון שהדבר יגרום להקצאת צפיפות תאים מוגזמת במרכז הבאר. - דגירה: לדגור על המגלשות ב 37 מעלות צלזיוס לזמן מתאים על פי התכנון הניסיוני, אשר יהיה תלוי ביישומים במורד הזרם. לדוגמה זו (טרנספקציה של שיבוטים מולקולריים של HIV), דגירה בין 16-24 שעות (איור 1B3).
הערה: זמני דגירה ארוכים יותר יגרמו למחזורי חלוקת תאים רבים יותר. לכן, התאם את מספר התאים ההתחלתי לזריעה בהתאם.
3. טרנספקציה
- הכנת תערובת טרנספקציה:
- הכן מגיב ליפוזום קטיוני מתאים עבור טרנספקציה פלסמיד לתוך קו התא שנבחר.
- בדוגמה זו של טרנספקציה, השתמש ב- 1 מיקרוגרם של DNA פלסמיד כולל לכל באר (בצלחת 6 בארות) כדי להיות נגוע ביחס של 1:3 בין פלסמיד HIViΔEnv לפלסמיד psPAX2. עבור כל באר, לדלל 1 מיקרוגרם של DNA לתוך 50 μL של DMEM ללא סרום. הומוגניזציה של התערובת באמצעות מיקרופיפטינג חוזר ונשנה או ערבול עדין של הצלחת.
- עבור כל באר, לדלל 3 μL של מגיב transfection ב DMEM ללא סרום, ולאחר מכן הומוגנית את התערובת שוב על ידי micropipetting או ערבול עדין. הוסיפו את כל תערובת מגיב הטרנספקציה המדולל לתערובת הדנ"א המדולל (שלב 3.1.2) ודגרו בטמפרטורת החדר (RT) במשך 15 דקות (איור 1C1).
הערה: בזמן שתערובת זו דוגרת, החלף את המדיה בבארות ב- 1.5 מ"ל DMEM טרי. היזהרו שלא לעקור את הרשתות מתחתית הבאר.
- כדי ליישם את תערובת הטרנספקציה, פיפטה 100 μL של התערובת משלב 3.1.3 טיפתית לכל באר, תוך ריכוז הטיפות מעל הרשתות כדי להבטיח מגע (איור 1C2). שנה את מדיום הגידול 16-24 שעות לאחר הטרנספקציה (איור 1C3).
4. לצלול הקפאה
הערה: שמור על התאים בטמפרטורה של 37°C עד שיידרש לצורך ניקוי. בנוסף, הקפידו לרשום את צד הפחמן של הרשתות לאורך כל התהליך.
- צפיפות תאים
- בדקו את הרשתות במיקרוסקופ אופטי הפוך ושימו לב לצפיפויות התאים בכל רשת.
הערה: רשתות עם פחות מ- 0.25 תאים לריבוע רשת (או תא אחד בכל 4 ריבועי רשת), נחשבות 'ריקות'. רשתות עם 0.25-1 תאים לכל ריבוע רשת נחשבות 'נורמליות'. רשתות עם יותר מתא אחד לכל ריבוע רשת נחשבות 'מלאות'. - שים לב לצפיפות התאים בכל רשת כדי לאפשר חיוג של זמני כתמים מאוחר יותר במהלך הקפאת הצניחה. מוסיפים 2-3 מ"ל PBS לצלחת/צלחת ריקה ומחממים ל-37°C.
- בדקו את הרשתות במיקרוסקופ אופטי הפוך ושימו לב לצפיפויות התאים בכל רשת.
- הכנת פידוקיאלים
- כדי להכין פידוקיאלים של זהב ליישומי קריוטומוגרפיה במורד הזרם, פיפטה 50 μL של תמיסת חרוזי זהב קולואידית 10 ננומטר לתוך צינור נקי של 1.5 מ"ל. הוסף 2 μL של 1 מ"ג / מ"ל BSA לצינור הומוגניזציה על ידי micropipetting שוב ושוב.
- צנטריפוגה את הצינור ב 15,000-20,000 x גרם במשך 15 דקות. מיקרופיפטה כדי להסיר כמה שיותר מהסופרנאטנט מבלי להפריע לכדורית.
הערה: הגלולה תהיה רופפת מאוד. - הוסף 50 μL של PBS לגלולה והשהה מחדש. צנטריפוגה את הצינור שוב ב 15,000-20,000 x גרם במשך 15 דקות.
- בעזרת קצה של 10 μL, שאפו ישירות 4 μL של הכדורית, והעבירו אותה לצינור נקי של 1.5 מ"ל (איור 1D1). יש להשתמש ב-1 מיקרוליטר של הזהב השטוף והמרוכז בכל רשת.
הערה: סוג הפידוקיאלים שבהם נעשה שימוש תלוי ביישומים במורד הזרם. עבור טומוגרפיה TEM, השתמש חרוזי זהב 10 ננומטר. עבור טומוגרפיה רנטגן רכה, להשתמש חרוזי זהב 200 ננומטר. למיקרוסקופ מתאם, השתמשו בחרוזי לטקס פלואורסצנטיים. Fiducials בדרך כלל אינם נחוצים לניסויים הכוללים כרסום cryoFIB, מכיוון שתהליך הכרסום יהרוס אותם.
- כתם
- הגדר את התא הסביבתי ללחות של 95% ול-30°C (איור 1D1). בחר רשת באמצעות פינצטה 5/15.
- שטפו את הרשתות עם PBS והעבירו אותן לפינצטה צוללת (איור 1D2). לאחר האבטחה, הסר את הפינצטה 5/15 והחלק את המהדק על הפינצטה הצוללת.
- הכניסו את הרשת למקפיא הצלילה, תוך שמירה על מהדק מאובטח (איור 1D3). הוסיפו 1 מיקרוליטר של זהב לצד האחורי של הרשת (איור 1D4). הוסף 2-3 μL של PBS לצד הפחמן של הרשת. השתמשו בכתמים אוטומטיים כדי לכתם את הצד האחורי של הרשת ולקפוא לתוך אתאן נוזלי (איור 1D5).
הערה: מומלץ שיהיה בין 3-4 מיקרוליטר נפח לרשת לניקוי אופטימלי. רשתות עשויות לשמור על כמות משתנה של PBS לאחר הכביסה. התאם את הנפח הנוסף של PBS כדי לקחת בחשבון שימור נוזלים קיים מראש ברשת. מומלץ להוסיף את פידוקיות הזהב לחלק האחורי של הרשת. חיבור מלפנים יכול לגרום לבריכות של זהב סמוך לנקודת ההחדרה, בעוד שחיבור מאחור מביא לתמיסה הומוגנית יותר. משך ההדבקה תלוי ברפואת השיניים התאית של הרשת. 2 שניות עבור רשתות ריקות, 3 שניות עבור רגיל ו- 4 שניות עבור רשתות מלאות, בהתאמה. סוג מקפיא הצלילה הזמין עשוי לקבוע כיצד ניגשים לניקוי: מקפיא הצלילה Leica GP2 הוא זה המשמש בפרוטוקול זה והוא מסוגל לבצע הכתמה חד צדדית אוטומטית כברירת מחדל. Thermo Fisher Vitrobot מבצע ניקוי דו-צדדי אוטומטי, אם כי לעתים קרובות זה פוגע בתאים המחוברים לצד הפחמן. כתם ידני בויטרובוט אפשרי גם, כמו גם בוכנות כבידה ידניות.
תוצאות
בעקבות ההעברה המשותפת של HIViGFPΔEnv ו- psPAX2, בכל הרשתות הייתה קריעה מינימלית בשכבת הפחמן. רשתות צולמו באמצעות מיקרוסקופ אור פאזה ומיקרוסקופ אור פלואורסצנטי 24 שעות לאחר הדגירה עם מגיב הטרנספקציה (איור 2). תאים הן ברשתות הדמה והן ברשתות המשולבות הכילו תאים בני קיימא בריבועי רשת מרובים.
קודי psPAX2 עבור כל החלבונים המבניים והאנזימטיים של HIV-1 ללא כל תיוג פלואורסצנטי. HIViGFPΔEnv דומה ל- psPAX2 אך עם קודים לחלבון HIV Gag המתויג GFP. שני הפלסמידים הם ΔEnvelope. הקוטרנספקציה גורמת להרכבה וניצנים דמויי ילידים של חלקיקי HIV-1 פלואורסצנטיים, מה שהופך אותה למערכת נהדרת למחקרי CLEM של HIV במצב בטיחות ביולוגית 1. הרשתות המזוהמות הראו תת-קבוצה של תאים המציגים פלואורסצנטיות ירוקה, מה שמצביע על קוטרנספקציה מוצלחת. אף תא ברשת המדומה לא הציג פלואורסצנטיות, מה שמאמת עוד יותר את הקוטרנספקציה באמצעות HIViGFPΔEnv ו-psPAX2. לאחר צפייה ברשתות באמצעות מיקרוסקופ מבוסס אור, הרשתות צללו קפואות והועברו לאחסון לטווח ארוך בחנקן נוזלי.
איור 3 מתאר תוצאות מרשתות שיוצרו באותה שיטת ניסוי אך משתמשות במבני פלסמיד שונים במקצת. רשתות המכילות U2OS הועברו במשותף באמצעות שיבוטים שונים של HIV (HIVmCherryΔEnv, ו- NL4-3ΔEnvGFP ביחס של 1:6). מכיוון שנעשה שימוש במסה גבוהה יותר של פלסמידים מתויגים פלואורסצנטית, רשתות אלה אפשרו תצפית על מספר גדול יותר של תאים נגועים, וסיפקו יתרון תוך לכידת תמונות באמצעות cryoCLEM ו- cryoET. באמצעות cryoCLEM, אטלסים של רשת מלאה נוצרו עבור כל רשת באמצעות מיקרוסקופ cryofluorescence כדי להקליט את המיקומים של כל התאים הנגועים במשותף. עם מיקומי התאים הידועים, בוצע cryoET. אטלס רשת מלא בהגדלה נמוכה נאסף ומכוסה באטלס הפלואורסצנטי שנאסף בהקפאה (איור 3A). קריוטומוגרפיות נאספו באתרים תאיים ולוכדות פרטים מורכבים של מחזור החיים הנגיפי, כולל הרכבה וניצנים של HIV מתאים (איור 3B).
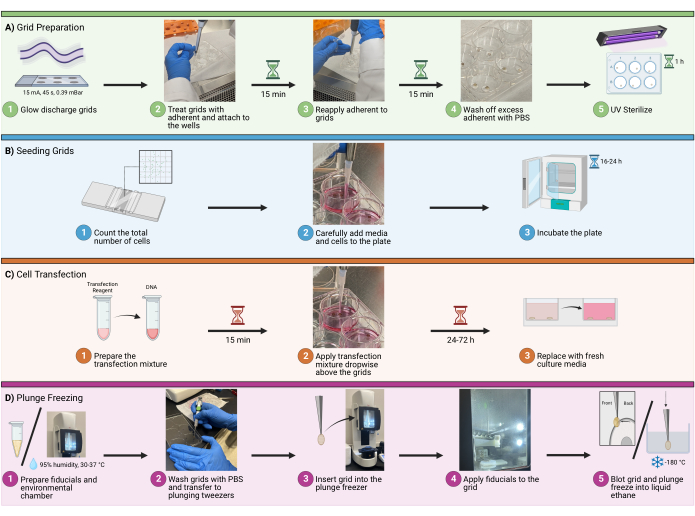
איור 1: זרימת עבודה של זריעת תאים ברשתות. סכמטי המתאר את ההליך הכולל לזרע תאים על רשתות cryoEM. התהליך מחולק לארבעה שלבים עיקריים, כולל (A) הכנת רשתות בבארות לזריעה, (B) הוספת כמות התאים המתאימה לכל באר, (C) העברה אופציונלית של תאים לדימות פלואורסצנטי, ו-(D) הקפאת רשתות כדי לאפשר ויטריפיקציה של הדגימה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: העברה משותפת של U2OS באמצעות HIViGFPΔEnv ו-psPAX2. תאי U2OS הודבקו יחד עם HIViGFPΔEnv ו-psPAX2 המכילים GFP ביחס של 1:3. הרשתות צולמו באמצעות ניגודיות פאזה ומיקרוסקופ פלואורסצנטי. תאים שהוכח שיש להם ביטוי GFP מצביעים על קוטרנספקציה מוצלחת. סרגל קנה מידה: 500 מיקרומטר. סרגל קנה מידה (קביעות): 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
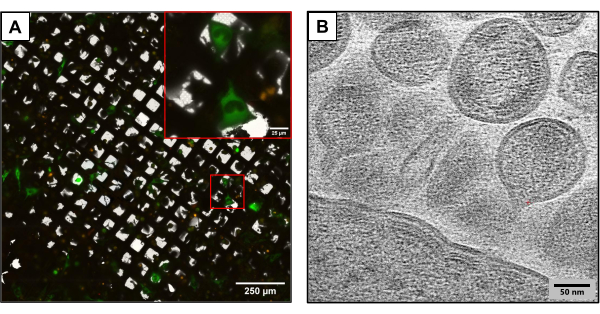
איור 3: שיטות פוטנציאליות מבוססות הקפאה במורד הזרם . (A) תמונת cryoCLEM עם תאי U2OS שעברו טרנסדבקציה משותפת. תאים בירוק מייצגים תאים מייצרי HIV ומשמשים למדידת הצלחת קוטרנספקציה. פונקטה אדומה מייצגת mCherry מתויג HIV-1 Gag. סרגל קנה מידה: 250 מיקרומטר. סרגל קנה מידה (כניסה): 25 מיקרומטר (B) תמונת cryoET של חלקיקי HIV מרובים הניצנים מקרום הפלזמה של תאי U2OS. סרגל קנה מידה: 50 ננומטר לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
כאן, סיפקנו פרוטוקול נגיש, גמיש וניתן לשחזור לתאי זרע ברשתות מיקרוסקופ אלקטרונים עבור יישומי טומוגרפיה קריואלקטרונים באתרם . ניתן להתאים שיטה זו בקלות לצרכים של יישומים במורד הזרם ו / או דרישות ניסיוניות. בנוסף לגמישות רבה, תיארנו זרימת עבודה שממטבת ומפחיתה מלכודות נפוצות בזריעת רשת, בעיקר נזק נרחב לשכבת הפחמן, צפיפות תאים נמוכה ושלמות מבנית ירודה של הקרנות תאים דקים.
למרות שהפרוטוקול המתואר כאן מספק מספר חלופות, ישנם כמה צעדים קריטיים שיש לבצע כדי לייעל את התוצאות הכלליות. אחת הבעיות הגדולות ביותר עם זריעה של תאי רשת היא ניתוק וציפה של רשתות מהבאר או מהמיקרו-מגלשה. לכן, חשוב להרטיב את הרשת במלואה בתמיסה דבקה משני הצדדים ולמנוע ממנה להתייבש במהלך תקופת הדגירה. אם אתה משתמש במחזיקי רשת המודפסים בתלת-ממד, שים לב שלשינויים מרובים של מדיה במחזיקים אלה יש פוטנציאל ליצור רשתות צפות מכיוון שהאוויר הכלוא מתחת לרשת יכול לדחוק אותו החוצה מהמחזיק.
הבחירה שלנו בפינצטה גם משפרת את איכות הרשת בדרך של מתן דרך טובה מבחינה גיאומטרית לתפעל את הרשתות ללא כיפוף רשת נרחב שיפגע בשכבת הפחמן. שמירה על טמפרטורה של 37°C למשך זמן רב ככל האפשר לפני הצלילה מפחיתה את סבל התאים ומשפרת את מספר התאים הדקים הניתנים לצילום ברשת. לבסוף, כתם מצד הזהב יגן על התאים מפני כוחות מכניים קשים שעלולים להוביל לנזק למבנים תאיים שבירים.
למרות שלא נכלל בפרוטוקול זה, הוכח כי מיקרו-תבניות של צילומי רשת מגדילות את מספר התאים הניתנים לתמונה על-ידי מיטוב החיבור שלהם למרכז ריבועי הרשת14. לבסוף, לאחרונה נעשה שימוש במחזיקי רשת מודפסים בתלת-ממד כדי להפחית את הנזק לרשת על ידי הגבלת מניפולציה ישירה ברשת12.
חשוב לציין כי פרוטוקול זה מותאם להדמיית קצוות דקים ובלטות מתאים ליישום קריוטומוגרפיה. אנו מציעים פתרון בעיות במגוון מצבים מההמלצות שלנו בפרוטוקול כדי למצוא את התוצאה הטובה ביותר עבור היישומים במורד הזרם הנבחרים. בסך הכל, פרוטוקול זה מספק שיטה אמינה אך רב-תכליתית של זריעת תאים על גבי רשתות שניתן לכוונן לצרכים ספציפיים.
Disclosures
המחברים מצהירים כי אין אינטרסים מתחרים.
Acknowledgements
ברצוננו להודות למעבדת מנסקי על הגישה לציוד להקפאת צוללות. חלקים מעבודה זו בוצעו במתקן האפיון של אוניברסיטת מינסוטה, המקבל תמיכה חלקית מהקרן הלאומית למדע (NSF) באמצעות המרכז למדע והנדסה של מחקר חומרים (MRSEC; מספר הפרס DMR-2011401) והיוזמה הלאומית לתוכניות לימודים במדעי המוח (NNCI; מספר פרס ECCS-2025124) תוכניות. ברצוננו להודות למימון מהמרכז להתנהגות HIV בסביבות נגיפיות (B-HIVE; 1U54AI170855-01) וממרכז דיוק לביולוגיה מבנית של HIV (DCHSB; U54AI170752) מרכז.
Materials
| Name | Company | Catalog Number | Comments |
| 10 nm colloidal gold bead solution | Sigma-Aldrich | 741957 | |
| 6 well multidish, 100/CS | Fisher Scientific | FB012927 | |
| Allegra V-15R Benchtop Centrifuge, IVD 120 V 60 Hz | Beckman-Coulter | C63125 | |
| Au G300F1 with R2/2 Quantifoil carbon | Quantifoil | TEM-G300F1-AU | |
| Bovine serum albumin | MilliporeSigma | A9647 | |
| BRAND counting chamber BLAUBRAND Neubauer improved | Sigma-Aldrich | BR717805-1EA | |
| DMi1 Inverted Microscope | Leica | 22A00G119 | |
| Dulbecco's modified eagle's medium - high glucose, no glutamine | Gibco | 11-960-044 | |
| Dumont 5/15 tweezer | Electron Microscopy Sciences | 0103-5/15-PO | |
| EM GP2 | Leica | 587085 | Automated plunge freezer |
| Fetal Bovine Serum | Gibco | A5209 | |
| Fibronectin from bovine plasma, cell culture grade | MilliporeSigma | F1141 | |
| GenJet version II in vitro DNA transfection reagent | SignaGen Laboratories | SL100489 | |
| GlutaMAX I 100x | Fisher Scientific | 35050061 | Media supplement |
| Neslab EX-211 Heating Circulator | Neslab | Out of production | Water bath for media warming |
| Original Portable Pipet-Aid Pipette Controller | Drummond Scientific | 4-000-100 | |
| PBS, pH 7.4 | Gibco | 10010023 | |
| Pelco easyGlow device | Pelco | 91000S | Glow discharge device |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | Media supplement |
| Pipetman P1000, 100–1000 µL, Metal Ejector | Gilson | F144059M | |
| Pipetman P2, 0.2–2 µL, Metal Ejector | Gilson | F144054M | |
| Pipetman P20, 2–20 µL, Metal Ejector | Gilson | F144056M | |
| Whatman number 2 filter paper, 55 mm | Whatman | 28455-041 | Blotting paper |
References
- Zhang, P., Mendonça, L. Analysis of Viruses in the Cellular Context by Electron Tomography. Encyclopedia of Virology. 1, Elsevier, Academic Press. 242-247 (2021).
- Fäßler, F., Dimchev, G., Hodirnau, V. -V., Wan, W., Schur, F. K. M. Cryo-electron tomography structure of Arp2/3 complex in cells reveals new insights into the branch junction. Nature Communications. 11, 6437(2020).
- McDowall, A. W., et al. Electron microscopy of frozen hydrated sections of vitreous ice and vitrified biological samples. Journal of Microscopy. 131 (Pt 1), 1-9 (1983).
- Stewart, M., Vigers, G. Electron microscopy of frozen-hydrated biological material. Nature. 319 (6055), 631-636 (1986).
- Gan, L., Jensen, G. J. Electron tomography of cells. Quarterly Reviews of Biophysics. 45 (1), 27-56 (2012).
- Yang, J. E., Larson, M. R., Sibert, B. S., Shrum, S., Wright, E. R. CorRelator: Interactive software for real-time high precision cryo-correlative light and electron microscopy. Journal of Structural Biology. 213 (2), 107709(2021).
- Mendonça, L., et al. Correlative multi-scale cryo-imaging unveils SARS-CoV-2 assembly and egress. Nature Communications. 12 (1), 4629(2021).
- Klumpe, S., et al. A modular platform for automated cryo-FIB workflows. eLife. 10, e70506(2021).
- Wagner, F. R., et al. Preparing samples from whole cells using focused-ion-beam milling for cryo-electron tomography. Nature Protocols. 15 (6), 2041-2070 (2020).
- Klein, S., et al. IFITM3 blocks influenza virus entry by sorting lipids and stabilizing hemifusion. Cell Host & Microbe. 31 (4), 616.e20-633.e20 (2023).
- Shah, P. N. M., et al. Characterization of the rotavirus assembly pathway in situ using cryoelectron tomography. Cell Host & Microbe. 31 (4), 604.e4-615.e4 (2023).
- Fäßler, F., Zens, B., Hauschild, R., Schur, F. K. M. 3D printed cell culture grid holders for improved cellular specimen preparation in cryo-electron microscopy. Journal of Structural Biology. 212 (3), 107633(2020).
- Hoffmann, P. C., et al. Electron cryo-tomography reveals the subcellular architecture of growing axons in human brain organoids. eLife. 10, e70269(2021).
- Toro-Nahuelpan, M., et al. Tailoring cryo-electron microscopy grids by photo-micropatterning for in-cell structural studies. Nature Methods. 17 (1), 50-54 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved