Method Article
Memeli Hücrelerinin İn Situ Kriyotomografisi için Numune Hazırlama
Bu Makalede
Özet
Bu yöntem, in situ hücresel kriyotomografi ve korelasyon ışık ve elektron mikroskobu (CLEM) için elektron mikroskobu (EM) ızgaralarının hazırlanması için erişilebilir ve esnek bir protokol sağlar.
Özet
Yerinde hücresel kriyotomografi, karmaşık nesneleri doğal dondurulmuş-hidratlı hücresel bağlamlarında incelemek için güçlü bir tekniktir ve bu da onu hücresel biyoloji ve viroloji ile oldukça alakalı hale getirir. Kriyotomografiyi diğer mikroskopi modaliteleri ile birleştirme potansiyeli, onu bütünleştirici ve korelasyonlu görüntüleme için mükemmel bir teknik haline getirir. Bununla birlikte, in situ hücresel tomografi için numune hazırlama kolay değildir, çünkü hücreler elektron mikroskobu ızgarasına kolayca bağlanmaz ve gerilmez. Ek olarak, ızgaraların kendileri kırılgandır ve çok güçlü bir şekilde kullanılırsa kırılabilir, bu da görüntülenebilir alanların kaybolmasına neden olur. Doku kültürü kaplarının geometrisi, ızgaraları cımbızla manipüle ederken de zorluk teşkil edebilir. Burada, bu (ve diğer) zorlukların üstesinden gelmek ve yerinde hücresel kriyotomografi ve yapışık memeli hücrelerinin korelasyon görüntülemesi için kaliteli numuneler hazırlamak için ipuçlarını ve püf noktalarını açıklıyoruz. Kriyomikroskopi teknolojisindeki sürekli ilerlemelerle, bu teknik, karmaşık biyolojik sistemler hakkındaki anlayışımızı ilerletmek için muazzam bir umut vaat ediyor.
Giriş
İn situ hücresel kriyotomografi, kimyasal fiksasyon olmadan hücrelerde biyolojik olarak ilgili yapıların incelenmesine izin veren güçlü bir tekniktir. Hücreleri EM ızgaralarına bağlayarak ve ızgaraları bir kriyojende daldırarak dondurarak, ilgilenilen nesneler, hücre içi sudan kristal buz oluşmadandoğal hücresel bağlamlarında dondurulur 1,2. Hem kimyasal fiksasyon hem de kristal buz oluşumu, proteinler ve lipitler gibi ilgili moleküllerin yapılarını bozabilir ve bu teknikler kullanılarak elde edilen görüntülerin biyolojik doğruluğunu azaltabilir 3,4. Tomografide, ızgaralar elektron mikroskobu kullanılarak artımlı açılarda görüntülenir ve bu görüntüler daha sonra görüntülenen hedef bölgenin üç boyutlu temsillerini oluşturmak için kullanılır5. İn situ kriyotomografi, kriyofloresan görüntüleme, yumuşak x-ışını tomografisi ve kriyoFIB/SEM (kriyojenik Odaklanmış İyon Işını/Taramalı Elektron Mikroskobu) gibi bütünleştirici ve bağıntılı görüntüleme için diğer mikroskopi teknikleriyle birlikte kullanılabilir6,7,8,9,10,11. Birden fazla tekniğin entegrasyonu, bir yapı veya süreç hakkında herhangi bir mikroskopi tekniğinin elde edebileceğinden daha fazla bilgi elde edilmesini sağlar.
İn situ hücresel kriyotomografinin tüm faydalarına rağmen, numune hazırlama çeşitli nedenlerle zor olabilir. Kırılganlıkları nedeniyle, elektron mikroskobu ızgaralarının kuvvetli bir şekilde manipüle edilmesi, özellikle ince karbon tabakasının hassas ve yırtılmaya eğilimli olması, ızgaraların görüntülenebilir alanını azaltması nedeniyle hasara yol açabilir. Elektron mikroskobu ızgaralarının küçük boyutlarından dolayı manipüle edilmesi de zordur ve hücreleri büyütmek için kullanılan kuyuların veya mikro slaytların yüzeyinden ayrılmaya eğilimlidir. Kuyucuklar veya mikro slaytlar içindeki ızgaraların manipülasyonu, bunların geometrisi nedeniyle zor olabilir. Izgaraların yanlış hazırlanması (örneğin, yüzmelerine izin verilmesi), düşük hücre yoğunluğuna ve potansiyel görüntüleme alanlarının sayısının, özellikle hücrelerin ızgaralara bağlanmaya eğilimli olmadığı durumlarda, azalmasına neden olabilir. Doğrudan hücresel kriyotomografi için, hücrelerin çok ince yayılması gerekir, bu da uygun olmayan sıcaklıklar veya ızgaraların kaba kullanımı dahil olmak üzere birçok nedenden dolayı bozulabilir.
Çeşitli optimizasyonlar yoluyla, bu makalede sunulan teknikler, kriyotomografi için elektron mikroskobu ızgaralarının hazırlanması sırasında ortaya çıkan bu en yaygın tuzakları ele almayı amaçlamaktadır. 5/15 açılı cımbız kullanımı, kuyu plakaları veya mikro slaytlar içindeki ızgaraların manipüle edilmesine izin verir. Kaplamadan önce ızgaraların her iki tarafına uygulanan bir fibronektin çözeltisi, yüzen ızgaraları daha az olası hale getirir, bu da ızgaraların yeterli hücre yoğunluğuna sahip olmasını ve ızgaraların manipülasyon nedeniyle zarar görme olasılığının daha düşük olmasını sağlamada faydalıdır. Izgaraları 37°C'de dalma dondurmadan hemen öncesine kadar inkübe ederek, hücrelerin ince kenarlarını geri çekmesini önlemek için hücrelerin rahat bir ortamda tutulmasını da sağlıyoruz. Izgaraların arka taraftan karartılması, hücrelerin mekanik kuvvetten zarar görmesini de önler. Toplamda, bu önlemler, in situ hücresel kriyotomografi çalışmaları için numune hazırlamanın başarı oranını artırarak bu görüntüleme yaklaşımının erişilebilirliğini artırır.
Protokol
1. Izgara hazırlığı
NOT: Deneysel tasarımda, daldırma-dondurma seansı başına toplam maksimum 8-12 ızgara ve kuyu başına 4-5 ızgara planlayın. Bundan daha fazlası, hücre stresinin artmasına, buz kontaminasyonuna ve kullanıcı hatalarına neden olabilecek çok uzun bir dalma-dondurma seansına yol açacaktır.
- Kızdırma deşarjı
- Bir kızdırma deşarj cihazında 0,39 mBar atmosferde 45 saniye boyunca 15 mA'da kızdırma deşarjı yapılacak delikli bir karbon destek filmi ile uygun sayıda ızgara yükleyin.
- Izgaranın karbon tarafının yukarı baktığından emin olun. Bitirdiğinizde, ızgaraları filtre kağıdıyla kaplı temiz bir kaba aktarın (Şekil 1A 1).
NOT: Malzeme hücreler için toksik olmadığı sürece (herhangi bir bakır ızgara hariç) diğer ızgaralar kullanılabilir. Bulucu ızgaraları, bağıntılı etütler için kullanışlıdır. Diğer malzemelerden yapılmış ızgaralar da mümkündür. Birçok laboratuvar, SiO2 destek ızgaraları 8,9'un üzerinde hücre yetiştirme konusunda iyi sonuçlar elde etti.
- Yapışkan tedavi
- Izgaraları, fibronektini, PBS'yi, plakaları ve cımbızı bir biyogüvenlik kabinine aktarın. Izgaraların her iki tarafını 20 μg / mL sığır fibronektini ile 6 oyuklu bir plakanın kapağı gibi steril bir yüzeye iki cömertçe boyutlandırılmış yapışkan çözelti noktasını mikropipetleyerek tedavi edin. Noktaların tüm ızgarayı saracak kadar büyük olduğundan emin olun (yaklaşık 100 μL önerilir).
NOT: Seçilen yapışkan çözelti ile işlemden önce, ızgara karelerinin ortasındaki hücrelerin bağlanmasını optimize etmek için burada ızgarayı foto-mikro modelleme seçeneği vardır. Hücrelerin çubuklara bağlanma yeteneğinin azaltılması, görüntülenebilir hücrelerin sayısını artıracaktır. Bu, kriyoFIB öğütmeyi içeren deneyler için idealdir. - Izgaraları değiştirmek için 5/15 cımbız kullanın. Izgaranın her iki tarafını da çözelti içinde tedavi ettiğinizden emin olun.
NOT: Diğer yapışkan solüsyonlar kullanılabilir (fibrinojen, kollajen, diğer hücre dışı matris bileşenleri, vb.). Fibronektin, çok çeşitli hücre dizileri ile iyi sonuçlar verdiği için burada kullanılır. (U2OS, HeLa, Vero, Calu-3, Tzm-bl). 5/15 cımbız, geometrisi 6 oyuklu plakalar, 35 mm'lik tabaklar ve mikro kızaklar etrafında gelişmiş manevra kabiliyeti sağladığı için kullanışlıdır. Bu, ızgaralar üzerinde daha az mekanik stres ve daha sağlam bir karbon filmi ile sonuçlanır. Başlamadan önce gerekli tüm malzemelerin biyogüvenlik kabinine yerleştirildiğinden emin olun, çünkü bu, şebeke kontaminasyonu olasılığını azaltır.
- Izgaraları, fibronektini, PBS'yi, plakaları ve cımbızı bir biyogüvenlik kabinine aktarın. Izgaraların her iki tarafını 20 μg / mL sığır fibronektini ile 6 oyuklu bir plakanın kapağı gibi steril bir yüzeye iki cömertçe boyutlandırılmış yapışkan çözelti noktasını mikropipetleyerek tedavi edin. Noktaların tüm ızgarayı saracak kadar büyük olduğundan emin olun (yaklaşık 100 μL önerilir).
- Izgaraların takılması
- Sığır fibronektini ile tedavi edildikten sonra, ızgara yapışkan hale gelecektir. 5/15 cımbız kullanarak, ızgaranın karbon olmayan yüzeyine boş bir tabağın/tabağın dibine hafifçe dokunun ve cımbızı açın. Izgara yeni yüzeye kolayca yapışmalıdır (Şekil 1A2).
NOT: Izgaraları tabağın/tabağın doğrudan ortasına veya kenarlarına yerleştirmekten kaçının. Hücre eklerken, hücre yoğunluğunun plakanın merkezinde birikme eğilimi vardır. Bu, aşırı hücresel yoğunluğa sahip ızgaralara neden olabilir. Alternatif olarak, hücreleri doğrudan tabağın/tabağın12 yüzeyine tutturmak yerine burada 3D baskılı ızgara tutucular kullanılabilir.
- Sığır fibronektini ile tedavi edildikten sonra, ızgara yapışkan hale gelecektir. 5/15 cımbız kullanarak, ızgaranın karbon olmayan yüzeyine boş bir tabağın/tabağın dibine hafifçe dokunun ve cımbızı açın. Izgara yeni yüzeye kolayca yapışmalıdır (Şekil 1A2).
- Kuluçka
- Izgaraları fibronektin yapışkan çözeltisinde (20 μg / mL) 30 dakika inkübe edin. Bu işlem sırasında ızgaraların kurumamasını sağlamak için, her 15 dakikada bir doğrudan ızgaraların üzerine 1-2 damla daha yapışkan çözelti damlatın (Şekil 1A3).
NOT: Kuluçka süresi, kullanılan yapışkan çözeltiye bağlı olarak değişecektir. Sığır fibronektini için önerilen süre 30 dakikadır.
- Izgaraları fibronektin yapışkan çözeltisinde (20 μg / mL) 30 dakika inkübe edin. Bu işlem sırasında ızgaraların kurumamasını sağlamak için, her 15 dakikada bir doğrudan ızgaraların üzerine 1-2 damla daha yapışkan çözelti damlatın (Şekil 1A3).
- Yıkama
- İnkübasyon süresinin ardından, fazla yapışan çözeltiyi mikropipetleme yoluyla çıkarın. Izgaraları, PBS damlalarını doğrudan ızgaraların üzerine mikropipetleyerek yıkayın. Bunu 2-3 kez tekrarlayın. (Şekil 1A4).
- Sterilizasyon
- Biyogüvenlik kabinindeki ızgaraları 1 saat sterilize etmek için UV ışığı kullanın. Sterilizasyonu en üst düzeye çıkarmak için ızgaraları UV kaynağına mümkün olduğunca yakın yerleştirin (Şekil 1A5). Bu işlem sırasında ızgaraların kurumamasını sağlamak için, her 10 dakikada bir doğrudan ızgaraların üzerine 1-2 damla PBS mikropipetleyin.
NOT : 1.4-1.6 adımları aynı anda gerçekleştirilebilir.
- Biyogüvenlik kabinindeki ızgaraları 1 saat sterilize etmek için UV ışığı kullanın. Sterilizasyonu en üst düzeye çıkarmak için ızgaraları UV kaynağına mümkün olduğunca yakın yerleştirin (Şekil 1A5). Bu işlem sırasında ızgaraların kurumamasını sağlamak için, her 10 dakikada bir doğrudan ızgaraların üzerine 1-2 damla PBS mikropipetleyin.
2. Tohumlama ızgaraları
- Hücre sayısı:
- Mekanik veya enzimatik yöntemler kullanarak hücreleri ayırın ve sayın. Saymadan önce tohumlama için kullanılacak optimum hücre sayısını belirleyin. 6 oyuklu bir plakaya ekilen U2OS için, oyuk başına 6 x 104 ila 1,6 x 105 hücre arasında herhangi bir yerde kullanın (Şekil 1B1).
NOT: Ekilen hücre sayısı, hücre tipine, kuyunun yüzey alanına, kullanılan çanak veya mikro slayta, tohumlama ve daldırma dondurma arasındaki süreye ve deney tasarımına göre değişecektir. Daldırma donması sırasında ızgara karesi başına 0,25-1 hücre ile sonuçlanacak koşulları belirlemek için bir dizi hücre sayısını test edin. Yüksek hücre yoğunluğunun ısı transfer hızını azalttığını ve vitrifikasyon sürecini etkileyebileceğini unutmamak önemlidir. Bununla mücadele etmek için, bazı laboratuvarlar, hücre kümelerinin oluşmasını önlemek için hareket eden hücre süzgeçlerini kullanarak başarı elde ettiler13. Son olarak, bu protokol, hücrelerin karbon tabakasına rastgele bağlanmasıyla sonuçlanır. Hedefli bir bağlantı gerekliyse, foto-mikro modelleme kullanılabilir (bkz. adım 1.3)14.
- Mekanik veya enzimatik yöntemler kullanarak hücreleri ayırın ve sayın. Saymadan önce tohumlama için kullanılacak optimum hücre sayısını belirleyin. 6 oyuklu bir plakaya ekilen U2OS için, oyuk başına 6 x 104 ila 1,6 x 105 hücre arasında herhangi bir yerde kullanın (Şekil 1B1).
- Hücrelerin ve büyüme ortamının eklenmesi : Kabarcıklardan kaçınarak hücreleri mikropipet aracılığıyla kuyucuklara ekleyin (Şekil 1B2). 6 oyuklu bir plakada, toplam 1.5-2.0 mL'lik bir kuyu hacmi önerilir.
NOT: Tüm hacmi eklemeden önce ızgaraların etrafını dikkatlice ıslatmanız önerilir. Bu, ızgaraların çözümde ayrılmasını ve yüzmesini önlemeye yardımcı olur. Kuyucuk üzerinde homojen hücre dağılımını kolaylaştırmak için plakayı yavaşça yan yana hareket ettirin. Plakayı dairesel hareketlerle döndürmeyin, çünkü bu, kuyu merkezinde aşırı hücre yoğunluğunun tahsis edilmesine neden olur. - İnkübasyon: Slaytları, sonraki uygulamalara bağlı olacak deney tasarımına göre uygun bir süre için 37 °C'de inkübe edin. Bu örnek için (HIV moleküler klonlarının transfeksiyonu), 16-24 saat arasında inkübe edin (Şekil 1B3).
NOT: Daha uzun inkübasyon süreleri, daha fazla hücre bölünmesi döngüsüne neden olacaktır. Bu nedenle, tohumlama için başlangıç hücre sayısını buna göre ayarlayın.
3. Transfeksiyon
- Transfeksiyon karışımının hazırlanması:
- Seçilen hücre hattına plazmit transfeksiyonu için uygun bir katyonik lipozom reaktifi hazırlayın.
- Bu transfeksiyon örneğinde, HIViΔEnv plazmidinin psPAX2 plazmidine 1:3 oranında transfekte edilecek oyuk başına (6 oyuklu bir plakada) 1 μg toplam plazmit DNA kullanın. Her kuyucuk için 1 μg DNA'yı 50 μL serumsuz DMEM'e seyreltin. Karışımı tekrar tekrar mikropipetleyerek veya plakayı hafifçe döndürerek homojenize edin.
- Her kuyucuk için, 3 μL transfeksiyon reaktifini serumsuz DMEM'de seyreltin, ardından karışımı mikropipetleme veya hafifçe döndürme ile tekrar homojenize edin. Seyreltilmiş transfeksiyon reaktif karışımının tamamını seyreltilmiş DNA karışımına ekleyin (adım 3.1.2) ve oda sıcaklığında (RT) 15 dakika inkübe edin (Şekil 1C1).
NOT: Bu karışım inkübe edilirken, kuyucuklardaki ortamı 1.5 mL taze DMEM ile değiştirin. Izgaraları kuyu dibinden çıkarmamaya dikkat edin.
- Transfeksiyon karışımını uygulamak için, her bir oyuğa adım 3.1.3'ten itibaren karışımın 100 μL'sini damla damla pipetleyin ve teması sağlamak için damlaları ızgaralar üzerinde yoğunlaştırın (Şekil 1C2). Transfeksiyondan 16-24 saat sonra büyüme ortamını değiştirin (Şekil 1C3).
4. Daldırmalı dondurma
NOT: Lekeleme için gerekli olana kadar hücreleri 37 °C'de tutun. Ek olarak, işlem boyunca ızgaraların karbon tarafını not ettiğinizden emin olun.
- Hücre yoğunluğu
- Izgaraları ters çevrilmiş bir optik mikroskopta kontrol edin ve her ızgaradaki hücre yoğunluklarını not edin.
NOT: Izgara karesi başına 0,25'ten az hücre (veya her 4 ızgara karesinde bir hücre) bulunan ızgaralar 'boş' olarak kabul edilir. Izgara karesi başına 0,25-1 hücreli ızgaralar 'normal' olarak kabul edilir. Izgara karesi başına 1'den fazla hücre içeren ızgaralar 'dolu' olarak kabul edilir. - Daldırma-dondurma sırasında daha sonra lekeleme sürelerinin çevrilmesine izin vermek için her ızgaradaki hücre yoğunluğunu not edin. Boş bir tabağa/tabağa 2-3 mL PBS ekleyin ve 37 °C'ye ısıtın.
- Izgaraları ters çevrilmiş bir optik mikroskopta kontrol edin ve her ızgaradaki hücre yoğunluklarını not edin.
- Mütevelli heyetlerinin hazırlanması
- Aşağı akış kriyotomografi uygulamaları için altın referans hazırlamak için, 50 μL 10 nm kolloidal altın boncuk çözeltisini temiz bir 1,5 mL'lik tüpe pipetleyin. Tüpe 2 μL 1 mg/mL BSA ekleyin ve tekrar tekrar mikropipetleme yaparak homojenize edin.
- Tüpü 15.000-20.000 x g'da 15 dakika santrifüjleyin. Peletleri bozmadan süpernatanı mümkün olduğunca uzaklaştırmak için mikropipet.
NOT: Pelet çok gevşek olacaktır. - Pelete 50 μL PBS ekleyin ve yeniden süspanse edin. Tüpü tekrar 15.000-20.000 x g'da 15 dakika santrifüjleyin.
- 10 μL'lik bir uç kullanarak, peletin 4 μL'sini doğrudan aspire edin ve temiz bir 1.5 mL tüpe aktarın (Şekil 1D1). Izgara başına 1 μL yıkanmış ve konsantre altın kullanın.
NOT: Kullanılan referansların türü, sonraki uygulamalara bağlıdır. TEM tomografi için 10 nm altın boncuklar kullanınız. Yumuşak X-ışını tomografisi için 200 nm altın boncuklar kullanın. Korelasyon mikroskobu için floresan lateks boncuklar kullanın. Öğütme işlemi onları yok edeceğinden, kriyoFIB öğütmeyi içeren deneyler için normalde referanslar gerekli değildir.
- Blot
- Çevre odasını %95 neme ve 30°C'ye ayarlayın (Şekil 1D1). 5/15 cımbız kullanarak bir ızgara seçin.
- Izgaraları PBS ile yıkayın ve dalma cımbızına aktarın (Şekil 1D2). Sabitledikten sonra 5/15 cımbızı çıkarın ve cl'yi kaydırın.amp dalma cımbız üzerinde.
- Izgarayı cl'ye yerleştirin ve cl'yi tutun.amp güvenli (Şekil 1D3). Izgaranın arka tarafına 1 μL altın referans ekleyin (Şekil 1D4). Izgaranın karbon tarafına 2-3 μL PBS ekleyin. Izgaranın arka tarafını lekelemek için otomatik lekeleme kullanın ve donmayı sıvı etan içine daldırın (Şekil 1D5).
NOT: Optimum lekeleme için ızgara başına 3-4 μL arasında hacim olması önerilir. Izgaralar, yıkandıktan sonra değişken miktarda PBS tutabilir. Şebekede önceden var olan sıvı tutulmasını hesaba katmak için eklenen PBS hacmini ayarlayın. Altın referansların ızgaranın arkasına eklenmesi tavsiye edilir. Öne ekleme, yerleştirme noktasının yakınında altın referans havuzlarına neden olabilirken, arkadan ekleme daha homojen bir çözelti ile sonuçlanır. Lekelenme süresi, ızgaranın hücre diş hekimliğine bağlıdır. Sırasıyla boş ızgaralar için 2 s, normal için 3 s ve dolu ızgaralar için 4 s. Mevcut dalma dondurucu tipi, lekelemeye nasıl yaklaşılacağını belirleyebilir: Leica GP2 dalma dondurucu, bu protokolde kullanılan dondurucudur ve varsayılan olarak otomatik tek taraflı lekeleme yeteneğine sahiptir. Thermo Fisher Vitrobot, otomatik çift taraflı lekeleme yapar, ancak bu genellikle karbon tarafına bağlı hücrelere zarar verir. Vitrobot'ta manuel lekelemenin yanı sıra manuel yerçekimi pistonları da mümkündür.
Sonuçlar
HIViGFPΔEnv ve psPAX2'nin birlikte transfeksiyonunu takiben, tüm ızgaralarda karbon tabakasında minimum yırtılma vardı. Izgaralar, transfeksiyon reaktifi ile inkübasyondan 24 saat sonra faz ışık mikroskobu ve floresan ışık mikroskobu kullanılarak görüntülendi (Şekil 2). Hem sahte ızgaralardaki hem de birlikte transfekte edilmiş ızgaralardaki hücreler, birden çok ızgara karesinde canlı hücreler içeriyordu.
psPAX2, herhangi bir floresan etiketlemesi olmadan HIV-1'in tüm yapısal ve enzimatik proteinlerini kodlar. HIViGFPΔEnv, psPAX2'ye benzer, ancak GFP etiketli bir HIV Gag proteini için kodlar içerir. Her iki plazmit de ΔEnvelope'dur. Kotransfeksiyon, floresan HIV-1 partiküllerinin doğal benzeri bir araya gelmesi ve tomurcuklanması ile sonuçlanır, bu da bunu Biyogüvenlik Seviye 1 koşulunda HIV'in CLEM çalışmaları için harika bir sistem haline getirir. Birlikte transfekte edilmiş ızgaralar, başarılı kotransfeksiyonu gösteren yeşil floresan sergileyen bir hücre alt kümesi gösterdi. Sahte ızgaradaki hiçbir hücre floresan sergilemedi, bu da HIViGFPΔEnv ve psPAX2 kullanarak kotransfeksiyonu daha da doğruladı. Izgaraları ışık tabanlı mikroskopi kullanarak görüntüledikten sonra, ızgaralar donduruldu ve sıvı nitrojen içinde uzun süreli depolamaya taşındı.
Şekil 3, aynı deneysel yöntem kullanılarak üretilen ancak biraz farklı plazmit yapıları kullanan ızgaralardan elde edilen sonuçları göstermektedir. U2OS içeren ızgaralar, farklı HIV klonları (1:6 oranında HIVmCherryΔEnv ve NL4-3ΔEnvGFP) kullanılarak birlikte transfekte edildi. Daha yüksek bir floresan etiketli plazmit kütlesi kullanıldığından, bu ızgaralar daha fazla sayıda transfekte edilmiş hücrenin gözlemlenmesini sağladı ve cryoCLEM ve cryoET kullanarak görüntü yakalarken bir avantaj sağladı. CryoCLEM kullanılarak, birlikte transfekte edilen tüm hücrelerin konumlarını kaydetmek için kriyofloresan mikroskobu kullanılarak her ızgara için tam ızgara atlasları oluşturuldu. Hücrelerin yerleri bilinerek cryoET yapıldı. Tam bir düşük büyütmeli ızgara atlası toplandı ve kriyofloresanda toplanan floresan atlas ile kaplandı (Şekil 3A). Kriyotomogramlar, hücrelerden HIV'in montajı ve tomurcuklanması da dahil olmak üzere viral yaşam döngüsünün karmaşık ayrıntılarını yakalayan hücresel bölgelerde toplandı (Şekil 3B).
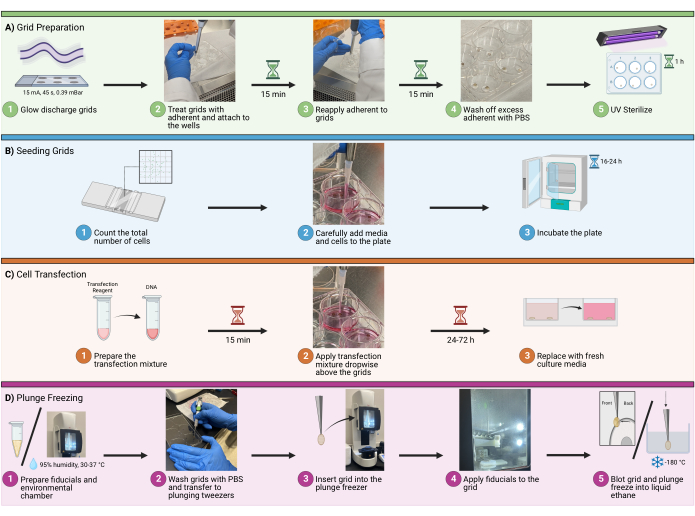
Şekil 1: Izgara iş akışında hücre tohumlama. CryoEM ızgaralarında hücreleri tohumlamak için genel prosedürü gösteren bir şema. İşlem, (A) tohumlama için kuyucuklarda ızgaraların hazırlanması, (B) her kuyucuğa uygun miktarda hücre eklenmesi, (C) floresan görüntüleme için hücrelerin isteğe bağlı transfeksiyonu ve (D) numunenin vitrifikasyonuna izin vermek için ızgaraların daldırılarak dondurulması dahil olmak üzere dört ana adıma bölünmüştür. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: HIViGFPΔEnv ve psPAX2 kullanılarak U2OS'un birlikte transfeksiyonu. U2OS hücreleri, GFP içeren HIViGFPΔEnv ve psPAX2 ile 1:3 oranında birlikte transfekte edildi. Izgaralar faz kontrastı ve floresan mikroskobu ile görüntülendi. GFP ekspresyonuna sahip olduğu gösterilen hücreler, başarılı kotransfeksiyonu gösterir. Ölçek çubuğu: 500 μm. Ölçek çubuğu (iç kısımlar): 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
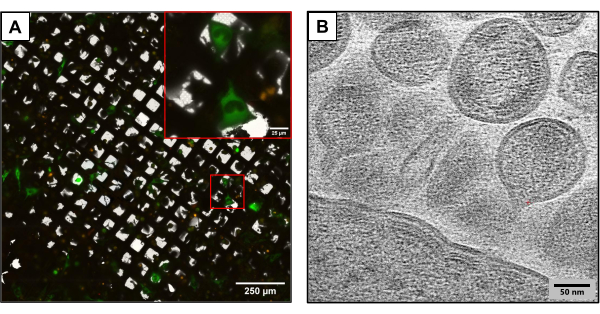
Şekil 3: Potansiyel aşağı akış kriyo tabanlı yöntemler . (A) Birlikte transfekte edilmiş U2OS hücrelerine sahip bir kriyoCLEM görüntüsü. Yeşil renkli hücreler HIV üreten hücreleri temsil eder ve kotransfeksiyon başarısını ölçmek için kullanılır. Kırmızı punkta, mCherry etiketli HIV-1 Gag'ı temsil eder. Ölçek çubuğu: 250 μm. Ölçek çubuğu (iç): 25 μm (B) U2OS hücrelerinin plazma membranından tomurcuklanan çoklu HIV partiküllerinin kriyoET görüntüsü. Ölçek çubuğu: 50 nm Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada, in situ kriyoelektron tomografi uygulamaları için elektron mikroskobu ızgaralarındaki tohum hücrelerine erişilebilir, esnek ve tekrarlanabilir bir protokol sağladık. Bu yöntem, sonraki uygulamaların ihtiyaçlarına ve/veya deneysel gereksinimlere uyacak şekilde kolayca uyarlanabilir. Büyük esnekliğe ek olarak, ızgara tohumlamadaki yaygın tuzakları, özellikle karbon tabakasına verilen kapsamlı hasarı, düşük hücre yoğunluğunu ve ince hücre projeksiyonlarının zayıf yapısal bütünlüğünü optimize eden ve azaltan bir iş akışı tanımladık.
Burada açıklanan protokol birkaç alternatif sunsa da, genel sonuçları optimize etmek için izlenmesi gereken bazı kritik adımlar vardır. Izgara hücresi tohumlama ile ilgili en büyük sorunlardan biri, ızgaraların kuyudan veya mikro slayttan ayrılması ve yüzmesidir. Bu nedenle, ızgarayı her iki tarafta yapışkan bir çözelti ile tamamen ıslatmak ve inkübasyon süresi boyunca kurumasını önlemek önemlidir. 3D baskılı ızgara tutucular kullanıyorsanız, ızgaranın altında sıkışan hava onu tutucudan dışarı çıkmaya zorlayabileceğinden, bu tutucularda birden fazla ortam değişikliğinin yüzer ızgaralar üretme potansiyeline sahip olduğunu unutmayın.
Cımbız seçimimiz, karbon tabakasına zarar verebilecek kapsamlı ızgara bükülmesi olmadan ızgaraları manipüle etmenin geometrik olarak uygun bir yolunu sağlama yolunda ızgara kalitesini de artırır. Hücreleri daldırmadan önce mümkün olduğunca uzun süre 37 ° C'de tutmak, hücre ıstırabını azaltır ve ızgaradaki ince görüntülenebilir hücrelerin sayısını artırır. Son olarak, altın tarafından lekeleme, hücreleri kırılgan hücresel yapılara zarar verebilecek sert mekanik kuvvetlerden koruyacaktır.
Bu protokole dahil edilmemekle birlikte, ızgara foto-mikro modellemenin, ızgara karelerinin merkezine bağlanmalarını optimize ederek görüntülenebilir hücrelerin sayısını artırdığıgösterilmiştir 14. Son olarak, 3D baskılı ızgara tutucular, doğrudan ızgara manipülasyonunu sınırlayarak ızgara hasarını azaltmak için yakın zamanda kullanılmıştır12.
Bu protokolün, kriyotomografi uygulaması için hücrelerden ince kenarları ve çıkıntıları görüntülemek için optimize edildiğine dikkat etmek önemli olabilir. Tercih edilen aşağı akış uygulamaları için en iyi sonucu bulmak için protokoldeki önerilerimizden çeşitli koşullarda sorun gidermenizi öneririz. Genel olarak, bu protokol, hücreleri belirli ihtiyaçlar için ayarlanabilen ızgaralara tohumlamak için güvenilir ancak çok yönlü bir yöntem sağlar.
Açıklamalar
Yazarlar hiçbir çıkar çatışması beyan etmezler.
Teşekkürler
Daldırmalı dondurma ekipmanına erişim için Mansky laboratuvarına teşekkür ederiz. Bu çalışmanın bir kısmı, Malzeme Araştırma Bilim ve Mühendislik Merkezi (MRSEC; Ödül Numarası DMR-2011401) ve Ulusal Sinirbilim Müfredat Girişimi (NNCI; Ödül Numarası ECCS-2025124) programlarında yer almaktadır. Viral Ortamlarda HIV Davranışı merkezi (B-HIVE; 1U54AI170855-01) ve Duke HIV Yapısal Biyoloji Merkezi'nden (DCHSB; U54AI170752) merkezi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10 nm colloidal gold bead solution | Sigma-Aldrich | 741957 | |
| 6 well multidish, 100/CS | Fisher Scientific | FB012927 | |
| Allegra V-15R Benchtop Centrifuge, IVD 120 V 60 Hz | Beckman-Coulter | C63125 | |
| Au G300F1 with R2/2 Quantifoil carbon | Quantifoil | TEM-G300F1-AU | |
| Bovine serum albumin | MilliporeSigma | A9647 | |
| BRAND counting chamber BLAUBRAND Neubauer improved | Sigma-Aldrich | BR717805-1EA | |
| DMi1 Inverted Microscope | Leica | 22A00G119 | |
| Dulbecco's modified eagle's medium - high glucose, no glutamine | Gibco | 11-960-044 | |
| Dumont 5/15 tweezer | Electron Microscopy Sciences | 0103-5/15-PO | |
| EM GP2 | Leica | 587085 | Automated plunge freezer |
| Fetal Bovine Serum | Gibco | A5209 | |
| Fibronectin from bovine plasma, cell culture grade | MilliporeSigma | F1141 | |
| GenJet version II in vitro DNA transfection reagent | SignaGen Laboratories | SL100489 | |
| GlutaMAX I 100x | Fisher Scientific | 35050061 | Media supplement |
| Neslab EX-211 Heating Circulator | Neslab | Out of production | Water bath for media warming |
| Original Portable Pipet-Aid Pipette Controller | Drummond Scientific | 4-000-100 | |
| PBS, pH 7.4 | Gibco | 10010023 | |
| Pelco easyGlow device | Pelco | 91000S | Glow discharge device |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | Media supplement |
| Pipetman P1000, 100–1000 µL, Metal Ejector | Gilson | F144059M | |
| Pipetman P2, 0.2–2 µL, Metal Ejector | Gilson | F144054M | |
| Pipetman P20, 2–20 µL, Metal Ejector | Gilson | F144056M | |
| Whatman number 2 filter paper, 55 mm | Whatman | 28455-041 | Blotting paper |
Referanslar
- Zhang, P., Mendonça, L. Analysis of Viruses in the Cellular Context by Electron Tomography. Encyclopedia of Virology. 1, Elsevier, Academic Press. 242-247 (2021).
- Fäßler, F., Dimchev, G., Hodirnau, V. -V., Wan, W., Schur, F. K. M. Cryo-electron tomography structure of Arp2/3 complex in cells reveals new insights into the branch junction. Nature Communications. 11, 6437(2020).
- McDowall, A. W., et al. Electron microscopy of frozen hydrated sections of vitreous ice and vitrified biological samples. Journal of Microscopy. 131 (Pt 1), 1-9 (1983).
- Stewart, M., Vigers, G. Electron microscopy of frozen-hydrated biological material. Nature. 319 (6055), 631-636 (1986).
- Gan, L., Jensen, G. J. Electron tomography of cells. Quarterly Reviews of Biophysics. 45 (1), 27-56 (2012).
- Yang, J. E., Larson, M. R., Sibert, B. S., Shrum, S., Wright, E. R. CorRelator: Interactive software for real-time high precision cryo-correlative light and electron microscopy. Journal of Structural Biology. 213 (2), 107709(2021).
- Mendonça, L., et al. Correlative multi-scale cryo-imaging unveils SARS-CoV-2 assembly and egress. Nature Communications. 12 (1), 4629(2021).
- Klumpe, S., et al. A modular platform for automated cryo-FIB workflows. eLife. 10, e70506(2021).
- Wagner, F. R., et al. Preparing samples from whole cells using focused-ion-beam milling for cryo-electron tomography. Nature Protocols. 15 (6), 2041-2070 (2020).
- Klein, S., et al. IFITM3 blocks influenza virus entry by sorting lipids and stabilizing hemifusion. Cell Host & Microbe. 31 (4), 616.e20-633.e20 (2023).
- Shah, P. N. M., et al. Characterization of the rotavirus assembly pathway in situ using cryoelectron tomography. Cell Host & Microbe. 31 (4), 604.e4-615.e4 (2023).
- Fäßler, F., Zens, B., Hauschild, R., Schur, F. K. M. 3D printed cell culture grid holders for improved cellular specimen preparation in cryo-electron microscopy. Journal of Structural Biology. 212 (3), 107633(2020).
- Hoffmann, P. C., et al. Electron cryo-tomography reveals the subcellular architecture of growing axons in human brain organoids. eLife. 10, e70269(2021).
- Toro-Nahuelpan, M., et al. Tailoring cryo-electron microscopy grids by photo-micropatterning for in-cell structural studies. Nature Methods. 17 (1), 50-54 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır