Method Article
哺乳類細胞の in situ クライオトモグラフィーのためのサンプル調製
要約
この方法は、 in situ 細胞クライオトモグラフィーおよび相関光電子顕微鏡(CLEM)用の電子顕微鏡(EM)グリッドを調製するためのアクセス可能で柔軟なプロトコルを提供します。
要約
in situ 細胞クライオトモグラフィーは、天然の凍結水和細胞環境で複雑な物体を研究するための強力な技術であり、細胞生物学およびウイルス学に非常に関連しています。クライオトモグラフィーを他の顕微鏡法と組み合わせることで、統合的および相関的なイメージングに最適な技術となります。しかし、 in situ 細胞トモグラフィーのサンプル調製は、細胞が電子顕微鏡グリッド上に容易に付着して伸びないため、簡単ではありません。さらに、グリッド自体は壊れやすく、力を入れすぎると壊れてしまい、イメージ可能な領域が失われる可能性があります。組織培養皿の形状は、ピンセットでグリッドを操作する際にも課題となる可能性があります。ここでは、これらの(およびその他の)課題を克服し、in situ 細胞クライオトモグラフィーおよび接着哺乳類細胞の相関イメージング用の高品質のサンプルを調製するためのヒントとコツについて説明します。クライオ顕微鏡技術の継続的な進歩により、この技術は複雑な生物学的システムの理解を深める上で大きな可能性を秘めています。
概要
in situ細胞クライオトモグラフィーは、化学的固定なしで細胞内の生物学的に関連のある構造の研究を可能にする強力な技術です。細胞をEMグリッドに付着させ、そのグリッドを低温剤で急降凍結することにより、細胞内水から結晶氷を形成することなく、対象物を自然な細胞環境で凍結します1,2。化学的固定と結晶氷の形成はどちらも、タンパク質や脂質などの関連分子の構造を破壊する可能性があり、これらの技術を使用して得られる画像の生物学的精度を低下させる可能性があります3,4。トモグラフィーでは、電子顕微鏡を用いてグリッドをインクリメンタルな角度で撮像し、これらの画像を用いて、撮像された標的領域の3次元表現を構築する5。in situクライオトモグラフィーは、クライオ蛍光イメージング、軟X線トモグラフィー、クライオFIB/SEM(極低温集束イオンビーム/走査型電子顕微鏡)など、統合的および相関的なイメージングのための他の顕微鏡技術と併用することができます6,7,8,9,10,11 .複数の技術を統合することで、単一の顕微鏡技術では達成できない構造やプロセスについてより多くの情報を得ることができます。
in situ細胞クライオトモグラフィーにはさまざまな利点がありますが、サンプル調製はさまざまな理由で困難な場合があります。電子顕微鏡グリッドは壊れやすいため、損傷につながる可能性があり、特に薄いカーボン層はデリケートで破れやすく、グリッドの画像化可能領域が減少します。また、電子顕微鏡グリッドはサイズが小さいため操作が難しく、細胞の増殖に使われるウェルやマイクロスライドの表面から外れやすくなります。坑井内のグリッドやマイクロスライドの操作は、これらの形状のために困難であることがわかります。グリッドの不適切な調製(例えば、グリッドを浮遊させる)は、細胞密度の低下につながり、特に細胞がグリッド自体に付着しにくい場合に、潜在的なイメージング領域の数を減らす可能性があります。直接細胞クライオトモグラフィーでは、細胞を非常に薄く広げる必要があり、不適切な温度やグリッドの乱暴な取り扱いなど、さまざまな理由で破壊される可能性があります。
本稿で紹介する手法は、さまざまな最適化により、クライオトモグラフィー用の電子顕微鏡グリッドの準備中に発生する最も一般的な落とし穴に対処することを目的としています。5/15の角度付きピンセットを使用することで、ウェルプレートやマイクロスライド内のグリッドの操作が可能になります。めっき前にグリッドの両側にフィブロネクチン溶液を塗布すると、グリッドが浮遊する可能性が低くなり、グリッドが適切な細胞密度を持ち、操作によるグリッドが損傷する可能性が低くなります。また、37°Cで凍結直前までインキュベートすることで、細胞が薄いエッジを引っ込めないように快適な環境に保ちます。グリッドを裏側からブロットすることで、機械的な力による細胞の損傷も防ぐことができます。全体として、これらの測定により、 in situ 細胞クライオトモグラフィー研究のサンプル調製の成功率が向上し、このイメージングアプローチのアクセシビリティが向上します。
プロトコル
1. グリッドの準備
注:実験計画では、プランジ凍結セッションごとに合計で最大8〜12グリッド、ウェルあたり4〜5グリッドを計画します。それを超えると、非常に長いプランジ凍結セッションにつながり、細胞ストレスの増加、氷の汚染、およびユーザーエラーを引き起こす可能性があります。
- グロー放電
- グロー放電装置で0.39 mBar雰囲気で15 mAで45秒間グロー放電するように、適切な数のグリッドに穴あきカーボンサポートフィルムをロードします。
- グリッドのカーボン側が上を向いていることを確認してください。終了したら、グリッドをろ紙で裏打ちされた清潔な容器に移します(図1A1)。
注:材料が細胞に有毒でない限り、他のグリッドを使用できます(銅グリッドは除外されます)。ファインダーグリッドは、相関調査に役立ちます。他の材料で作られたグリッドも可能です。多くの研究室では、SiO2支持グリッド8,9の上に細胞を成長させ、良好な結果が得られています。
- 接着治療
- グリッド、フィブロネクチン、PBS、プレート、ピンセットをバイオセーフティキャビネットに移します。グリッドの両側を 20 μg/mL のウシフィブロネクチンで処理し、6ウェルプレートの蓋などの無菌表面に、たっぷりの大きさの付着溶液を2つマイクロピペッティングします。ドットがグリッド全体を包み込むのに十分な大きさであることを確認してください(約100μLを推奨)。
注:選択した接着液で処理する前に、グリッドの正方形の中心に細胞の付着を最適化するために、ここでグリッドをフォトマイクロパターニングするオプションがあります。細胞がバーに付着する能力を下げると、イメージング可能な細胞の数が増えます。これは、クライオFIBミリングを含む実験に最適です。 - 5/15ピンセットを使用してグリッドを操作します。グリッドの両側を溶液で処理してください。
注:他の接着溶液(フィブリノーゲン、コラーゲン、その他の細胞外マトリックス成分など)を使用できます。フィブロネクチンは、さまざまな細胞株で良好な結果が得られるため、ここで使用されます。(U2OS、HeLa、Vero、Calu-3、Tzm-bl)。5/15ピンセットは、その形状により、6ウェルプレート、35mmディッシュ、マイクロスライドの周りの操作性が向上しているため、便利です。これにより、グリッドへの機械的ストレスが軽減され、カーボン膜がより無傷になります。グリッド汚染の可能性を減らすために、開始する前に必要なすべての材料がバイオセーフティキャビネットに配置されていることを確認してください。
- グリッド、フィブロネクチン、PBS、プレート、ピンセットをバイオセーフティキャビネットに移します。グリッドの両側を 20 μg/mL のウシフィブロネクチンで処理し、6ウェルプレートの蓋などの無菌表面に、たっぷりの大きさの付着溶液を2つマイクロピペッティングします。ドットがグリッド全体を包み込むのに十分な大きさであることを確認してください(約100μLを推奨)。
- グリッドのアタッチ
- ウシフィブロネクチンで処理すると、グリッドは粘着性になります。5/15ピンセットを使用して、グリッドの非カーボン表面を空の皿/プレートの底にそっと触れ、ピンセットを開きます。グリッドは新しいサーフェスに簡単に取り付けられます(図1A、2)。
注意: 皿/プレートの真ん中または端にグリッドを配置しないようにしてください。細胞を追加すると、細胞密度がプレートの中心に蓄積する傾向があります。これにより、グリッドのセル密度が過度になる可能性があります。或いは、3Dプリントされたグリッドホルダーを、皿/プレート12の表面に直接セルを付着させる代わりに、ここで使用されてもよい。
- ウシフィブロネクチンで処理すると、グリッドは粘着性になります。5/15ピンセットを使用して、グリッドの非カーボン表面を空の皿/プレートの底にそっと触れ、ピンセットを開きます。グリッドは新しいサーフェスに簡単に取り付けられます(図1A、2)。
- 潜伏
- グリッドをフィブロネクチン付着溶液(20 μg/mL)中で30分間インキュベートします。このプロセス中にグリッドが乾燥しないように、マイクロピペット1〜2個を15分ごとにグリッドの上に直接滴下します(図1A3)。
注:インキュベーション期間は、使用する接着液によって異なります。ウシフィブロネクチンの場合、推奨時間は30分です。
- グリッドをフィブロネクチン付着溶液(20 μg/mL)中で30分間インキュベートします。このプロセス中にグリッドが乾燥しないように、マイクロピペット1〜2個を15分ごとにグリッドの上に直接滴下します(図1A3)。
- 洗浄
- インキュベーション期間の後、マイクロピペッティングで余分な付着液を除去します。PBSをグリッドの上に直接マイクロピペッティング滴下してグリッドを洗浄します。これを2〜3回繰り返します。(図1A、4)。
- 殺菌
- UVライトを使用して、バイオセーフティキャビネット内のグリッドを1時間滅菌します。グリッドをUV光源にできるだけ近づけて、滅菌を最大化します(図1A5)。このプロセス中にグリッドが乾燥しないように、マイクロピペットで10分ごとにPBSをグリッドの上に直接滴下します。
注:手順1.4〜1.6は同時に実行できます。
- UVライトを使用して、バイオセーフティキャビネット内のグリッドを1時間滅菌します。グリッドをUV光源にできるだけ近づけて、滅菌を最大化します(図1A5)。このプロセス中にグリッドが乾燥しないように、マイクロピペットで10分ごとにPBSをグリッドの上に直接滴下します。
2. シードグリッド
- セルを数える:
- 機械的または酵素的方法を使用して細胞を分離し、カウントします。カウントする前に、播種に使用する最適なセル数を決定します。6ウェルプレートに播種されたU2OSの場合は、ウェルあたり6 x 104 〜1.6 x 105 セルを使用します(図1B1)。
注:播種する細胞の数は、細胞の種類、ウェルの表面積、使用するディッシュまたはマイクロスライド、播種からプランジ凍結までの時間、および実験計画によって異なります。セル番号の範囲をテストして、プランジ凍結時にグリッド正方形あたり0.25-1セルになる条件を特定します。セル密度が高いと熱伝達速度が低下し、ガラス化プロセスに影響を与える可能性があることに注意することが重要です。これに対抗するために、一部の研究室では、細胞凝集塊の形成を防ぐ作用を持つセルストレーナーを使用することに成功しています13。最後に、このプロトコルはカーボン層に細胞の任意付加で起因する。ターゲットアタッチメントが必要な場合は、フォトマイクロパターニングを使用できます(ステップ1.3を参照)14。
- 機械的または酵素的方法を使用して細胞を分離し、カウントします。カウントする前に、播種に使用する最適なセル数を決定します。6ウェルプレートに播種されたU2OSの場合は、ウェルあたり6 x 104 〜1.6 x 105 セルを使用します(図1B1)。
- 細胞と増殖培地の添加:気泡を避けながら、マイクロピペットを介して細胞をウェルに添加します(図1B2)。6ウェルプレートでは、1.5〜2.0 mLの総ウェル容量が推奨されます。
注意: ボリューム全体を追加する前に、グリッドの周りを注意深く濡らすことをお勧めします。これにより、グリッドが分離してソリューション内で浮動するのを防ぐことができます。プレートを左右に静かに動かして、ウェル上での細胞の均一な分布を促進します。プレートを円運動で渦巻かせると、ウェルの中心に過剰な細胞密度が割り当てられるため、行わないでください。 - インキュベーション:スライドを37°Cで適切な時間、実験デザインに従ってインキュベートしますが、これは下流のアプリケーションによって異なります。この例(HIV分子クローンのトランスフェクション)では、16〜24時間インキュベートします(図1B3)。
注:インキュベーション時間が長いほど、細胞分裂サイクルが長くなります。したがって、それに応じて播種する開始セルの数を調整します。
3. トランスフェクション
- トランスフェクション混合物の調製:
- 選択した細胞株へのプラスミドトランスフェクションに適したカチオン性リポソーム試薬を調製します。
- このトランスフェクションの例では、1 μgの総プラスミドDNAを1ウェルあたり(6ウェルプレートで)使用し、HIViΔEnvプラスミドとpsPAX2プラスミドの比率を1:3の比率でトランスフェクションします。各ウェルについて、1 μg の DNA を 50 μL の無血清 DMEM に希釈します。マイクロピペッティングを繰り返すか、プレートを穏やかに旋回させることで、混合物を均質化します。
- 各ウェルについて、トランスフェクション試薬3 μLを無血清DMEMで希釈し、マイクロピペッティングまたは穏やかな旋回により混合物を再度ホモジナイズします。希釈したトランスフェクション試薬混合物全体を希釈したDNA混合物に加え(ステップ3.1.2)、室温(RT)で15分間インキュベートします(図1C1)。
注:この混合物がインキュベートされている間に、ウェル内の培地を 1.5 mL の新鮮な DMEM と交換します。井戸の底からグリッドが外れないように注意してください。
- トランスフェクション混合物を塗布するには、ステップ 3.1.3 の混合物 100 μL を各ウェルに滴下し、グリッド上に滴下を集中させて確実に接触させます(図 1C2)。トランスフェクションの16〜24時間後に増殖培地を交換します(図1C、3)。
4.プランジ凍結
注:ブロッティングが必要になるまで、細胞を37°Cに保ってください。さらに、プロセス全体を通して、グリッドの炭素側を必ずメモしてください。
- 細胞密度
- 倒立光学顕微鏡でグリッドを確認し、各グリッドの細胞密度を記録します。
注: グリッドの正方形あたり 0.25 セル未満 (またはグリッドの正方形 4 つごとに 1 つのセル) のグリッドは「空」と見なされます。グリッドの正方形あたり 0.25-1 セルのグリッドは「標準」と見なされます。グリッドの正方形ごとに 1 つ以上のセルを持つグリッドは、「フル」と見なされます。 - 各グリッドの細胞密度に注意して、後でプランジ凍結中にブロッティング時間を調整できるようにします。空のプレート/ディッシュに2〜3 mLのPBSを加え、37°Cに温めます。
- 倒立光学顕微鏡でグリッドを確認し、各グリッドの細胞密度を記録します。
- 指標の準備
- ダウンストリームクライオトモグラフィーアプリケーション用の金フィデューシャルを調製するには、50 μL の 10 nm 金コロイドビーズ溶液を清潔な 1.5 mL チューブにピペットで移します。2 μL の 1 mg/mL BSA をチューブに加え、マイクロピペッティングを繰り返してホモジナイズします。
- チューブを15,000〜20,000 x g で15分間遠心分離します。マイクロピペットは、ペレットを乱すことなく、できるだけ多くの上清を除去します。
注意: ペレットは非常に緩くなります。 - 50 μLのPBSをペレットに添加し、再懸濁します。チューブを15,000-20,000 x g で15分間再度遠心分離します。
- 10 μL チップを使用して、4 μL のペレットを直接吸引し、清潔な 1.5 mL チューブに移します(図 1D1)。グリッドあたり1 μLの洗浄濃縮金を使用します。
注: 使用される指標のタイプは、下流のアプリケーションによって異なります。TEMトモグラフィーには、10nmの金ビーズを使用します。軟X線トモグラフィーには、200nmの金ビーズを使用してください。相関顕微鏡には、蛍光ラテックスビーズを使用します。基準法は、フライス加工プロセスによって破壊されるため、通常、クライオFIBミリングを含む実験には必要ありません。
- 吸い取り
- 恒温槽を湿度95%、30°Cに設定します(図1D1)。5/15ピンセットを使用してグリッドを選択します。
- グリッドをPBSで洗浄し、プランジピンセットに移します(図1D2)。固定したら、5/15ピンセットを取り外し、プランジピンセットのクランプをスライドさせます。
- グリッドをプランジフリーザーに挿入し、クランプを固定します(図1D3)。グリッドの裏側に 1 μL の金フィデューシャルを加えます(図 1D4)。2〜3μLのPBSをグリッドのカーボン側に加えます。自動ブロッティングを使用してグリッドの裏側を吸い取り、凍結液を液体エタンに沈めます(図1D5)。
注:最適なブロッティングのために、グリッドあたり3〜4 μLの容量を使用することをお勧めします。グリッドは、洗浄後に可変量のPBSを保持してもよい。PBSの追加量を調整して、グリッド上の既存の液体保持を考慮します。金の基準はグリッドの背面に追加することをお勧めします。前面から添加すると、挿入点付近に金の基準材が溜まりますが、背面から添加すると、より均質化された溶液になります。ブロッティングの持続時間は、グリッドの細胞歯科によって異なります。空の場合は 2 秒、法線の場合は 3 秒、フル グリッドの場合は 4 秒です。利用可能なプランジフリーザーの種類によって、ブロッティングへのアプローチ方法が決まります:Leica GP2プランジフリーザーは、このプロトコルで使用されるもので、デフォルトで自動片面ブロッティングが可能です。サーモフィッシャー Vitrobot は自動両面ブロッティングを行いますが、カーボン側に付着したセルに損傷を与えることがよくあります。Vitrobotでの手動ブロッティングや、手動重力プランジャーも可能です。
結果
HIViGFPΔEnvとpsPAX2のコトランスフェクション後、すべてのグリッドでカーボン層の裂け目が最小限に抑えられました。グリッドは、トランスフェクション試薬とのインキュベーションの24時間後に位相光顕微鏡および蛍光顕微鏡を使用してイメージングしました(図2)。モックグリッドとコトランスフェクションされたグリッドの両方のセルには、複数のグリッドの正方形に生存可能なセルが含まれていました。
psPAX2は、HIV-1のすべての構造タンパク質および酵素タンパク質を蛍光標識なしでコードします。HIViGFPΔEnvはpsPAX2に似ていますが、GFPタグ付きHIVギャグタンパク質のコードがあります。どちらのプラスミドもΔEnvelopeです。コトランスフェクションにより、蛍光HIV-1粒子のネイティブ様の集合と出芽が得られ、バイオセーフティレベル1の状態でのHIVのCLEM研究に最適なシステムです。コトランスフェクションされたグリッドは、緑色蛍光を示す細胞のサブセットを示し、コトランスフェクションが成功したことを示しています。モックグリッド上の細胞は蛍光を示さず、HIViGFPΔEnvおよびpsPAX2を用いたコトランスフェクションをさらに検証しました。光ベースの顕微鏡でグリッドを観察した後、グリッドをプランジ凍結し、液体窒素中で長期保存しました。
図3は、同じ実験方法を用いて、わずかに異なるプラスミドコンストラクトを用いて作成したグリッドの結果を示しています。U2OSを含むグリッドは、異なるHIVクローン(HIVmCherryΔEnv、およびNL4-3ΔEnvGFP、1:6の比率)を用いて共トランスフェクションした。蛍光タグ付きプラスミドの質量が大きいため、これらのグリッドはより多くのトランスフェクションされた細胞の観察を可能にし、cryoCLEMおよびcryoETを使用して画像を撮影する際に利点を提供します。クライオクレムを用いて、クライオ蛍光顕微鏡を用いて各グリッドのフルグリッドアトラスを作成し、共トランスフェクションされたすべての細胞の位置を記録しました。細胞の位置がわかったので、cryoETを実施しました。完全な低倍率グリッドアトラスを収集し、凍結蛍光で収集した蛍光アトラスと重ね合わせました(図3A)。細胞部位でクライオトモグラムを収集し、細胞からのHIVの組み立てや出芽など、ウイルスのライフサイクルの複雑な詳細を捉えました(図3B)。
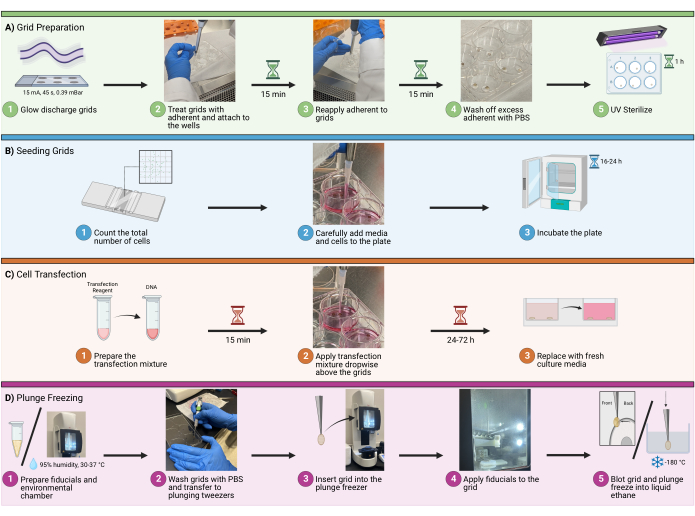
図1:グリッド上の細胞播種ワークフロー。 クライオ電子顕微鏡グリッド上に細胞を播種する全体的な手順を示す概略図。このプロセスは、(A)播種用のウェル内のグリッドの準備、(B)各ウェルへの適切な量の細胞の添加、(C)蛍光イメージング用の細胞のオプションのトランスフェクション、(D)サンプルのガラス化を可能にするためのグリッドのプランジ凍結の4つの主要なステップに分かれています。 この図の拡大版をご覧になるには、ここをクリックしてください。

図2:HIViGFPΔEnvとpsPAX2を用いたU2OSのコトランスフェクション。 U2OS細胞をGFP含有HIViGFPΔEnvおよびpsPAX2と1:3の比率で共トランスフェクションしました。グリッドは、位相差と蛍光顕微鏡法によって画像化されました。GFP発現が示された細胞は、コトランスフェクションが成功したことを示しています。スケールバー:500μm。スケールバー(インセット):100 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
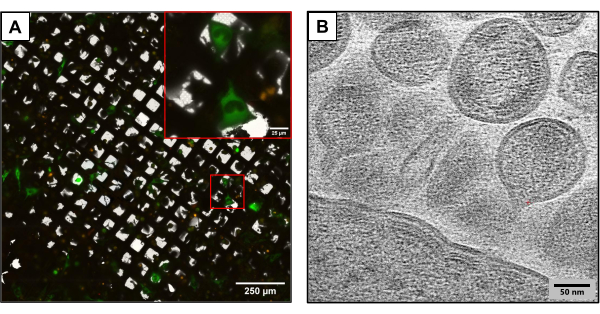
図3:潜在的なダウンストリームクライオベースの分析法 。 (A)U2OS細胞を共トランスフェクションしたクライオクレム画像。緑色の細胞はHIV産生細胞を表し、コトランスフェクションの成功を測定するために使用されます。赤いプンクタは、mCherryタグ付きHIV-1ギャグを表します。スケールバー:250 μm。スケールバー(挿入図):25 μm (B) U2OS細胞の原形質膜から出芽する複数のHIV粒子のクライオET画像。スケールバー:50 nm この図の拡大版をご覧になるには、ここをクリックしてください。
ディスカッション
ここでは、 in situ クライオ電子線トモグラフィーアプリケーション向けに、電子顕微鏡グリッド上のシード細胞へのアクセス、柔軟性、再現性のあるプロトコルを提供しました。この方法は、下流のアプリケーションや実験要件のニーズに合わせて簡単に適合させることができます。優れた柔軟性に加えて、グリッドシーディングの一般的な落とし穴、特に炭素層への広範な損傷、低いセル密度、および薄いセル突起の構造的完全性の悪さを最適化および軽減するワークフローについて説明しました。
ここで説明するプロトコルはいくつかの選択肢を提供しますが、一般的な結果を最適化するために従うべきいくつかの重要なステップがあります。グリッドセル播種における最大の問題の1つは、ウェルまたはマイクロスライドからのグリッドの剥離と浮遊です。したがって、グリッドの両面を付着液で完全に濡らし、インキュベーション期間中に乾燥しないようにすることが重要です。3Dプリントされたグリッドホルダーを使用する場合、グリッドの下に閉じ込められた空気がホルダーから押し出される可能性があるため、これらのホルダーにメディアを複数回変更すると、フローティンググリッドが生成される可能性があることに注意してください。
また、ピンセットの選択により、炭素層を損傷する大規模なグリッド曲げを行うことなく、幾何学的に有利な方法でグリッドを操作することができるため、グリッドの品質が向上します。細胞を37°Cにできるだけ長く保つと、細胞の苦しみが軽減され、グリッド上の薄いイメージング可能な細胞の数が増えます。最後に、金側からのブロッティングは、脆弱な細胞構造の損傷につながる可能性のある過酷な機械的力から細胞を保護します。
このプロトコルには含まれていないが、グリッドフォトマイクロパターニングは、グリッド正方形14の中心へのそれらの付着を最適化することによって、イメージング可能な細胞の数を増加させることが示されている。最後に、3Dプリントされたグリッドホルダーは、最近、グリッドの直接操作を制限することにより、グリッドの損傷を軽減するために使用されています12。
このプロトコルは、クライオトモグラフィーの適用のために細胞からの薄いエッジや突起をイメージングするために最適化されていることに注意することが重要かもしれません。プロトコルの推奨事項からさまざまな条件をトラブルシューティングして、選択したダウンストリームアプリケーションに最適な結果を見つけることをお勧めします。全体として、このプロトコルは、特定のニーズに合わせて調整できるグリッドに細胞を播種する信頼性が高く汎用性の高い方法を提供します。
開示事項
著者らは、競合する利害関係がないことを宣言します。
謝辞
プランジ凍結装置へのアクセスを提供してくれたマンスキー研究所に感謝します。この作業の一部は、ミネソタ大学の特性評価施設で実施され、材料研究科学工学センター(MRSEC;受賞番号 DMR-2011401)およびNational Neuroscience Curriculum Initiative(NNCI;受賞番号 ECCS-2025124)プログラム。Behavior of HIV in Viral Environments center (B-HIVE; 1U54AI170855-01) と Duke Center for HIV Structural Biology (DCHSB;U54AI170752)センター。
資料
| Name | Company | Catalog Number | Comments |
| 10 nm colloidal gold bead solution | Sigma-Aldrich | 741957 | |
| 6 well multidish, 100/CS | Fisher Scientific | FB012927 | |
| Allegra V-15R Benchtop Centrifuge, IVD 120 V 60 Hz | Beckman-Coulter | C63125 | |
| Au G300F1 with R2/2 Quantifoil carbon | Quantifoil | TEM-G300F1-AU | |
| Bovine serum albumin | MilliporeSigma | A9647 | |
| BRAND counting chamber BLAUBRAND Neubauer improved | Sigma-Aldrich | BR717805-1EA | |
| DMi1 Inverted Microscope | Leica | 22A00G119 | |
| Dulbecco's modified eagle's medium - high glucose, no glutamine | Gibco | 11-960-044 | |
| Dumont 5/15 tweezer | Electron Microscopy Sciences | 0103-5/15-PO | |
| EM GP2 | Leica | 587085 | Automated plunge freezer |
| Fetal Bovine Serum | Gibco | A5209 | |
| Fibronectin from bovine plasma, cell culture grade | MilliporeSigma | F1141 | |
| GenJet version II in vitro DNA transfection reagent | SignaGen Laboratories | SL100489 | |
| GlutaMAX I 100x | Fisher Scientific | 35050061 | Media supplement |
| Neslab EX-211 Heating Circulator | Neslab | Out of production | Water bath for media warming |
| Original Portable Pipet-Aid Pipette Controller | Drummond Scientific | 4-000-100 | |
| PBS, pH 7.4 | Gibco | 10010023 | |
| Pelco easyGlow device | Pelco | 91000S | Glow discharge device |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | Media supplement |
| Pipetman P1000, 100–1000 µL, Metal Ejector | Gilson | F144059M | |
| Pipetman P2, 0.2–2 µL, Metal Ejector | Gilson | F144054M | |
| Pipetman P20, 2–20 µL, Metal Ejector | Gilson | F144056M | |
| Whatman number 2 filter paper, 55 mm | Whatman | 28455-041 | Blotting paper |
参考文献
- Zhang, P., Mendonça, L. Analysis of Viruses in the Cellular Context by Electron Tomography. Encyclopedia of Virology. 1, Elsevier, Academic Press. 242-247 (2021).
- Fäßler, F., Dimchev, G., Hodirnau, V. -V., Wan, W., Schur, F. K. M. Cryo-electron tomography structure of Arp2/3 complex in cells reveals new insights into the branch junction. Nature Communications. 11, 6437(2020).
- McDowall, A. W., et al. Electron microscopy of frozen hydrated sections of vitreous ice and vitrified biological samples. Journal of Microscopy. 131 (Pt 1), 1-9 (1983).
- Stewart, M., Vigers, G. Electron microscopy of frozen-hydrated biological material. Nature. 319 (6055), 631-636 (1986).
- Gan, L., Jensen, G. J. Electron tomography of cells. Quarterly Reviews of Biophysics. 45 (1), 27-56 (2012).
- Yang, J. E., Larson, M. R., Sibert, B. S., Shrum, S., Wright, E. R. CorRelator: Interactive software for real-time high precision cryo-correlative light and electron microscopy. Journal of Structural Biology. 213 (2), 107709(2021).
- Mendonça, L., et al. Correlative multi-scale cryo-imaging unveils SARS-CoV-2 assembly and egress. Nature Communications. 12 (1), 4629(2021).
- Klumpe, S., et al. A modular platform for automated cryo-FIB workflows. eLife. 10, e70506(2021).
- Wagner, F. R., et al. Preparing samples from whole cells using focused-ion-beam milling for cryo-electron tomography. Nature Protocols. 15 (6), 2041-2070 (2020).
- Klein, S., et al. IFITM3 blocks influenza virus entry by sorting lipids and stabilizing hemifusion. Cell Host & Microbe. 31 (4), 616.e20-633.e20 (2023).
- Shah, P. N. M., et al. Characterization of the rotavirus assembly pathway in situ using cryoelectron tomography. Cell Host & Microbe. 31 (4), 604.e4-615.e4 (2023).
- Fäßler, F., Zens, B., Hauschild, R., Schur, F. K. M. 3D printed cell culture grid holders for improved cellular specimen preparation in cryo-electron microscopy. Journal of Structural Biology. 212 (3), 107633(2020).
- Hoffmann, P. C., et al. Electron cryo-tomography reveals the subcellular architecture of growing axons in human brain organoids. eLife. 10, e70269(2021).
- Toro-Nahuelpan, M., et al. Tailoring cryo-electron microscopy grids by photo-micropatterning for in-cell structural studies. Nature Methods. 17 (1), 50-54 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved