A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تجربة عشوائية خاضعة للتحكم في الخداع للتحفيز الكهربائي للجمجمة لألم الألم العضلي الليفي والوظيفة البدنية ، باستخدام المؤشرات الحيوية لتصوير الدماغ
In This Article
Summary
الدراسة الحالية عبارة عن تجربة عشوائية خاضعة للتحكم الوهمي لتحديد فعالية التحفيز الكهربائي للجمجمة (CES) لتحسين الألم والوظيفة في الألم العضلي الليفي وتطوير التصوير بالرنين المغناطيسي للاتصال الوظيفي (rs-fcMRI) كأداة سريرية لتقييم الارتباطات العصبية وآليات الألم المزمن والاستجابة المسكنة.
Abstract
الألم العضلي الليفي هو متلازمة الألم المزمن التي تظهر مع كوكبة من الأعراض واسعة ، بما في ذلك انخفاض الوظيفة البدنية ، والتعب ، والاضطرابات المعرفية ، وغيرها من الشكاوى الجسدية. غالبا ما تكون العلاجات المتاحة غير كافية في علاج الأعراض ، مع عدم كفاية السيطرة على الألم مما يؤدي عادة إلى استخدام المواد الأفيونية لمحاولة الإدارة. التحفيز الكهربائي الجمجمة (CES) هو خيار علاجي غير دوائي واعد لحالات الألم التي تستخدم تحفيز التيار الكهربائي النبضي لتعديل وظائف المخ عبر الأقطاب الكهربائية عبر الجلد. تتطلب هذه الآليات العصبية وتطبيقات CES في تخفيف أعراض الألم العضلي الليفي مزيدا من الاستكشاف.
تم تسجيل ما مجموعه 50 مشاركا من نظام الرعاية الصحية لشؤون المحاربين القدامى في أتلانتا (VAHCS) الذين تم تشخيصهم بالألم العضلي الليفي ثم تم حظرهم عشوائيا إما في العلاج الوهمي بالإضافة إلى العلاج القياسي أو CES النشط بالإضافة إلى مجموعة العلاج القياسية. تم الحصول على تقييمات خط الأساس قبل بدء العلاج. حدث كلا التدخلين على مدار 12 أسبوعا ، وتم تقييم المشاركين في 6 أسابيع و 12 أسبوعا بعد بدء العلاج. تحققت النتيجة الأولية فيما إذا كان الألم والتحسينات الوظيفية تحدث مع تطبيق CES. بالإضافة إلى ذلك ، تم الحصول على خط الأساس والمتابعة للتصوير بالرنين المغناطيسي للاتصال الوظيفي (rs-fcMRI) في النقاط الزمنية لمدة 6 أسابيع و 12 أسبوعا لتقييم التطبيقات السريرية للمؤشرات الحيوية للاتصال العصبي والارتباطات العصبية الأساسية المتعلقة بتأثيرات العلاج.
هذه تجربة عشوائية خاضعة للتحكم الوهمي لتحديد فعالية CES لتحسين الألم والوظيفة في الألم العضلي الليفي وتطوير rs-fcMRI كأداة سريرية لتقييم الارتباطات العصبية وآليات الألم المزمن والاستجابة المسكنة.
Introduction
من بين العديد من حالات الألم المزمن الموجودة ، يعد الألم العضلي الليفي أحد أكثر الأمراض صعوبة في تشخيصها وتقييمها سريريا وعلاجها. الألم العضلي الليفي هو متلازمة الألم المزمن المنهكة التي تنطوي على ألم مزمن واسع الانتشار ، وانخفاض الوظيفة البدنية ، والتعب ، والاضطرابات النفسية والعاطفية والنوم ، والشكاوى الجسدية المختلفة التي تؤثر على ما يقرب من 2-3 ٪ من عامة السكان في الأمريكتين (حوالي 8 ملايين شخص في الولايات المتحدة) 1. يعتمد تشخيص المرض بشكل كبير على فهم المريض لملف الأعراض الخاص به وتجربة الألم ، وبدون هذا الفهم الصحيح من قبل كل من الطبيب والمريض للمرض ، تفقد طرق العلاج فعالية كبيرة2. من الضروري وجود تعريف أفضل لأصول الألم العضلي الليفي وتأثيره بالإضافة إلى علامة حيوية سريرية موثوقة لتوجيه تشخيص وعلاج الألم العضلي الليفي لتقديم أفضل خدمة لجميع المرضى.
حتى مع التشخيص المؤكد ، فإن الصعوبات في عملية العلاج تنمو فقط. بشكل عام ، يؤثر الألم المزمن على الأفراد أكثر من أمراض القلب والسكري والسرطان مجتمعة. إن الطبيعة الذاتية لتقييمه تضعه كمحرك أساسي لوباء المواد الأفيونية ، خاصة بالنظر إلى صعوبة تمييز الألم الجسدي غير المعالج بشكل كامل من اضطراب تعاطي المخدرات وسلوك البحث عن المخدرات3. في عام 2020 ، حدثت 91,799 حالة وفاة بجرعة زائدة من المخدرات في الولايات المتحدة (بزيادة 30٪ عن عام 2019) ، ووجد أن المواد الأفيونية هي السبب الرئيسي لهذه الوفيات (74.8٪ من جميع وفيات الجرعات الزائدة من المخدرات لعام 2020)4. وبالتالي ، هناك حاجة إلى بدائل غير دوائية لعلاج الألم المزمن والألم العضلي الليفي لإبطاء وباء المواد الأفيونية ، وهو أمر مهم بشكل خاص في السكان القدامى حيث يكون خطر الانتحار واضطراب استخدام المواد الأفيونية أعلى5. لذلك غالبا ما تستخدم العلاجات غير الدوائية والتكميلية كعلاجات الخط الأول6.
قاد البحث عن تدخلات فيبروميالغيا جديدة وفعالة العديد من الباحثين والأطباء إلى طرق تحفيز الدماغ غير الباضعة، بما في ذلك تحفيز الجمجمة. على الرغم من أن الآليات الفيزيولوجية المرضية التي تؤدي إلى تطور المرض لم يتم تحديدها بشكل نهائي ، إلا أن الأدلة الحالية تدعم فكرة أن الألم العضلي الليفي هو اضطراب في خلل وظيفي في الجهاز العصبي اللاإرادي وآليات معالجة الألم المركزية (أي الدماغ والحبل الشوكي) 7,8. يمكن أن يؤدي تحفيز مناطق معينة من الدماغ إلى تحسين الوظيفة في تلك المناطق من المعالجة. ارتبط التحفيز المغناطيسي المتكرر عبر الجمجمة (rTMS) والتحفيز الحالي المباشر عبر الجمجمة (tDCS) بانخفاض الألم ولكنه ارتبط أيضا بتهيج فروة الرأس في موقع التنشيط والصداع وعدم إمكانية الوصول خارج مرافق العلاج9. تحفيز العصب المبهم غير الباضع (nVNS) ، والذي يمكن أن يوفر التعديل العصبي من خلال التحفيز على الجلد في الرقبة أو على مستوى الأذن ، لديه القدرة على علاج الألم المزمن ، وقد ثبت أن تحفيز العصب المبهم الغازي (VNS) يحسن أعراض الألم المزمن10. ومع ذلك ، لم يتم استكشاف VNS الغازية أو غير الغازية بشكل كاف في الأدبيات أو التحقق من صحتها بالكامل للاستخدام في علاج الألم العضلي الليفي11،12،13،14.
التحفيز الكهربائي للجمجمة (CES) هو علاج غير دوائي وغير جراحي لتحفيز الدماغ يتكون من تيار دقيق نابض ومتناوب (أقل من 0.5 مللي أمبير) يتم تطبيقه عبر أقطاب كهربائية عبر الجلد موضوعة على شحمة الأذن15. يمكن الوصول إليه بشكل ملحوظ ويمكن توصيله من خلال الأجهزة المحمولة التي يستخدمها المرضى داخل أماكن المعيشة الخاصة بهم. بالمقارنة مع طرق تحفيز الجمجمة الأخرى ، فإن الطبيعة غير الباضعة وراحة التطبيق الذاتي للمريض في المنزل تزيد من إمكانات CES كخيار مفيد لاستخدام علاج الألم العضلي الليفي على نطاق واسع والإدارة الذاتية للألم. تم تطهيره من قبل إدارة الغذاء والدواء الأمريكية (FDA) كعلاج للأرق والاكتئاب والقلق والألم15.
تقيم الدراسة الحالية فعالية CES كطريقة لعلاج الألم العضلي الليفي من خلال مقارنة CES النشط (الذي يديره جهاز دراسة حقيقي) مقابل CES الوهمي (يديره جهاز دراسة زائف). هناك بعض الأدلة الأولية لدعم استخدام CES في علاج حالات الألم مثل فيبروميالغيا16،17. كشفت دراسة أجريت عام 2001 على 60 مشاركا تم اختيارهم عشوائيا إلى CES النشط أو الوهمي لمدة 3 أسابيع من الجلسات اليومية لمدة 60 دقيقة عن تحسن بنسبة 28٪ في درجات نقاط العطاء ، وتحسن بنسبة 27٪ في درجات الألم العامة ، وعدم وجود تأثير وهمي18. لم يتم تقييم CES في السكان المخضرمين ، ولم يتم تقييمه بشكل كاف في الذكور المصابين بالألم العضلي الليفي. خلصت مراجعة منهجية ممولة من شؤون المحاربين القدامى (VA) ل CES نشرت في عام 2018 إلى أن الأدلة غير كافية ل CES ليكون لها تأثيرات مهمة سريريا على الألم العضلي الليفي ، بالنظر إلى أن معظم التجارب كانت لها أحجام عينات صغيرة ، وفترات قصيرة ، ومخاطر عالية للتحيز بسبب عدم كفاية العمى. ومع ذلك ، تشير المراجعة إلى أن CES لا يسبب آثارا جانبية خطيرة ، وهناك أدلة منخفضة القوة تشير إلى فوائد متواضعة في المرضى الذين يعانون من القلق والاكتئاب19. لذلك ، هناك ما يبرر إجراء مزيد من الأبحاث فيما يتعلق باستخدام هذا الجهاز منخفض المخاطر الذي تم تطهيره من قبل إدارة الغذاء والدواء ، خاصة في الألم العضلي الليفي.
من أجل تقييم الفعالية بشكل كامل ، قام الباحثون بتقييم اللياقة البدنية جنبا إلى جنب مع المؤشرات الحيوية العصبية وتجربة الألم. الغرض من علاج حالات الألم المزمن هو تحسين الوظيفة البدنية. يرتبط الألم العضلي الليفي باستمرار بالآثار السلبية على كل من الوظيفة البدنية وتصور المرضى لقدراتهم البدنية20. استخدمت الدراسات السابقة تقييمات بسيطة للياقة البدنية لتحديد القدرة على التحمل والتنقل ، مثل اختبار المشي لمدة 6 دقائق (6MWT) 20,21 ، وخمس مرات من الجلوس إلى الوقوف (5TSTS) 20 ، ومقاييس مختلفة للقدرة الاستيعابية والقوة في سياق الأنشطة اليومية22. لحساب التدابير القياسية مع التخفيف أيضا من مقدار النشاط الشاق المطلوب قبل فحص التصوير بالرنين المغناطيسي مباشرة ، استخدم فريق الدراسة اختبار حامل الجلوس على الكرسي لمدة 30 ثانية كمقياس للقدرة على التحمل والتنقل وكل من تجعيد العضلة ذات الرأسين واختبار قبضة اليد كمقاييس للقوة23. الحركات المطلوبة في كل من هذه التقييمات شائعة جدا في الأنشطة اليومية ، لذلك فهي مقياس واضح لكيفية عمل الناس جسديا في حياتهم اليومية ، سواء مع العلاج أو بدونه.
حتى مع تقييمات الألم الذاتية ومقاييس الفعالية الوظيفية البدنية ، فإن آليات CES ليست مفهومة تماما. سعت دراسات التصوير العصبي السابقة إلى فهم أفضل من خلال استكشاف التأثير المباشر ل CES على اتصال الشبكة في الدماغ. وجد Feusner et al.24 أن CES مرتبط بإلغاء التنشيط القشري لتحفيز 0.5 هرتز و 100 μA لمناطق خط الوسط الأمامية والجدارية والخلفية الثنائية وافترض أن تكرار التحفيز قد يكون له تأثير أكبر من شدة التيار فيما يتعلق بإلغاء التنشيط القشري. وجدت مجموعتهم تأثيرات كبيرة على بعض وليس كل عقد شبكة الوضع الافتراضي (DMN). يقترح المؤلفون أنه بناء على هذه البيانات ، قد يؤثر CES على الاتصال الوظيفي لحالة الراحة. لقد ثبت أن الألم العضلي الليفي وحالات الألم المزمن الأخرى تؤثر على اتصال الدماغ الداخلي في المناطق المرتبطة بالألم والإدراك25,26 ، لذا فإن العلاجات التي تغير الاتصال الوظيفي في الاستجابة يمكن أن تكون مفيدة وفعالة. هناك حاجة إلى مزيد من الاستكشاف للآثار طويلة المدى للعلاج اليومي فيما يتعلق بالتحسين السريري ، وكذلك كيفية ارتباط التنشيط المتوفى في الدماغ بالانخفاضات التي لوحظت سابقا في ترددات تخطيط كهربية الدماغ ، لفهم الآلية العلاجية للعمل27.
التصوير بالرنين المغناطيسي للاتصال الوظيفي في حالة الراحة (rs-fcMRI) هو طريقة التصوير العصبي التي تسمح بمراقبة تغييرات الاتصال الوظيفية هذه. يسمح التصوير بالرنين المغناطيسي الوظيفي لحالة الراحة الطولية للأطباء والباحثين بإنشاء خط أساس لاتصال حالة الراحة وتتبع التغييرات بمرور الوقت استجابة لطرق علاج CES. كما أنه يساعد على تحديد كيفية ارتباط التغييرات في الاتصال الوظيفي بالاختلافات في تجربة الألم. استخدمت الدراسات الأولية للتصوير العصبي للفيبروميالغيا التصوير المقطعي بالإصدار البوزيتروني (PET) والتصوير المقطعي المحوسب بإصدار فوتون واحد (SPECT) لفحص الدماغ ، ولكن هناك مشكلات في كلتا التقنيتين في هذا الصدد: SPECT لديه دقة أقل من PET ، وفحوصات PET غازية ، وهو أمر غير مفضل للمرضى الذين يعانون من الألم المزمن. تتمتع فحوصات التصوير بالرنين المغناطيسي الوظيفي (fMRI) بدقة أكبر من التصوير المقطعي بالإصدار المقطعي بالإصدار المحوسب ، لكنها تفحص نشاط الدماغ استجابة لأفعال المرضى المحددة أو تصوراتهم للمنبهات28. إن فحوصات rs-fcMRI هي التي يمكن أن تحدد الاتصال الوظيفي بين مناطق الدماغ وقد تكون قادرة على تحديد مكان وكيفية وجود الألم العضلي الليفي بالإضافة إلى أفضل طرق العلاج28.
يعد تقييم فعالية العلاجات غير الدوائية لحالات الألم مثل الألم العضلي الليفي ذا أهمية قصوى في كل من الوضع الحالي لوباء المواد الأفيونية وفي فحص الألم المزمن كعامل خطر للانتحار29,30 ، والذي يزداد بشكل كبير بين السكان المخضرمين. بالإضافة إلى ذلك ، فإن عدم وجود مؤشرات حيوية سريرية كافية للألم هو فجوة معرفية معترف بها. يعد استخدام مجموعة من التدابير السلوكية والتصوير العصبي في نقاط زمنية متعددة لتقييم استجابة العلاج نهجا جديدا لتقييم الألم العضلي الليفي ، وكذلك استخدام CES الأذني كعلاج.
يهدف البروتوكول إلى معالجة الفجوة في أبحاث الألم العضلي الليفي من خلال التحقيق في آثار CES على الألم ونتائج الوظيفة البدنية وتقييم التصوير العصبي كأداة للمؤشرات الحيوية التنبؤية والاستجابة المتعلقة بالنتائج السريرية لعلاج CES31.
Protocol
أجريت الدراسة بموافقة جامعة إيموري (IRB 112768) ومجالس المراجعة المؤسسية في أتلانتا فيرجينيا (1585632-2; الرقم المرجعي الداخلي: 003) بالإضافة إلى لجنة البحث والتطوير في أتلانتا فيرجينيا (الرقم المرجعي لمجلس الإدارة: 3881). أعطى جميع الأشخاص موافقتهم المستنيرة على الإدراج قبل مشاركتهم في هذه الدراسة. للحصول على تمثيل مرئي للجدول الزمني لبروتوكول الدراسة ، انظر الشكل 1).
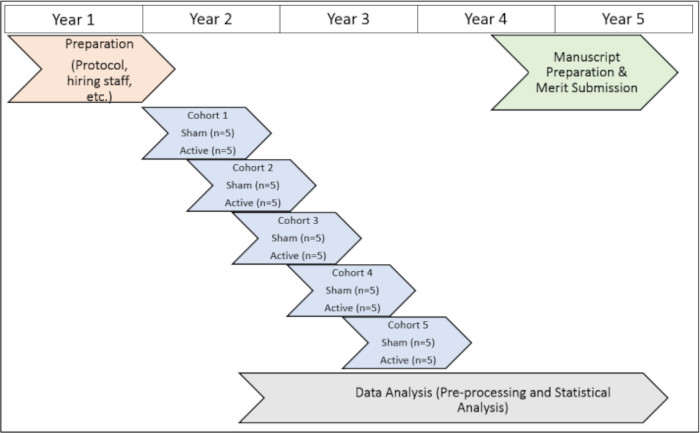
الشكل 1: الجدول الزمني للدراسة. تمثيل مرئي للجدول الزمني لتنفيذ إجراءات الدراسة خلال الفترة التجريبية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. تجنيد المشاركين عبر الطرق المتاحة
- اتبع الإرشادات المؤسسية المطلوبة لنشر مواد التوظيف الدراسية (النشرات ، المنشورات ، رسائل البريد الإلكتروني ، المكالمات ، إلخ) وطرق التوظيف المعتمدة.
ملاحظة: تم تجنيد الدراسة الحالية عبر رسائل التوظيف البريدية إلى مجموعات محددة ومكالمات هاتفية للمتابعة للمشاركين المحتملين. يتم تضمين التفاصيل المتعلقة بطلب أجهزة CES للدراسة في تعليمات طلب جهاز CES التكميلية (الملف التكميلي 1). - عندما يعبر شخص ما عن اهتمامه بالمشاركة في الدراسة ، قم بفحصه عبر الهاتف للتأكد من استيفائه لجميع معايير التضمين والاستبعاد.
- تشمل المشاركين الذين تنطبق عليهم معايير الأهلية: العمر 20-60 سنة (الحد المحدد أثناء الدراسة الأولية لتقليل التغيرات الهيكلية للدماغ بسبب الشيخوخة)31 ؛ تشخيص الألم العضلي الليفي من قبل الكلية الأمريكية لأمراض الروماتيزم 2016 المعايير32 ؛ اليد اليمنى (من أجل توفير الاتساق في بنية الدماغ ووظيفته) ؛ درجة الألم 4 أو أكثر على مقياس تصنيف آلام الدفاع والمحاربين القدامى (DVPRS) 33 في الأشهر الثلاثة السابقة للتسجيل ؛ الأدوية ذات الصلة ب FM متسقة ومستقرة لمدة 4 أسابيع على الأقل قبل التسجيل34 ؛ والقدرة على تحمل التصوير بالرنين المغناطيسي بأمان.
- بالنسبة لجزء فحص الألم العضلي الليفي ، املأ معايير تشخيص الألم العضلي الليفي السريريةالجديدة 32 مع المشارك المحتمل للحصول على درجة مؤشر الألم الواسع النطاق (WPI) ودرجة الشدة (SS). سجل وفقا للإرشادات المدرجة في أسفل الصفحة.
- بالنسبة لجزء فحص درجة الألم ، اطلب من المشاركين المحتملين تقييم متوسط الألم المتسق شفهيا على مدار الأشهر ال 3 الماضية على مقياس من صفر إلى عشرة.
- بالنسبة لجزء فحص التصوير بالرنين المغناطيسي ، أكمل نموذج فحص سلامة التصوير بالرنين المغناطيسي مع المشارك المحتمل المقدم من مؤسسة أو مرفق الماسح الضوئي نفسه.
- اسأل المشاركين عن جميع معايير الاستبعاد الممكنة. تشمل معايير الاستبعاد تاريخا من النوبات أو الحالات العصبية التي تغير الدماغ. الحمل; الخوف من الأماكن المغلقة ، أو الغرسات غير المتوافقة مع التصوير بالرنين المغناطيسي ، أو غيرها من الحالات غير المتوافقة مع التصوير بالرنين المغناطيسي ؛ وتاريخ من الأمراض النفسية غير المنضبطة أو أمراض المناعة الذاتية التي تؤدي إلى الألم ويمكن أن تفسر الأعراض بشكل أفضل31.
- إذا كان أي من معايير الاستبعاد ينطبق عليهم ، فإنهم يفشلون في الفحص. لا تقم بتضمينها في الدراسة.
- تشمل المشاركين الذين تنطبق عليهم معايير الأهلية: العمر 20-60 سنة (الحد المحدد أثناء الدراسة الأولية لتقليل التغيرات الهيكلية للدماغ بسبب الشيخوخة)31 ؛ تشخيص الألم العضلي الليفي من قبل الكلية الأمريكية لأمراض الروماتيزم 2016 المعايير32 ؛ اليد اليمنى (من أجل توفير الاتساق في بنية الدماغ ووظيفته) ؛ درجة الألم 4 أو أكثر على مقياس تصنيف آلام الدفاع والمحاربين القدامى (DVPRS) 33 في الأشهر الثلاثة السابقة للتسجيل ؛ الأدوية ذات الصلة ب FM متسقة ومستقرة لمدة 4 أسابيع على الأقل قبل التسجيل34 ؛ والقدرة على تحمل التصوير بالرنين المغناطيسي بأمان.
- عندما يجتاز شخص ما الفحص ، حدد موعدا لموعد موافقته وفحص التصوير بالرنين المغناطيسي الأساسي. الجدول الزمني 2 ساعة للموافقة ووقت المسح.
2. إدارة تعيينات الدراسة الأساسية والمتوسطة واللاحقة للمشاركين (انظر الجدول 1)
ملاحظة: تتم جميع المواعيد في موقع ماسح التصوير بالرنين المغناطيسي.
| الوقت | النشاط البحثي | |
| المرحلة 1 | الأسبوع 1 | التوظيف والفحص والتسجيل |
| المرحلة 2 | الأسبوع 2-3 | تقييمات خط الأساس ، rs-fcMRI |
| المرحلة 3 | الأسابيع 2-14 | تدخل |
| المرحلة 4 | الأسبوع 6-10 | المتابعة الحادة ، rs-fcMRI (6 أسابيع في العلاج) |
| المرحلة 5 | الأسبوع 12-16 | متابعة طويلة الأمد ، rs-fcMRI (12 أسبوعا من العلاج) |
الجدول 1: تصميم البحث. جدول زمني لمراحل المشاركة الفردية على مدار 12 أسبوعا من الدراسة.
- قبل كل زيارة أساسية ، قم بإعداد جهاز CES لإحضاره إلى كل مشارك.
- افتح العلبة للتأكد من أن الجهاز بالداخل (يجب أن يكون في غلاف فقاعي). قم بإزالة الجزء الخلفي من الجهاز وأدخل بطاريتين AAA.
- استبدل الجهاز مرة أخرى. قم بتشغيل الجهاز للتأكد من أنه يعمل قبل إحضاره إلى المشارك. اضغط مع الاستمرار على الزر العلوي لمدة 2 ثانية تقريبا حتى تضيء الشاشة لتشغيلها ، واستمر في الضغط عليه لمدة 2 ثانية تقريبا حتى تصبح الشاشة فارغة لإيقاف تشغيلها.
- تأكد من أن كل علبة تحتوي على الجهاز وبطاريات إضافية وحبل وقضيب محلول صغير ومشابك أذن. تأكد من أن الحقيبة التي يجب إعطاؤها للمشاركين تحتوي على علبة الجهاز ، وزجاجة من محلول التوصيل ، وغطاء إضافي لملء قضيب المحلول الصغير ، ووسادات قطب كهربائي إضافية لمشبك الأذن.
- بمجرد تحديد موعد موافقتهم وفحص التصوير بالرنين المغناطيسي الأساسي ، قابل المشارك في موقع ماسح التصوير بالرنين المغناطيسي للموعد مع نسختين من نموذج الموافقة ، وجهاز CES ومواده ، وأوراق اختبار الأهلية ، وحزمة استبيان لإكمالها. بالإضافة إلى ذلك ، أحضر جهاز نقل البيانات الذي سيتم من خلاله نقل بيانات التصوير بالرنين المغناطيسي إلى موقع التحليل.
ملاحظة: استخدمت هذه الدراسة محرك أقراص USB مشفر.- بالنسبة لأوراق الأهلية ، قم بتضمين معايير تشخيص الألم العضلي الليفي السريرية الجديدة32 و DVPRS33.
ملاحظة: يجب تضمين DVPRS لكل زيارة. - بالنسبة لاختبارات الوظائف البدنية ، قم بتضمين نموذج لتسجيل نتائج كل اختبار20،21،35.
- بالنسبة للاستبيانات التي سيملأها المشاركون ، قم بتضمين مقاييس PROMIS المناسبة (مقياس PROMIS v1.2 - الصحة العالمية ، بنك عناصر جودة الحياة العصبية v2.0 - وظيفة الإدراك - نموذج قصير ، بنك عناصر PROMIS v1.0 - تعاطي المخدرات / الكحول: تعاطي الكحول ، بنك العناصر PROMIS v1.0 - الضائقة العاطفية - القلق - نموذج قصير 7 أ ، بنك عناصر PROMIS v1.0 - الضائقة العاطفية - الاكتئاب - النموذج القصير 4 أ ، بنك العناصر PROMIS الإصدار 1.0 - التعب - النموذج القصير 6 أ ، بنك العناصر PROMIS v1.0 - تدخل الألم - نموذج قصير 4 أ ، بنك عناصر PROMIS v1.2 - الوظيفة البدنية - نموذج قصير 8 ب ، بنك عناصر PROMIS v2.0 - العزلة الاجتماعية - نموذج قصير 4 أ) 36.
- بالنسبة لأوراق الأهلية ، قم بتضمين معايير تشخيص الألم العضلي الليفي السريرية الجديدة32 و DVPRS33.
- في موقع التصوير بالرنين المغناطيسي ، قم بإدارة الزيارة الأساسية. اتصل بالمشارك في وقت مبكر للتأكيد.
- اقرأ نموذج الموافقة الكامل مع المشارك للتأكد من فهمه للمعلومات. اسألهم عما إذا كانوا يرغبون في المشاركة ، وإذا وافقوا ، اطلب منهم طباعة أسمائهم وتوقيعهم وتأريخ النموذج.
- بعد الموافقة ، إذا اختار المشارك المشاركة في الدراسة ، أكمل أوراق اختبار التضمين معهم. إذا كانوا مؤهلين للمتابعة ، فأكمل الخطوات أدناه ؛ إذا كانوا غير مؤهلين ، فقم بإنهاء مشاركتهم في الدراسة في هذه المرحلة.
- تأكد من أن أوراق اختبار الأهلية تتضمن معايير تشخيص الألم العضلي الليفي السريرية الجديدة و DVPRS.
- إذا كان المشارك مؤهلا بعد اختبار التضمين ، اشرح للمشارك كيفية استخدام جهاز CES.
- قم بإزالة الجهاز من العلبة وأظهر للمشاركين كيفية تشغيله وإيقاف تشغيله باستخدام الزر الموجود في الأعلى. ذكر المشاركين بأن الجهاز سيتم إلغاء تنشيطه تلقائيا بعد انقضاء 60 دقيقة.
- وضح للمشاركين كيفية توصيل سلك مشبك الأذن بالجانب. يتم توصيل الطرف المقابل للسلك من المشابك بفتحة صغيرة على الجانب الأيسر من الجهاز المسمى ب "1".
- شرح كيفية إزالة وسادات القطب القديمة من مشابك الأذن وإرفاق أخرى جديدة. لإزالة الوسادات القديمة ، اسحب المادة اللاصقة من حيث تتصل بالمشابك. لإرفاق وسادات جديدة ، قم بمحاذاة الفتحة الموجودة في وسادات الأقطاب الكهربائية الاحتياطية مع المنطقة المرتفعة في وسط المشبك واضغط لأسفل بإحكام.
ملاحظة: لا تسحب وسادات الأقطاب الكهربائية من الجزء الناعم الموجود في الأعلى. إنه عرضة للتمزق وسيترك المادة اللاصقة عالقة في المشابك. - شرح كيفية قص مشابك الأذن إلى شحمة الأذن واطلب منهم تجربتها مرة واحدة. اضغط على الأطراف الخضراء للمشبك لفتحه ، وضع شحمة الأذن بينهما ، وأغلق المشبك برفق لتثبيته.
- وضح لهم كيفية إزالة الجزء العلوي البلاستيكي من قضيب المحلول الصغير وتعبئته بالمحلول من الزجاجة الأكبر (انظر الخطوات 2.3.3.6-2.3.3.8). ذكرهم بأن الحل ضروري لكي يعمل الجهاز بشكل صحيح.
- لإزالة الجزء العلوي من قضيب المحلول الصغير ، قم بإزالة الغطاء واضغط بقوة على جانب الحافة. سوف يزيح الطرف البلاستيكي من بقية الزجاجة.
- قم بتوصيل الغطاء البديل لملء القضيب الصغير بأعلى زجاجة المحلول الأكبر. ادفع الفوهة الصغيرة لأعلى ، وحركها في القضيب الصغير ، واضغط على الزجاجة الكبيرة لملئها.
- أخبر المشاركين أنه يجب عليهم فقط إضافة حوالي 1-2 قطرات من المحلول إلى كل وسادة قطب كهربائي لمشبك الأذن. يجب إزالة أي محلول زائد قبل الاستخدام.
- اطلب من المشاركين استخدام الجهاز كل يوم من أيام الأسبوع لمدة 60 دقيقة في المساء ، حوالي 1 ساعة قبل الذهاب إلى السرير. اطلب من المشاركين استخدام الجهاز أثناء الراحة (أي الجلوس أو الاستلقاء ، وعدم الحركة).
ملاحظة: لكل من الوقت والمنصب ، سمح للمشاركين بالاختلافات الطبيعية في بيئة الاستخدام المنزلية لزيادة الطبيعة العملية لهذا العلاج للاستخدام المنزلي. لم يتم تعيين أي معلمات للصوت المسموح به في البيئة أو تخزين الجهاز المطلوب. - امنح المشاركين سجلا فارغا للجهاز واشرح لهم أنهم بحاجة إلى إدخال كل تاريخ لاستخدام الجهاز ، ودرجة الألم قبل وبعد استخدام الجهاز ، ووقت استخدام الجهاز.
- إذا لم يتمكن المشاركون من استخدام أجهزتهم لفترة من الوقت خلال 6 أسابيع بين المواعيد ولكنهم قادرون على تحديد مواعيد المتابعة ، فدعهم يظلون في الدراسة. إذا لم يتمكنوا من استخدام الجهاز أو الوصول إلى الزيارات الدراسية ، فقم بإنهاء مشاركتهم. انظر سجل جهاز CES التكميلي (الملف التكميلي 2) لسجل الجهاز الذي استخدمته هذه الدراسة.
ملاحظة: سيتم تكرار الخطوات التالية خلال الزيارات الثلاث.
- بعد شرح الجهاز ، اطلب من المشارك إكمال ثلاثة اختبارات قصيرة للوظائف البدنية23. لكل اختبار ، سيتم تسجيل الحد الأقصى لعدد النقاط (إجمالي التكرار لأول اثنين والقوة لكل تجربة للاختبار الثالث).
ملاحظة: كانت ساعة الإيقاف المستخدمة في هذه الدراسة هي Apple iPhone 12.- إدارة 30 ثانية كرسي الجلوس الوقوف الاختبار. اتبع الخطوات 2.3.4.2 إلى 2.3.4.6.
- ضع كرسيا وظهره على جدار غرفة الاختبار. اجعل المشارك يجلس على الكرسي وظهره على ظهر الكرسي.
- اطلب من المشارك أن يرتفع إلى وضع الوقوف الكامل ثم يجلس على طول الطريق مع ظهره على ظهر الكرسي عدة مرات قدر الإمكان في 30 ثانية.
ملاحظة: إذا نقروا على الكرسي ولكنهم لم يضعوا وزنهم بالكامل عليه في وضع الجلوس ، فلن يتم احتساب التكرار. - أخبر المشاركين متى يبدأون. ابدأ المؤقت عندما يبدأون في التحرك.
- اطلب من المشاركين القيام بتجعيد الذراع باستخدام الدمبل على كل جانب لمدة 30 ثانية لكل جانب. ابدأ بالذراع اليمنى أولا ثم انتقل إلى اليسار.
- سجل العدد الإجمالي لتجعيد الشعر لكل جانب. استخدم وزن 5 أرطال للنساء ووزن 8 أرطال للرجال. تأكد من جلوس المشاركين لاختبار تجعيد الذراع.
- اطلب من المشاركين إجراء ثلاث تجارب لقوة القبضة مع كل ذراع على مقياس دينامومتر. اتبع الخطوات 2.3.4.8-2.3.4.11. ابدأ بالذراع اليمنى أولا ثم انتقل إلى اليسار.
- ضع مقياس القوة في يد المشارك. يجب أن يضغطوا على القبضة في الأسفل ولا يلمسوا الاتصال الهاتفي في الأعلى.
- اطلب من المشاركين الضغط على مقياس القوة بأقصى ما يستطيعون ثم تحريره. ستتوقف الإبرة الموجودة على القرص عند أعلى مستوى من قوة القبضة التي عرضتها.
- سجل نتائج قوة قبضتهم عن طريق كتابة الرقم الذي تصل إليه الإبرة على الميناء. أعد ضبط القرص بين التكرارات عن طريق لف المقبض الصغير الموجود في مقدمة وجه القرص عكس اتجاه عقارب الساعة حتى تستقر الإبرة عند الصفر.
- تأكد من جلوس المشاركين لاختبار قبضة اليد.
ملاحظة: بين كل سلسلة ، يتلقى المشاركون حوالي 15-20 ثانية من الراحة أثناء نقلهم للمعدات إلى يدهم الأخرى. بين كل اختبار ، سيحصل المشاركون على حوالي 2 دقيقة من الراحة بينما يتم إعداد المعدات والأوراق للاختبار التالي.
- بعد اختبارات الوظائف البدنية ، اطلب من المشاركين إكمال حزمة الاستبيان بقلم. تحقق من الحزمة بعد ذلك للتأكد من أنهم أجابوا على جميع الأسئلة.
- بعد الانتهاء من جميع المراجعات والاختبارات والاستبيانات ، قم بتوجيه المشاركين إلى ماسح التصوير بالرنين المغناطيسي نفسه (للحصول على جميع معلومات بروتوكول التصوير بالرنين المغناطيسي ، انظر القسم 3). راجع نموذج الفحص مع فنيي التصوير بالرنين المغناطيسي وتأكد من أن المشاركين قد أزالوا جميع المعادن من شخصهم.
- تأكد من أن أعضاء فريق الدراسة ليس لديهم معدن على أشخاصهم.
- ساعد فنيي التصوير بالرنين المغناطيسي في إدخال المشاركين إلى الماسح الضوئي بشكل مريح. إدارة بروتوكول التصوير بالرنين المغناطيسي.
- إرشاد المشاركين حول إجراءات السلامة (اختبار زر الاتصال ومكبرات الصوت).
- ذكر المشاركين بعدم التحرك على الإطلاق أثناء الفحص.
- ذكر المشاركين بالمدة الإجمالية للفحص ، والتي يجب أن تكون 60 دقيقة.
- عند اكتمال الفحص ، ساعد المشاركين على الخروج من الماسح الضوئي.
- بعد الفحص ، قم بإنهاء الزيارة الأساسية للمشاركين وحدد موعدا لمنتصف زيارتهم لمدة 6 أسابيع بعد ذلك. سيحصل المشاركون على ثلاث زيارات دراسية إجمالا ، كل منها يفصل بينها 6 أسابيع. دفع بيانات التصوير بالرنين المغناطيسي إلى خوادم الدراسة الآمنة لتحليلها.
- في اليوم المحدد ، قم بإدارة منتصف الزيارة باتباع خطوات الزيارة الأساسية. اتصل بالمشارك في وقت مبكر للتأكيد.
- إدارة DVPRS. اطلب من المشاركين إرجاع سجل الجهاز المكتمل الأول وتزويدهم بسجل جهاز ثان.
- نفذ الخطوات من 2.3.4 إلى 2.3.6 (كما في زيارة خط الأساس).
- قم بإنهاء منتصف زيارة المشاركين وحدد موعدا لما بعد الزيارة لمدة 6 أسابيع بعد ذلك. دفع بيانات التصوير بالرنين المغناطيسي إلى خوادم الدراسة الآمنة لتحليلها.
- في اليوم المحدد ، قم بإدارة ما بعد الزيارة باتباع خطوات منتصف الزيارة. اتصل بالمشارك في وقت مبكر للتأكيد.
- إدارة DVPRS. اطلب من المشاركين إرجاع سجل الجهاز المكتمل الثاني.
- نفذ الخطوات من 2-3-4 إلى 2-3-6 (كما هو الحال في خط الأساس ومنتصف الزيارات). ليست هناك حاجة إلى جدولة زيارة إضافية للزيارة الأخيرة.
- إذا كانت هناك حاجة إلى أي معلومات لتعويض المشاركين ، فقم بإعداد وطلب تلك المعلومات في هذه الزيارة.
ملاحظة: طلبت هذه الدراسة اسمهم وعنوانهم لإصدار شيكات من أتلانتا فيرجينيا للحصول على تعويض. - إنهاء ما بعد زيارة المشاركين. دفع بيانات التصوير بالرنين المغناطيسي إلى خوادم الدراسة الآمنة لتحليلها.
ملاحظة: طوال فترة الدراسة ، تأكد من الاتصال وتسجيل الوصول مع المشاركين بين الزيارات للتأكد من أنهم يستخدمون الجهاز ، واستكمال سجلات الجهاز ، ومعرفة موعد زيارتهم التالية.
3. إعداد بروتوكولات فحص التصوير بالرنين المغناطيسي
- بالنسبة لبروتوكول فحص التصوير بالرنين المغناطيسي ، احصل على BOLD rs-fMRI على ماسح التصوير بالرنين المغناطيسي 3T مع ملف رأس صفيف مرحلي مكون من 32 قناة باستخدام تسلسل التصوير بالصدى المستوي المتدرج (EPI). استخدم معلمات MR التالية: مجال الرؤية (مجال الرؤية) = 220 مم2 ؛ TR (وقت التكرار) / TE (وقت الصدى) = 1500/25 مللي ثانية ، عامل تسارع متعدد النطاقات = 3 ؛ زاوية الوجه = 50 درجة ؛ حجم مصفوفة 110 × 110 ؛ سمك الشريحة = 2 مم ؛ عامل غرابا = 2 ؛ فورييه جزئي من 6/8 ؛ 34 خطا مرجعيا لتشفير الطور ، و 72 شريحة محورية متشابكة تغطي الدماغ بأكمله ، وما يقرب من 350 وحدة مسح ضوئي لإنتاج 8 دقائق من بيانات التصوير بالرنين المغناطيسي الوظيفي في حالة الراحة لتقدير مستقر لشبكات الاتصال.
- في بروتوكول المغنطة التشريحية T1w أعدت صدى التدرج السريع (MPRAGE) ، تعيين TR = 2530 مللي ثانية ، TE = 3 مللي ثانية ، زاوية الوجه = 7 درجة ، سمك الشريحة = 0.8 مم ، دقة الطور 1 مم. يستغرق الاستحواذ على T1w حوالي 6 دقائق.
- احصل على عمليات مسح التصوير المرجح بالانتشار (DWI) على ماسح التصوير بالرنين المغناطيسي 3T مع ملف رأس صفيف مرحلي مكون من 32 قناة باستخدام مخطط تصوير طيف الانتشار. اجمع ما مجموعه 129 اتجاها لأخذ عينات الانتشار بحد أقصى لقيمة b تبلغ 3000 ثانية / مم2 ، ودقة داخل المستوى تبلغ 2 × 2 مم2 ، وسمك شريحة يبلغ 2 مم.
- الحصول على البيانات الفسيولوجية (البيانات القلبية التنفسية باستخدام حزام مراقبة الجهاز التنفسي وقياس التأكسج النبضي) في وقت واحد (مغلق زمنيا) لبيانات التصوير بالرنين المغناطيسي الوظيفي.
- انقل بيانات التصوير بالرنين المغناطيسي بأمان من موقع الماسح الضوئي إلى موقع آمن للمعالجة المسبقة والتحليل. قم بتحويل DICOMS إلى NIFTIs للتوافق مع تنسيق BIDS باستخدام dc2bids v2.1.6.
- امسح بيانات المعرفات الفردية. استخدم رقم موضوع الدراسة على جميع البيانات حيثما ينطبق ذلك. قم بإجراء فحص الجودة لضمان عدم حدوث أي آثار شاذة ، مثل الحركة المفرطة ، في البيانات عبر MRIQC v21.0.0.
4. المعالجة المسبقة والتحليلات
- بمجرد استلام بيانات التصوير بالرنين المغناطيسي من الدراسة ، استخدم خطي أنابيب منفصلين لتحليلها: أحدهما لتحليل الاتصال الوظيفي بين المشاركين والآخر لتحليل مسار المادة البيضاء.
- بيانات T1w و rsfMRI الهيكلية لموضوعات المعالجة المسبقة عبر fMRIPrep v20.2.5 ، بما في ذلك استخراج الدماغ وتجزئة الأنسجة وتطبيع الصور المرجحة T1 (T1w) بالإضافة إلى تقدير الحجم المرجعي وتقدير حركة الرأس وتصحيح توقيت الشريحة والتسجيل في T1w للصور الوظيفية. ينتج عن هذه العملية تطبيع بيانات T1w و rsfMRI في مساحة MNI152NLin2009cAsym.
- استخدم بيانات التصوير بالرنين المغناطيسي المعالجة مسبقا في تحليل الاتصال الوظيفي (CONN).
- انظر الوثيقة المعيارية التكميلية fMRIPrep (الملف التكميلي 337-56). لمزيد من التفاصيل ، راجع الرابط: https://fmriprep.org/en/stable/
- قم باستيراد مجموعة البيانات المعالجة مسبقا إلى CONN Toolbox v22a لمزيد من المعالجة.
ملاحظة: تم تحديث CONN Toolbox من v21a إلى v22a خلال هذه الدراسة.- في مرحلة الإعداد ، قم بإنشاء متغيراتمشتركة من المستوى الثاني لتحديد مجموعات الدراسة (TRUE مقابل SHAM) للتحليل لاحقا وضمان جودة صور T1w و rsfMRI. بيانات الرنين المغناطيسي الوظيفي السلسة عبر نواة غاوسية 8 مم.
- بعد المعالجة المسبقة ، قم بإزالة الضوضاء من البيانات لإزالة الضوضاء الدخيلة والفسيولوجية.
ملاحظة: حسبت هذه الدراسة تحليل المستوى الأول ولكنها لم تقيمه أو تستخدمه لأن الباحثين غير مهتمين بنتائج موضوع واحد. - اختر البذور / عائد الاستثمار والمتغيرات المشتركة للموضوع واضبط التباين. قم بإجراء تحليل البذور إلى الفوكسل على مستوى المجموعة.
- بمجرد اكتمال خطوات الإعداد والمعالجة المسبقة وتقليل الضوضاء لخطوط الأنابيب، قم بتعيين عتبات الكتلة والفوكسل لعرض أنماط الاتصال.
- انظر الشكل التكميلي 1 ووثيقة تعليمات CES CONN التكميلية (الملف التكميلي 4).
- استخدم التصوير الارتباطي57 لتحديد التغيرات الطولية في سلامة المادة البيضاء المرتبطة بمجموعة التجربة لتحديد حزم المسالك والمناطق المرتبطة بمعالجة CES. فيما يلي خطوات التحليل الرئيسية:
- قم بتحويل صور DWI الخام من تنسيق .dcm (DICOM) إلى تنسيق .nii.gz (NIfTI).
- قم بمعالجة الصور مسبقا لتصحيح التشوهات التي يسببها القابلية للتأثر باستخدام FSL (الإصدار 6.0.6) TOPUP58,59 ولتشوهات التيار الدوامي باستخدام أداة EDDY60 الخاصة ب FSL.
- قم بإنشاء مقاييس DWI لمراقبة جودة الصورة (QC) المتعلقة بالحركة في موضوع واحد ومستويات الدراسة باستخدام أدوات EDDY QC الخاصة ب FSL.
- قم بتشغيل مقاييس ANOVA متكررة ثنائية الاتجاه على مقاييس مراقبة الجودة هذه لتحديد أي تباين بين المجموعة قد يربك نتائج سحب المجموعة. إذا أظهر المقياس تباينا بين المجموعات معنويا (p > 0.05) ، فيجب حسابه كمتغير مشترك في تحليل الجروغرافيا الارتباطية.
- قم باستيراد البيانات المعالجة مسبقا إلى DSI Studio (الإصدار "Chen" 21 نوفمبر 2022) حيث يتم تحويلها إلى ملفات .src (مصدر). لمزيد من المعلومات حول DSI Studio، راجع موقع البرنامج على الويب (https://dsi-studio.labsolver.org).
- أعد بناء بيانات الانتشار المستوردة باستخدام Q-Space Diffeomorphic Reconstruction (QSDR)61 لتحديد اتجاهات ألياف المادة البيضاء في مساحة قالب MNI. يتم إخراج ملف .fib (اتجاه الألياف) لكل صورة. اختيارات الخيارات لإعادة الإعمار هي:
طريقة (اختيار طريقة إعادة الإعمار) - QSDR
param0 (طول أخذ عينات الانتشار) - 1.25 (هذا هو الافتراضي)
القالب (أي مساحة قالب لإعادة بناء البيانات إليها) - ICBM152
align_acpc (سواء لتدوير حجم الصورة لمحاذاة AC-PC) - 0 (خطأ) - إنشاء قاعدة بيانات قياس الاتصال من ملفات .fib هذه، التي تستخرج قيم تباين الخواص الكمية (QA) من بيانات الانتشار المعاد بناؤها. احسب التغير الطولي في ضمان الجودة لكل موضوع في قاعدة البيانات. أضف التركيبة السكانية مثل مجموعة التجربة والعمر والجنس إلى جانب أي متغيرات مشتركة محددة في خطوة مراقبة الجودة عبر ملف .csv إلى قاعدة البيانات.
- بعد ذلك، قم بتحميل قاعدة بيانات قياس الاتصال في واجهة المستخدم الرسومية لتحليل قياس الشبكة الاتصالية للمجموعة.
- حدد المتغيرات المشتركة ليتم أخذها في الاعتبار في التحليل. تم تعيين أحد هذه المتغيرات المشتركة المختارة كمتغير الدراسة.
- لهذا التحليل، حدد تجميع كمتغير الدراسة. سيتم تحديد المساحات ذات التغيرات الطولية في ضمان الجودة المرتبطة بالمجموعة بينما سيتم التراجع عن تأثير المتغيرات المشتركة الأخرى المختارة.
- اختيارات الخيارات لتحليل قياس الشبكة العصبية للمجموعة هي:
- FDR Control (قطع معدل الاكتشاف الكاذب ، سيتم إخراج المساحات ذات الارتباط الكبير أدناه FDR فقط) - 0.05
- عتبة الطول (القيمة في voxels من الحد الأدنى لطول المسالك المستخدمة كفرضية فارغة) - 20 voxels (أو 40 مم لأحجام voxel 2 مم)
- عتبة T (عتبة قياس t-stat لتأثير الارتباط) - 2.5
- منطقة الدراسة (يسمح هذا الجزء بتضمين / استبعاد المناطق من التحليل) - حدد الدماغ كله مع - استبعاد فحص المخيخ
ملاحظة: بالنسبة لهذه الدراسة ، تم استبعاد المخيخ بسبب بعض فحوصات الانتشار التي تحتوي على أجزاء من المخيخ مقطوعة أثناء الاستحواذ.
- اضغط على زر تشغيل قياس الاتصال لإجراء التحليل، الذي ينتج عدة ملفات:
- ملف .fib يخزن إحصائيات t ويمكن فتحه في استوديو DSI لتصور إحصائيات t للمساحات مع زيادة ضمان الجودة (المخزنة ك "inc_t") أو تقليل ضمان الجودة (المخزنة ك "dec_t") ، والتي ترتبط بالمجموعة.
- .fdr_dist.values.txt ، الذي يسرد قيم FDR فيما يتعلق بطول المسالك
- .inc.tt.gz وهو ملف tractography يخزن المساحات مع زيادة ضمان الجودة الطولية المرتبطة بمتغير الدراسة. (المجموعة في حالتنا). يخزن ملف .dec.tt.gz المسالك مع انخفاض ضمان الجودة الطولي المرتبط بمتغير الدراسة.
- ملف .report.html الذي يبلغ بشكل ملائم عن نتائج قياس الشبكة جنبا إلى جنب مع مخططات المسالك المضمنة والصور ، بالإضافة إلى المعلومات المعيارية حول خطوات تحليل الجروغرافيا الارتباطية للنشر.
ملاحظة: للاطلاع على أمثلة على رمز R المستخدم في هذه الدراسة ، راجع مخططات رمز CES R التكميلية (الملف التكميلي 5) وملفات R Code CES eddy-qc Anova التكميلية (الملف التكميلي 6).
النتائج
فيما يتعلق بنتائج التوظيف ، تم تجنيد المشاركين في المقام الأول عبر إرسال رسائل التوظيف بالبريد ومكالمات هاتفية للمتابعة بناء على اللوائح المحددة لنظام الرعاية الصحية في أتلانتا فيرجينيا. قام فريق الدراسة بتجنيد ما مجموعه 50 مشاركا ، مما يثبت فعالية الأساليب المستخدمة ف?...
Discussion
لا توفر طرق الدراسة الحالية إمكانية وجود طريقة علاج فعالة للغاية للفيبروميالغيا فحسب ، بل توفر أيضا فرصة لتحسين عملية تشخيص الألم العضلي الليفي من الحالة الأولى لملف أعراض الألم. استخدام كل من CES النشط و sham CES ، مع اكتشاف نوع كل جهاز فردي يعتمد على الأرقام التسلسلية ومفتاح منفصل ، سمح بتعمي...
Disclosures
يعلن المؤلفون أنه ليس لديهم مصالح مالية متنافسة معروفة أو علاقات شخصية يمكن أن يبدو أنها تؤثر على العمل المذكور في هذه الورقة. الآراء الواردة في هذا المقال هي آراء المؤلفين ولا تعكس بالضرورة موقف أو سياسة وزارة شؤون المحاربين القدامى أو حكومة الولايات المتحدة.
Acknowledgements
يود المؤلفون أن يشكروا دعم الباحثين في مركز إعادة التأهيل البصري والمعرفي العصبي ، بما في ذلك الدكتور بروس كروسون والدكتورة ليزا كريشنامورثي ، لمساهمتهم في العمل. يشكر المؤلفون أيضا غريس إنغهام على مساعدتها التي لا تقدر بثمن في عملية التصوير. تم دعم هذا العمل جزئيا من قبل جائزة التطوير الوظيفي لخدمة البحث والتطوير في مجال إعادة التأهيل التابعة لوزارة شؤون المحاربين القدامى الأمريكية IK2 RX003227 (آنا وودبري) ومركز المنحة 5I50RX002358. ليس للممول أي دور في تصميم الدراسة أو جمع البيانات أو إدارتها أو تحليلها أو تفسيرها أو إعداد التقارير.
Materials
| Name | Company | Catalog Number | Comments |
| 3T Siemens MAGNETOM Prisma Scanner | Siemens Healthineers | N/A | From Emory's website: "The Siemens Magnetom Prisma 3T whole-body MR system is equipped with: a state-of-the art gradient system with a maximum (per axis) strength of 80 mT/m and slew rate of 200 T/m/sec 64 independent RF receiver channels capable of 204 receiver connections a 2-channel RF transmitter. Multiple coils are available, including: a 64-channel head/neck coil with 52 channels for imaging of the head region a 32-channel head-only coil a 20-channel head/neck coil with 16 channels for head spine array coil flexible chest coil large and small flexible coil for extremity imaging. |
| Alpha-Stim AID Kit | Electromedical Products International Inc. | SKU: 500KIT | A total of 50 devices ordered for research purposes. From the site: "A prescription or order from a licensed healthcare professional is required to purchase this device (within the USA). FDA cleared for anxiety, insomnia and pain only, with approval for depression outside of the United States." |
| CONN Toolbox v21a16 (RRID:SCR_009550) | Whitfield-Gabrieli and Nieto-Castanon | Version v21a16 (RRID:SCR_009550) | CONN is an open-source SPM-based cross-platform software for the computation, display, and analysis of functional connectivity Magnetic Resonance Imaging (fcMRI). CONN is used to analyze resting state data (rsfMRI) as well as task-related designs. |
| DSI Studio (RRID:SCR_009557) | Fang-Cheng (Frank) Yeh | RRID:SCR_009557 | DSI Studio is a tractography software tool that maps brain connections and correlates findings with neuropsychological disorders. It is a collective implementation of several diffusion MRI methods, including diffusion tensor imaging (DTI), generalized q-sampling imaging (GQI), q-space diffeomorphic reconstruction (QSDR), diffusion MRI connectometry, and generalized deterministic fiber tracking. |
| fMRIPrep 20.2.5 (RRID:SCR_016216) | NiPreps (NeuroImaging PREProcessing tools) | Version 20.2.5. (RRID:SCR_016216) | A functional magnetic resonance imaging (fMRI) data preprocessing pipeline that is designed to provide an easily accessible, state-of-the-art interface that is robust to variations in scan acquisition protocols and that requires minimal user input, while providing easily interpretable and comprehensive error and output reporting. It performs basic processing steps (coregistration, normalization, unwarping, noise component extraction, segmentation, skull-stripping, etc.) providing outputs that can be easily submitted to a variety of group level analyses, including task-based or resting-state fMRI, graph theory measures, and surface or volume-based statistics. |
| MRIQC | NiPreps (NeuroImaging PREProcessing tools) | MRIQC extracts no-reference IQMs (image quality metrics) from structural (T1w and T2w) and functional MRI (magnetic resonance imaging) data. (not directly used for analyses) | |
| Sammons Preston Jamar Hydraulic Hand Dynamometer | Alpha Med Inc. | SKU SAMP5030J1 | From the website: Ideal for routine screening of grip strength and initial and ongoing evaluation of clients with hand trauma and dysfunction. Unit comes with carrying/storage case, certificate of calibration and complete instructions. Warranted for one full year. The warranty does not cover calibration. Latex free. |
| SPRI 5-Pound Vinyl-Coated Weight | SPRI | Amazon | N/A | Color: (E) Dark Blue | 5-Pound. Appears on Amazon: Dumbbells Hand Weights Set of 2 - Vinyl Coated Exercise & Fitness Dumbbell for Home Gym Equipment Workouts Strength Training Free Weights for Women, Men (1-10 Pound, 12, 15, 18, 20 lb), https://www.amazon.com/stores/SPRI/Weights/page/9D10835A-CFAB-4DA1-BEE9-AE993C6B5BC1 |
| SPRI 8-Pound Vinyl-Coated Weight | SPRI | Amazon | N/A | Color: (H) Black |8-Pound. Appears on Amazon: Dumbbells Hand Weights Set of 2 - Vinyl Coated Exercise & Fitness Dumbbell for Home Gym Equipment Workouts Strength Training Free Weights for Women, Men (1-10 Pound, 12, 15, 18, 20 lb), https://www.amazon.com/stores/SPRI/Weights/page/9D10835A-CFAB-4DA1-BEE9-AE993C6B5BC1 |
References
- Heidari, F., Afshari, M., Moosazadeh, M. Prevalence of fibromyalgia in general population and patients, a systematic review and meta-analysis. Rheumatology International. 37 (9), 1527-1539 (2017).
- Dennis, N. L., Larkin, M., Derbyshire, S. W. G. 'A giant mess' - making sense of complexity in the accounts of people with fibromyalgia. British Journal of Health Psychology. 18 (4), 763-781 (2013).
- Woodbury, A. Opioids for nonmalignant chronic pain. AMA Journal of Ethics. 17 (3), 202-208 (2015).
- Hedegaard, H., Minino, A. M., Spencer, M. R., Warner, M. Drug overdose deaths in the United States, 1999-2020. NCHS Data Brief. 428, 1-8 (2021).
- . Report No.: 17-01846-316. Opioid prescribing to high-risk veterans receiving VA purchased care. Office of Healthcare Inspections. , (2017).
- Perry, R., Leach, V., Davies, P., Penfold, C., Ness, A., Churchill, R. An overview of systematic reviews of complementary and alternative therapies for fibromyalgia using both AMSTAR and ROBIS as quality assessment tools. Systematic Reviews. 6 (1), 97 (2017).
- Martinez-Lavin, M., Hermosillo, A. G. Dysautonomia in Gulf War syndrome and in fibromyalgia. The American Journal of Medicine. 118 (4), 446 (2005).
- Petersel, D. L., Dror, V., Cheung, R. Central amplification and fibromyalgia: disorder of pain processing. Journal of Neuroscience Research. 89 (1), 29-34 (2011).
- Marlow, N. M., Bonilha, H. S., Short, E. B. Efficacy of transcranial direct current stimulation and repetitive transcranial magnetic stimulation for treating fibromyalgia syndrome: A systematic review. Pain Practice. 13 (2), 131-145 (2013).
- Molero-Chamizo, A., et al. Noninvasive transcutaneous vagus nerve stimulation for the treatment of fibromyalgia symptoms: A study protocol. Brain sciences. 12 (1), 95 (2022).
- Cimpianu, C. L., et al. Vagus nerve stimulation in psychiatry: A systematic review of the available evidence. Journal of Neural Transmission. 124 (1), 145-158 (2017).
- Napadow, V., et al. Evoked pain analgesia in chronic pelvic pain patients using respiratory-gated auricular vagal afferent nerve stimulation. Pain Medicine (Malden, Mass). 13 (6), 777-789 (2012).
- Zhang, Y., et al. Transcutaneous auricular vagus nerve stimulation (taVNS) for migraine: an fMRI study. Regional Anesthesia and Pain. 46 (2), 145-150 (2021).
- Tassorelli, C., et al. Noninvasive vagus nerve stimulation as acute therapy for migraine: The randomized PRESTO study. Neurology. 91 (4), e364-e373 (2018).
- . NBC4 Washington - Electrotherapy Device Treats Anxiety, Insomnia, Depression. Alpha-Stim. , (2021).
- Taylor, A. G., Anderson, J. G., Riedel, S. L., Lewis, J. E., Bourguignon, C. A randomized, controlled, double-blind pilot study of the effects of cranial electrical stimulation on activity in brain pain processing regions in individuals with fibromyalgia. Explore (NY). 9 (1), 32-40 (2013).
- Taylor, A. G., Anderson, J. G., Riedel, S. L., Lewis, J. E., Kinser, P. A., Bourguignon, C. Cranial electrical stimulation improves symptoms and functional status in individuals with fibromyalgia. Pain Management Nursing. 14 (4), 327-335 (2013).
- Lichtbroun, A. S., Raicer, M. M., Smith, R. B. The treatment of fibromyalgia with cranial electrotherapy stimulation. Journal of Clinical Rheumatology. 7 (2), 72-78 (2001).
- Shekelle, P. G., Cook, I. A., Miake-Lye, I. M., Booth, M. S., Beroes, J. M., Mak, S. Benefits and harms of cranial electrical stimulation for chronic painful conditions, depression, anxiety, and insomnia: A systematic review. Annals of Internal Medicine. 168 (6), 414-421 (2018).
- Dailey, D. L., et al. Perceived function and physical performance are associated with pain and fatigue in women with fibromyalgia. Arthritis Research & Therapy. 18, 68 (2016).
- Gowans, S. E., deHueck, A., Voss, S., Silaj, A., Abbey, S. E., Reynolds, W. J. Effect of a randomized, controlled trial of exercise on mood and physical function in individuals with fibromyalgia. Arthritis & Rheumatism. 45 (6), 519-529 (2001).
- Jones, J., Rutledge, D. N., Jones, K. D., Matallana, L., Rooks, D. S. Self-Assessed physical function levels of women with fibromyalgia: A national survey. Women's Health Issues. 18 (5), 406-412 (2008).
- Rikli, R. E., Jones, C. J. Development and validation of criterion-referenced clinically relevant fitness standards for maintaining physical independence in later years. The Gerontologist. 53 (2), 255-267 (2013).
- Feusner, J. D., et al. Effects of cranial electrotherapy stimulation on resting state brain activity. Brain and Behavior. 2 (3), 211-220 (2012).
- Harris, R. E., et al. Pregabalin rectifies aberrant brain chemistry, connectivity, and functional response in chronic pain patients. Anesthesiology. 119 (6), 1453-1464 (2013).
- Napadow, V., Harris, R. E. What has functional connectivity and chemical neuroimaging in fibromyalgia taught us about the mechanisms and management of 'centralized' pain. Arthritis Research & Therapy. 16 (5), 425 (2014).
- Schroeder, M. J., Barr, R. E. Quantitative analysis of the electroencephalogram during cranial electrotherapy stimulation. Clinical Neurophysiology. 112 (11), 2075-2083 (2001).
- Cordes, D., et al. Mapping functionally related regions of brain with functional connectivity MR imaging. American Journal of Neuroradiology. 21 (9), 1636-1644 (2000).
- Hassett, A. L., Aquino, J. K., Ilgen, M. A. The risk of suicide mortality in chronic pain patients. Current Pain and Headache Reports. 18 (8), 436 (2014).
- Stenager, E., Christiansen, E., Handberg, G., Jensen, B. Suicide attempts in chronic pain patients. A register-based study. Scandinavian Journal of Pain. 5 (1), 4-7 (2014).
- Woodbury, A., et al. Feasibility of auricular field stimulation in fibromyalgia: Evaluation by functional magnetic resonance imaging, randomized trial. Pain Medicine. 22 (3), 715-726 (2021).
- Wolfe, F., et al. Revisions to the 2010/2011 fibromyalgia diagnostic criteria. Seminars in Arthritis and Rheumatism. 46 (3), 319-329 (2016).
- Polomano, R. C., et al. Psychometric testing of the defense and veterans pain rating scale (DVPRS): A new pain scale for military population. Pain Medicine. 17 (8), 1505-1519 (2016).
- Electromedical Products International, Inc. . Scientific and clinical literature examination for the Alpha-Stim M microcurrent and cranial electrotherapy stimulator. , (2016).
- Lein, D. H., Alotaibi, M., Almutairi, M., Singh, H. Normative reference values and validity for the 30-second chair-stand test in healthy young adults. International Journal of Sports Physical Therapy. 17 (5), 907-914 (2022).
- Revicki, D. A., Cook, K. F., Amtmann, D., Harnam, N., Chen, W. H., Keefe, F. J. Exploratory and confirmatory factor analysis of the PROMIS pain quality item bank. Quality of Life Research. 23 (1), 245-255 (2014).
- Tustison, N. J., et al. N4ITK: improved N3 bias correction. IEEE Transactions on Medical Imaging. 29 (6), 1310-1320 (2010).
- Avants, B. B., Epstein, C. L., Grossman, M., Gee, J. C. Symmetric diffeomorphic image registration with cross-correlation: evaluating automated labeling of elderly and neurodegenerative brain. Medical Image Analysis. 12 (1), 26-41 (2008).
- Zhang, Y., Brady, M., Smith, S. Segmentation of brain MR images through a hidden Markov random field model and the expectation-maximization algorithm. IEEE Transactions on Medical Imaging. 20 (1), 45-57 (2001).
- Dale, A. M., Fischl, B., Sereno, M. I. Cortical surface-based analysis: I. Segmentation and surface reconstruction. NeuroImage. 9 (2), 179-194 (1999).
- Klein, A., et al. Mindboggling morphometry of human brains. PLoS Computational Biology. 13 (2), e1005350 (2017).
- Fonov, V. S., Evans, A. C., McKinstry, R. C., Almli, C. R., Collins, D. L. Unbiased nonlinear average age-appropriate brain templates from birth to adulthood. NeuroImage. 47 (Supplement 1), S102 (2009).
- Evans, A. C., Janke, A. L., Collins, D. L., Baillet, S. Brain templates and atlases. NeuroImage. 62 (2), 911-922 (2012).
- Greve, D. N., Fischl, B. Accurate and robust brain image alignment using boundary-based registration. NeuroImage. 48 (1), 63-72 (2009).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. NeuroImage. 17 (2), 825-841 (2002).
- Cox, R. W., Hyde, J. S. Software tools for analysis and visualization of fMRI data. NMR in Biomedicine. 10 (4-5), 171-178 (1997).
- Pruim, R. H. R., Mennes, M., van Rooij, D., Llera, A., Buitelaar, J. K., Beckmann, C. F. ICA-AROMA: A robust ICA-based strategy for removing motion artifacts from fMRI data. NeuroImage. 112, 267-277 (2015).
- Power, J. D., Mitra, A., Laumann, T. O., Snyder, A. Z., Schlaggar, B. L., Petersen, S. E. Methods to detect, characterize, and remove motion artifact in resting state fMRI. NeuroImage. 84, 320-341 (2014).
- Behzadi, Y., Restom, K., Liau, J., Liu, T. T. A component based noise correction method (CompCor) for BOLD and perfusion based fMRI. NeuroImage. 37 (1), 90-101 (2007).
- Satterthwaite, T. D., et al. An improved framework for confound regression and filtering for control of motion artifact in the preprocessing of resting-state functional connectivity data. NeuroImage. 64, 240-256 (2013).
- Lanczos, C. Evaluation of noisy data. Journal of the Society for Industrial and Applied Mathematics Series B Numerical Analysis. 1 (1), 76 (1964).
- Oscar, E., et al. fMRIPrep: A robust preprocessing pipeline for functional MRI. Nature Methods. 16, 111-116 (2019).
- Oscar, E., et al. FMRIPrep. Software. Zenodo. , (2018).
- Gorgolewski, K. J., et al. Nipype: a flexible, lightweight and extensible neuroimaging data processing framework in python. Frontiers in Neuroinformatics. 5, 13 (2011).
- Gorgolewski, K. J., et al. Nipype. Software. Zenodo. , (2018).
- Abraham, A., et al. Machine learning for neuroimaging with scikit-learn. Frontiers in Neuroinformatics. 8, 14 (2014).
- Yeh, F. -. C., Badre, D., Verstynen, T. Connectometry: A statistical approach harnessing the analytical potential of the local connectome. NeuroImage. 125 (2016), 162-171 (2015).
- Andersson, J. L. R., Skare, S., Ashburner, J. How to correct susceptibility distortions in spin-echo echo-planar images: application to diffusion tensor imaging. NeuroImage. 20 (2), 870-888 (2003).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. NeuroImage. 23 (S1), 208-219 (2004).
- Andersson, J. L. R., Sotiropoulos, S. N. An integrated approach to correction for off-resonance effects and subject movement in diffusion MR imaging. NeuroImage. 125, 1063-1078 (2016).
- Yeh, F. -. C., Tseng, W. -. Y. I. NTU-90: a high angular resolution brain atlas constructed by -q-space diffeomorphic reconstruction. Neuroimage. 58 (1), 91-99 (2011).
- Nieto-Castanon, A. Cluster-Level Inferences. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , (2020).
- Hemington, K. S., Wu, Q., Kucyi, A., Inman, R. D., Davis, K. D. Abnormal cross-network functional connectivity in chronic pain and its association with clinical symptoms. Brain Structure & Function. 221 (8), 4203-4219 (2016).
- Ichesco, E., et al. Altered resting state connectivity of the insular cortex in individuals with fibromyalgia. Journal of Pain. 15 (8), 815-826 (2014).
- Kim, J., et al. The somatosensory link in fibromyalgia: functional connectivity of the primary somatosensory cortex is altered by sustained pain and is associated with clinical/autonomic dysfunction. Arthritis & Rheumatology. 67 (5), 1395-1405 (2015).
- Napadow, V., LaCount, L., Park, K., As-Sanie, S., Clauw, D. J., Harris, R. E. Intrinsic brain connectivity in fibromyalgia is associated with chronic pain intensity. Arthritis and Rheumatism. 62 (8), 2545-2555 (2010).
- Napadow, V., Kim, J., Clauw, D. J., Harris, R. E. Decreased intrinsic brain connectivity is associated with reduced clinical pain in fibromyalgia. Arthritis and Rheumatism. 64 (7), 2398-2403 (2012).
- Puiu, T., et al. Association of alterations in gray matter volume with reduced evoked-pain connectivity following short-term administration of pregabalin in patients with fibromyalgia. Arthritis & Rheumatology. 68 (6), 1511-1521 (2016).
- Fallon, N., Chiu, Y., Nurmikko, T., Stancak, A. Functional Connectivity with the default mode network is altered in fibromyalgia patients. PLoS One. 11 (7), e0159198 (2016).
- Wang, Y., Kang, J., Kemmer, P. B., Guo, Y. An efficient and reliable statistical method for estimating functional connectivity in large scale brain networks using partial correlation. Frontiers in Neuroscience. 10, 123 (2016).
- Mease, P. J., et al. Estimation of minimum clinically important difference for pain in fibromyalgia. Arthritis Care and Research (Hoboken). 63 (6), 821-826 (2011).
- Bingel, U., et al. Somatotopic organization of human somatosensory cortices for pain: a single trial fMRI study. NeuroImage. 23 (1), 224-232 (2004).
- Wager, T. D., et al. Pain in the ACC. Proceedings of the National Academy of Sciences of the United States of America. 113 (18), E2474-E2475 (2016).
- Nieto-Castanon, A. . FMRI Denoising Pipeline. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , (2020).
- Friston, K. J., Williams, S., Howard, R., Frackowiak, R. S., Turner, R. Movement-related effects in fMRI time-series. Magnetic Resonance in Medicine. 35 (3), 346-355 (1996).
- Hallquist, M. N., Hwang, K., Luna, B. The nuisance of nuisance regression: spectral misspecification in a common approach to resting-state fMRI preprocessing reintroduces noise and obscures functional connectivity. NeuroImage. 82, 208-225 (2013).
- Chai, X. J., Nieto-Castanon, A., Ongur, D., Whitfield-Gabrieli, S. Anticorrelations in resting state networks without global signal regression. NeuroImage. 59 (2), 1420-1428 (2012).
- Nieto-Castanon, A. General Linear Model. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , (2020).
- Worsley, K. J., Marrett, S., Neelin, P., Vandal, A. C., Friston, K. J., Evans, A. C. A unified statistical approach for determining significant signals in images of cerebral activation. Human Brain Mapping. 4 (1), 58-73 (1996).
- Chumbley, J., Worsley, K., Flandin, G., Friston, K. Topological FDR for neuroimaging. NeuroImage. 49 (4), 3057-3064 (2010).
- Page, S. J., Persch, A. C. Recruitment, retention, and blinding in clinical trials. The American Journal of Occupational Therapy. 67 (2), 154-161 (2013).
- McGrath, R. E., Mitchell, M., Kim, B. H., Hough, L. Evidence for response bias as a source of error variance in applied assessment. Psychological Bulletin. 136 (3), 450-470 (2010).
- Robinson-Papp, J., George, M. C., Dorfman, D., Simpson, D. M. Barriers to chronic pain measurement: A qualitative study of patient perspectives. Pain Medicine. 16 (7), 1256-1264 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved