このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
脳イメージングバイオマーカーを使用した、線維筋痛症の痛みと身体機能に対する頭蓋電気刺激の無作為化偽対照試験
要約
現在の研究は、頭蓋電気刺激 (CES) の有効性を判断するための無作為化プラセボ対照試験です 線維筋痛症の痛みと機能を改善し、さらに 安静時機能接続磁気共鳴画像法 (rs-fcMRI) を臨床ツールとして開発します 慢性疼痛と鎮痛反応のメカニズム。
要約
線維筋痛症は慢性疼痛症候群で、身体機能の低下、疲労、認知障害、その他の身体性不調など、さまざまな症状を呈します。利用可能な治療法は症状の治療に不十分であることが多く、疼痛管理が不十分であるため、管理を試みるためにオピオイドを使用するのが一般的です。頭蓋電気刺激 (CES) は、パルス電流刺激を使用して経皮電極を介して脳機能を変更する、痛みの状態に対する有望な非薬理学的治療オプションです。これらの神経メカニズムと、線維筋痛症の症状緩和におけるCESの応用については、さらなる調査が必要です。
線維筋痛症と診断されたアトランタ退役軍人医療システム(VAHCS)から合計50人の参加者が登録され、プラセボと標準治療の併用群またはCESと標準治療のアクティブ群のいずれかにブロック無作為に割り付けられました。ベースライン評価は、治療開始前に取得されました。どちらの介入も12週間にわたって行われ、参加者は治療開始の6週間後と12週間後に評価されました。主要アウトカムは、CESの適用により痛みと機能の改善が起こるかどうかを調査した。さらに、ベースラインおよびフォローアップの安静時機能的接続性磁気共鳴画像法 (rs-fcMRI) を 6 週間および 12 週間の時点で取得し、神経接続性バイオマーカーの臨床応用と治療効果に関連する根底にある神経関連を評価しました。
これは、線維筋痛症の痛みと機能を改善するための CES の有効性を判断し、慢性疼痛と鎮痛反応の神経相関とメカニズムを評価するための臨床ツールとして rs-fcMRI をさらに開発するための無作為化プラセボ対照試験です。
概要
慢性疼痛の多くの既存の状態の中で、診断、臨床的評価、治療が最も難しい疾患の一つが線維筋痛症です。線維筋痛症は、慢性的な広範囲にわたる痛み、身体機能の低下、疲労、精神感情障害、睡眠障害、およびさまざまな身体疾患の愁訴を伴う衰弱性の慢性疼痛症候群であり、南北アメリカの一般人口の約2〜3%(米国では約800万人)が罹患しています1. 疾患の診断は、患者自身の症状プロファイルと痛みの経験に対する患者の理解に大きく依存しており、臨床医と患者の両方が疾患を適切に理解しなければ、治療方法はかなりの有効性を失います2.線維筋痛症の起源と影響をより明確に定義し、線維筋痛症の診断と治療を導くための信頼性の高い臨床バイオマーカーは、すべての患者に最高のサービスを提供するために必要です。
診断が確定しても、治療プロセスの困難さは増すばかりです。全体として、慢性疼痛は、心臓病、糖尿病、がんを合わせたよりも多くの個人に影響を及ぼします。その評価の主観的な性質は、特に物質使用障害や薬物探索行動から不完全に治療された身体的痛みを識別することの難しさを考えると、オピオイドの蔓延の主要な推進力として位置付けられています3。2020年には、米国で91,799人の薬物過剰摂取による死亡が発生し(2019年から30%増加)、オピオイドがこれらの死亡の主な原因であることが判明しました(2020年の薬物過剰摂取による死亡全体の74.8%)4。したがって、オピオイドの蔓延を遅らせるためには、慢性疼痛や線維筋痛症の治療には非薬理学的な代替手段が必要であり、これは自殺やオピオイド使用障害のリスクが高い退役軍人集団で特に重要です5。したがって、非薬理学的および補完的治療は、第一選択治療としてよく使用されます6。
新規で効果的な線維筋痛症の介入の探求は、多くの研究者や臨床医を、頭蓋刺激を含む非侵襲的な脳刺激の方法に導きました。この疾患の発症をもたらす病態生理学的メカニズムは決定されていませんが、既存の証拠は、線維筋痛症が自律神経系の機能障害と中枢性(つまり、脳と脊髄)の痛み処理メカニズムの障害であるという考えを支持しています7,8。脳の特定の領域を刺激すると、それらの処理領域の機能が改善される可能性があります。反復経頭蓋磁気刺激法 (rTMS) と経頭蓋直流刺激法 (tDCS) は、痛みの軽減と相関していますが、活性化部位の頭皮の炎症、頭痛、および治療施設の外へのアクセスのしやすさとも関連しています9.非侵襲的迷走神経刺激 (nVNS) は、首や耳のレベルで皮膚を刺激することで神経調節を行うことができ、慢性疼痛の治療に可能性を秘めており、侵襲的迷走神経刺激 (VNS) は慢性疼痛の症状を改善することが示されています10。しかし、侵襲的VNSも非侵襲的VNSも文献では十分に研究されておらず、線維筋痛症治療での使用についても十分に検証されていません11,12,13,14。
頭蓋電気刺激(CES)は、耳たぶ15に配置された経皮的電極を介してパルス状の交流マイクロカレント(0.5mA未満)を印加することからなる非薬理学的、非侵襲的な脳刺激療法である。非常にアクセスしやすく、患者が自分の生活空間で使用するポータブルデバイスを介して配信できます。他の頭蓋刺激法と比較して、非侵襲的な性質と自宅での患者の自己適用の利便性により、CESは広範な線維筋痛症治療の使用と痛みの自己管理のための有益な選択肢としての可能性を高めます。米国食品医薬品局(FDA)によって、不眠症、うつ病、不安神経症、および痛みの治療薬として承認されています15。
現在の研究では、線維筋痛症の治療モダリティとしてのCESの有効性を評価します アクティブなCES(真の研究デバイスによって投与される)と偽のCES(偽の研究デバイスによって投与される)を比較します。線維筋痛症などの疼痛状態の治療におけるCESの使用を支持する予備的な証拠がいくつかあります16,17。2001年の研究では、60人の参加者をアクティブCESまたは偽CESに無作為に割り付け、毎日60分間のセッションを3週間行った結果、圧痛点スコアが28%改善し、一般的な疼痛スコアが27%改善し、プラセボ効果はなかったことが明らかになりました18。CESは退役軍人集団では評価されておらず、線維筋痛症の男性でも適切に評価されていません。退役軍人省(VA)が資金提供した2018年に発表されたCESのシステマティックレビューでは、ほとんどの試験がサンプルサイズが小さく、期間が短く、不十分な盲検化によるバイアスのリスクが高いことを考えると、CESが線維筋痛症に臨床的に重要な影響を与えるにはエビデンスが不十分であると結論付けました。しかし、このレビューでは、CESは重篤な副作用を引き起こさないことが示唆されており、不安やうつ病の患者に適度な利益があることを示唆する強度の低い証拠がある19。したがって、このFDA認可の低リスクデバイスの使用、特に線維筋痛症での使用については、さらなる研究が必要です。
有効性を完全に評価するために、研究者は神経バイオマーカーと痛みの経験とともに体力を評価しました。慢性疼痛状態を治療する目的は、身体機能を改善することです。線維筋痛症は、身体機能と患者の自身の身体能力の認識の両方に対する悪影響と一貫して相関しています20。これまでの研究では、6分間歩行テスト(6MWT)20,21、5時間座って立っている(5TSTS)20、日常生活の文脈における運搬能力と筋力のさまざまな測定など、スタミナと可動性を決定するための単純な体力評価を利用してきました22。標準的な測定値を考慮しながら、MRIスキャンの直前に必要な激しい活動の量を軽減するために、研究チームはスタミナと可動性の尺度として30秒チェアシットスタンドテストを使用し、強度23の尺度として上腕二頭筋カールとハンドグリップテストの両方を使用しました。これらの評価のそれぞれに必要な動きは、日常生活で非常に一般的であるため、治療の有無にかかわらず、人々が日常生活でどのように身体的に機能しているかを明確に測定します。
主観的な疼痛評価や身体機能の有効性測定を行っても、CESのメカニズムは完全には理解されていません。これまでのニューロイメージング研究では、CESが脳内のネットワーク接続に及ぼす直接的な影響を調査することで、より深い理解が求められてきました。Feusnerら24は、CESが両側の前頭葉、頭頂部、および後部正中線領域の0.5Hzおよび100μA刺激の皮質不活性化と関連していることを発見し、刺激の頻度は皮質の不活性化に関連して電流強度よりも大きな影響を与える可能性があると仮定しました。彼らのグループは、デフォルトモードネットワーク(DMN)の一部のノード(すべてではない)に大きな影響があることを発見しました。著者たちは、このデータに基づいて、CESが安静時の機能的接続性に影響を与える可能性があるという考えを示している。線維筋痛症やその他の慢性疼痛状態は、痛みや知覚に関連する領域の脳内在性接続に影響を与えることが示されています25,26、したがって、それに応じて機能的接続性を変化させる治療は、有益で効果的であることが証明される可能性があります。臨床的改善に関連する日常的な治療の長期的な影響、および脳内の死亡した活性化が以前に観察された脳波周波数の減少とどのように関連しているかについてさらに調査する必要があります27。
安静時機能的コネクティビティ 磁気共鳴画像法(rs-fcMRI)は、これらの機能的コネクティビティの変化を観察できるニューロイメージング法です。縦断的安静時fMRIにより、臨床医や研究者は安静時接続性のベースラインを確立し、CES治療方法に応答して経時的な変化を追跡することができます。また、機能的接続性の変化が痛みの経験の違いとどのように相関しているかを判断するのにも役立ちます。線維筋痛症のニューロイメージングの初期研究では、陽電子放出断層撮影法(PET)と単一光子放出型コンピューター断層撮影法(SPECT)を使用して脳を調べましたが、この点で両方の技術には問題があります:SPECTはPETよりも解像度が低く、PETスキャンは侵襲的であり、慢性的な痛みを経験している患者には好ましくありません。機能的磁気共鳴画像法(fMRI)スキャンは、SPECTよりも解像度が高いが、患者の特定の行動や刺激の知覚に反応して脳活動を調べる28。脳の領域間の機能的接続性を概説できるのはrs-fcMRIスキャンであり、線維筋痛症がどこでどのように存在するか、および最良の治療法を特定できる可能性があります28。
線維筋痛症などの疼痛状態に対する非薬理学的治療の有効性を評価することは、オピオイドの流行の現在の状況と、退役軍人の間で大幅に増加している自殺の危険因子としての慢性疼痛を調べることの両方で最も重要です29,30。さらに、疼痛に対する適切な臨床バイオマーカーの欠如は、認識されている知識のギャップです。複数の時点での行動測定とニューロイメージングを組み合わせて治療反応を評価することは、線維筋痛症の評価に対する新しいアプローチであり、治療としての耳介CESの利用も同様です。
このプロトコルは、疼痛および身体機能の結果に対するCESの影響を調査し、CES療法の臨床転帰に関連する予測および反応バイオマーカーのツールとしてニューロイメージングを評価することにより、線維筋痛症研究のギャップに対処することを目的としています31。
プロトコル
この研究は、エモリー大学(IRB 112768)およびアトランタVA治験審査委員会(1585632-2;内部参照番号:003)、およびアトランタVA R&D委員会(取締役会参照番号:3881)も設立しました。すべての被験者は、この研究に参加する前に、含めるためのインフォームド コンセントを与えました。研究プロトコルのタイムラインを視覚的に表現するには、 図1を参照してください。
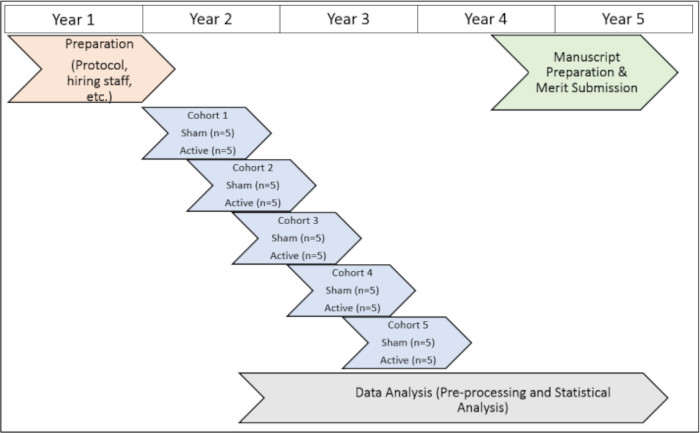
図1:調査のタイムライン。 試用期間中に試験手順を実行するためのタイムラインを視覚的に表現したものです。 この図の拡大版を表示するには、ここをクリックしてください。
1. 利用可能な方法で参加者を募集する
- 研究募集資料(チラシ、投稿、電子メール、電話など)および承認された募集方法を配布するために必要なそれぞれの機関のガイドラインに従ってください。
注: 現在の研究では、特定のコホートへの募集書の郵送と、潜在的な参加者へのフォローアップ電話を通じて募集されました。本試験のためのCESデバイスの注文に関する詳細は、補足のCESデバイスの注文指示書(補足ファイル1)に記載されています。 - 誰かが研究への参加に興味を示した場合は、電話でスクリーニングして、すべての包含基準と除外基準を満たしていることを確認します。
- 適格基準に適合する参加者を含めます: 20 歳から 60 歳 (加齢による脳の構造変化を最小限に抑えるために予備研究中に設定された制限)31;American College of Rheumatology 2016 基準32 による線維筋痛症の診断;右利き(脳の構造と機能の一貫性を提供するため)。-登録前の3か月間に、Defense and Veterans Pain Rating Scale(DVPRS)33 で4以上の痛みスコア。-登録34の少なくとも4週間前の一貫した安定したFM関連の投薬;MRIに安全に耐える能力。
- 線維筋痛症のスクリーニング部分については、新しい臨床線維筋痛症診断基準32 に、広範囲にわたる疼痛指数 (WPI) スコアと重症度スコア (SS) を取得する可能性のある参加者を記入します。ページ下部に記載されているガイドラインに従って採点してください。
- 疼痛スコアのスクリーニング部分では、潜在的な参加者に、過去 3 か月間の平均的で一貫した痛みを 0 から 10 のスケールで口頭で評価してもらいます。
- MRIスクリーニング部分については、施設またはスキャナー施設自体から提供された潜在的な参加者とともに、MRI安全性スクリーニングフォームに記入してください。
- 考えられるすべての除外基準について参加者に尋ねます。除外基準には、脳を変化させる発作または神経学的状態の病歴が含まれます。妊娠;閉所恐怖症、MRIに適合しないインプラント、またはMRIと互換性のないその他の状態;そして、痛みを引き起こし、症状をよりよく説明できる制御不能な精神疾患または自己免疫疾患の病歴31.
- 除外基準のいずれかが適用される場合、スクリーニングに不合格となります。それらを研究に含めないでください。
- 適格基準に適合する参加者を含めます: 20 歳から 60 歳 (加齢による脳の構造変化を最小限に抑えるために予備研究中に設定された制限)31;American College of Rheumatology 2016 基準32 による線維筋痛症の診断;右利き(脳の構造と機能の一貫性を提供するため)。-登録前の3か月間に、Defense and Veterans Pain Rating Scale(DVPRS)33 で4以上の痛みスコア。-登録34の少なくとも4週間前の一貫した安定したFM関連の投薬;MRIに安全に耐える能力。
- 誰かがスクリーニングに合格したら、同意の予約とベースラインMRIスキャンをスケジュールします。同意とスキャン時間の 2 時間をスケジュールします。
2.ベースライン、中期、および参加者後の研究予定の管理( 表1を参照)
注:すべての予約はMRIスキャナーの場所で行われます。
| 時間 | 研究活動 | |
| フェーズ 1 | 1週目 | 採用・選考・登録 |
| フェーズ 2 | 2-3週目 | ベースライン評価、rs-fcMRI |
| フェーズ3 | 2週目から14週目 | 介入 |
| フェーズ4 | 6-10週目 | 急性期フォローアップ、rs-fcMRI(治療開始6週間) |
| フェーズ5 | 12-16週目 | 長期フォローアップ、rs-fcMRI(治療開始12週間) |
表1:研究デザイン。研究の12週間にわたる個々の参加のフェーズのタイムライン。
- 各ベースライン訪問の前に、各参加者に持参するCESデバイスを準備します。
- ケースを開けて、デバイスが内部にあることを確認します(プチプチになっている必要があります)。デバイスの背面を取り外し、2つのAAAバッテリーを挿入します。
- デバイスを元に戻します。デバイスの電源を入れて動作を確認してから、参加者に持ち込みます。画面が点灯するまでトップボタンを約2秒間押し続けてオンにし、画面が空白になるまで約2秒間押し続けてオフにします。
- 各ケースに、デバイス、予備のバッテリー、ストラップ、小さな溶液アプリケーター、イヤークリップが含まれていることを確認してください。参加者に渡すバッグには、デバイスケース、導電溶液のボトル、小さな溶液アプリケーターを充填するための追加のキャップ、および追加のイヤークリップ電極パッドが含まれていることを確認してください。
- 同意とベースライン MRI スキャンがスケジュールされたら、同意書のコピー 2 部、CES デバイスとその資料、適格性テストの書類、および記入するためのアンケート パケットを持って、MRI スキャナーの場所で参加者に会います。さらに、MRIデータを分析サイトに転送するためのデータ転送デバイスを持参してください。
注:この研究では、暗号化されたUSBドライブを使用しました。- 適格性の事務処理には、新しい臨床線維筋痛症診断基準32 と DVPRS33 を含めてください。
注:DVPRSは、訪問ごとに含める必要があります。 - 身体機能テストについては、各テスト20,21,35の結果を記録するフォームを含める。
- 参加者が記入するアンケートには、適切なPROMIS対策を含めてください(PROMISスケールv1.2-グローバルヘルス、ニューロQOLアイテムバンクv2.0-認知機能-ショートフォーム、PROMISアイテムバンクv1.0-物質使用/アルコール:アルコール使用、PROMISアイテムバンクv1.0-感情的苦痛-不安-ショートフォーム7a、PROMISアイテムバンクv1.0-感情的苦痛-うつ病-ショートフォーム4a、PROMISアイテムバンクv1.0-疲労-ショートフォーム6a、 PROMISアイテムバンクv1.0 - 痛みの干渉 - ショートフォーム4a、PROMISアイテムバンクv1.2 - 身体機能 - ショートフォーム8b、PROMISアイテムバンクv2.0 - 社会的孤立 - ショートフォーム4a)36。
- 適格性の事務処理には、新しい臨床線維筋痛症診断基準32 と DVPRS33 を含めてください。
- MRIの場所で、ベースライン訪問を管理します。事前に参加者に電話して確認してください。
- 参加者と一緒に同意書の全文を読み、参加者が情報を理解していることを確認します。参加したいかどうかを尋ね、同意する場合は、フォームに名前、署名、日付を印刷してもらいます。
- 同意後、参加者が研究への参加を選択した場合は、参加者と一緒にインクルージョンテストの書類を完成させます。続行する資格がある場合は、以下の手順を完了してください。彼らが不適格である場合は、この時点で研究への参加を終了してください。
- 適格性検査の書類に、新しい臨床線維筋痛症の診断基準とDVPRSが含まれていることを確認してください。
- インクルージョンテスト後に参加者が適格である場合は、CESデバイスの使用方法を参加者に説明します。
- デバイスをケースから取り出し、上部のボタンでオンとオフを切り替える方法を参加者に示します。60分が経過するとデバイスが自動的に非アクティブ化されることを参加者に思い出させます。
- 参加者にイヤークリップコードを側面に取り付ける方法を示します。クリップからのコードの反対側の端は、「1」のラベルが付いたデバイスの左側にある小さな穴に差し込みます。
- イヤークリップから古い電極パッドを取り外し、新しい電極パッドを取り付ける方法を示します。古いパッドを取り外すには、クリップに接続されている場所から接着剤を引き上げます。新しいパッドを取り付けるには、予備の電極パッドの穴をクリップの中央の隆起した領域に合わせ、しっかりと押し下げます。
注意: 上部の柔らかい部分で電極パッドを引っ張らないでください。破れやすく、接着剤がクリップに付着したままになります。 - 耳たぶにイヤークリップをクリップする方法を実演し、一度試してみてもらいます。クリップの緑色の先端を絞って開き、その間に耳たぶを置き、クリップを静かに閉じて取り付けます。
- 小さな溶液アプリケーターからプラスチックトップを取り外し、大きなボトルの溶液で満たす方法を示します(手順2.3.3.6-2.3.3.8を参照)。デバイスが正しく機能するためには解決策が必要であることを彼らに思い出させます。
- 小型溶液アプリケーターの上部を取り外すには、キャップを取り外し、先端の側面をしっかりと押し付けます。プラスチック製の先端がボトルの残りの部分から外れます。
- 小さなアプリケーターを充填するための代替キャップを大きな溶液ボトルの上部に取り付けます。小さなノズルを押し上げ、小さなアプリケーターにスライドさせ、大きなボトルを絞って充填します。
- 各イヤークリップ電極パッドに約1〜2滴の溶液のみを追加する必要があることを参加者に伝えます。余分な溶液は、使用前に軽くたたく必要があります。
- 参加者に、就寝の約 1 時間前の夕方 60 分間、毎日デバイスを使用するように指示します。参加者に、安静時(つまり、動き回らずにじっと座ったり横になったりして)デバイスを使用するように指示します。
注:時間と位置の両方について、参加者は、この治療法の家庭用の実用的な性質を高めるために、自宅の使用環境に通常の変動を許可されました。環境または必要なデバイスストレージで許可されるサウンドのパラメーターが設定されていませんでした。 - 参加者に空白のデバイスログを渡し、デバイスの使用日、デバイスの使用前後の痛みスコア、デバイスの使用時間を入力する必要があることを説明します。
- 参加者が予約間の 6 週間の間に一定期間デバイスを使用できない場合、フォローアップの予約を行うことができる場合は、研究にとどまらせてください。彼らがデバイスを使用できない場合、または研究訪問に参加できない場合は、参加を終了します。この研究で使用したデバイスログについては、補足のCESデバイスログ(補足ファイル2)を参照してください。
注:次の手順は、3回の訪問すべてで繰り返されます。
- 装置の説明の後、参加者に3つの短い身体機能テスト23を完了させる。各テストでは、スコアの最大数が記録されます (最初の 2 回の反復の合計と 3 回目の試行あたりの強度)。
注:この調査で使用したストップウォッチはApple iPhone 12でした。- 30 sチェアシットスタンドテストを実施します。手順 2.3.4.2 から 2.3.4.6 に従います。
- 椅子を背にして試験室の壁に置きます。参加者に背中を椅子の背もたれにつけて椅子に座ってもらいます。
- 参加者に完全な立位まで立ち上がるよう指示し、その後、30秒間にできるだけ多くの回数、椅子の背もたれに背を向けて座ります。
注:椅子を軽くたたいても、座った状態で体重を完全に戻さない場合、繰り返しはカウントされません。 - 参加者にいつ開始するかを伝えます。彼らが動き始めたらタイマーを開始します。
- 参加者に、両側にダンベルを付けてアームカールを片面30秒間行ってもらいます。最初に右腕から始めて、次に左に移動します。
- 各面のカールの総数を記録します。女性には5ポンドの重量、男性には8ポンドの重量を使用してください。参加者がアームカールテストのために着席していることを確認します。
- 参加者に、ダイナモメーターで各腕を使って握力試験を3回行ってもらいます。手順 2.3.4.8 から 2.3.4.11 に従います。最初に右腕から始めて、次に左に移動します。
- ダイナモメーターを参加者の手に置きます。下部のグリップを握り、上部のダイヤルに触れないようにする必要があります。
- 参加者に、ダイナモメーターをできるだけ強く握ってから離すように伝えます。ダイヤルの針は、表示した最高レベルの握力で停止します。
- 針が到達する数字をダイヤルに書き留めて、握力の結果を記録します。針がゼロになるまで、文字盤の前面にある小さなノブを反時計回りにひねり、繰り返しの合間にダイヤルをリセットします。
- 参加者がハンドグリップテストのために着席していることを確認します。
注:各シリーズの間に、参加者は機器をもう一方の手に移すときに約15〜20秒の休息を取ります。各テストの間に、参加者は次のテストのための機器と書類を準備する間、約2分間の休憩を取ります。
- 身体機能テストの後、参加者にペンで質問票に記入してもらいます。後でパケットをチェックして、彼らがすべての質問に答えたことを確認します。
- すべてのレビュー、テスト、およびアンケートが完了したら、参加者をMRIスキャナー自体に連れて行きます(すべてのMRIプロトコル情報については、セクション3を参照してください)。MRI技師と一緒にスクリーニングフォームを確認し、参加者が体からすべての金属を取り除いたことを確認します。
- 研究チームのメンバーが体に金属を持っていないことを確認してください。
- MRI技師が参加者を快適にスキャナーに取り込めるように支援します。MRI スキャンプロトコルを管理します。
- 参加者に安全手順(テストコールボタンとスピーカー)について指導します。
- スキャン中はまったく動かないように参加者に通知してください。
- スキャンの合計時間 (60 分) を参加者に思い出させます。
- スキャンが完了したら、参加者をスキャナーから外します。
- スキャン後、参加者のベースライン訪問を終了し、6週間後に中間訪問をスケジュールします。参加者は、それぞれ 6 週間間隔で合計 3 回の研究訪問を受けます。MRIデータを研究の安全なサーバーにプッシュして分析します。
- 予定された日に、ベースライン訪問の手順に従って、訪問の途中で管理します。事前に参加者に電話して確認してください。
- DVPRS を管理します。参加者に最初に完了したデバイスログを返してもらい、2 番目のデバイスログを提供してもらいます。
- 手順 2.3.4 から 2.3.6 を実行します (ベースライン訪問と同じ)。
- 参加者の訪問を途中で終了し、訪問後のスケジュールを 6 週間後にスケジュールします。MRIデータを研究の安全なサーバーにプッシュして分析します。
- 予定された日に、訪問中の手順に従って訪問後の管理を行います。事前に参加者に電話して確認してください。
- DVPRS を管理します。参加者に 2 つ目の完了したデバイス ログを返してもらいます。
- 手順 2.3.4 から 2.3.6 を実行します (ベースラインおよび訪問中と同じ)。最後の訪問に追加の訪問スケジュールは必要ありません。
- 参加者を補償するために情報が必要な場合は、この訪問時にその情報を準備してリクエストしてください。
注:この調査では、アトランタVAから報酬の小切手を発行するために、彼らの名前と住所が必要でした。 - 参加者の訪問後の作業を完了します。MRIデータを研究の安全なサーバーにプッシュして分析します。
注: 研究全体を通して、訪問の合間に参加者に電話してチェックインし、参加者がデバイスを使用していることを確認し、デバイスのログを完了し、次の訪問がいつになるかを認識してください。
3. MRIスキャンプロトコルの設定
- MRIスキャンプロトコルでは、勾配エコー平面イメージング(EPI)シーケンスを使用して、32チャンネルフェーズドアレイヘッドコイルを備えた3T MRIスキャナーでBOLDのrs-fMRIを取得します。次のMRパラメータを使用します:FOV(視野)= 220 mm2;TR (繰り返し時間)/TE (エコー時間) = 1500/25 ms、マルチバンド加速係数 = 3;フリップ角度= 50°;110 x 110 マトリックス サイズ。スライスの厚さ= 2 mm;GRAPPA係数= 2;6/8の部分フーリエ。34本の位相符号化基準線、脳全体を覆う72本のインターリーブ軸スライス、約350回のスキャンボリュームにより、8分間の安静状態fMRIデータが得られ、接続ネットワークの安定した推定が可能になります。
- 解剖学的T1w磁化のプロトコルでは、TR = 2530 ms、TE = 3 ms、フリップ角度= 7°、スライス厚さ= 0.8 mm、1 mmの位相分解能を調製した高速グラジエントエコー(MPRAGE)を準備しました。T1w の捕捉は約 6 分間続きます。
- 拡散スペクトルイメージングスキームを使用して、32チャンネルフェーズドアレイヘッドコイルを備えた3T MRIスキャナーで拡散強調イメージング(DWI)スキャンを取得します。最大b値が3000 s/mm2、面内分解能が2x2 mm2、スライス厚さが2 mmで、合計129の拡散サンプリング方向を収集します。
- 生理データ(呼吸モニターベルトとパルスオキシメトリを用いた心肺データ)をfMRIデータと同時に取得(タイムロック)します。
- MRIデータをスキャナーの位置から安全な場所に安全に転送し、前処理と分析を行います。dc2bids v2.1.6 を使用して BIDS 形式に準拠するように、DICOMS を NIFTI に変換します。
- 個々の識別子のデータをスクラブします。該当する場合は、すべてのデータに研究対象番号を使用してください。MRIQC v21.0.0 を介して、データに過度の動きなどの異常なアーティファクトが発生していないことを確認するために、品質チェックを実施します。
4. 前処理と分析
- 研究からMRIデータを受け取ったら、2つの別々のパイプラインを利用して分析します:1つは参加者間の機能的接続性を分析し、もう1つは白質トラクトグラフィーを分析します。
- fMRIPrep v20.2.5 を介して、脳の抽出、組織セグメンテーション、T1 強調 (T1w) 画像の正規化、参照体積推定、頭部運動推定、スライス タイミング補正、機能画像の T1w への登録など、被験者の構造 T1w および rsfMRI データを前処理します。このプロセスにより、T1w と rsfMRI のデータは MNI152NLin2009cAsym 空間に正規化されます。
- 前処理されたMRIデータを機能的接続性解析(CONN)で使用します。
- 補足資料のfMRIPrep Boilerplate(Supplementary File 337-56)を参照のこと。詳細については、次のリンクを参照してください https://fmriprep.org/en/stable/
- 前処理されたデータセットを CONN Toolbox v22a にインポートして、さらに処理します。
注: この調査中に CONN Toolbox が v21a から v22a に更新されました。- セットアップフェーズでは、2番目の レベル共変量を確立して、後で分析するための研究グループ (TRUE と SHAM) を定義し、T1w および rsfMRI 画像の品質を確保します。8mmガウスカーネルによる滑らかなfMRIデータ。
- 前処理に続いて、データのノイズを除去して、無関係なノイズや生理学的なノイズを除去します。
注:この研究では、第1レベルの分析を計算しましたが、研究者が単一被験者の結果に関心がないため、評価または使用しませんでした。 - シード/ROIと被験者の共変量を選択し、対比を設定します。グループレベルのシード-ボクセル解析を実行します。
- パイプラインのセットアップ、前処理、ノイズ除去の手順が完了したら、クラスターとボクセルのしきい値を設定して接続パターンを表示します。
- 補足図 1 および補足の CES CONN 指示書 (補足ファイル 4) ドキュメントを参照してください。
- 相関トラクトグラフィーを使用する57 CES治療に関連するトラクトバンドルと領域を特定するための実験グループと相関する白質完全性の縦方向の変化を決定するため。以下は、主な分析手順です。
- 生のDWI画像を.dcm(DICOM)から.nii.gz(NIfTI)形式に変換します。
- FSL(バージョン6.0.6)のTOPUP58,59を使用して感受性に起因する歪みを補正し、FSLのEDDYツール60を使用して渦電流歪みを補正するために、画像を前処理します。
- FSLのEDDY QCツールを使用して、単一被験者および研究ごとのレベルでの動きに関連するDWI画像品質管理(QC)指標を生成します。
- これらのQC指標で二元配置反復測定ANOVAを実行し、グループトラクトグラフィーの結果を混乱させる可能性のあるグループ間分散を特定します。指標が有意な (p > 0.05) グループ間分散を示している場合、相関トラクトグラフィー分析では共変量として考慮する必要があります。
- 前処理されたデータをDSI Studio(バージョン「Chen」、2022年11月21日)にインポートし、.src(ソース)ファイルに変換します。DSI Studioの詳細については、ソフトウェアのWebサイト(https://dsi-studio.labsolver.org)を参照してください。
- Q-Space Diffeomorphic Reconstruction(QSDR)61 を使用してインポートした拡散データを再構築し、MNIテンプレート空間における白質繊維配向を決定します。画像ごとに.fib(繊維配向)ファイルが出力されます。再構築のオプション選択は次のとおりです。
工法(再構成法選択) - QSDR
param0 (拡散サンプリング長) - 1.25 (これがデフォルト)
テンプレート (データを再構築するテンプレート空間) - ICBM152
align_acpc(AC-PCを揃えるために画像のボリュームを回転させるかどうか) - 0(false) - これらの .fib ファイルからコネクトメトリーデータベースを作成し、再構築された拡散データから定量的異方性(QA)値を抽出します。データベース内の各被験者のQAの縦方向の変化を計算します。実験グループ、年齢、性別などの人口統計と、QCステップで特定された共変量を.csvファイルを介してデータベースに追加します。
- 次に、コネクトメトリーデータベースをグループコネクトメトリー分析GUIにロードします。
- 分析で考慮する共変量を選択します。これらの選択された共変量の 1 つが 「分析変数」として指定されます。
- この分析では、スタディ変数として グループ を選択します。 QA の縦方向の変化がグループと相関している地区が特定され、選択された他の共変量の影響は回帰されます。
- グループコネクトメトリー解析のオプション選択は次のとおりです。
- FDR 制御 (False Discovery Rate カットオフ、FDR より有意な相関関係を持つ地区のみが出力されます) - 0.05
- 長さの閾値 (帰無仮説として使用される最小トラクト長のボクセル単位の値) - 20 ボクセル (2 mm ボクセル サイズの場合は 40 mm)
- T閾値(相関効果のt-stat測定閾値) - 2.5
- 研究領域 (このペインでは、領域を分析に含める/除外できます) - 「全脳 」を選択し、「小 脳を除外 する」にチェックを入れます
注:この研究では、一部の拡散スキャンで取得中に小脳の一部が切断されたため、小脳は除外されました。
- [コネクトメトリーの実行] ボタンを押して分析を実行すると、複数のファイルが出力されます。
- t-stats が格納され、DSI Studio で開いて QA の増加 ("inc_t" として格納) または QA の減少 ("dec_t" として格納) のトラクトの t-stats を視覚化できる .fib ファイル。これは Group と相関します。
- .fdr_dist.values.txt: 地区の長さに対する FDR 値をリストします。
- .inc.tt.gz は、スタディ変数と相関する縦断的 QA が増加したトラクトを保存するトラクトグラフィファイルです。(私たちの場合はグループ)。.dec.tt.gzファイルには、スタディ変数と相関する縦断的QAが減少したトラクトが保存されます。
- ネクレート測定の結果と、埋め込まれたトラクトプロット、写真、および相関トラクトグラフィ分析ステップの定型情報を公開用に便利に報告する.report.htmlファイル。
注: この調査で使用した R コードの例については、補足の CES R コード プロット (補足ファイル 5) と補足の R コード CES eddy-qc 分散分析ファイル (補足ファイル 6) を参照してください。
結果
募集結果に関しては、参加者は主に、アトランタVAヘルスケアシステムの概説された規制に基づいて、募集レターの郵送とフォローアップの電話を通じて募集されました。研究チームは合計50人の参加者を募集し、募集目標を達成するために使用された方法の有効性を証明しました( 図2を参照)。新しい臨床的な線維筋痛症の診断基準を使用する?...
ディスカッション
現在の研究の方法は、線維筋痛症の非常に効果的な治療法の可能性だけでなく、線維筋痛症の診断プロセスをその痛みの症状プロファイルの最初の例から改善する機会も提供します。アクティブCESと偽CESの両方を使用することは、個々のデバイスのタイプがシリアル番号と個別のキーに依存することを発見することで、被験者と研究者の両方を参加終了まで盲検化することを可能にし、それ?...
開示事項
著者らは、この論文で報告された研究に影響を与えたと思われる可能性のある既知の競合する金銭的利益や個人的な関係がないことを宣言します。この記事で表明された見解は著者のものであり、必ずしも退役軍人省または米国政府の立場や政策を反映しているわけではありません。
謝辞
著者らは、Bruce Crosson博士やLisa Krishnamurthy博士など、Center for Visual and Neurocognitive Rehabilitationの研究者の支援に感謝したいと思います。また、著者は、撮影プロセスにおける彼女の貴重な助けについて、グレース・インガムに感謝しています。この作業は、米国退役軍人省リハビリテーション研究開発サービスキャリア開発賞IK2 RX003227(Anna Woodbury)およびCenter Grant 5I50RX002358によって部分的に支援されました。資金提供者は、研究デザイン、データ収集、管理、分析、解釈、または報告においての役割を一切負いません。
資料
| Name | Company | Catalog Number | Comments |
| 3T Siemens MAGNETOM Prisma Scanner | Siemens Healthineers | N/A | From Emory's website: "The Siemens Magnetom Prisma 3T whole-body MR system is equipped with: a state-of-the art gradient system with a maximum (per axis) strength of 80 mT/m and slew rate of 200 T/m/sec 64 independent RF receiver channels capable of 204 receiver connections a 2-channel RF transmitter. Multiple coils are available, including: a 64-channel head/neck coil with 52 channels for imaging of the head region a 32-channel head-only coil a 20-channel head/neck coil with 16 channels for head spine array coil flexible chest coil large and small flexible coil for extremity imaging. |
| Alpha-Stim AID Kit | Electromedical Products International Inc. | SKU: 500KIT | A total of 50 devices ordered for research purposes. From the site: "A prescription or order from a licensed healthcare professional is required to purchase this device (within the USA). FDA cleared for anxiety, insomnia and pain only, with approval for depression outside of the United States." |
| CONN Toolbox v21a16 (RRID:SCR_009550) | Whitfield-Gabrieli and Nieto-Castanon | Version v21a16 (RRID:SCR_009550) | CONN is an open-source SPM-based cross-platform software for the computation, display, and analysis of functional connectivity Magnetic Resonance Imaging (fcMRI). CONN is used to analyze resting state data (rsfMRI) as well as task-related designs. |
| DSI Studio (RRID:SCR_009557) | Fang-Cheng (Frank) Yeh | RRID:SCR_009557 | DSI Studio is a tractography software tool that maps brain connections and correlates findings with neuropsychological disorders. It is a collective implementation of several diffusion MRI methods, including diffusion tensor imaging (DTI), generalized q-sampling imaging (GQI), q-space diffeomorphic reconstruction (QSDR), diffusion MRI connectometry, and generalized deterministic fiber tracking. |
| fMRIPrep 20.2.5 (RRID:SCR_016216) | NiPreps (NeuroImaging PREProcessing tools) | Version 20.2.5. (RRID:SCR_016216) | A functional magnetic resonance imaging (fMRI) data preprocessing pipeline that is designed to provide an easily accessible, state-of-the-art interface that is robust to variations in scan acquisition protocols and that requires minimal user input, while providing easily interpretable and comprehensive error and output reporting. It performs basic processing steps (coregistration, normalization, unwarping, noise component extraction, segmentation, skull-stripping, etc.) providing outputs that can be easily submitted to a variety of group level analyses, including task-based or resting-state fMRI, graph theory measures, and surface or volume-based statistics. |
| MRIQC | NiPreps (NeuroImaging PREProcessing tools) | MRIQC extracts no-reference IQMs (image quality metrics) from structural (T1w and T2w) and functional MRI (magnetic resonance imaging) data. (not directly used for analyses) | |
| Sammons Preston Jamar Hydraulic Hand Dynamometer | Alpha Med Inc. | SKU SAMP5030J1 | From the website: Ideal for routine screening of grip strength and initial and ongoing evaluation of clients with hand trauma and dysfunction. Unit comes with carrying/storage case, certificate of calibration and complete instructions. Warranted for one full year. The warranty does not cover calibration. Latex free. |
| SPRI 5-Pound Vinyl-Coated Weight | SPRI | Amazon | N/A | Color: (E) Dark Blue | 5-Pound. Appears on Amazon: Dumbbells Hand Weights Set of 2 - Vinyl Coated Exercise & Fitness Dumbbell for Home Gym Equipment Workouts Strength Training Free Weights for Women, Men (1-10 Pound, 12, 15, 18, 20 lb), https://www.amazon.com/stores/SPRI/Weights/page/9D10835A-CFAB-4DA1-BEE9-AE993C6B5BC1 |
| SPRI 8-Pound Vinyl-Coated Weight | SPRI | Amazon | N/A | Color: (H) Black |8-Pound. Appears on Amazon: Dumbbells Hand Weights Set of 2 - Vinyl Coated Exercise & Fitness Dumbbell for Home Gym Equipment Workouts Strength Training Free Weights for Women, Men (1-10 Pound, 12, 15, 18, 20 lb), https://www.amazon.com/stores/SPRI/Weights/page/9D10835A-CFAB-4DA1-BEE9-AE993C6B5BC1 |
参考文献
- Heidari, F., Afshari, M., Moosazadeh, M. Prevalence of fibromyalgia in general population and patients, a systematic review and meta-analysis. Rheumatology International. 37 (9), 1527-1539 (2017).
- Dennis, N. L., Larkin, M., Derbyshire, S. W. G. 'A giant mess' - making sense of complexity in the accounts of people with fibromyalgia. British Journal of Health Psychology. 18 (4), 763-781 (2013).
- Woodbury, A. Opioids for nonmalignant chronic pain. AMA Journal of Ethics. 17 (3), 202-208 (2015).
- Hedegaard, H., Minino, A. M., Spencer, M. R., Warner, M. Drug overdose deaths in the United States, 1999-2020. NCHS Data Brief. 428, 1-8 (2021).
- . Report No.: 17-01846-316. Opioid prescribing to high-risk veterans receiving VA purchased care. Office of Healthcare Inspections. , (2017).
- Perry, R., Leach, V., Davies, P., Penfold, C., Ness, A., Churchill, R. An overview of systematic reviews of complementary and alternative therapies for fibromyalgia using both AMSTAR and ROBIS as quality assessment tools. Systematic Reviews. 6 (1), 97 (2017).
- Martinez-Lavin, M., Hermosillo, A. G. Dysautonomia in Gulf War syndrome and in fibromyalgia. The American Journal of Medicine. 118 (4), 446 (2005).
- Petersel, D. L., Dror, V., Cheung, R. Central amplification and fibromyalgia: disorder of pain processing. Journal of Neuroscience Research. 89 (1), 29-34 (2011).
- Marlow, N. M., Bonilha, H. S., Short, E. B. Efficacy of transcranial direct current stimulation and repetitive transcranial magnetic stimulation for treating fibromyalgia syndrome: A systematic review. Pain Practice. 13 (2), 131-145 (2013).
- Molero-Chamizo, A., et al. Noninvasive transcutaneous vagus nerve stimulation for the treatment of fibromyalgia symptoms: A study protocol. Brain sciences. 12 (1), 95 (2022).
- Cimpianu, C. L., et al. Vagus nerve stimulation in psychiatry: A systematic review of the available evidence. Journal of Neural Transmission. 124 (1), 145-158 (2017).
- Napadow, V., et al. Evoked pain analgesia in chronic pelvic pain patients using respiratory-gated auricular vagal afferent nerve stimulation. Pain Medicine (Malden, Mass). 13 (6), 777-789 (2012).
- Zhang, Y., et al. Transcutaneous auricular vagus nerve stimulation (taVNS) for migraine: an fMRI study. Regional Anesthesia and Pain. 46 (2), 145-150 (2021).
- Tassorelli, C., et al. Noninvasive vagus nerve stimulation as acute therapy for migraine: The randomized PRESTO study. Neurology. 91 (4), e364-e373 (2018).
- . NBC4 Washington - Electrotherapy Device Treats Anxiety, Insomnia, Depression. Alpha-Stim. , (2021).
- Taylor, A. G., Anderson, J. G., Riedel, S. L., Lewis, J. E., Bourguignon, C. A randomized, controlled, double-blind pilot study of the effects of cranial electrical stimulation on activity in brain pain processing regions in individuals with fibromyalgia. Explore (NY). 9 (1), 32-40 (2013).
- Taylor, A. G., Anderson, J. G., Riedel, S. L., Lewis, J. E., Kinser, P. A., Bourguignon, C. Cranial electrical stimulation improves symptoms and functional status in individuals with fibromyalgia. Pain Management Nursing. 14 (4), 327-335 (2013).
- Lichtbroun, A. S., Raicer, M. M., Smith, R. B. The treatment of fibromyalgia with cranial electrotherapy stimulation. Journal of Clinical Rheumatology. 7 (2), 72-78 (2001).
- Shekelle, P. G., Cook, I. A., Miake-Lye, I. M., Booth, M. S., Beroes, J. M., Mak, S. Benefits and harms of cranial electrical stimulation for chronic painful conditions, depression, anxiety, and insomnia: A systematic review. Annals of Internal Medicine. 168 (6), 414-421 (2018).
- Dailey, D. L., et al. Perceived function and physical performance are associated with pain and fatigue in women with fibromyalgia. Arthritis Research & Therapy. 18, 68 (2016).
- Gowans, S. E., deHueck, A., Voss, S., Silaj, A., Abbey, S. E., Reynolds, W. J. Effect of a randomized, controlled trial of exercise on mood and physical function in individuals with fibromyalgia. Arthritis & Rheumatism. 45 (6), 519-529 (2001).
- Jones, J., Rutledge, D. N., Jones, K. D., Matallana, L., Rooks, D. S. Self-Assessed physical function levels of women with fibromyalgia: A national survey. Women's Health Issues. 18 (5), 406-412 (2008).
- Rikli, R. E., Jones, C. J. Development and validation of criterion-referenced clinically relevant fitness standards for maintaining physical independence in later years. The Gerontologist. 53 (2), 255-267 (2013).
- Feusner, J. D., et al. Effects of cranial electrotherapy stimulation on resting state brain activity. Brain and Behavior. 2 (3), 211-220 (2012).
- Harris, R. E., et al. Pregabalin rectifies aberrant brain chemistry, connectivity, and functional response in chronic pain patients. Anesthesiology. 119 (6), 1453-1464 (2013).
- Napadow, V., Harris, R. E. What has functional connectivity and chemical neuroimaging in fibromyalgia taught us about the mechanisms and management of 'centralized' pain. Arthritis Research & Therapy. 16 (5), 425 (2014).
- Schroeder, M. J., Barr, R. E. Quantitative analysis of the electroencephalogram during cranial electrotherapy stimulation. Clinical Neurophysiology. 112 (11), 2075-2083 (2001).
- Cordes, D., et al. Mapping functionally related regions of brain with functional connectivity MR imaging. American Journal of Neuroradiology. 21 (9), 1636-1644 (2000).
- Hassett, A. L., Aquino, J. K., Ilgen, M. A. The risk of suicide mortality in chronic pain patients. Current Pain and Headache Reports. 18 (8), 436 (2014).
- Stenager, E., Christiansen, E., Handberg, G., Jensen, B. Suicide attempts in chronic pain patients. A register-based study. Scandinavian Journal of Pain. 5 (1), 4-7 (2014).
- Woodbury, A., et al. Feasibility of auricular field stimulation in fibromyalgia: Evaluation by functional magnetic resonance imaging, randomized trial. Pain Medicine. 22 (3), 715-726 (2021).
- Wolfe, F., et al. Revisions to the 2010/2011 fibromyalgia diagnostic criteria. Seminars in Arthritis and Rheumatism. 46 (3), 319-329 (2016).
- Polomano, R. C., et al. Psychometric testing of the defense and veterans pain rating scale (DVPRS): A new pain scale for military population. Pain Medicine. 17 (8), 1505-1519 (2016).
- Electromedical Products International, Inc. . Scientific and clinical literature examination for the Alpha-Stim M microcurrent and cranial electrotherapy stimulator. , (2016).
- Lein, D. H., Alotaibi, M., Almutairi, M., Singh, H. Normative reference values and validity for the 30-second chair-stand test in healthy young adults. International Journal of Sports Physical Therapy. 17 (5), 907-914 (2022).
- Revicki, D. A., Cook, K. F., Amtmann, D., Harnam, N., Chen, W. H., Keefe, F. J. Exploratory and confirmatory factor analysis of the PROMIS pain quality item bank. Quality of Life Research. 23 (1), 245-255 (2014).
- Tustison, N. J., et al. N4ITK: improved N3 bias correction. IEEE Transactions on Medical Imaging. 29 (6), 1310-1320 (2010).
- Avants, B. B., Epstein, C. L., Grossman, M., Gee, J. C. Symmetric diffeomorphic image registration with cross-correlation: evaluating automated labeling of elderly and neurodegenerative brain. Medical Image Analysis. 12 (1), 26-41 (2008).
- Zhang, Y., Brady, M., Smith, S. Segmentation of brain MR images through a hidden Markov random field model and the expectation-maximization algorithm. IEEE Transactions on Medical Imaging. 20 (1), 45-57 (2001).
- Dale, A. M., Fischl, B., Sereno, M. I. Cortical surface-based analysis: I. Segmentation and surface reconstruction. NeuroImage. 9 (2), 179-194 (1999).
- Klein, A., et al. Mindboggling morphometry of human brains. PLoS Computational Biology. 13 (2), e1005350 (2017).
- Fonov, V. S., Evans, A. C., McKinstry, R. C., Almli, C. R., Collins, D. L. Unbiased nonlinear average age-appropriate brain templates from birth to adulthood. NeuroImage. 47 (Supplement 1), S102 (2009).
- Evans, A. C., Janke, A. L., Collins, D. L., Baillet, S. Brain templates and atlases. NeuroImage. 62 (2), 911-922 (2012).
- Greve, D. N., Fischl, B. Accurate and robust brain image alignment using boundary-based registration. NeuroImage. 48 (1), 63-72 (2009).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. NeuroImage. 17 (2), 825-841 (2002).
- Cox, R. W., Hyde, J. S. Software tools for analysis and visualization of fMRI data. NMR in Biomedicine. 10 (4-5), 171-178 (1997).
- Pruim, R. H. R., Mennes, M., van Rooij, D., Llera, A., Buitelaar, J. K., Beckmann, C. F. ICA-AROMA: A robust ICA-based strategy for removing motion artifacts from fMRI data. NeuroImage. 112, 267-277 (2015).
- Power, J. D., Mitra, A., Laumann, T. O., Snyder, A. Z., Schlaggar, B. L., Petersen, S. E. Methods to detect, characterize, and remove motion artifact in resting state fMRI. NeuroImage. 84, 320-341 (2014).
- Behzadi, Y., Restom, K., Liau, J., Liu, T. T. A component based noise correction method (CompCor) for BOLD and perfusion based fMRI. NeuroImage. 37 (1), 90-101 (2007).
- Satterthwaite, T. D., et al. An improved framework for confound regression and filtering for control of motion artifact in the preprocessing of resting-state functional connectivity data. NeuroImage. 64, 240-256 (2013).
- Lanczos, C. Evaluation of noisy data. Journal of the Society for Industrial and Applied Mathematics Series B Numerical Analysis. 1 (1), 76 (1964).
- Oscar, E., et al. fMRIPrep: A robust preprocessing pipeline for functional MRI. Nature Methods. 16, 111-116 (2019).
- Oscar, E., et al. FMRIPrep. Software. Zenodo. , (2018).
- Gorgolewski, K. J., et al. Nipype: a flexible, lightweight and extensible neuroimaging data processing framework in python. Frontiers in Neuroinformatics. 5, 13 (2011).
- Gorgolewski, K. J., et al. Nipype. Software. Zenodo. , (2018).
- Abraham, A., et al. Machine learning for neuroimaging with scikit-learn. Frontiers in Neuroinformatics. 8, 14 (2014).
- Yeh, F. -. C., Badre, D., Verstynen, T. Connectometry: A statistical approach harnessing the analytical potential of the local connectome. NeuroImage. 125 (2016), 162-171 (2015).
- Andersson, J. L. R., Skare, S., Ashburner, J. How to correct susceptibility distortions in spin-echo echo-planar images: application to diffusion tensor imaging. NeuroImage. 20 (2), 870-888 (2003).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. NeuroImage. 23 (S1), 208-219 (2004).
- Andersson, J. L. R., Sotiropoulos, S. N. An integrated approach to correction for off-resonance effects and subject movement in diffusion MR imaging. NeuroImage. 125, 1063-1078 (2016).
- Yeh, F. -. C., Tseng, W. -. Y. I. NTU-90: a high angular resolution brain atlas constructed by -q-space diffeomorphic reconstruction. Neuroimage. 58 (1), 91-99 (2011).
- Nieto-Castanon, A. Cluster-Level Inferences. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , (2020).
- Hemington, K. S., Wu, Q., Kucyi, A., Inman, R. D., Davis, K. D. Abnormal cross-network functional connectivity in chronic pain and its association with clinical symptoms. Brain Structure & Function. 221 (8), 4203-4219 (2016).
- Ichesco, E., et al. Altered resting state connectivity of the insular cortex in individuals with fibromyalgia. Journal of Pain. 15 (8), 815-826 (2014).
- Kim, J., et al. The somatosensory link in fibromyalgia: functional connectivity of the primary somatosensory cortex is altered by sustained pain and is associated with clinical/autonomic dysfunction. Arthritis & Rheumatology. 67 (5), 1395-1405 (2015).
- Napadow, V., LaCount, L., Park, K., As-Sanie, S., Clauw, D. J., Harris, R. E. Intrinsic brain connectivity in fibromyalgia is associated with chronic pain intensity. Arthritis and Rheumatism. 62 (8), 2545-2555 (2010).
- Napadow, V., Kim, J., Clauw, D. J., Harris, R. E. Decreased intrinsic brain connectivity is associated with reduced clinical pain in fibromyalgia. Arthritis and Rheumatism. 64 (7), 2398-2403 (2012).
- Puiu, T., et al. Association of alterations in gray matter volume with reduced evoked-pain connectivity following short-term administration of pregabalin in patients with fibromyalgia. Arthritis & Rheumatology. 68 (6), 1511-1521 (2016).
- Fallon, N., Chiu, Y., Nurmikko, T., Stancak, A. Functional Connectivity with the default mode network is altered in fibromyalgia patients. PLoS One. 11 (7), e0159198 (2016).
- Wang, Y., Kang, J., Kemmer, P. B., Guo, Y. An efficient and reliable statistical method for estimating functional connectivity in large scale brain networks using partial correlation. Frontiers in Neuroscience. 10, 123 (2016).
- Mease, P. J., et al. Estimation of minimum clinically important difference for pain in fibromyalgia. Arthritis Care and Research (Hoboken). 63 (6), 821-826 (2011).
- Bingel, U., et al. Somatotopic organization of human somatosensory cortices for pain: a single trial fMRI study. NeuroImage. 23 (1), 224-232 (2004).
- Wager, T. D., et al. Pain in the ACC. Proceedings of the National Academy of Sciences of the United States of America. 113 (18), E2474-E2475 (2016).
- Nieto-Castanon, A. . FMRI Denoising Pipeline. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , (2020).
- Friston, K. J., Williams, S., Howard, R., Frackowiak, R. S., Turner, R. Movement-related effects in fMRI time-series. Magnetic Resonance in Medicine. 35 (3), 346-355 (1996).
- Hallquist, M. N., Hwang, K., Luna, B. The nuisance of nuisance regression: spectral misspecification in a common approach to resting-state fMRI preprocessing reintroduces noise and obscures functional connectivity. NeuroImage. 82, 208-225 (2013).
- Chai, X. J., Nieto-Castanon, A., Ongur, D., Whitfield-Gabrieli, S. Anticorrelations in resting state networks without global signal regression. NeuroImage. 59 (2), 1420-1428 (2012).
- Nieto-Castanon, A. General Linear Model. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , (2020).
- Worsley, K. J., Marrett, S., Neelin, P., Vandal, A. C., Friston, K. J., Evans, A. C. A unified statistical approach for determining significant signals in images of cerebral activation. Human Brain Mapping. 4 (1), 58-73 (1996).
- Chumbley, J., Worsley, K., Flandin, G., Friston, K. Topological FDR for neuroimaging. NeuroImage. 49 (4), 3057-3064 (2010).
- Page, S. J., Persch, A. C. Recruitment, retention, and blinding in clinical trials. The American Journal of Occupational Therapy. 67 (2), 154-161 (2013).
- McGrath, R. E., Mitchell, M., Kim, B. H., Hough, L. Evidence for response bias as a source of error variance in applied assessment. Psychological Bulletin. 136 (3), 450-470 (2010).
- Robinson-Papp, J., George, M. C., Dorfman, D., Simpson, D. M. Barriers to chronic pain measurement: A qualitative study of patient perspectives. Pain Medicine. 16 (7), 1256-1264 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved