È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Uno studio randomizzato, controllato da Sham, sulla stimolazione elettrica cranica per il dolore e la funzione fisica della fibromialgia, utilizzando biomarcatori di imaging cerebrale
In questo articolo
Riepilogo
L'attuale studio è uno studio randomizzato, controllato con placebo, per determinare l'efficacia della stimolazione elettrica cranica (CES) per migliorare il dolore e la funzione nella fibromialgia e sviluppare ulteriormente la risonanza magnetica della connettività funzionale a riposo (rs-fcMRI) come strumento clinico per valutare i correlati neurali e i meccanismi del dolore cronico e della risposta analgesica.
Abstract
La fibromialgia è una sindrome dolorosa cronica che si presenta con una costellazione di sintomi generali, tra cui diminuzione della funzione fisica, affaticamento, disturbi cognitivi e altri disturbi somatici. Le terapie disponibili sono spesso insufficienti nel trattamento dei sintomi, con un controllo inadeguato del dolore che porta comunemente all'uso di oppioidi per la tentata gestione. La stimolazione elettrica cranica (CES) è una promettente opzione di trattamento non farmacologica per le condizioni di dolore che utilizza la stimolazione a corrente elettrica pulsata per modificare la funzione cerebrale tramite elettrodi transcutanei. Questi meccanismi neurali e le applicazioni della CES nel sollievo dai sintomi della fibromialgia richiedono ulteriori esplorazioni.
Un totale di 50 partecipanti dell'Atlanta Veterans Affairs Healthcare System (VAHCS) con diagnosi di fibromialgia sono stati arruolati e poi randomizzati in blocco in un gruppo placebo più terapia standard o CES attivo più terapia standard. Le valutazioni di base sono state ottenute prima dell'inizio del trattamento. Entrambi gli interventi sono avvenuti nell'arco di 12 settimane e i partecipanti sono stati valutati a 6 settimane e 12 settimane dopo l'inizio del trattamento. L'esito primario ha indagato se il dolore e i miglioramenti funzionali si verificano con l'applicazione della CES. Inoltre, la risonanza magnetica per la connettività funzionale allo stato di riposo (rs-fcMRI) al basale e al follow-up è stata ottenuta ai punti temporali di 6 e 12 settimane per valutare le applicazioni cliniche dei biomarcatori di connettività neurale e le associazioni neurali sottostanti correlate agli effetti del trattamento.
Si tratta di uno studio randomizzato, controllato con placebo, per determinare l'efficacia della CES nel migliorare il dolore e la funzione nella fibromialgia e sviluppare ulteriormente la rs-fcMRI come strumento clinico per valutare i correlati neurali e i meccanismi del dolore cronico e della risposta analgesica.
Introduzione
Tra i molti stati esistenti di dolore cronico, una delle malattie notoriamente più difficili da diagnosticare, valutare clinicamente e trattare è la fibromialgia. La fibromialgia è una sindrome da dolore cronico debilitante che comporta dolore cronico diffuso, diminuzione della funzione fisica, affaticamento, disturbi psico-emotivi e del sonno e vari disturbi somatici che colpiscono circa il 2-3% della popolazione generale nelle Americhe (circa 8 milioni di persone negli Stati Uniti). 1. La diagnosi della malattia dipende fortemente dalla comprensione da parte del paziente del proprio profilo sintomatico e dell'esperienza del dolore e, senza tale corretta comprensione della malattia sia da parte del medico che del paziente, i metodi di trattamento perdono una notevole efficacia2. Per servire al meglio tutti i pazienti sono necessari una migliore definizione delle origini e dell'impatto della fibromialgia, nonché un biomarcatore clinico affidabile per guidare la diagnosi e il trattamento della fibromialgia.
Anche con una diagnosi confermata, le difficoltà con il processo di trattamento non fanno che aumentare. Nel complesso, il dolore cronico colpisce più individui rispetto alle malattie cardiache, al diabete e al cancro messi insieme. La natura soggettiva della sua valutazione lo colloca come un fattore primario per l'epidemia di oppioidi, soprattutto data la difficoltà nel discernere il dolore fisico trattato in modo incompleto dal disturbo da uso di sostanze e dal comportamento di ricerca di droghe3. Nel 2020, negli Stati Uniti si sono verificati 91.799 decessi per overdose di droga (un aumento del 30% rispetto al 2019) e gli oppioidi sono risultati la causa principale di questi decessi (74,8% di tutti i decessi per overdose di droga del 2020)4. Pertanto, sono necessarie alternative non farmacologiche per il trattamento del dolore cronico e della fibromialgia per rallentare l'epidemia di oppioidi, che è particolarmente importante nella popolazione veterana dove il rischio di suicidio e disturbo da uso di oppioidi è più alto5. Le terapie non farmacologiche e complementari sono quindi spesso utilizzate come trattamenti di prima linea6.
La ricerca di nuovi ed efficaci interventi sulla fibromialgia ha portato molti ricercatori e medici a metodi di stimolazione cerebrale non invasiva, compresa la stimolazione cranica. Anche se i meccanismi fisiopatologici che determinano lo sviluppo della malattia non sono stati definitivamente determinati, le prove esistenti supportano l'idea che la fibromialgia sia un disturbo della disfunzione del sistema nervoso autonomo e dei meccanismi centrali (cioè del cervello e del midollo spinale) 7,8. La stimolazione di alcune aree del cervello potrebbe portare a un miglioramento della funzione in quelle aree di elaborazione. La stimolazione magnetica transcranica ripetitiva (rTMS) e la stimolazione transcranica a corrente continua (tDCS) sono state correlate a riduzioni del dolore, ma sono state anche associate a irritazione del cuoio capelluto nel sito di attivazione, mal di testa e inaccessibilità al di fuori delle strutture di trattamento9. La stimolazione non invasiva del nervo vago (nVNS), che può fornire neuromodulazione attraverso la stimolazione sulla pelle del collo o a livello dell'orecchio, ha il potenziale per il trattamento del dolore cronico e la stimolazione invasiva del nervo vago (VNS) ha dimostrato di migliorare i sintomi del dolore cronico10. Tuttavia, né la VNS invasiva né quella non invasiva sono state sufficientemente esplorate in letteratura o completamente convalidate per l'uso nel trattamento della fibromialgia 11,12,13,14.
La stimolazione elettrica cranica (CES) è un trattamento di stimolazione cerebrale non farmacologica e non invasiva che consiste in microcorrente alternata pulsata (inferiore a 0,5 mA) applicata tramite elettrodi transcutanei posizionati sui lobi delle orecchie15. È notevolmente accessibile e può essere erogato attraverso dispositivi portatili utilizzati dai pazienti all'interno dei propri spazi abitativi. Rispetto ad altri metodi di stimolazione cranica, la natura non invasiva e la comodità dell'auto-applicazione del paziente a casa aumentano il potenziale della CES come opzione vantaggiosa per l'uso diffuso del trattamento della fibromialgia e l'autogestione del dolore. È stato autorizzato dalla Food and Drug Administration (FDA) degli Stati Uniti come trattamento per l'insonnia, la depressione, l'ansia e il dolore15.
L'attuale studio valuta l'efficacia della CES come modalità di trattamento della fibromialgia confrontando la CES attiva (somministrata da un vero dispositivo di studio) con la CES fittizia (somministrata da un dispositivo di studio fittizio). Ci sono alcune prove preliminari a sostegno dell'uso della CES nel trattamento di condizioni di dolore come la fibromialgia16,17. Uno studio del 2001 su 60 partecipanti randomizzati a CES attivo o fittizio per 3 settimane di sessioni giornaliere di 60 minuti ha rivelato un miglioramento del 28% nei punteggi dei punti di tenerezza, un miglioramento del 27% nei punteggi del dolore generale e nessun effetto placebo18. La CES non è stata valutata in una popolazione di veterani, né è stata adeguatamente valutata nei maschi con fibromialgia. Una revisione sistematica del CES finanziata da Veterans Affairs (VA) pubblicata nel 2018 ha concluso che le prove sono insufficienti perché il CES abbia effetti clinicamente importanti sulla fibromialgia, dato che la maggior parte degli studi aveva campioni di piccole dimensioni, brevi durate e un alto rischio di distorsione a causa di un accecamento inadeguato. Tuttavia, la revisione suggerisce che la CES non causa gravi effetti collaterali e ci sono prove a bassa intensità che suggeriscono benefici modesti nei pazienti con ansia e depressione19. Pertanto, sono necessarie ulteriori ricerche sull'uso di questo dispositivo a basso rischio approvato dalla FDA, in particolare nella fibromialgia.
Al fine di valutare appieno l'efficacia, i ricercatori hanno valutato la forma fisica insieme ai biomarcatori neurali e all'esperienza del dolore. Lo scopo del trattamento degli stati di dolore cronico è migliorare la funzione fisica. La fibromialgia è costantemente correlata con effetti negativi sia sulla funzione fisica che sulla percezione delle proprie capacità fisiche da parte dei pazienti20. Studi precedenti hanno utilizzato semplici valutazioni dell'idoneità fisica per determinare la resistenza e la mobilità, come il 6 Minute Walk Test (6MWT)20,21, il Five Time Sit to Stand (5TSTS)20 e varie misure della capacità di carico e della forza nel contesto delle attivitàquotidiane22. Per tenere conto delle misure standard e allo stesso tempo mitigare la quantità di attività faticosa richiesta subito prima di una risonanza magnetica, il team di studio ha utilizzato il 30-Second Chair Sit Stand Test come misura della resistenza e della mobilità e sia i curl bicipiti che un test di presa della mano come misure di forza23. I movimenti richiesti in ciascuna di queste valutazioni sono molto comuni nelle attività quotidiane, quindi è una chiara misura di come le persone funzionano fisicamente nella loro vita quotidiana, sia con che senza trattamento.
Anche con le valutazioni soggettive del dolore e le misure di efficacia della funzione fisica, i meccanismi della CES non sono completamente compresi. Precedenti studi di neuroimaging hanno cercato una migliore comprensione esplorando l'effetto diretto della CES sulla connettività di rete nel cervello. Feusner et al.24 hanno scoperto che la CES è associata alla disattivazione corticale per la stimolazione a 0,5 Hz e 100 μA delle regioni bilaterali della linea mediana frontale, parietale e posteriore e hanno ipotizzato che la frequenza di stimolazione possa avere un effetto maggiore dell'intensità di corrente in relazione alla disattivazione corticale. Il loro gruppo ha riscontrato effetti significativi su alcuni, ma non su tutti, i nodi della rete in modalità predefinita (DMN). Gli autori suggeriscono che, sulla base di questi dati, la CES può influenzare la connettività funzionale dello stato di riposo. È stato dimostrato che la fibromialgia e altri stati di dolore cronico influenzano la connettività cerebrale intrinseca nelle regioni associate al dolore e alla percezione25,26, quindi i trattamenti che alterano la connettività funzionale in risposta potrebbero rivelarsi sia benefici che efficaci. Per comprendere ulteriormente il meccanismo d'azione terapeutico27 è necessaria un'ulteriore esplorazione degli effetti a lungo termine del trattamento quotidiano in relazione al miglioramento clinico, nonché del modo in cui l'attivazione deceduta nel cervello si relaziona alle diminuzioni precedentemente osservate nelle frequenze dell'elettroencefalogramma.
La risonanza magnetica per connettività funzionale in stato di riposo (rs-fcMRI) è il metodo di neuroimaging che consente l'osservazione di questi cambiamenti di connettività funzionale. La fMRI longitudinale in stato di riposo consente a medici e ricercatori di stabilire una linea di base della connettività dello stato di riposo e di tenere traccia delle alterazioni nel tempo in risposta ai metodi di trattamento CES. Aiuta anche a determinare in che modo i cambiamenti nella connettività funzionale sono correlati alle differenze nell'esperienza del dolore. Gli studi iniziali di neuroimaging per la fibromialgia hanno utilizzato la tomografia a emissione di positroni (PET) e la tomografia computerizzata a emissione di fotoni singoli (SPECT) per esaminare il cervello, ma ci sono problemi con entrambe le tecniche a questo proposito: la SPECT ha una risoluzione inferiore rispetto alla PET e le scansioni PET sono invasive, il che non è preferibile per i pazienti che soffrono di dolore cronico. Le scansioni di risonanza magnetica funzionale (fMRI) hanno una risoluzione maggiore rispetto alla SPECT, ma esaminano l'attività cerebrale in risposta alle azioni specifiche dei pazienti o alle percezioni degli stimoli28. Sono le scansioni rs-fcMRI che possono delineare la connettività funzionale tra le regioni del cervello e possono essere in grado di determinare dove e come esiste la fibromialgia, nonché i migliori metodi di trattamento28.
La valutazione dell'efficacia dei trattamenti non farmacologici per condizioni di dolore come la fibromialgia è della massima importanza sia nell'attuale contesto dell'epidemia di oppioidi sia nell'esame del dolore cronico come fattore di rischio per il suicidio29,30, che è sostanzialmente aumentato tra la popolazione dei veterani. Inoltre, la mancanza di adeguati biomarcatori clinici per il dolore è una lacuna di conoscenza riconosciuta. L'utilizzo di una combinazione di misure comportamentali e neuroimaging in più punti temporali per valutare la risposta al trattamento è un nuovo approccio alla valutazione della fibromialgia, così come l'utilizzo della CES auricolare come trattamento.
Il protocollo mira a colmare il divario nella ricerca sulla fibromialgia studiando gli effetti della CES sul dolore e sugli esiti della funzione fisica e valutando il neuroimaging come strumento per biomarcatori predittivi e di risposta correlati agli esiti clinici della terapia CES31.
Protocollo
Lo studio è stato condotto con l'approvazione della Emory University (IRB 112768) e dell'Atlanta VA Institutional Review Board (1585632-2; Numero di riferimento interno: 003) e il Comitato di ricerca e sviluppo di Atlanta VA (numero di riferimento del consiglio: 3881). Tutti i soggetti hanno dato il loro consenso informato per l'inclusione prima di partecipare a questo studio. Per una rappresentazione visiva della sequenza temporale del protocollo di studio, vedere la Figura 1).
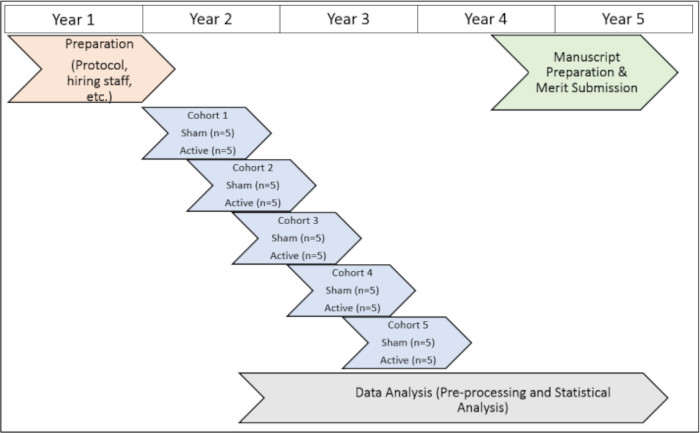
Figura 1: Cronologia dello studio. Una rappresentazione visiva della tempistica per l'esecuzione delle procedure di studio durante il periodo di prova. Clicca qui per visualizzare una versione più grande di questa figura.
1. Reclutamento dei partecipanti tramite i metodi disponibili
- Seguire le rispettive linee guida istituzionali richieste per la diffusione dei materiali di reclutamento degli studi (volantini, post, e-mail, bandi, ecc.) e i metodi di reclutamento approvati.
NOTA: L'attuale studio ha reclutato tramite lettere di reclutamento inviate a coorti specifiche e telefonate di follow-up a potenziali partecipanti. I dettagli relativi all'ordinazione dei dispositivi CES per lo studio sono inclusi nelle istruzioni supplementari per l'ordine dei dispositivi CES (File supplementare 1). - Quando qualcuno esprime interesse per la partecipazione allo studio, selezionalo al telefono per assicurarti che soddisfi tutti i criteri di inclusione ed esclusione.
- Includi i partecipanti che soddisfano i criteri di ammissibilità: età 20-60 anni (limite stabilito durante lo studio preliminare per ridurre al minimo i cambiamenti strutturali del cervello dovuti all'invecchiamento)31; diagnosi di fibromialgia secondo l'American College of Rheumatology 2016 criteri32; destrormano (al fine di fornire coerenza nella struttura e nella funzione del cervello); punteggio del dolore di 4 o superiore sulla Defense and Veterans Pain Rating Scale (DVPRS)33 nei 3 mesi precedenti l'arruolamento; farmaci coerenti e stabili correlati alla FM per almeno 4 settimane prima dell'arruolamento34; e capacità di tollerare in sicurezza la risonanza magnetica.
- Per la parte di screening della fibromialgia, compilare i nuovi criteri diagnostici clinici per la fibromialgia32 con il potenziale partecipante per ottenere il punteggio dell'indice di dolore diffuso (WPI) e il punteggio di gravità (SS). Assegna un punteggio in base alle linee guida elencate in fondo alla pagina.
- Per la parte di screening del punteggio del dolore, chiedi ai potenziali partecipanti di valutare verbalmente il loro dolore medio e costante negli ultimi 3 mesi su una scala da zero a dieci.
- Per la parte di screening della risonanza magnetica, compilare un modulo di screening di sicurezza della risonanza magnetica con il potenziale partecipante fornito da un'istituzione o dalla struttura dello scanner stessa.
- Chiedi ai partecipanti quali sono i possibili criteri di esclusione. I criteri di esclusione includono una storia di convulsioni o condizioni neurologiche che alterano il cervello; gravidanza; claustrofobia, impianti incompatibili con la risonanza magnetica o altre condizioni incompatibili con la risonanza magnetica; e una storia di malattia psichiatrica incontrollata o malattia autoimmune che porta al dolore e può spiegare meglio i sintomi31.
- Se uno qualsiasi dei criteri di esclusione si applica a loro, non superano lo screening. Non includerli nello studio.
- Includi i partecipanti che soddisfano i criteri di ammissibilità: età 20-60 anni (limite stabilito durante lo studio preliminare per ridurre al minimo i cambiamenti strutturali del cervello dovuti all'invecchiamento)31; diagnosi di fibromialgia secondo l'American College of Rheumatology 2016 criteri32; destrormano (al fine di fornire coerenza nella struttura e nella funzione del cervello); punteggio del dolore di 4 o superiore sulla Defense and Veterans Pain Rating Scale (DVPRS)33 nei 3 mesi precedenti l'arruolamento; farmaci coerenti e stabili correlati alla FM per almeno 4 settimane prima dell'arruolamento34; e capacità di tollerare in sicurezza la risonanza magnetica.
- Quando qualcuno supera lo screening, programmalo per l'appuntamento per il consenso e la risonanza magnetica di base. Programmare 2 ore per il consenso e il tempo di scansione.
2. Somministrazione degli appuntamenti di studio al basale, a metà e dopo i partecipanti (vedi Tabella 1)
NOTA: Tutti gli appuntamenti si svolgono presso la sede dello scanner MRI.
| Ore | Attività di ricerca | |
| Fase 1 | Settimana 1 | Reclutamento, Screening, Iscrizione |
| Fase 2 | Settimana 2-3 | Valutazioni di base, rs-fcMRI |
| Fase 3 | Settimane 2–14 | Intervento |
| Fase 4 | Settimana 6-10 | Follow-up acuto, rs-fcMRI (6 settimane di trattamento) |
| Fase 5 | Settimana 12–16 | Follow-up a lungo termine, rs-fcMRI (12 settimane di trattamento) |
Tabella 1: Disegno della ricerca. Una cronologia delle fasi della partecipazione individuale nelle 12 settimane dello studio.
- Prima di ogni visita di riferimento, preparare un dispositivo CES da portare a ciascun partecipante.
- Apri la custodia per assicurarti che il dispositivo sia all'interno (dovrebbe essere avvolto in pluriball). Rimuovere il retro del dispositivo e inserire due batterie AAA.
- Riposizionare il dispositivo. Accendi il dispositivo per assicurarti che funzioni prima di portarlo al partecipante. Tieni premuto il pulsante superiore per circa 2 secondi finché lo schermo non si illumina per accenderlo e tienilo premuto per circa 2 secondi finché lo schermo non si spegne per spegnerlo.
- Assicurati che ogni custodia contenga il dispositivo, batterie extra, un cordino, un piccolo applicatore di soluzione e clip per le orecchie. Assicurati che la borsa da dare ai partecipanti contenga la custodia del dispositivo, un flacone di soluzione conduttiva, un tappo extra per riempire il piccolo applicatore di soluzione e elettrodi extra con clip per l'orecchio.
- Una volta programmato il consenso e la risonanza magnetica di base, incontra il partecipante presso la sede dello scanner MRI per l'appuntamento con due copie del modulo di consenso, un dispositivo CES e i suoi materiali, i documenti per i test di idoneità e un pacchetto di questionari da compilare. Inoltre, portare il dispositivo di trasferimento dati attraverso il quale i dati della risonanza magnetica verranno trasferiti al sito di analisi.
NOTA: Questo studio ha utilizzato un'unità USB crittografata.- Per i documenti di idoneità, includere i nuovi criteri diagnostici per la fibromialgia clinica32 e il DVPRS33.
NOTA: Il DVPRS deve essere incluso per ogni visita. - Per i test di funzionalità fisica, includere un modulo per registrare i risultati di ciascun test 20,21,35.
- Per i questionari che i partecipanti compileranno, includere le misure PROMIS appropriate (PROMIS Scale v1.2 - Global Health, Neuro-QOL Item Bank v2.0 - Cognition Function - Short Form, PROMIS Item Bank v1.0 - Substance Use/Alcohol: Alcohol Use, PROMIS Item Bank v1.0 - Emotional Distress - Anxiety- Short Form 7a, PROMIS Item Bank v1.0 - Emotional Distress-Depression - Short Form 4a, PROMIS Item Bank v1.0 - Fatigue - Short Form 6a, PROMIS Item Bank v1.0 - Interferenza del dolore - Short Form 4a, PROMIS Item Bank v1.2 - Physical Function - Short Form 8b, PROMIS Item Bank v2.0 - Social Isolation - Short Form 4a)36.
- Per i documenti di idoneità, includere i nuovi criteri diagnostici per la fibromialgia clinica32 e il DVPRS33.
- Presso la sede della risonanza magnetica, somministrare la visita di riferimento. Chiama il partecipante in anticipo per confermare.
- Leggi il modulo di consenso completo con il partecipante assicurandoti di aver compreso le informazioni. Chiedi loro se desiderano partecipare e, se sono d'accordo, chiedi loro di stampare il loro nome, firmare e datare il modulo.
- Dopo aver acconsentito, se il partecipante sceglie di partecipare allo studio, completa con lui i documenti del test di inclusione. Se sono idonei a continuare, completa i passaggi seguenti; Se non sono idonei, interrompi la loro partecipazione allo studio a questo punto.
- Assicurarsi che i documenti per i test di idoneità includano i nuovi criteri diagnostici per la fibromialgia clinica e il DVPRS.
- Se un partecipante è idoneo dopo il test di inclusione, spiegargli come utilizzare il dispositivo CES.
- Rimuovi il dispositivo dalla custodia e mostra ai partecipanti come accenderlo e spegnerlo con il pulsante in alto. Ricorda ai partecipanti che il dispositivo si disattiverà automaticamente dopo che sono trascorsi 60 minuti.
- Mostra ai partecipanti come collegare lateralmente il cavo della clip per l'orecchio. L'estremità opposta del cavo rispetto alle clip si inserisce in un piccolo foro sul lato sinistro del dispositivo etichettato con un "1".
- Dimostra come rimuovere i vecchi elettrodi dalle clip per le orecchie e fissarne di nuovi. Per rimuovere i vecchi cuscinetti, sollevare l'adesivo dal punto in cui si collega alle clip. Per fissare nuovi elettrodi, allineare il foro negli elettrodi di ricambio con l'area rialzata al centro della clip e premere con decisione.
NOTA: Non tirare gli elettrodi per la parte morbida in alto. È soggetto a strappi e lascerà l'adesivo attaccato alle clip. - Dimostra come agganciare le clip per le orecchie ai lobi delle orecchie e chiedi loro di provarlo una volta. Premi le punte verdi della clip per aprirla, posiziona il lobo dell'orecchio tra di loro e chiudi delicatamente la clip per fissarla.
- Mostra loro come rimuovere il tappo di plastica dal piccolo applicatore di soluzione e riempirlo con la soluzione dal flacone più grande (vedere i passaggi 2.3.3.6-2.3.3.8). Ricorda loro che la soluzione è necessaria per il corretto funzionamento del dispositivo.
- Per rimuovere la parte superiore dell'applicatore di soluzione piccola, rimuovere il tappo e premere con decisione contro il lato della punta. La punta di plastica si staccherà dal resto della bottiglia.
- Fissare il tappo alternativo per riempire l'applicatore piccolo alla parte superiore del flacone di soluzione più grande. Spingi verso l'alto l'ugello piccolo, fallo scorrere nell'applicatore piccolo e stringi il flacone grande per riempirlo.
- Dire ai partecipanti che dovrebbero aggiungere solo circa 1-2 gocce di soluzione a ciascun elettrodo della clip per l'orecchio. L'eventuale soluzione in eccesso deve essere tamponata prima dell'uso.
- Istruire i partecipanti a utilizzare il dispositivo ogni giorno della settimana per 60 minuti la sera, circa 1 ora prima di andare a letto. Istruire i partecipanti a utilizzare il dispositivo a riposo (ad esempio, seduti o sdraiati, senza muoversi).
NOTA: Sia per il tempo che per la posizione, ai partecipanti sono state concesse normali variazioni nel loro ambiente domestico di utilizzo per aumentare la natura pratica di questa terapia per uso domestico. Non sono stati impostati parametri per il suono consentito nell'ambiente o per la memorizzazione del dispositivo richiesta. - Fornisci ai partecipanti un registro vuoto del dispositivo e spiega che devono inserire ogni data di utilizzo del dispositivo, il loro punteggio del dolore prima e dopo l'uso del dispositivo e l'ora di utilizzo del dispositivo.
- Se i partecipanti non sono in grado di utilizzare il proprio dispositivo per un periodo di tempo durante le 6 settimane tra gli appuntamenti, ma sono in grado di effettuare gli appuntamenti di follow-up, lasciarli rimanere nello studio. Se non sono in grado di utilizzare il dispositivo o di partecipare alle visite di studio, interrompono la loro partecipazione. Vedere il registro del dispositivo CES supplementare (File supplementare 2) per il registro del dispositivo utilizzato da questo studio.
NOTA: I seguenti passaggi verranno ripetuti durante tutte e tre le visite.
- Dopo la spiegazione del dispositivo, chiedere al partecipante di completare tre brevi test di funzionalità fisica23. Per ogni prova verrà registrato un numero massimo di voti (ripetizioni totali per le prime due e forza per prova per la terza).
NOTA: Il cronometro utilizzato per questo studio era un Apple iPhone 12.- Somministrare il test di seduta in piedi della sedia di 30 secondi. Seguire i passaggi 2.3.4.2-2.3.4.6.
- Posiziona una sedia con lo schienale contro il muro della sala prove. Chiedi al partecipante di sedersi sulla sedia con la schiena contro lo schienale della sedia.
- Chiedi al partecipante di alzarsi in posizione eretta completa e poi di sedersi completamente con la schiena contro lo schienale della sedia il maggior numero di volte possibile in 30 secondi.
NOTA: Se toccano la sedia ma non rimettono completamente il peso su di essa in posizione seduta, la ripetizione non conta. - Comunica ai partecipanti quando iniziare. Avvia il timer quando iniziano a muoversi.
- Chiedi ai partecipanti di fare curl con un manubrio su ciascun lato per 30 secondi per lato. Inizia prima con il braccio destro e poi spostati a sinistra.
- Registra il numero totale di riccioli per lato. Usa un peso di 5 libbre per le donne e un peso di 8 libbre per gli uomini. Assicurati che i partecipanti siano seduti per il test di curl delle braccia.
- Chiedi ai partecipanti di fare tre prove di forza di presa con ciascun braccio su un dinamometro. Seguire i passaggi 2.3.4.8-2.3.4.11. Inizia prima con il braccio destro e poi spostati a sinistra.
- Posizionare il dinamometro nella mano del partecipante. Dovrebbero stringere l'impugnatura nella parte inferiore e non toccare il quadrante nella parte superiore.
- Chiedi ai partecipanti di stringere il dinamometro il più forte possibile e poi rilasciarlo. L'ago sul quadrante si fermerà al massimo livello di forza di presa che hanno mostrato.
- Registra i risultati della loro forza di presa annotando il numero raggiunto dall'ago sul quadrante. Reimpostare la manopola tra le ripetizioni ruotando la piccola manopola sulla parte anteriore del quadrante in senso antiorario finché l'ago non si posiziona a zero.
- Assicurarsi che i partecipanti siano seduti per la prova di impugnatura.
NOTA: Tra una serie e l'altra, i partecipanti ricevono circa 15-20 secondi di riposo mentre spostano l'attrezzatura sull'altra mano. Tra un test e l'altro, i partecipanti riceveranno circa 2 minuti di riposo mentre vengono preparate l'attrezzatura e i documenti per il successivo.
- Dopo i test di funzionalità fisica, chiedi ai partecipanti di completare il pacchetto del questionario con una penna. Controlla il pacchetto in seguito per assicurarti che abbiano risposto a tutte le domande.
- Dopo aver completato tutte le revisioni, i test e i questionari, accompagnare i partecipanti allo scanner MRI stesso (per tutte le informazioni sul protocollo MRI, vedere la sezione 3). Rivedi il modulo di screening con i tecnici della risonanza magnetica e assicurati che i partecipanti abbiano rimosso tutto il metallo dalla loro persona.
- Assicurarsi che i membri del team di studio non abbiano metallo addosso.
- Aiuta i tecnici della risonanza magnetica a inserire comodamente i partecipanti nello scanner. Somministrare il protocollo di scansione MRI.
- Istruire i partecipanti sulle procedure di sicurezza (pulsante di chiamata di prova e altoparlanti).
- Ricorda ai partecipanti di non muoversi affatto durante la scansione.
- Ricorda ai partecipanti la durata totale della scansione, che dovrebbe essere di 60 minuti.
- Quando la scansione è stata completata, aiuta i partecipanti a uscire dallo scanner.
- Dopo la scansione, termina la visita di riferimento dei partecipanti e programma la loro visita intermedia per 6 settimane dopo. I partecipanti avranno tre visite di studio in totale, ciascuna a distanza di 6 settimane. Inviate i dati della risonanza magnetica ai server sicuri dello studio per l'analisi.
- Il giorno programmato, somministrare la visita intermedia seguendo i passaggi della visita di riferimento. Chiama il partecipante in anticipo per confermare.
- Amministrare il DVPRS. Chiedi ai partecipanti di restituire il primo registro del dispositivo completato e di fornire loro un secondo registro del dispositivo.
- Eseguire i passaggi 2.3.4-2.3.6 (come nella visita di riferimento).
- Termina la visita intermedia dei partecipanti e programma la loro post-visita per 6 settimane dopo. Inviate i dati della risonanza magnetica ai server sicuri dello studio per l'analisi.
- Il giorno previsto, somministrare il post-visita seguendo i passaggi della visita intermedia. Chiama il partecipante in anticipo per confermare.
- Amministrare il DVPRS. Chiedi ai partecipanti di restituire il secondo registro del dispositivo completato.
- Eseguire i passaggi 2.3.4-2.3.6 (come nel basale e durante le visite). Non è necessaria alcuna programmazione aggiuntiva delle visite per l'ultima visita.
- Se sono necessarie informazioni per compensare i partecipanti, preparare e richiedere tali informazioni durante questa visita.
NOTA: Questo studio ha richiesto il loro nome e indirizzo per emettere assegni dall'Atlanta VA per un risarcimento. - Termina la post-visita dei partecipanti. Inviate i dati della risonanza magnetica ai server sicuri dello studio per l'analisi.
NOTA: Durante lo studio, assicurati di chiamare e controllare con i partecipanti tra una visita e l'altra per assicurarti che stiano utilizzando il dispositivo, completando i registri del dispositivo e sapendo quando sarà la loro prossima visita.
3. Impostazione dei protocolli di scansione MRI
- Per il protocollo di scansione MRI, acquisire BOLD rs-fMRI su uno scanner MRI 3T con una bobina di testa phased array a 32 canali utilizzando una sequenza di imaging ecoplanare gradiente (EPI). Utilizzare i seguenti parametri MR: FOV (Field of View)= 220 mm2; TR (Tempo di ripetizione)/TE (Tempo di eco) = 1500/25 ms, fattore di accelerazione multibanda =3; angolo di ribaltamento = 50°; dimensione della matrice 110 x 110; spessore fetta = 2 mm; Fattore GRAPPA = 2; Parziale di Fourier di 6/8; 34 linee di riferimento con codifica di fase, 72 fette assiali interlacciate che coprono l'intero cervello, circa 350 volumi di scansione per produrre 8 minuti di dati fMRI in stato di riposo per una stima stabile delle reti di connettività.
- Nel protocollo per la magnetizzazione anatomica T1w preparato rapid gradient echo (MPRAGE), impostare TR = 2530 ms, TE = 3 ms, angolo di ribaltamento = 7°, spessore della fetta = 0,8 mm, risoluzione di fase di 1 mm. L'acquisizione del T1w dura circa 6 minuti.
- Acquisizione di scansioni DWI (Diffusion-Weighted Imaging) su uno scanner MRI 3T con una bobina di testa phased array a 32 canali utilizzando uno schema di imaging a spettro di diffusione. Raccogli un totale di 129 direzioni di campionamento della diffusione con un valore b massimo di 3000 s/mm2, una risoluzione nel piano di 2x2 mm2 e uno spessore della fetta di 2 mm.
- Acquisizione di dati fisiologici (dati cardiorespiratori utilizzando una cintura di monitoraggio respiratorio e pulsossimetria) contemporaneamente (temporizzato) ai dati fMRI.
- Trasferisci in modo sicuro i dati della risonanza magnetica dalla posizione dello scanner a un sito sicuro per la pre-elaborazione e l'analisi. Converti DICOM in NIFTI per conformarti alla formattazione BIDS utilizzando dc2bids v2.1.6.
- Cancella i dati dei singoli identificatori. Utilizzare un numero di soggetto dello studio su tutti i dati, ove applicabile. Eseguire un controllo di qualità per assicurarsi che non si siano verificati artefatti anomali, come movimenti eccessivi, nei dati tramite MRIQC v21.0.0.
4. Pre-elaborazione e analisi
- Una volta ricevuti i dati MRI dello studio, utilizzare due pipeline separate per analizzarli: uno per analizzare la connettività funzionale tra i partecipanti e un altro per analizzare la trattografia della sostanza bianca.
- Pre-elaborare i dati strutturali T1w e rsfMRI dei soggetti tramite fMRIPrep v20.2.5, inclusa l'estrazione cerebrale, la segmentazione dei tessuti e la normalizzazione delle immagini pesate in T1 (T1w), nonché la stima del volume di riferimento, la stima del movimento della testa, la correzione della temporizzazione della fetta e la registrazione al T1w per le immagini funzionali. Questo processo si traduce nella normalizzazione dei dati T1w e rsfMRI nello spazio MNI152NLin2009cAsym.
- Utilizzare i dati MRI pre-elaborati nell'analisi della connettività funzionale (CONN).
- Vedere il documento supplementare fMRIPrep Boilerplate (file supplementare 337-56). Per ulteriori dettagli si rimanda al link: https://fmriprep.org/en/stable/
- Importare il set di dati pre-elaborato in CONN Toolbox v22a per un'ulteriore elaborazione.
NOTA: CONN Toolbox è stato aggiornato da v21a a v22a durante questo studio.- Nella fase di configurazione, stabilire le covariate di 2° livello per definire i gruppi di studio (TRUE vs. SHAM) per l'analisi successiva e garantire la qualità delle immagini T1w e rsfMRI. Dati fMRI uniformi tramite kernel gaussiano da 8 mm.
- Dopo la pre-elaborazione, eliminare il rumore dei dati per rimuovere il rumore estraneo e fisiologico.
NOTA: Questo studio ha calcolato l'analisi di primo livello ma non l'ha valutata o utilizzata poiché i ricercatori non sono interessati ai risultati di un singolo soggetto. - Scegli semi/ROI e covariate del soggetto e imposta i contrasti. Esegui un'analisi da seme a voxel a livello di gruppo.
- Una volta completati i passaggi di configurazione, pre-elaborazione e riduzione del rumore per le pipeline, impostare le soglie del cluster e del voxel per visualizzare i modelli di connettività.
- Vedere la Figura 1 supplementare e il documento CES CONN Instructions supplementare (File 4) supplementare.
- Usa la trattografia correlazionale57 per determinare i cambiamenti longitudinali nell'integrità della sostanza bianca correlati con il gruppo sperimentale per identificare i fasci di tratti e le regioni associate al trattamento CES. Di seguito sono riportate le principali fasi di analisi:
- Converti le immagini DWI raw dal formato .dcm (DICOM) a .nii.gz (NIfTI).
- Pre-elabora le immagini per correggere le distorsioni indotte dalla suscettibilità utilizzando il TOPUP58,59 di FSL (versione 6.0.6) e per le distorsioni a correnti parassite utilizzando lo strumento EDDY60 di FSL.
- Genera metriche di controllo della qualità dell'immagine DWI (QC) relative al movimento a livello di singolo soggetto e di studio utilizzando gli strumenti EDDY QC di FSL.
- Esegui un'ANOVA a misure ripetute a due vie su queste metriche QC per identificare qualsiasi varianza tra i gruppi che possa confondere i risultati della trattografia di gruppo. Se una metrica mostra una varianza tra i gruppi che è significativa (p > 0,05), allora dovrebbe essere considerata come una covariata nell'analisi trattografica correlazionale.
- Importa i dati pre-elaborati in DSI Studio (versione "Chen": 21 novembre 2022) dove vengono convertiti in file .src (sorgente). Per ulteriori informazioni su DSI Studio, fare riferimento al sito Web del software (https://dsi-studio.labsolver.org).
- Ricostruisci i dati di diffusione importati utilizzando la ricostruzione diffeomorfica Q-Space (QSDR)61 per determinare gli orientamenti delle fibre della sostanza bianca nello spazio del modello MNI. Per ogni immagine viene emesso un file .fib (orientamento della fibra). Le opzioni selezionate per la ricostruzione sono:
metodo (selezione del metodo di ricostruzione) - QSDR
Param0 (lunghezza del campionamento di diffusione) - 1,25 (impostazione predefinita)
template (in quale spazio template ricostruire i dati) - ICBM152
align_acpc (se ruotare il volume dell'immagine per allineare AC-PC) - 0 (false) - Crea un database di connettometria da questi file .fib, che estrae i valori di anisotropia quantitativa (QA) dai dati di diffusione ricostruiti. Calcola la variazione longitudinale del QA per ogni soggetto nel database. Aggiungi al database dati demografici come il gruppo dell'esperimento, l'età, il sesso, insieme a eventuali covariate identificate nella fase di controllo qualità tramite un file .csv.
- Quindi, caricare il database della connettoria nella GUI di Group Connectometry Analysis.
- Selezionare le covariate da considerare nell'analisi. Una di queste covariate selezionate è designata come variabile di studio.
- Per questa analisi, selezionare Gruppo come variabile dello studio. Saranno identificati i tratti con variazioni longitudinali della QA correlate al Gruppo , mentre l'effetto delle altre covariate selezionate sarà regredito.
- Le opzioni selezionate per l'analisi della connettometria di gruppo sono:
- Controllo FDR (False Discovery Rate cutoff, verranno emessi solo i tratti con una correlazione significativa inferiore a FDR) - 0,05
- Soglia di lunghezza (valore in voxel della lunghezza minima del tratto utilizzato come ipotesi nulla) - 20 voxel (o 40 mm per dimensioni di voxel di 2 mm)
- Soglia T (soglia di misurazione t-stat per l'effetto di correlazione) - 2,5
- Regione di studio (questo riquadro consente di includere/escludere le regioni dall'analisi) - selezionare Cervello intero con - Escludi cervelletto selezionato
NOTA: Per questo studio, il cervelletto è stato escluso a causa di alcune scansioni di diffusione con parti del cervelletto tagliate durante l'acquisizione.
- Premere il pulsante Esegui connettometria per eseguire l'analisi, che produce diversi file:
- Un file .fib che memorizza le t-stats e può essere aperto in DSI studio per visualizzare le t-stats dei tratti con QA crescente (memorizzato come "inc_t") o decrescente QA (memorizzato come "dec_t"), che sono correlati con il Gruppo.
- Un .fdr_dist.values.txt, che elenca i valori FDR rispetto alla lunghezza del tratto
- Un .inc.tt.gz che è un file trattografico che memorizza i tratti con un aumento del QA longitudinale correlato alla variabile di studio. (Gruppo nel nostro caso). Un file .dec.tt.gz memorizza i tratti con una diminuzione del QA longitudinale correlata alla variabile dello studio.
- Un file .report.html che riporta comodamente i risultati della connettometria insieme ai grafici del tratto incorporati, alle immagini e alle informazioni standard sulle fasi di analisi della trattografia correlazionale per la pubblicazione.
NOTA: Per vedere esempi del codice R utilizzato per questo studio, vedere i grafici supplementari del codice R CES (file supplementare 5) e i file supplementari R Code CES eddy-qc Anova (file supplementare 6).
Risultati
In termini di risultati del reclutamento, i partecipanti sono stati reclutati principalmente tramite l'invio di lettere di reclutamento e telefonate di follow-up in base alle normative delineate dell'Atlanta VA Healthcare System. Il team di studio ha reclutato un totale di 50 partecipanti, dimostrando l'efficacia dei metodi utilizzati per raggiungere l'obiettivo di reclutamento (vedi Figura 2). L'uso dei nuovi criteri diagnostici clinici per la fibromialgia h...
Discussione
I metodi del presente studio forniscono non solo la possibilità di una modalità di trattamento altamente efficace per la fibromialgia, ma anche l'opportunità di migliorare il processo diagnostico della fibromialgia dalla prima istanza del suo profilo sintomatico del dolore. L'uso sia del CES attivo che del CES fittizio, con la scoperta del tipo di ogni singolo dispositivo dipendente dai numeri di serie e da una chiave separata, ha consentito l'accecamento sia dei soggetti che dei ricercatori fino al termine della part...
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti noti o relazioni personali che possano aver influenzato il lavoro riportato in questo articolo. Le opinioni espresse in questo articolo sono quelle degli autori e non riflettono necessariamente la posizione o la politica del Dipartimento degli Affari dei Veterani o del governo degli Stati Uniti.
Riconoscimenti
Gli autori desiderano ringraziare i ricercatori del Center for Visual and Neurocognitive Rehabilitation, tra cui il Dr. Bruce Crosson e la Dr. Lisa Krishnamurthy, per il loro contributo al lavoro. Gli autori ringraziano anche Grace Ingham per il suo inestimabile aiuto nel processo di ripresa. Questo lavoro è stato sostenuto in parte dal Dipartimento degli Affari dei Veterani, dal Servizio di Ricerca e Sviluppo per la Riabilitazione degli Stati Uniti, dal Premio per lo Sviluppo della Carriera IK2 RX003227 (Anna Woodbury) e dal Center Grant 5I50RX002358. Il finanziatore non ha alcun ruolo nella progettazione dello studio, nella raccolta dei dati, nella gestione, nell'analisi, nell'interpretazione o nella rendicontazione.
Materiali
| Name | Company | Catalog Number | Comments |
| 3T Siemens MAGNETOM Prisma Scanner | Siemens Healthineers | N/A | From Emory's website: "The Siemens Magnetom Prisma 3T whole-body MR system is equipped with: a state-of-the art gradient system with a maximum (per axis) strength of 80 mT/m and slew rate of 200 T/m/sec 64 independent RF receiver channels capable of 204 receiver connections a 2-channel RF transmitter. Multiple coils are available, including: a 64-channel head/neck coil with 52 channels for imaging of the head region a 32-channel head-only coil a 20-channel head/neck coil with 16 channels for head spine array coil flexible chest coil large and small flexible coil for extremity imaging. |
| Alpha-Stim AID Kit | Electromedical Products International Inc. | SKU: 500KIT | A total of 50 devices ordered for research purposes. From the site: "A prescription or order from a licensed healthcare professional is required to purchase this device (within the USA). FDA cleared for anxiety, insomnia and pain only, with approval for depression outside of the United States." |
| CONN Toolbox v21a16 (RRID:SCR_009550) | Whitfield-Gabrieli and Nieto-Castanon | Version v21a16 (RRID:SCR_009550) | CONN is an open-source SPM-based cross-platform software for the computation, display, and analysis of functional connectivity Magnetic Resonance Imaging (fcMRI). CONN is used to analyze resting state data (rsfMRI) as well as task-related designs. |
| DSI Studio (RRID:SCR_009557) | Fang-Cheng (Frank) Yeh | RRID:SCR_009557 | DSI Studio is a tractography software tool that maps brain connections and correlates findings with neuropsychological disorders. It is a collective implementation of several diffusion MRI methods, including diffusion tensor imaging (DTI), generalized q-sampling imaging (GQI), q-space diffeomorphic reconstruction (QSDR), diffusion MRI connectometry, and generalized deterministic fiber tracking. |
| fMRIPrep 20.2.5 (RRID:SCR_016216) | NiPreps (NeuroImaging PREProcessing tools) | Version 20.2.5. (RRID:SCR_016216) | A functional magnetic resonance imaging (fMRI) data preprocessing pipeline that is designed to provide an easily accessible, state-of-the-art interface that is robust to variations in scan acquisition protocols and that requires minimal user input, while providing easily interpretable and comprehensive error and output reporting. It performs basic processing steps (coregistration, normalization, unwarping, noise component extraction, segmentation, skull-stripping, etc.) providing outputs that can be easily submitted to a variety of group level analyses, including task-based or resting-state fMRI, graph theory measures, and surface or volume-based statistics. |
| MRIQC | NiPreps (NeuroImaging PREProcessing tools) | MRIQC extracts no-reference IQMs (image quality metrics) from structural (T1w and T2w) and functional MRI (magnetic resonance imaging) data. (not directly used for analyses) | |
| Sammons Preston Jamar Hydraulic Hand Dynamometer | Alpha Med Inc. | SKU SAMP5030J1 | From the website: Ideal for routine screening of grip strength and initial and ongoing evaluation of clients with hand trauma and dysfunction. Unit comes with carrying/storage case, certificate of calibration and complete instructions. Warranted for one full year. The warranty does not cover calibration. Latex free. |
| SPRI 5-Pound Vinyl-Coated Weight | SPRI | Amazon | N/A | Color: (E) Dark Blue | 5-Pound. Appears on Amazon: Dumbbells Hand Weights Set of 2 - Vinyl Coated Exercise & Fitness Dumbbell for Home Gym Equipment Workouts Strength Training Free Weights for Women, Men (1-10 Pound, 12, 15, 18, 20 lb), https://www.amazon.com/stores/SPRI/Weights/page/9D10835A-CFAB-4DA1-BEE9-AE993C6B5BC1 |
| SPRI 8-Pound Vinyl-Coated Weight | SPRI | Amazon | N/A | Color: (H) Black |8-Pound. Appears on Amazon: Dumbbells Hand Weights Set of 2 - Vinyl Coated Exercise & Fitness Dumbbell for Home Gym Equipment Workouts Strength Training Free Weights for Women, Men (1-10 Pound, 12, 15, 18, 20 lb), https://www.amazon.com/stores/SPRI/Weights/page/9D10835A-CFAB-4DA1-BEE9-AE993C6B5BC1 |
Riferimenti
- Heidari, F., Afshari, M., Moosazadeh, M. Prevalence of fibromyalgia in general population and patients, a systematic review and meta-analysis. Rheumatology International. 37 (9), 1527-1539 (2017).
- Dennis, N. L., Larkin, M., Derbyshire, S. W. G. 'A giant mess' - making sense of complexity in the accounts of people with fibromyalgia. British Journal of Health Psychology. 18 (4), 763-781 (2013).
- Woodbury, A. Opioids for nonmalignant chronic pain. AMA Journal of Ethics. 17 (3), 202-208 (2015).
- Hedegaard, H., Minino, A. M., Spencer, M. R., Warner, M. Drug overdose deaths in the United States, 1999-2020. NCHS Data Brief. 428, 1-8 (2021).
- . Report No.: 17-01846-316. Opioid prescribing to high-risk veterans receiving VA purchased care. Office of Healthcare Inspections. , (2017).
- Perry, R., Leach, V., Davies, P., Penfold, C., Ness, A., Churchill, R. An overview of systematic reviews of complementary and alternative therapies for fibromyalgia using both AMSTAR and ROBIS as quality assessment tools. Systematic Reviews. 6 (1), 97 (2017).
- Martinez-Lavin, M., Hermosillo, A. G. Dysautonomia in Gulf War syndrome and in fibromyalgia. The American Journal of Medicine. 118 (4), 446 (2005).
- Petersel, D. L., Dror, V., Cheung, R. Central amplification and fibromyalgia: disorder of pain processing. Journal of Neuroscience Research. 89 (1), 29-34 (2011).
- Marlow, N. M., Bonilha, H. S., Short, E. B. Efficacy of transcranial direct current stimulation and repetitive transcranial magnetic stimulation for treating fibromyalgia syndrome: A systematic review. Pain Practice. 13 (2), 131-145 (2013).
- Molero-Chamizo, A., et al. Noninvasive transcutaneous vagus nerve stimulation for the treatment of fibromyalgia symptoms: A study protocol. Brain sciences. 12 (1), 95 (2022).
- Cimpianu, C. L., et al. Vagus nerve stimulation in psychiatry: A systematic review of the available evidence. Journal of Neural Transmission. 124 (1), 145-158 (2017).
- Napadow, V., et al. Evoked pain analgesia in chronic pelvic pain patients using respiratory-gated auricular vagal afferent nerve stimulation. Pain Medicine (Malden, Mass). 13 (6), 777-789 (2012).
- Zhang, Y., et al. Transcutaneous auricular vagus nerve stimulation (taVNS) for migraine: an fMRI study. Regional Anesthesia and Pain. 46 (2), 145-150 (2021).
- Tassorelli, C., et al. Noninvasive vagus nerve stimulation as acute therapy for migraine: The randomized PRESTO study. Neurology. 91 (4), e364-e373 (2018).
- . NBC4 Washington - Electrotherapy Device Treats Anxiety, Insomnia, Depression. Alpha-Stim. , (2021).
- Taylor, A. G., Anderson, J. G., Riedel, S. L., Lewis, J. E., Bourguignon, C. A randomized, controlled, double-blind pilot study of the effects of cranial electrical stimulation on activity in brain pain processing regions in individuals with fibromyalgia. Explore (NY). 9 (1), 32-40 (2013).
- Taylor, A. G., Anderson, J. G., Riedel, S. L., Lewis, J. E., Kinser, P. A., Bourguignon, C. Cranial electrical stimulation improves symptoms and functional status in individuals with fibromyalgia. Pain Management Nursing. 14 (4), 327-335 (2013).
- Lichtbroun, A. S., Raicer, M. M., Smith, R. B. The treatment of fibromyalgia with cranial electrotherapy stimulation. Journal of Clinical Rheumatology. 7 (2), 72-78 (2001).
- Shekelle, P. G., Cook, I. A., Miake-Lye, I. M., Booth, M. S., Beroes, J. M., Mak, S. Benefits and harms of cranial electrical stimulation for chronic painful conditions, depression, anxiety, and insomnia: A systematic review. Annals of Internal Medicine. 168 (6), 414-421 (2018).
- Dailey, D. L., et al. Perceived function and physical performance are associated with pain and fatigue in women with fibromyalgia. Arthritis Research & Therapy. 18, 68 (2016).
- Gowans, S. E., deHueck, A., Voss, S., Silaj, A., Abbey, S. E., Reynolds, W. J. Effect of a randomized, controlled trial of exercise on mood and physical function in individuals with fibromyalgia. Arthritis & Rheumatism. 45 (6), 519-529 (2001).
- Jones, J., Rutledge, D. N., Jones, K. D., Matallana, L., Rooks, D. S. Self-Assessed physical function levels of women with fibromyalgia: A national survey. Women's Health Issues. 18 (5), 406-412 (2008).
- Rikli, R. E., Jones, C. J. Development and validation of criterion-referenced clinically relevant fitness standards for maintaining physical independence in later years. The Gerontologist. 53 (2), 255-267 (2013).
- Feusner, J. D., et al. Effects of cranial electrotherapy stimulation on resting state brain activity. Brain and Behavior. 2 (3), 211-220 (2012).
- Harris, R. E., et al. Pregabalin rectifies aberrant brain chemistry, connectivity, and functional response in chronic pain patients. Anesthesiology. 119 (6), 1453-1464 (2013).
- Napadow, V., Harris, R. E. What has functional connectivity and chemical neuroimaging in fibromyalgia taught us about the mechanisms and management of 'centralized' pain. Arthritis Research & Therapy. 16 (5), 425 (2014).
- Schroeder, M. J., Barr, R. E. Quantitative analysis of the electroencephalogram during cranial electrotherapy stimulation. Clinical Neurophysiology. 112 (11), 2075-2083 (2001).
- Cordes, D., et al. Mapping functionally related regions of brain with functional connectivity MR imaging. American Journal of Neuroradiology. 21 (9), 1636-1644 (2000).
- Hassett, A. L., Aquino, J. K., Ilgen, M. A. The risk of suicide mortality in chronic pain patients. Current Pain and Headache Reports. 18 (8), 436 (2014).
- Stenager, E., Christiansen, E., Handberg, G., Jensen, B. Suicide attempts in chronic pain patients. A register-based study. Scandinavian Journal of Pain. 5 (1), 4-7 (2014).
- Woodbury, A., et al. Feasibility of auricular field stimulation in fibromyalgia: Evaluation by functional magnetic resonance imaging, randomized trial. Pain Medicine. 22 (3), 715-726 (2021).
- Wolfe, F., et al. Revisions to the 2010/2011 fibromyalgia diagnostic criteria. Seminars in Arthritis and Rheumatism. 46 (3), 319-329 (2016).
- Polomano, R. C., et al. Psychometric testing of the defense and veterans pain rating scale (DVPRS): A new pain scale for military population. Pain Medicine. 17 (8), 1505-1519 (2016).
- Electromedical Products International, Inc. . Scientific and clinical literature examination for the Alpha-Stim M microcurrent and cranial electrotherapy stimulator. , (2016).
- Lein, D. H., Alotaibi, M., Almutairi, M., Singh, H. Normative reference values and validity for the 30-second chair-stand test in healthy young adults. International Journal of Sports Physical Therapy. 17 (5), 907-914 (2022).
- Revicki, D. A., Cook, K. F., Amtmann, D., Harnam, N., Chen, W. H., Keefe, F. J. Exploratory and confirmatory factor analysis of the PROMIS pain quality item bank. Quality of Life Research. 23 (1), 245-255 (2014).
- Tustison, N. J., et al. N4ITK: improved N3 bias correction. IEEE Transactions on Medical Imaging. 29 (6), 1310-1320 (2010).
- Avants, B. B., Epstein, C. L., Grossman, M., Gee, J. C. Symmetric diffeomorphic image registration with cross-correlation: evaluating automated labeling of elderly and neurodegenerative brain. Medical Image Analysis. 12 (1), 26-41 (2008).
- Zhang, Y., Brady, M., Smith, S. Segmentation of brain MR images through a hidden Markov random field model and the expectation-maximization algorithm. IEEE Transactions on Medical Imaging. 20 (1), 45-57 (2001).
- Dale, A. M., Fischl, B., Sereno, M. I. Cortical surface-based analysis: I. Segmentation and surface reconstruction. NeuroImage. 9 (2), 179-194 (1999).
- Klein, A., et al. Mindboggling morphometry of human brains. PLoS Computational Biology. 13 (2), e1005350 (2017).
- Fonov, V. S., Evans, A. C., McKinstry, R. C., Almli, C. R., Collins, D. L. Unbiased nonlinear average age-appropriate brain templates from birth to adulthood. NeuroImage. 47 (Supplement 1), S102 (2009).
- Evans, A. C., Janke, A. L., Collins, D. L., Baillet, S. Brain templates and atlases. NeuroImage. 62 (2), 911-922 (2012).
- Greve, D. N., Fischl, B. Accurate and robust brain image alignment using boundary-based registration. NeuroImage. 48 (1), 63-72 (2009).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. NeuroImage. 17 (2), 825-841 (2002).
- Cox, R. W., Hyde, J. S. Software tools for analysis and visualization of fMRI data. NMR in Biomedicine. 10 (4-5), 171-178 (1997).
- Pruim, R. H. R., Mennes, M., van Rooij, D., Llera, A., Buitelaar, J. K., Beckmann, C. F. ICA-AROMA: A robust ICA-based strategy for removing motion artifacts from fMRI data. NeuroImage. 112, 267-277 (2015).
- Power, J. D., Mitra, A., Laumann, T. O., Snyder, A. Z., Schlaggar, B. L., Petersen, S. E. Methods to detect, characterize, and remove motion artifact in resting state fMRI. NeuroImage. 84, 320-341 (2014).
- Behzadi, Y., Restom, K., Liau, J., Liu, T. T. A component based noise correction method (CompCor) for BOLD and perfusion based fMRI. NeuroImage. 37 (1), 90-101 (2007).
- Satterthwaite, T. D., et al. An improved framework for confound regression and filtering for control of motion artifact in the preprocessing of resting-state functional connectivity data. NeuroImage. 64, 240-256 (2013).
- Lanczos, C. Evaluation of noisy data. Journal of the Society for Industrial and Applied Mathematics Series B Numerical Analysis. 1 (1), 76 (1964).
- Oscar, E., et al. fMRIPrep: A robust preprocessing pipeline for functional MRI. Nature Methods. 16, 111-116 (2019).
- Oscar, E., et al. FMRIPrep. Software. Zenodo. , (2018).
- Gorgolewski, K. J., et al. Nipype: a flexible, lightweight and extensible neuroimaging data processing framework in python. Frontiers in Neuroinformatics. 5, 13 (2011).
- Gorgolewski, K. J., et al. Nipype. Software. Zenodo. , (2018).
- Abraham, A., et al. Machine learning for neuroimaging with scikit-learn. Frontiers in Neuroinformatics. 8, 14 (2014).
- Yeh, F. -. C., Badre, D., Verstynen, T. Connectometry: A statistical approach harnessing the analytical potential of the local connectome. NeuroImage. 125 (2016), 162-171 (2015).
- Andersson, J. L. R., Skare, S., Ashburner, J. How to correct susceptibility distortions in spin-echo echo-planar images: application to diffusion tensor imaging. NeuroImage. 20 (2), 870-888 (2003).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. NeuroImage. 23 (S1), 208-219 (2004).
- Andersson, J. L. R., Sotiropoulos, S. N. An integrated approach to correction for off-resonance effects and subject movement in diffusion MR imaging. NeuroImage. 125, 1063-1078 (2016).
- Yeh, F. -. C., Tseng, W. -. Y. I. NTU-90: a high angular resolution brain atlas constructed by -q-space diffeomorphic reconstruction. Neuroimage. 58 (1), 91-99 (2011).
- Nieto-Castanon, A. Cluster-Level Inferences. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , (2020).
- Hemington, K. S., Wu, Q., Kucyi, A., Inman, R. D., Davis, K. D. Abnormal cross-network functional connectivity in chronic pain and its association with clinical symptoms. Brain Structure & Function. 221 (8), 4203-4219 (2016).
- Ichesco, E., et al. Altered resting state connectivity of the insular cortex in individuals with fibromyalgia. Journal of Pain. 15 (8), 815-826 (2014).
- Kim, J., et al. The somatosensory link in fibromyalgia: functional connectivity of the primary somatosensory cortex is altered by sustained pain and is associated with clinical/autonomic dysfunction. Arthritis & Rheumatology. 67 (5), 1395-1405 (2015).
- Napadow, V., LaCount, L., Park, K., As-Sanie, S., Clauw, D. J., Harris, R. E. Intrinsic brain connectivity in fibromyalgia is associated with chronic pain intensity. Arthritis and Rheumatism. 62 (8), 2545-2555 (2010).
- Napadow, V., Kim, J., Clauw, D. J., Harris, R. E. Decreased intrinsic brain connectivity is associated with reduced clinical pain in fibromyalgia. Arthritis and Rheumatism. 64 (7), 2398-2403 (2012).
- Puiu, T., et al. Association of alterations in gray matter volume with reduced evoked-pain connectivity following short-term administration of pregabalin in patients with fibromyalgia. Arthritis & Rheumatology. 68 (6), 1511-1521 (2016).
- Fallon, N., Chiu, Y., Nurmikko, T., Stancak, A. Functional Connectivity with the default mode network is altered in fibromyalgia patients. PLoS One. 11 (7), e0159198 (2016).
- Wang, Y., Kang, J., Kemmer, P. B., Guo, Y. An efficient and reliable statistical method for estimating functional connectivity in large scale brain networks using partial correlation. Frontiers in Neuroscience. 10, 123 (2016).
- Mease, P. J., et al. Estimation of minimum clinically important difference for pain in fibromyalgia. Arthritis Care and Research (Hoboken). 63 (6), 821-826 (2011).
- Bingel, U., et al. Somatotopic organization of human somatosensory cortices for pain: a single trial fMRI study. NeuroImage. 23 (1), 224-232 (2004).
- Wager, T. D., et al. Pain in the ACC. Proceedings of the National Academy of Sciences of the United States of America. 113 (18), E2474-E2475 (2016).
- Nieto-Castanon, A. . FMRI Denoising Pipeline. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , (2020).
- Friston, K. J., Williams, S., Howard, R., Frackowiak, R. S., Turner, R. Movement-related effects in fMRI time-series. Magnetic Resonance in Medicine. 35 (3), 346-355 (1996).
- Hallquist, M. N., Hwang, K., Luna, B. The nuisance of nuisance regression: spectral misspecification in a common approach to resting-state fMRI preprocessing reintroduces noise and obscures functional connectivity. NeuroImage. 82, 208-225 (2013).
- Chai, X. J., Nieto-Castanon, A., Ongur, D., Whitfield-Gabrieli, S. Anticorrelations in resting state networks without global signal regression. NeuroImage. 59 (2), 1420-1428 (2012).
- Nieto-Castanon, A. General Linear Model. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , (2020).
- Worsley, K. J., Marrett, S., Neelin, P., Vandal, A. C., Friston, K. J., Evans, A. C. A unified statistical approach for determining significant signals in images of cerebral activation. Human Brain Mapping. 4 (1), 58-73 (1996).
- Chumbley, J., Worsley, K., Flandin, G., Friston, K. Topological FDR for neuroimaging. NeuroImage. 49 (4), 3057-3064 (2010).
- Page, S. J., Persch, A. C. Recruitment, retention, and blinding in clinical trials. The American Journal of Occupational Therapy. 67 (2), 154-161 (2013).
- McGrath, R. E., Mitchell, M., Kim, B. H., Hough, L. Evidence for response bias as a source of error variance in applied assessment. Psychological Bulletin. 136 (3), 450-470 (2010).
- Robinson-Papp, J., George, M. C., Dorfman, D., Simpson, D. M. Barriers to chronic pain measurement: A qualitative study of patient perspectives. Pain Medicine. 16 (7), 1256-1264 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon